链脲佐菌素诱导糖尿病大鼠窦房结HCN通道表达的变化
钟妮尔, 郑小璞, 马爱群, 王 欢, 黄 欣
(西安交通大学第一附属医院心血管内科,西安 710061; *通讯作者,E-mail:hearthx@126.com)
链脲佐菌素诱导糖尿病大鼠窦房结HCN通道表达的变化
钟妮尔, 郑小璞, 马爱群, 王欢, 黄欣*
(西安交通大学第一附属医院心血管内科,西安710061;*通讯作者,E-mail:hearthx@126.com)
摘要:目的观察糖尿病对大鼠窦房结功能及超极化激活环核苷酸门控阳离子通道(HCN)表达的影响。 方法选择3月龄健康雄性SD大鼠,随机分为链脲佐菌素(streptozotocin,STZ)诱导糖尿病组和对照组,测定固有心率、窦房传导时间、窦房结恢复时间,观察两组间窦房结功能的差异;采用光标测技术识别窦房结组织,Western blot检测HCN通道亚型HCN1、HCN2、HCN3、HCN4蛋白在大鼠窦房结中的表达。结果糖尿病大鼠静息心率及固有心率减慢,窦房传导时间和窦房结恢复时间延长,与对照组相比,具有统计学差异(P<0.05);Western blot结果显示,大鼠窦房结组织存在HCN2和HCN4蛋白的表达,但是未检测到HCN1和HCN3蛋白的表达;与对照组相比,糖尿病组大鼠窦房结HCN2和HCN4蛋白表达量均显著减少,差异具有统计学意义(P<0.01)。结论STZ诱导糖尿病大鼠窦房结组织HCN2和HCN4蛋白表达减少,这可能是糖尿病相关窦房结功能障碍的分子机制之一。
关键词:超极化激活环核苷酸门控阳离子通道;链脲佐菌素;糖尿病;窦房结
窦房结功能异常是糖尿病的重要并发症之一[1]。动物实验发现,链脲佐菌素(streptozotocin,STZ)诱导的糖尿病大鼠模型存在窦房结功能异常,表现为静息心率减慢、校正的窦房结恢复时间(corrected sinus node recovery time,CSNRT)延长以及心率变时性异常[2-4]。心率的下降在STZ诱导糖尿病大鼠离体灌注心脏和表面灌流心房组织中也有发现[5,6],提示这种心脏节律的异常至少部分是因为窦房结功能的异常。
窦房结起搏电流(If电流)在窦房结自发性舒张期除极过程中起到了重要的作用。编码If电流的超极化激活环核苷酸门控阳离子通道(hyperpolarization-activated cyclic nucleotide-gated channels,HCN)共有4个亚型(HCN1-4)。大鼠心脏中主要表达HCN2及HCN4[7,8]。既往研究已证实衰老可导致HCN通道表达下降[9],但是糖尿病大鼠窦房结HCN通道亚型表达的变化尚不明确。本研究以STZ诱导的糖尿病大鼠为研究对象,观察糖尿病对大鼠窦房结功能以及窦房结HCN通道不同亚型蛋白表达的影响,以期探讨糖尿病相关窦房结功能异常的分子机制。
1材料与方法
1.1主要试剂
兔抗大鼠超极化激活的阳离子通道HCN1-4的多克隆抗体(Alomone Labs,以色列),小鼠抗大鼠β-actin单克隆抗体(Santa Cruz Biotechnology,Inc.,Texas,美国);山羊抗兔IRDye®800CW(Li-COR Biosciences,美国);山羊抗小鼠IRDye®680 L(Li-COR Biosciences,美国);di-4-ANEPPS (Molecular Probes,美国);链脲佐菌素(sigma,美国);普萘洛尔(sigma,美国);异丙肾上腺素(sigma,美国);阿托品(sigma,美国);甲基胆碱(sigma,美国)。
1.2实验动物和分组
清洁级封闭群健康雄性Sprague-Dawley大鼠(3月龄,体重200-250 g),购自西安交通大学医学院实验动物中心,生产许可证号:SCXK(陕)2007-001。随机分为糖尿病组和对照组。以STZ 10 mmol/L单次腹腔注射制作大鼠糖尿病模型,注射剂量为55 mg/kg体重。以同体积生理盐水单次腹腔注射制作大鼠对照组。所有动物均予正常饮食,自由饮水,12∶12光暗循环。
1.3大鼠在体静息心率(RHR)和固有心率(IHR)的测定
参照Safa-Tisseront等[10]的方法确定自主神经全阻滞药物剂量。0.2%戊巴比妥钠(2 ml/kg)腹腔注射麻醉大鼠,然后经鼠尾静脉给予心脏β受体的全阻滞剂量的普萘洛尔4.5 mg/kg,待药物作用稳定(约10 min)后,再给予阿托品3 mg/kg静脉注射即达到完全的心脏自主神经阻滞状态,记录心电图,取1 min心率的平均值为固有心率。
1.4窦房结恢复时间(sinus node recovery time,SNRT)的测定
大鼠麻醉后,记录标准Ⅱ导联心电图,将双极电极经食道置于右心耳处,应用超速抑制分级递增法测定SNRT[11]。刺激的起始频率为6.5 Hz,每次递增0.5 Hz,刺激时间30 s,间隔15 min,脉宽10 ms,起搏电压15-25 mV,测量每次刺激的最后一次脉冲到第一个窦性P波起点之间的距离(即SNRT),至SNRT不再延长,其最大值为SNRTmax。CSNRTmax(SNRTmax的校正值):CSNRTmax=SNRTmax-平均窦性心动周期。
1.5窦房传导时间(sinoatrial conduction time,SACT)的测定
应用短阵起搏法[12],以高于基础心率10-20次/min的频率起搏,脉宽10 ms,起搏电压15-25 mV,每次给予8个连续刺激,间隔15 min,重复3次。最后一次脉冲与刺激终止后第一次P波之间的距离减去刺激前的平均窦性心动周期,所得值除以2即为窦房传导时间SACT。取3次测量的均值。
1.6离体灌流心脏模型的建立和心电图记录
根据Maier等[13]建立的方法,将离体心脏固定在Langendorff灌流装置上,用37 ℃以95%O2+5%CO2混合气饱和的改良Krebs-Henseleit缓冲液(KHB)经主动脉逆行灌流,灌流压80 mmHg。改良KHB含:118 mmol/L氯化钠、4.7 mmol/L氯化钾、1.2 mmol/L硫酸镁、1.2 mmol/L磷酸二氢钾、11 mmol/L葡萄糖、2.0 mmol/L氯化钙、2.0 mmol/L丙酮酸钠、25 mmol/L碳酸氢钠、1 μmol/L普萘洛尔、100 nmol/L阿托品以及5 U/L胰岛素。两记录电极分别固定于左右心耳,经BL-420生理记录仪进行心电图记录和数据分析。
1.7窦房结组织电活动的光标测
麻醉动物,开胸取出心脏,用37 ℃氧饱和的台氏液经主动脉行Langendorff灌注,灌注压为80-95 mmHg。将心脏内血液冲洗干净后,取下心脏,于37 ℃氧饱和的台氏液中迅速分离窦房结组织,浸入含2 mmol/L di-4-ANEPPS的台氏液中染色约10 s,固定于中空的黑色橡皮薄板上,心内膜面朝向高速CCD摄像机,置于组织灌流槽中。灌流槽中含37 ℃、95%O2+5%CO2平衡的台氏液(pH 7.4±0.5)(36±0.5 ℃)。采用波长为532 nm的LED光源激发,心脏组织外表面的荧光可通过截止波长(cut of wavelength)600 nm的滤镜,并通过高速CCD摄像机以910 frames/s的速率同时采集X轴和Y轴的64×64点的信号。图像数据通过LabVIEW TM工具包采集分析。
1.8Western blot定量测定窦房结HCN1-4蛋白表达
通过光标测技术识别窦房结首要起搏位点,并进行分离,提取组织中总蛋白并检测总蛋白含量:取20 μl样品/泳道上样于10% SDS-PAGE进行凝胶电泳;4 ℃电转膜90 min。TBST封闭1 h,洗脱后加入一抗兔抗大鼠超极化激活的阳离子通道HCN1-4的多克隆抗体(稀释比例1∶200)或者内参小鼠抗大鼠β-actin单克隆抗体(稀释比例1∶1 000),4 ℃过夜。TBST漂洗10 min×3次后,加入二抗山羊抗兔IRDye®800CW或者山羊抗小鼠IRDye®680 LT(稀释比例1∶2 000)。室温孵育1 h后TBST洗膜。使用Odyssey Western分析仪(Lincoln,NE)对图像进行分析,通过Bandscan软件分析HCN1-4蛋白的相对含量。
1.9统计学分析
2结果
2.1糖尿病大鼠窦房结功能的变化
糖尿病大鼠体质量、心质量以及心脏质量/体质量比值均显著低于对照组,差异具有统计学意义(P<0.05,见表1)。窦房结功能测定显示,与对照组相比,糖尿病组大鼠RHR及IHR减慢,SACT和CSNRTmax延长,差异具有统计学意义(P<0.05,见表1)。

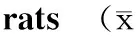
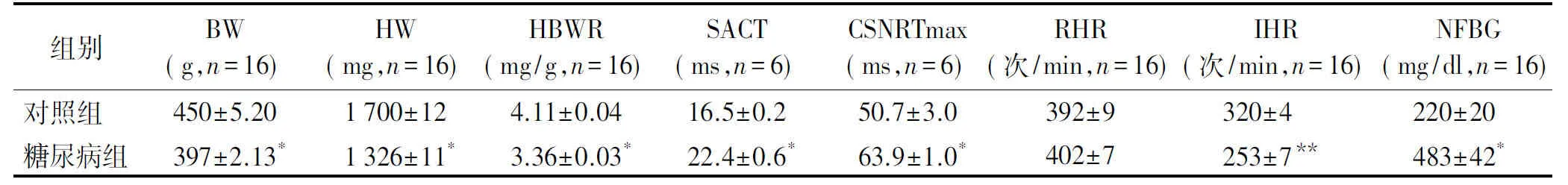
组别BW(g,n=16)HW(mg,n=16)HBWR(mg/g,n=16)SACT(ms,n=6)CSNRTmax(ms,n=6)RHR(次/min,n=16)IHR(次/min,n=16)NFBG(mg/dl,n=16)对照组450±5.201700±124.11±0.0416.5±0.250.7±3.0392±9320±4 220±20 糖尿病组397±2.13*1326±11*3.36±0.03*22.4±0.6*63.9±1.0*402±7253±7**483±42*
BW:体质量;HW:心脏质量;HBWR:心脏质量/体质量;SACT:窦房传导时间;CSNRTmax:校正的最大窦房结恢复时间;RHR:静息心率;IHR:固有心率;NFBG:非空腹血糖;与对照组比较,*P<0.05
2.2糖尿病大鼠离体灌流心脏固有心率的变化
在整个灌流过程中,对照组大鼠离体灌流心脏自发性节律,即固有心率,维持恒定(P>0.05),说明灌流系统稳定可靠。糖尿病大鼠离体灌流心脏固有心率显著低于对照组[(190±3)次/minvs(243±5)次/min,P<0.05,见图1)。
2.3窦房结组织光标测技术识别首要起搏位点
窦房结位于上、下腔静脉、界嵴和房间隔之间,肉眼可见与周围心房肌之间无明显界限(见图2)。窦房结组织经di-4-ANEPPS染色后通过光学标测系统能够很好地显示首要起搏位点的位置。
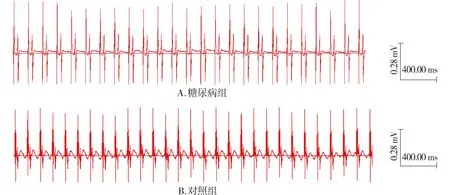
图1 糖尿病大鼠离体灌流心脏固有心率的变化Figure 1 Change of the intrinsic heart rate of diabetic rats in vitro
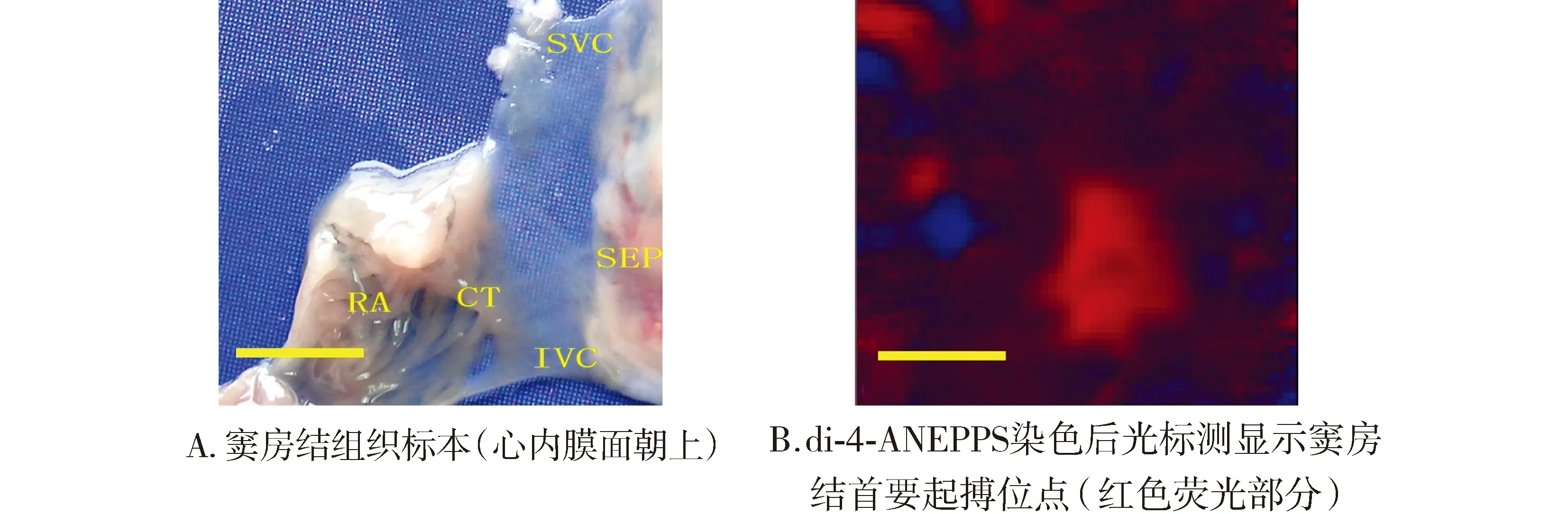
SVC:上腔静脉;SEP:房间隔;IVC:下腔静脉;RA:右心耳;CT:界嵴;标尺=5 mm图2 光标测技术识别窦房结首要起搏位点Figure 2 Identification of the leading pacemaker site of the sinoatrial node by optical mapping
2.4糖尿病大鼠窦房结HCN异构体的表达
大鼠窦房结组织存在HCN2和HCN4蛋白的表达,但是未检测到HCN1和HCN3蛋白的表达(见图3)。与对照组相比,糖尿病大鼠窦房结HCN2和HCN4蛋白表达量均显著减少,差异具有统计学意义(P<0.01,见表2)。
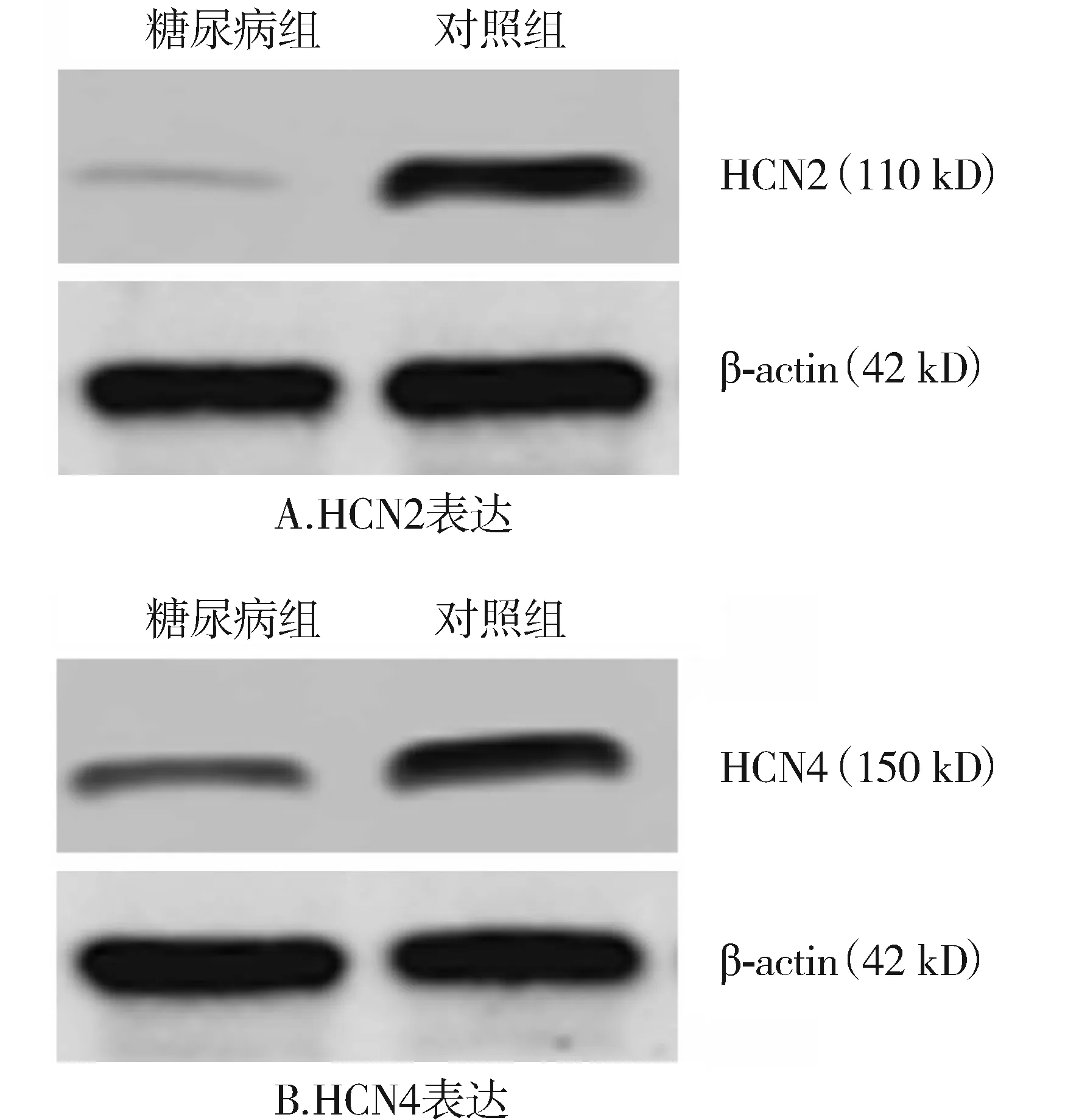
图3 Western blot检测大鼠窦房结HCN异构体的蛋白表达Figure 3 Expression of HCN isoforms in rat sinoatrial node by Western blot
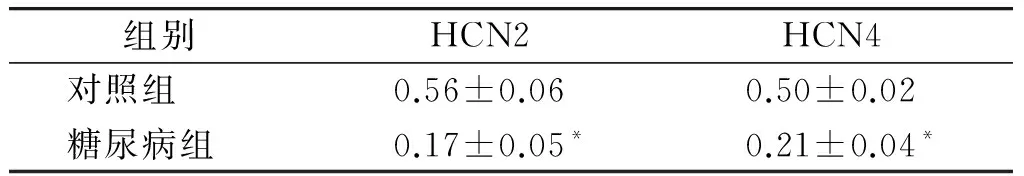
组别HCN2HCN4对照组0.56±0.060.50±0.02糖尿病组0.17±0.05*0.21±0.04*
与对照组比较,*P<0.01
3讨论
心血管并发症是糖尿病患者致死和致残的首要原因[14]。临床研究和动物实验发现即使不伴有动脉粥样硬化,糖尿病仍然与各种心律失常的发生有关[15]。随着2型糖尿病的患病率不断增加,对于其机制的深入理解,为更好地预防和治疗心律失常提供理论基础。
窦房结功能障碍在1型和2型糖尿病患者中均很常见,可以表现为窦性心动过速或者窦性心动过缓[16]。动物实验发现,糖尿病小鼠和大鼠模型均存在窦房结功能障碍,表现为静息心率减慢、校正的窦房结恢复时间延长以及心率变时性异常[2-4,17],并且胰岛素替代治疗可以部分逆转这种心率的下降[18,19]。本研究结果亦显示,STZ诱导的糖尿病大鼠RHR及IHR减慢,SACT和CSNRTmax延长,离体灌流心脏自发性节律显著降低,存在窦房结功能障碍。以上结果提示,在糖尿病的发生发展过程中,窦房结经历着电重构过程,但其分子机制有待于阐明。
超极化激活的环核苷酸门控阳离子通道及其产生的起搏电流(If)在窦房结细胞4期自动除极过程中起重要作用[20,21]。迄今为止,共识别了4种HCN通道亚型,包括HCN1-4。本研究采用Western blot定量分析HCN1-4蛋白在大鼠窦房结组织的表达情况,结果显示,大鼠窦房结组织存在HCN2和HCN4蛋白的表达,未检测到HCN1和HCN3蛋白的表达;并且,与对照组相比,STZ诱导的糖尿病大鼠窦房结组织HCN2和HCN4蛋白表达量显著降低。近期的基因敲除小鼠模型证实HCN2[22,23]和HCN4[24]对于维持正常的窦房结自律性以及心率变异性至关重要。HCN2基因敲除小鼠心率变异性增加。HCN4基因敲除小鼠多在胚胎9.5-11.5 d死亡,但无心脏结构的异常。与野生型小鼠胚胎相比,HCN4基因敲除小鼠胚胎心率明显下降。临床上,HCN功能缺失性突变能够导致家族性病态窦房结综合征的发生[25]。以上结果提示,HCN表达和功能的异常与窦房结功能障碍的发生有关。本研究结果显示,STZ诱导的糖尿病大鼠窦房结HCN2和HCN4蛋白表达量均显著低于对照组,因此,我们推断,HCN蛋白表达的下降与糖尿病大鼠窦房结功能的异常相关。
糖尿病相关的起搏功能障碍与患者心血管死亡率增加有关。因此揭示糖尿病相关窦房结功能障碍的机制,寻找更为有效的防治措施,对于改善患者预后至关重要。本实验结果提示STZ诱导糖尿病大鼠窦房结组织HCN2和HCN4蛋白表达减少,这可能是糖尿病相关窦房结功能障碍的分子机制之一。尚需进一步的电生理学研究证实。
参考文献:
[1]Linnemann B,Janka HU.Prolonged QTc interval and elevated heart rate identify the type 2 diabetic patient at high risk for cardiovascular death.The Bremen Diabetes Study[J].Exp Clin Endocrinol Diabetes,2003,111(4):215-222.
[2]Howarth FC,Al-Sharhan R,Al-Hammadi A,etal.Effects of streptozotocin-induced diabetes on action potentials in the sinoatrial node compared with other regions of the rat heart[J].Mol Cell Biochem,2007,300(1/2):39-46.
[3]Hicks KK,Seifen E,Stimers JR,etal.Effects of streptozotocin-induced diabetes on heart rate,blood pressure and cardiac autonomic nervous control[J].J Auton Nerv Syst,1998,69(1):21-30.
[4]Zhang L,Parratt JR,Beastall GH,etal.Streptozotocin diabetes protects against arrhythmias in rat isolated hearts:role of hypothyroidism[J].Eur J Pharmacol,2002,435(2/3):269-276.
[5]Li XS,Tanz RD,Chang KS.Effect of age and methacholine on the rate and coronary flow of isolated hearts of diabetic rats[J].Br J Pharmacol,1989,97(4):1209-1217.
[6]Kofo-Abayomi A,Lucas PD.A comparison between atria from control and streptozotocin-diabetic rats:the effects of dietary myoinositol[J].Br J Pharmacol,1988,93(1):3-8.
[7]Ludwig A,Zong X,Jeglitsch M,etal.A family of hyperpolarization-activated mammalian cation channels[J].Nature,1998,393(6685):587-591.
[8]Shi W,Wymore R,Yu H,etal.Distribution and prevalence of hyperpolarization-activated cation channel(HCN) mRNA expression in cardiac tissues[J].Circ Res,1999,85(1):e1-6.
[9]Huang X,Yang P,Yang Z,etal.Age-associated expression of HCN channel isoforms in rat sinoatrial node[J].Exp Biol Med(Maywood),2016,241(3):331-319.
[10]Safa-Tisseront V,Ponchon P,Laude D,etal.Contribution of the autonomic nervous system to blood pressure and heart rate variability changes in early experimental hyperthyroidism[J].Eur J Pharmacol,1998,352(2-3):247-255.
[11]Breithardt G,Seipel L,Loogen F.Sinus node recovery time and calculated sinoatrial conduction time in normal subjects and patients with sinus node dysfunction[J].Circulation,1977,56(1):43-50.
[12]Narula OS,Shantha N,Vasquez M,etal.A new method for measurement of sinoatrial conduction time[J].Circulation,1978,58(4):706-714.
[13]Maier SK,Westenbroek RE,Yamanushi TT,etal.An unexpected requirement for brain-type sodium channels for control of heart rate in the mouse sinoatrial node[J].Proc Natl Acad Sci USA,2003,100(6):3507-3512.
[14]Amos AF,McCarty DJ,Zimmet P.The rising global burden of diabetes and its complications: estimates and projections to the year 2010[J].Diabet Med,1997,14(Suppl 5):S1-85.
[15]Dhalla NS,Pierce GN,Innes IR,etal.Pathogenesis of cardiac dysfunction in diabetes mellitus[J].Can J Cardiol,1985,1(4):263-281.
[16]Dai S,Thompson KH,McNeill JH.One-year treatment of streptozotocin-induced diabetic rats with vanadyl sulphate[J].Pharmacol Toxicol,1994,74(2):101-109.
[17]Luo M,Guan X,Luczak ED,etal.Diabetes increases mortality after myocardial infarction by oxidizing CaMKII[J].J Clin Invest,2013,123(3):1262-1274.
[18]Howarth FC,Jacobson M,Shafiullah M,etal.Effects of insulin treatment on heart rhythm,body temperature and physical activity in streptozotocin-induced diabetic rat[J].Clin Exp Pharmacol Physiol,2006,33(4):327-331.
[19]Howarth FC,Jacobson M,Naseer O,etal.Short-term effects of streptozotocin-induced diabetes on the electrocardiogram,physical activity and body temperature in rats[J].Exp Physiol,2005,90(2):237-245.
[20]DiFrancesco D.Pacemaker mechanisms in cardiac tissue[J].Annu Rev Physiol,1993,55:455-472.
[21]Robinson RB,Siegelbaum SA.Hyperpolarization-activated cation currents:from molecules to physiological function[J].Annu Rev Physiol,2003,65:453-480.
[22]Yasui K,Liu W,Opthof T,etal.I(f) current and spontaneous activity in mouse embryonic ventricular myocytes[J].Circ Res, 2001,88(5):536-542.
[23]Stieber J,Hofmann F,Ludwig A.Pacemaker channels and sinus node arrhythmia[J].Trends Cardiovasc Med,2004,14(1):23-28.
[24]Nof E,Antzelevitch C,Glikson M.The Contribution of HCN4 to normal sinus node function in humans and animal models[J].Pacing Clin Electrophysiol,2010,33(1):100-106.
[25]Laish-Farkash A,Glikson M,Brass D,etal.A novel mutation in the HCN4 gene causes symptomatic sinus bradycardia in Moroccan Jews[J].J Cardiovasc Electrophysiol,2010,21(12):1365-1372.
Expression of HCN channel isoforms in streptozotocin-induced diabetic rats
ZHONG Nier, ZHENG Xiaopu, MA Aiqun, WANG Huan, HUANG Xin*
(DepartmentofCardiology,FirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China;*Correspondingauthor,E-mail:hearthx@126.com)
Abstract:ObjectiveTo investigate the sinoatrial node function and the expression of the HCN channel isoforms in sinoatrial node in streptozotocin-induced diabetic rats.MethodsHealthy male 3-month-old SD rats were divided into streptozotocin-induced diabetes group and control group. The intrinsic heart rate, sinoatrial conduction time and sinoatrial node recovery time were tested and compared between the two groups. The optical mapping was used to identify the sinoatrial node tissue. The expression levels of HCN channel isoforms(HCN1,HCN2,HCN3 and HCN4) in sinoatrial node were determined by Western blot.ResultsCompared with control group, the rest heart rate and intrinsic heart rate were reduced in streptozotocin-induced diabetes group with the prolonging of sinoatrial node conduction time and sinoatrial node recovery time(P<0.05). Western blot analysis revealed the expression of HCN2 and HCN4 proteins in streptozotocin-induced diabetes group was lower than in control group(P<0.01).ConclusionThe expression of HCN2 and HCN4 proteins is decreased in streptozotocin-induced diabetic rats, which might be one of the molecular mechanisms of the impaired sinoatrial node function associated with diabetes.
Key words:HCN channel;streptozotocin;diabetes;sinoatrial node
基金项目:国家自然科学基金资助项目(81100132);西安交通大学第一附属医院基金资助项目(2015YK26)
作者简介:钟妮尔,女,1992-04生,硕士
收稿日期:2016-03-01
中图分类号:R363
文献标志码:A
文章编号:1007-6611(2016)05-0406-05
DOI:10.13753/j.issn.1007-6611.2016.05.002

