水体和动物源性食品中残留抗生素的新型检测技术研究进展*
谭 韬,唐 倩 综述,伍 彬,刘应杰,曾 雪 审校
(重庆医药高等专科学校药物分析教研室 401331)
水体和动物源性食品中残留抗生素的新型检测技术研究进展*
谭韬,唐倩 综述,伍彬△,刘应杰,曾雪 审校
(重庆医药高等专科学校药物分析教研室401331)
[关键词]残留抗生素;检测技术;样品预处理;联用技术
由于医疗、个人护理品、养殖等领域几十年来的抗生素滥用,有的抗生素在土壤中的残留量已达到了有机农药污染物的水平[1],所带来的一系列问题已引起警觉。据报道,2013年中国抗生素的产量达12.12万吨,成为世界第一抗生素生产和消费大国。目前常见抗生素检测方法为微生物检测法、免疫学分析法、电磁传感器、现代仪器法等[2-4]。微生物检测法用于抗生素残留检查的初筛,存在耗时、定性差等问题;免疫法的检测对象较为单一;传感器虽可快速检测多种抗生素,但难以确认种类,而现代仪器法能同时对多种残留抗生素进行准确检测。本文就国内外对自然水体、蜂蜜、牛奶、水产品、禽肉、蛋等样品中残留抗生素的检测技术、样品预处理及应用前景进行综述,其中重点介绍以色谱法为代表的现代仪器检测技术。
1自然水体
60多种抗生素在我国地表水中被测出,其总体浓度与检出频率均高于其他国家。这些抗生素主要来源于制药厂和医院废水的排放、畜牧养殖的废水及粪便等残渣、生活污水。
自然水体中抗生素多为ng/L~μg/L级别,因此良好的样品富集方法、高效的分离手段及高灵敏检测器就尤为重要。杨常青等[5]采用固相萃取-液相色谱-串联质谱(SPE-HPLC-MS/MS)法建立了水中磺胺(SAs)、氟喹诺酮(FQs)、四环素(TCs)和氯霉素(CAPs)4类共16种抗生素同时检测的方法。该研究选择了HLB作为固相萃取填料,采用两种溶剂(甲醇及含氨水的甲醇)组合对目标抗生素进行洗脱,在减少洗脱溶剂用量的同时又提高了回收率,获得了良好的富集效果,还利于下一步的氮吹操作。该方法的回收率为69.5%~122.6%,检出限达到0.05~0.32 ng/L。
Hu等[6]采用冻干法(FDP)对样品进行富集,采用LC-MS/MS法共测量了水样中26种残留抗生素。这种富集方法操作简单,可同时对6大类26种抗生素进行富集,能减小目标分析物的损耗,回收率高,优于液液萃取和固相微萃取技术。富集后的样品,应选用适合ESI-MS系统的溶剂溶解,必要时需进行冷冻离心(4 ℃)及过滤处理。
较于高效液相色谱(HPLC),超高效液相色谱(UPLC)具有更省时、更灵敏、分离效果更好、抗基质干扰能力更强等特点。Gros等[7]采用SPE-UPLC-MS/MS对医院、城市废水及自然水体中的53种残留抗生素及其代谢产物进行了检测。Gros在HLB和MCX间也选了净化富集能力更好的HLB。研究表明富集前加入EDTA-Na2并采用低pH条件(pH=2.5),可获得更好的富集效率。该研究用新型Acquity HSS T3色谱柱取代了C18,使用梯度洗脱技术后更能大大改善峰形、提高分离效果;检出限达到了ng/L级别,回收率为30%~120%。
目前,HLB材料对水体中残留抗生素具有较高的富集效率而被优先采用,研究也表明C18柱对于自然水体中的喹诺酮类抗生素有较高的富集效率[8]。由于MS/MS灵敏度高,可对紫外吸收较低的抗生素(如氨基糖苷类)进行检测,因此常与LC联用。由于MS强大的定性、定量分析能力,甚至可认为LC不过是MS的进样系统。
2动物组织类食品
在养殖业中作为治病和促生长药物的抗生素被动物大量摄入;此外,动物还会通过进食(如水、食物、花蜜等[9])摄入环境中残留的抗生素。其中,90%的抗生素会以原形和活性代谢产物等形式排到自然界中[10],使水环境出现持续低浓度抗生素污染,不光会对水生生物产生远期毒性作用,还会使得水环境中微生物群落产生对抗生素的耐药性;另一部分抗生素将在动物组织内残留蓄积进入人类食物链,导致人类进一步滥用抗生素。由于动物组织样品较复杂,含有大量的蛋白质和脂类,如不进行合适的样品预处理(提取、净化)及富集,会对色谱柱产生不可逆转的破坏,因此良好的样品预处理方案将有助于残留抗生素的准确检测。
萃取法是最经典的样品预处理方案,该方法简单易行,在对动物组织中残留抗生素的研究中用得较多。Dasenaki等[11]采用UHPLC-ESI-MS/MS对鱼、猪、家禽肉中的17种磺胺类抗生素和5种四环素类抗生素进行了分离分析。该研究采用萃取法对均浆后的样品进行提取净化,线性范围为20~150 μg/kg,线性相关系数高于0.98,检出限为10~20 μg/kg。
Abdallah等[12]采用了优化了的“QuEChERS” 方法(Quick、Easy、Cheap、Rugged、Safe) 对样品进行了快速样品前处理,使用HPLC-HRMS对猪、牛、羊、鸡的肾、肝、肉中22种磺胺类抗生素及其代谢产物进行了检测。该研究检出限为3~26 μg/kg,定量限为1~88 μg/kg,回收率为88%~112%。
SPE法也常用于这个领域中。Jafari等[13]采用C18富集了鸡肉中的残留抗生素,并第一次采用离子淌度谱检测了禽肉中的3种抗生素。离子淌度谱具有检出限低、响应快速、便携性好的特点。该研究采用了连续电晕放电的电离源,获得了更高数量级的离子流,提高了检测分辨能力,线性关系可达0.99以上,定量限为12.5~19.7 μg/kg。
湍流色谱法是一种直接在线进样预处理技术,能使大分子的生物基质成分与小分子抗生素良好分离。Bousova等[14]采用LC-MS/MS对鸡肉中36种抗生素进行了分离分析。该方法先用乙腈与2%三氯乙酸(45∶55,v/v)对均浆后的鸡肉样品进行萃取、离心、过滤之后采用湍流色谱法进行富集净化。结果表明,湍流色谱法的富集效率优于固相萃取技术,该方法对24种抗生素及其代谢产物的检出限达到了0.3 μg/kg,定量限为1.0 μg/kg,回收率为80%~120%。
目前LC-MS/MS在动物源性食品中残留抗生素检测中大量应用,我国也有成熟的检测标准(如,GB/T 21317-2007,GB/T21320-2007,GB/T 21315-2007,GB/T 21312-2007等)。在与LC联用后,MS不光可以对目标抗生素进行定性、定量、结构分析,还能对抗生素在动物体内的代谢产物进行定量和结构分析,这大大方便了药代动力学的研究[15]。
3蜜、乳、蛋等
抗生素也会在动物所产的蜜、乳、蛋中残留[16],各国都明确规定了蜜、乳、蛋中抗生素最大允许残留量。
3.1色谱质谱联用技术各国基于LC-MS建立起来的蜜、乳、蛋中抗生素检测方法(如我国,GB/T 22968-2008,GB/T 18932.25-2005,GB/T 23411-2009等),基本上采用SPE法对样品进行净化富集。
Bohm等[17]用HLB材料的SPE法对蜂蜜样品进行了预处理和富集,然后采用LC-MS/MS对样品中37种抗生素进行了准确测量,确定限(CCα)达到了7.5~12.9 μg/kg,检测容量(CCβ) 达到9.4~19.9 μg/kg,回收率为92%~106%。
Jiménez等[18]也采用了LC-MS/MS对蛋进行检测。不同的是,该研究采用了加压萃取技术(PLE)对蛋中残留抗生素进行了净化和富集。提取物无需再进行其他的净化处理,用微孔滤膜过滤后即可直接采用UHPLC-MS/MS进行检测。该方法一共测定了蛋中41种残留抗生素,CCα可达到0.5~3.0 μg/L,CCβ 达到1.0~3.0 μg/L。但结果表明,该研究对蛋中残留四环素的定量分析能力略为逊色。为了得到较高的萃取效率,Xu等[19]采用了改良后的中空纤维液相微萃取技术(HF-SEBLLME)。这种技术需要一种含有金属丝的中空纤维管,内充萃取液,放入样品溶液中。开启磁力搅拌器,含金属丝的中空纤维管会快速转动,能大大提高萃取效率。提取物经富集后,采用GC进行检测,线性范围为0.20~20.00 ng/mL,检出限为0.02~0.06 ng/mL,定量限为0.07~0.19 ng/mL,回收率为93.6%~104.6%。研究数据表明这种萃取技术拥有更低的检出限,优势明显。
3.2毛细管电泳技术(CE)邵钰秀等[20]建立了一种采用电堆积方式在线富集的毛细管电泳技术对牛奶、鸡蛋和蜂蜜中四环素、土霉素、强力霉素进行了检测。在正向进样电压作用下,pH值为3的样品溶液中以阳离子形态存在的TC、OTC和DC在高场作用下快速电泳进入毛细管,当其穿越低电导率样品和高电导率运行缓冲液界面时,由于进入低场区,其运动速度将立即降低,发生分析物离子在样品与缓冲液界面处的堆积,由此实现了对分析物的在线富集。在优化条件下,四环素、土霉素和强力霉素的富集倍数分别为86、54和54,检出限为1.7~2.1 μg/kg,1.8~2.2 μg/kg和1.9~2.2 μg/kg,定量限均为20 μg/kg。
分子印迹技术也可以用于样品的预处理和富集,具有非常高的选择性,称为分子印迹固相萃取技术[21](MIPs-SPE)。Moreno-González等[22]就利用了这种技术,采用CE-MS联用技术对牛奶中8种喹诺酮类抗生素进行了检测。首先他在毛细管的一端内嵌进自制的分子印迹材料,通过加压进样的方式压入约22 μL样品溶液,然后压入甲醇/水/氨水(60/37/3) 溶液(约60 nL)进行分子印迹材料上保留物的洗脱。加电压前,还需用缓冲液将这段洗脱物从吸附材料上替换下来。该方法的回收率为70.0%~102.3%。该研究认为此富集技术与在线富集技术并不一样,因此称为管内嵌入式富集技术(In-line-MISPE)。该研究还对比了不同方法在测量牛奶中喹诺酮类抗生素时的检出限和定量限,见表1,该研究所提出的方法具有较高的准确性和灵敏度。
4现状与展望
抗生素残留带来的一系列问题已引起了民众和政府的重视。研究者们依然在孜孜不倦地寻找着富集效率更高的样品预处理方法,以及分离效率更好、检测灵敏度更高、可测种类更多的分离检测手段,见表2。
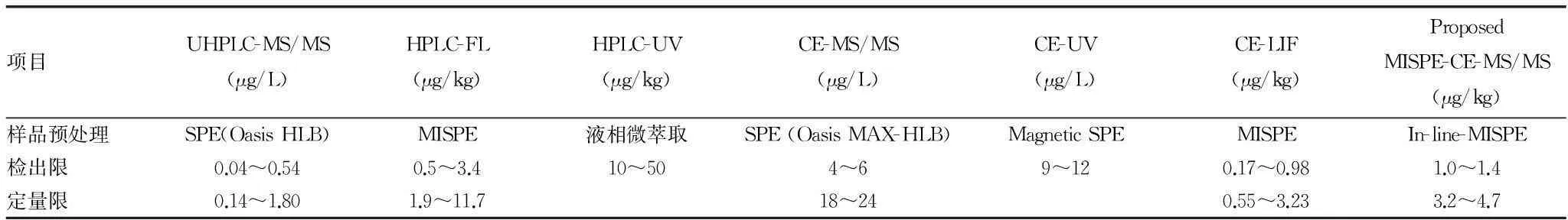
表1 不同方法在测量牛奶中喹诺酮类药物时的检出限和定量限对比

表2 样品净化和富集技术及分离和检测方法的优劣势比较

续表2 样品净化和富集技术及分离和检测方法的优劣势比较
对于抗生素残留的研究将向着两个方向发展:(1)快速准确检验,其研究重点集中在高效快速的检测手段开发。目前的研究希望整个样品的分析时间能控制在25 min以内,可无论是SPE等预处理法,还是LC-MS/MS等检测技术,都存在着耗时、昂贵、对操作者技术要求过高等问题,难以应对当前广泛的残留抗生素检测需求;而一些快速筛查技术,却又存在着定性弱、准确性较差、检测种类单一等问题。未来新型检测手段必将面临方便、快捷、准确、可同时检测多种抗生素等要求的考验。(2)抗生素的生物代谢情况及环境中的分布、转归、降解等情况的研究。这类研究将有助于揭开抗生素在生物体内代谢情况和环境降解情况,也能为残留抗生素的检测寻找合适的残留标识物;还能揭示残留抗生素在环境中的转归及分布规律,为残留抗生素的环境修复工程提供准确有效的数据和技术支持。
参考文献
[1]Thiele-Bruhn S.Phamaceutical antibiotic compounds insoils-areview[J].J Plant Nutr Soil Sci (1999),2003,166(2):145-167.
[2]Cheng L,Shen J,Wang Z,et al.A sensitive and specific ELISA for determining a residue marker of three quinoxaline antibiotics in swine liver[J].Anal Bioanal Chem,2013,405(8):2653-2659.
[3]Peng DP,Ye SQ,Wang YL,et al.Development and validation of an indirect competitive enzyme-linked immunosorbent assay for the screening of tylosin and tilmicosin in muscle,liver,milk,honey and eggs[J].J Agric Food Chem,2012,60(1):44-51.
[4]Conzuelo F,Ruiz-Valdepenas Montiel V,Campuzano S,et al.Rapid screening of multiple antibiotic residues in milk using disposable amperometric magnetosensors[J].Anal Chim Acta,2014,820(1):32-38.
[5]杨常青,王龙星,侯晓虹,等.大辽河水系河水中16种抗生素的污染水平分析[J].色谱,2012,30(8):756-762.
[6]Hu FY,He LM,Yang JW,et al.Determination of 26 veterinary antibiotics residues in water matrices by lyophilization in combination with LC-MS/MS[J].J Chromatogr B Analyt Technol Biomed Life Sci,2014,949(1):79-86.
[7]Gros M,Rodriguez-Mozaz S,Barcelo D.Rapid analysis of multiclass antibiotic residues and some of their metabolites in hospital,urban wastewater and river water by ultra-high-performance liquid chromatography coupled to quadrupole-linear ion trap tandem mass spectrometry[J].J Chromatogr A,2013(1292):173-188.
[8]Turiel E,Bordin G,Rodriguez AR.Trace enrichment of (fluoro)quinolone antibiotics in surface waters by solid-phase extraction and their determination by liquid chromatography-ultraviolet detection[J].J Chromatogr A,2003,1008(2):145-155.
[9]Berendsen BJ,Zuidema T,De Jong J,et al.Discrimination of eight chloramphenicol isomers by liquid chromatography tandem mass spectrometry in order to investigate the natural occurrence of chloramphenicol[J].Anal Chim Acta,2011,700(1/2):78-85.
[10]Ching-Hua H,Renew JE.Assessment of potential antibiotic contaminants in water and preliminary occurrence analysis[J].J Contem Water Res Educat,2001,120(1):30-40.
[11]Dasenaki ME,Thomaidis NS.Multi-residue determination of seventeen sulfonamides and five tetracyclines in fish tissue using a multi-stage LC-ESI-MS/MS approach based on advanced mass spectrometric techniques[J].Anal Chim Acta,2010,672(1/2):93-102.
[12]Abdallah H,Arnaudguilhem C,Jaber F,et al.Multiresidue analysis of 22 sulfonamides and their metabolites in animal tissues using quick,easy,cheap,effective,rugged,and safe extraction and high resolution mass spectrometry (hybrid linear ion trap-Orbitrap)[J].J Chromatogr A,2014,1355(1):61-72.
[13]Jafari MT,Khayamian T,Shaer V,et al.Determination of veterinary drug residues in chicken meat using corona discharge ion mobility spectrometry[J].Anal Chim Acta,2007,581(1):147-153.
[14]Bousova K,Senyuva H,Mittendorf K.Quantitative multi-residue method for determination antibiotics in chicken meat using turbulent flow chromatography coupled to liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2013,1274(1):19-27.
[15]Jin HE,Lee KR,Kang IH,et al.Determination of zabofloxacin in rat plasma by liquid chromatography with mass spectrometry and its application to pharmacokinetic study[J].J Pharm Biomed Anal,2011,54(4):873-877.
[16]Donkor ES,Newman MJ,Tay SC,et al.Investigation into the risk of exposure to antibiotic residues contaminating meat and egg in Ghana[J].Food Control,2011,22(6):869-873.
[17]Bohm DA,Stachel CS,Gowik P.Validation of a multi-residue method for the determination of several antibiotic groups in honey by LC-MS/MS[J].Anal Bioanal Chem,2012,403(10):2943-2953.
[18]Jiménez AR,Guiteras J.Development and validation of a multiclass method for the analysis of antibiotic residues in eggs by liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2011,1218(11):1443-1451.
[19]Xu X,Liang FH,Shi JY,et al.Determination of hormones in milk by hollow fiber-based stirring extraction bar liquid-liquid microextraction gas chromatography mass spectrometry[J].Anal Chim Acta,2013,790(1):39-46.
[20]邵钰秀,余云娟,肖晶,等.电堆积毛细管电泳法检测食品中四环素类抗生素残留[J].河北大学学报:自然科学版,2013,33(2):161-166.
[21]Lv YK,Zhang JQ,He YD,et al.Adsorption-controlled preparation of molecularly imprinted hybrid composites for selective extraction of tetracycline residues from honey and milk[J].New J Chem,2014,38(2):802-808.
[22]Moreno-González D,Lara FJ,Gámiz-Gracia L,et al.Molecularly imprinted polymer as in-line concentrator in capillary electrophoresis coupled with mass spectrometry for the determination of quinolones in bovine milk samples[J].J Chromatogr A,2014,1360(1):1-8.
doi:·综述·10.3969/j.issn.1671-8348.2016.09.037
* 基金项目:重庆市卫生与计划生育委员会医学科研计划项目(2015MSXMD99);重庆医药高专自科项目(CQZ2013109,YGZ2014106)。
作者简介:谭韬(1981-),讲师,硕士,主要从事药物与生物大分子相互作用方向的研究。△通讯作者,E-mail:wubin3412@163.com。
[中图分类号]X832;S859.84
[文献标识码]A
[文章编号]1671-8348(2016)09-1271-04
(收稿日期:2015-07-08修回日期:2015-12-27)

