金属氧化物对霍林河褐煤催化热解行为的影响
廖厚琪,吴华东,於 暕,张 严,郭 嘉
(1.武汉工程大学化工与制药学院,湖北 武汉,430073;2.武汉工程大学绿色化工过程教育部重点实验室,湖北 武汉,430073)
金属氧化物对霍林河褐煤催化热解行为的影响
廖厚琪,吴华东,於暕,张严,郭嘉
(1.武汉工程大学化工与制药学院,湖北 武汉,430073;2.武汉工程大学绿色化工过程教育部重点实验室,湖北 武汉,430073)
摘要:选用4种金属氧化物(CaO、Al2O3、Fe2O3、NiO)作为催化剂对霍林河褐煤进行热解,利用热重分析技术和动力学模型对褐煤热解行为进行分析,研究不同金属氧化物对褐煤热解催化效果的影响。结果表明,4种金属氧化物催化剂的加入均能有效提高褐煤热解的转化率,其对褐煤热解转化率的促进作用顺序为:NiO>CaO>Fe2O3>Al2O3;在褐煤整个热解过程中,CaO、Fe2O3 及NiO均表现出良好的催化作用,而 Al2O3仅在热缩聚阶段有一定的催化效果;褐煤在活泼热解阶段和热缩聚阶段的热解过程分别可用一级单一反应模型和二级单一反应模型进行描述,4种金属氧化物在活泼热解阶段对褐煤的催化效果为:NiO> Fe2O3>CaO>Al2O3,在热缩聚阶段对褐煤的催化效果为:Fe2O3>CaO>NiO>Al2O3。
关键词:褐煤;催化热解;热重分析;动力学;金属氧化物;催化剂
煤催化热解是煤资源分级、洁净以及综合利用的一个重要研究方向,经过催化过程,不仅可以提高煤热解转化率,调控其热解产物的组成与分布,并可降低反应温度,使热解条件变得比较温和[1]。褐煤具有挥发分高、含碳量低、高水分等特点,其品质次于烟煤和无烟煤,如果将褐煤直接用于燃烧,不仅放热量少,而且还会造成对空气的严重污染。通过催化热解提质,不仅可以降低褐煤的热解温度,提高其热解转化率,并能提高目标产物的产率[2-3],因此通过褐煤的催化热解实现褐煤的高效利用具有重要的研究意义。
利用热重分析技术分析煤的热解行为具有操作性强、准确可控等特点,并且依据热解失重曲线(TG)和失重速率曲线(DTG)可实现对煤热解过程的定性分析和定量计算[4]。煤的燃烧、热解、气化反应动力学是热重分析技术在煤炭加工转化技术研究中的重要应用, 近年来取得了较大的进展和广泛应用[5-6],其分析既有助于准确地把握热解过程与机理,也有助于更好地解释实验现象。
目前,煤热解催化剂的种类大都集中在碱金属、碱土金属、过渡金属化合物、沸石和分子筛催化剂,另外,还有为降低催化剂成本而选择的天然矿物质和较廉价型催化剂[7]。现有研究发现金属氧化物催化剂对煤热解具有不同程度的促进作用,但其对煤催化热解行为的影响还有待深入研究。为此,本研究选用4种不同种类的金属氧化物(CaO、Al2O3、Fe2O3、NiO)作为催化剂对内蒙古霍林河褐煤进行热解,利用热重分析技术和动力学模型对褐煤热解行为进行分析,研究不同金属氧化物催化剂对褐煤热解催化效果的影响,以期获得对霍林河褐煤热解具有优良催化效果的催化剂,进而为实现对褐煤的高效利用提供参考。
1试验
1.1煤样的制备及试剂
实验所用原煤为内蒙古霍林河褐煤,其工业分析及元素分析结果如表1所示。按照GB474—1996将原煤进行减灰处理后,经破碎、研磨,过筛至粒度为250 μm以下,在80 ℃下干燥12 h得到干燥煤样。实验所用催化剂为:CaO、Al2O3、Fe2O3和NiO,均为分析纯。
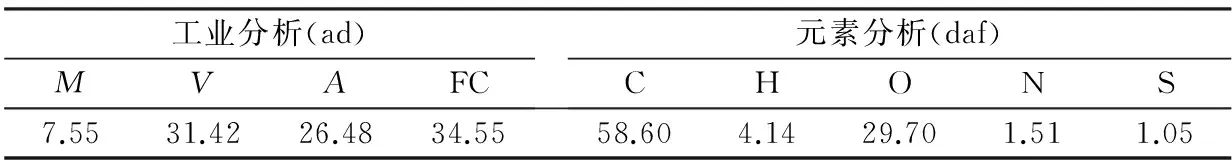
表1 霍林河褐煤的工业分析及元素分析结果(wB/%)
1.2试验方法
按照一定比例称取干燥煤样和催化剂,其中所添加催化剂中金属原子的质量与干燥煤样质量比为5%,即向煤样中分别添加6.54%CaO、8.63%Al2O3、6.66%Fe2O3和5.98%NiO,采用物理混合法混匀后存于密封玻璃容器中备用。采用美国TA公司生产的Q50热重分析仪对其热解特性进行分析,操作条件:取样约10 mg,载气为氮气,压力为常压,以25 ℃/min的恒定升温速率由室温升至850 ℃,保护性气体流量为40 mL/min,反应性气体流量为80 mL/min。
2结果与讨论
2.1原煤的热解分析
原煤在N2气氛下的热解TG和DTG曲线如图1所示,从图1中TG曲线可以看出,原煤的热解程度随热解温度的升高而逐渐加深,其中在干燥脱气阶段(350 ℃以前) 煤样的质量减少比较缓慢,在活泼热解阶段(350 ~550 ℃) 和热缩聚阶段(550 ~850 ℃) 煤样的质量明显减少,当升温至800 ℃时,原煤的转化率可达32.57%。这是因为,煤样在干燥脱气阶段主要是脱水及脱除吸附的气体,并发生脱侧链羧基反应脱除大分子结构中镶嵌的部分小分子物质[8];在活泼热解阶段,煤样主要发生裂解和解聚反应,生成包括煤气、焦油及水在内的大量挥发物,此外,煤中的大分子还会发生少量的内部缩合反应[9];在热缩聚阶段主要发生煤分子间的热缩聚反应,析出的焦油量极少,挥发物主要是煤气,700 ℃后煤气的主要成分是氢气[10]。由图1中DTG曲线可以看出,原煤在465 ℃时出现第一个热解峰,热解失重速率峰值为0.1148%/℃;在735 ℃时出现第二个热解峰,热解失重速率峰值为0.0508%/℃,这是由煤的热裂解反应和缩聚反应共同作用的结果,因为缩聚芳构化过程相对缓慢且不会形成显著的失重峰,而热裂解过程因为反应异常剧烈会形成显著的失重峰。
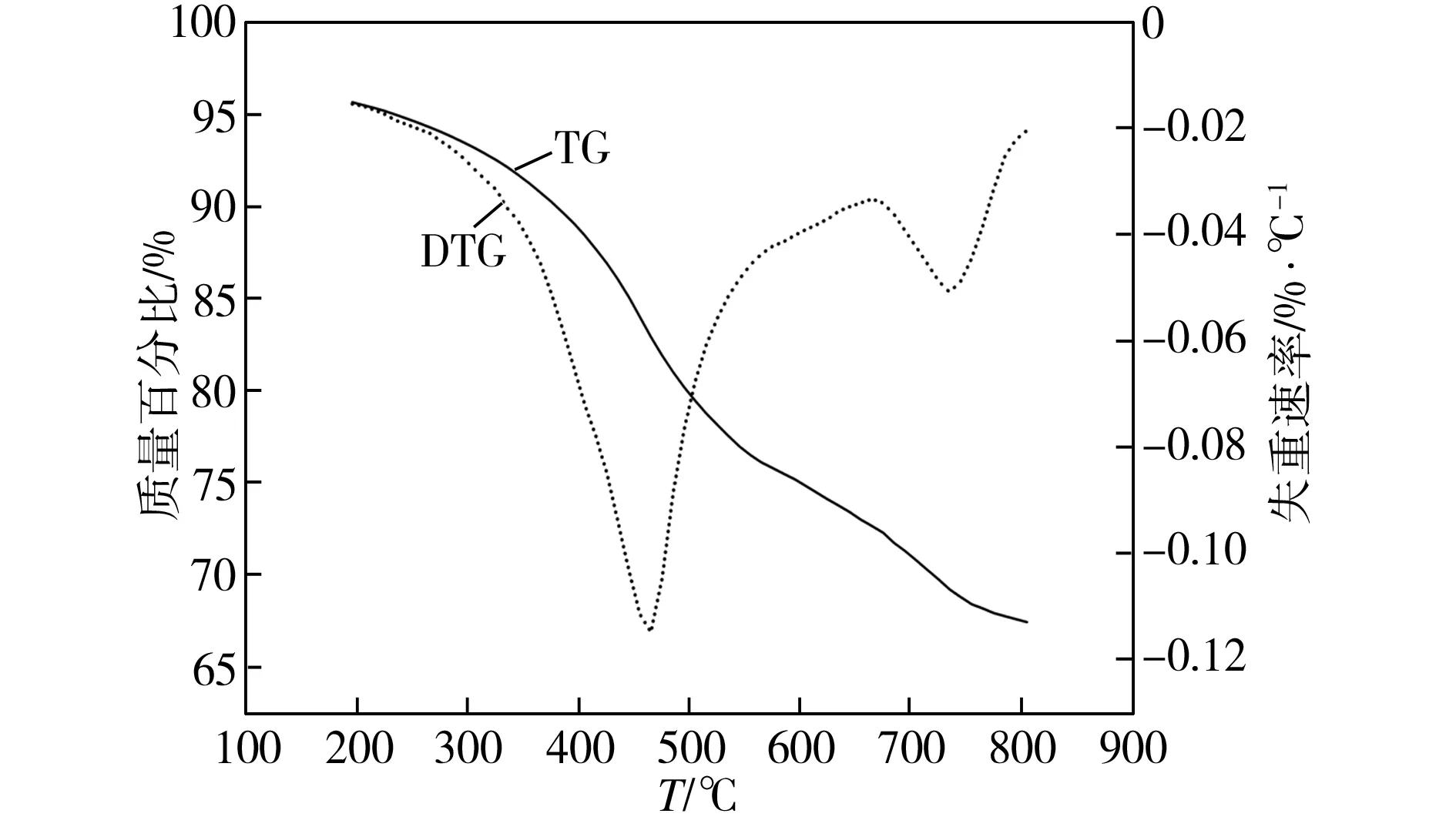
图1 原煤在N2下的热解TG/DTG曲线
2.2CaO催化褐煤热解分析
添加6.54% CaO后煤的热解TG和DTG曲线如图2所示,从图2中TG曲线可看出,添加CaO后煤样的热解转化率较原煤明显提高,最终热解转化率达到34.85%;由图2中DTG曲线比较可知,添加CaO煤样在活泼热解阶段的热解失重速率一直高于原煤,在466 ℃时出现第一个热解峰,峰温与原煤相近,但失重速率峰值相比原煤提高0.0045%/℃;在热缩聚阶段的热解失重速率较原煤有较大提高,在728 ℃时出现第二个热解峰,与原煤比较,峰温降低7 ℃,失重速率峰值提高0.0034%/℃。由此表明,添加CaO后有利于促进煤样的热解,可能是因为在氧化钙颗粒的内外表面具有极性的裂解活化位,当芳香族化合物被吸附在活化位上后,其π型电子云被破坏而失去稳定性,使芳香环上C—C键的断裂更容易发生,降低裂解活化能,从而促进裂解反应的进行[11]。
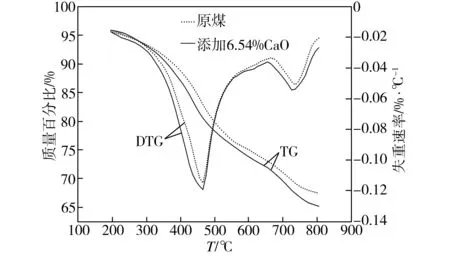
图2 添加6.54% CaO后煤的热解TG/DTG曲线
Fig.2 TG/DTG curves of coal pyrolysis by adding 6.54% CaO
2.3Al2O3催化褐煤热解分析
添加8.63% Al2O3后煤的热解TG和DTG曲线如图3所示。由图3中TG曲线可以看出,添加Al2O3后煤样的热解转化率较原煤明显提高,最终热解转化率达到33.79%。由图3中DTG曲线可以看出,添加Al2O3后煤样在活泼热解阶段与原煤的热解行为相似,峰值有所降低但并不明显,由此表明,Al2O3在此阶段对褐煤热解的催化作用有限,而在热缩聚阶段后期添加Al2O3后煤的热解失重速率较原煤有所提高,在727 ℃时出现第二个热解峰,与原煤比较,峰温降低8 ℃,失重速率峰值提高0.0031%/℃。这是因为,Al2O3在高温阶段对脱烷基和脱氢反应具有良好的催化活性,影响煤的气化及催化氢转移到煤分子中[12]。因此,Al2O3对煤样热解的催化效果更多体现在热缩聚阶段。

图3 添加8.63% Al2O3后煤的热解TG/DTG曲线
Fig.3 TG/DTG curves of coal pyrolysis by adding 8.63% Al2O3
2.4Fe2O3催化褐煤热解分析
添加6.66% Fe2O3后煤的热解TG和DTG曲线如图4所示。从图4中TG曲线可以看出,添加Fe2O3后煤样较原煤的热解转化率有明显提高,最终热解转化率达到34.65%。从图4中DTG曲线可以看出,添加Fe2O3后煤样在450 ℃之前的热解失重速率一直高于原煤,表明添加Fe2O3对煤热解的干燥脱气阶段和活泼热解阶段前期有明显的促进作用;在活泼热解阶段的热解峰在453 ℃时出现,较原煤降低12 ℃,但热解失重速率峰值与原煤相比降低0.0033%/℃,这是因为,Fe2O3的加入促进部分活性结构在相对较低的温度下发生断裂,而在热解峰处的裂解反应减少;在550~670 ℃的热解温度范围内,添加Fe2O3后煤样的热解行为与原煤相似,而在670 ℃以后其热解失重速率较原煤有显著提高。由DTG曲线还可看出,添加Fe2O3后煤样在733 ℃时出现热缩聚阶段的热解峰,峰温与原煤相近,但热解失重速率峰值较原煤提高0.0060%/℃。由此表明,Fe2O3能有效促进煤样的热解,使挥发物的析出量有所提高。这是因为,Fe2O3能促进煤热解过程中自由基的生成,自由基相互碰撞再次生成小分子气体逸出,导致热解失重率的增加,Fe2O3能使半焦的碳结构石墨化和有序化程度降低,使半焦活性位增加,从而在热缩聚阶段促进作用明显[13-14]。
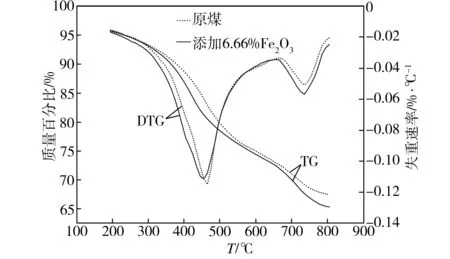
图4 添加6.66% Fe2O3后煤的热解TG/DTG曲线
Fig.4 TG/DTG curves of coal pyrolysis by adding 6.66% Fe2O3
2.5NiO催化褐煤热解分析
添加5.98% NiO后煤的热解TG和DTG曲线如图5所示。由图5中TG曲线可以看出,添加NiO后煤样较原煤的热解转化率有明显提高,最终热解转化率达到35.02%。从图5中DTG曲线可以看出,与原煤相比,添加NiO后煤在活泼热解阶段前期的热解失重速率明显提高,而峰温及失重速率峰值均无明显变化;在热缩聚阶段,NiO对煤样热解失重速率提高较快,在725 ℃时出现热解峰,该热解峰的峰温与原煤相比降低10 ℃,同时失重速率峰值较原煤提高0.0041%/℃。由此表明,NiO对原煤热解具有明显的促进作用,其原因是NiO受热后产生金属离子,其空d轨道能对煤中含氧官能团中的氧(包括羟基、烃氧基)或不饱和烃中π键产生化学吸附,从而有效降低煤中大分子间作用力,促进了更多挥发份的产生,促进了煤的热解[15]。

图5 添加5.98% NiO后煤的热解TG/DTG曲线
Fig.5 TG/DTG curves of coal pyrolysis by adding 5.98% NiO
2.6褐煤热解动力学分析
目前常用的动力学模型为单一反应模型及分布活化能模型(DAEM)。何涛[3]等用单一反应模型对铜川煤催化加氢热解进行动力学分析并取得较好的线性拟合效果。因此本文采用单一反应模型进行煤热解动力学分析。单一反应模型一般采用一级或n级,因本研究煤样有两个主要热解阶段,经试验计算后分别采用一级单一反应模型及二级单一反应模型对两个热解线性区域进行动力学分析。
采用一级单一反应模型对霍林河褐煤的活泼热解阶段进行动力学分析。将动力学方程进行整理后并采用Coats-Redfern积分法近似后得到积分型方程:
(1)
式中:X为煤热解转化率,%;β为升温速率,K/s;E为活化能,kJ/mol;R为气体常数,R=8.314×10-3kJ/(mol·K) ;T为热力学温度,K;A为频率因子,s-1。
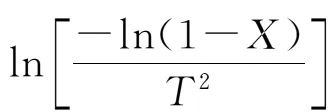
运用一级动力学方程计算添加不同金属氧化物后煤的反应动力学参数见表2。从表2中可以看出,一级动力学方程相关系数均在0.99以上,表明一级单一反应模型能较好地描述煤样在活泼热解阶段的热解特性,反应模型的选择是可取的。从表2中还可看出,与原煤相比,添加催化剂后煤样的反应活化能均有不同程度的降低,除Al2O3外,添加NiO、Fe2O3、CaO后煤样的反应活化能明显降低。由此表明,NiO、Fe2O3、CaO对褐煤的催化热解效果明显,而Al2O3在这一阶段产生的影响极为有限,这与热重分析结果一致。由此可以推断,在活泼热解阶段,4种金属氧化物对褐煤的催化效果为:NiO> Fe2O3>CaO> Al2O3。
表2添加不同金属氧化物后煤的反应动力学参数(一级反应)
Table 2 Kinetic parameters of coal pyrolysis by adding different mental oxides(first-order reaction)

催化剂E/kJ·mol-1A/s-1R2T/℃-29.532.720.9963405~495CaO24.871.090.9941405~495Al2O329.292.550.9964405~495Fe2O323.730.990.9917395~485NiO22.490.720.9939405~495
采用二级单一反应模型对霍林河褐煤的热缩聚阶段进行动力学分析。同理将动力学方程进行整理后并采用Coats-Redfern积分法近似后得到积分型方程:
(2)
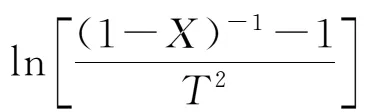
运用二级动力学方程计算添加不同金属氧化物后煤的反应动力学参数见表3。从表3中可以看出,二级动力学方程的相关系数均在0.99以上,表明二级单一反应模型能较好地描述煤样在热缩聚阶段的热解特性,反应模型的选择是合理的。从表3中还可看出,与原煤相比,添加4种金属氧化物催化剂能使煤样的反应活化能明显降低,表明在此阶段中催化剂的加入对褐煤的热解存在显著的促进作用,这与热缩聚阶段的热重分析结果一致。由此可以推断,在热缩聚阶段,4种金属氧化物对褐煤的催化效果为:Fe2O3>CaO>NiO>Al2O3。
表3添加不同金属氧化物后煤的反应动力学参数(二级反应)
Table 3 Kinetic parameters of coal pyrolysis by adding different mental oxides(second-order reaction)

催化剂E/kJ·mol-1A/s-1R2T/℃-44.5230.310.9971665~755CaO29.212.780.9908665~745Al2O340.1715.180.9949665~755Fe2O324.461.160.9921655~745NiO32.023.950.9981655~745
3结论
(1)4种金属氧化物催化剂均能有效提高褐煤热解的转化率,不同催化剂对褐煤热解行为的影响程度不同,其对褐煤热解转化率的促进作用顺序为:NiO>CaO> Fe2O3>Al2O3。
(2)在整个热解过程中,CaO 、Fe2O3及NiO均表现出良好的催化作用,而 Al2O3在活泼热解阶段无明显促进作用,在热缩聚阶段有一定的催化效果。
(3)褐煤在活泼热解阶段的热解过程可用一级单一反应模型进行描述,在活泼热解阶段,4种金属氧化物对褐煤的催化效果为:NiO> Fe2O3>CaO> Al2O3。
(4)褐煤在热缩聚阶段的热解过程可采用二级单一反应模型进行描述,在热缩聚阶段,4种金属氧化物对褐煤的催化效果为:Fe2O3>CaO>NiO>Al2O3。
参考文献
[1]张晶,张生军,周凡,等. 煤催化热解研究现状[J]. 煤炭技术,2014,33(4):238-241.
[2]Li C Z,Sathe C,Kershaw J R,et al. Fates and roles of alkali and alkaline earth metals during the pyrolysis of a Victorian brown coal[J]. Fuel, 2000, 79:427-438.
[3]何涛,马晓迅,罗进成,等. 铜川煤催化加氢热解行为的研究[J]. 煤炭转化,2008,31(2):4-7.
[4]Russell N V, Beeley T J, Man C K, et a1. Deve-lopment of TG measurements of intrinsic char combustion reactivity for industrial and research purposes[J]. Fuel Processing Technology, 1998, 57(2):113-130.
[5]王俊琪,方梦祥,骆仲泱, 等. 煤的快速热解动力学研究[J]. 中国电机工程学报,2007,27(17):18-22.
[6]周静,何品晶,于遵宏. 用热失重仪研究煤快速热解[J]. 煤炭转化,2004,27(2):30-36.
[7]郝丽芳,李松庚,崔丽杰,等. 煤催化热解技术研究进展[J]. 煤炭科学技术,2012,40(10):108-112.
[8]何涛. 铜川煤催化热解行为的热重研究[D]. 西安:西北大学,2007.
[9]罗进成. 中国西部五种典型煤的热解及催化加氢热解行为热重研究[D].西安:西北大学,2008.
[10]刘琼,吴国光,孟献梁, 等. 新疆伊宁长焰煤催化热解行为的热重研究[J]. 能源技术与管理,2012(1):120-122.
[11]吕俊复,岳光溪.氧化钙条件下焦油主要组分的催化裂解[J].清华大学学报:自然科学版,1997,37(2):6-10.
[12]Quanrun Liu, Haoquan Hu,Qiang Zhou, et al. Effect of inorganic matter on reactivity and kinetics of coal pyrolysis[J]. Fuel, 2004,83:713-718.
[13]公旭中,郭占成,王志. Fe2O3对高变质程度脱灰煤热解反应性与半焦结构的影响[J]. 化工学报,2009,60(9):2321-2326.
[14]Metta Chareonpanich, Zhan Guo Zhang, Akio Nishijima, et al. Effect of catalysts on yields of monocyclic aromatic hydrocarbons in hydrocracking of coal volatile matter[J]. Fuel, 1995, 74(11):1636-1640.
[15]许莹,孙小星,胡宾生. 催化剂对混合煤在快速热解过程中的影响[J]. 化学工程,2007,35(4):65-67,71.
[责任编辑张惠芳]
Effect of metal oxides on catalytic pyrolysis of Huolin River lignite
LiaoHouqi,WuHuadong,YuJian,ZhangYan,GuoJia
(1.School of Chemical Engineering and Pharmacy, Wuhan Institute of Technology,Wuhan 430073, China; 2.Key Laboratory of Green Chemical Process of Ministry of Education ,Wuhan Institute of Technology, Wuhan 430073, China)
Abstract:Four metal oxides (CaO, Al2O3, Fe2O3 and NiO) were selected as catalysts for the pyrolysis of Huolin River lignite. The pyrolysis behaviors of the lignite were analyzed by thermogravimetric analysis technique and kinetic model. The effects of different metal oxides on the catalytic pyrolysis behaviors of the lignite were investigated. The results show that the addition of any of these metal oxide catalysts can effectively improve conversion rate of the lignite pyrolysis,and their effects on the conversion rate of the lignite pyrolysis are NiO>CaO>Fe2O3>Al2O3. CaO, Fe2O3 and NiO have promotion effects for the whole pyrolysis process of the lignite, whilst Al2O3 only shows a certain catalytic effect during the thermal condensation stage. The pyrolysis process during the active pyrolysis and thermal condensation stage can be described by the first-order reaction and second-order reaction model, respectively. The catalytic effect order of four metal oxides on the lignite pyrolysis during the active pyrolysis stage is NiO>Fe2O3>CaO>Al2O3, while that during the thermal condensation stage is Fe2O3>CaO>NiO>Al2O3.
Key words:lignite; catalytic pyrolysis; thermogravimetric analysis; kinetics; metal oxide; catalyst
收稿日期:2015-12-26
基金项目:国家自然科学基金资助项目(51346005);湖北省自然科学基金资助项目(2014CFA090).
作者简介:廖厚琪(1991-),男,武汉工程大学硕士生.E-mail:liaohouqi@foxmail.com通讯作者:郭嘉(1969-),男,湖北省“楚天学者”计划特聘教授,武汉工程大学教授,博士生导师.E-mail:guojia@wit.edu.cn
中图分类号:TQ530.2
文献标志码:A
文章编号:1674-3644(2016)02-0102-05

