46例胃肠道间质瘤临床病理分析及免疫组织化学研究
聂瑜 付耒 吕国庆
46例胃肠道间质瘤临床病理分析及免疫组织化学研究
聂瑜 付耒 吕国庆
目的 分析胃肠道间质瘤临床病理并研究其免疫组织化学特点。方法 选择胃肠道间质瘤患者46例为研究对象,观察肿瘤的发生部位、大小及生长方式,评价不同部位胃肠道间质瘤的风险度,同时研究胃肠道间质瘤的免疫组织化学特点。结果 46例胃肠道间质瘤发生在胃部28例,占比为60.9%,发生在小肠10例,占比为21.7%,发生在大肠5例,占比为10.8%,发生在胃肠外3例,占比为6.6%。胃肠道间质瘤的生长方式主要分为腔内/外、腔内、腔外3种,其中腔内/外的生长方式占的比例最高为39.1%,且腔内/外生长方式的胃肠道间质瘤诊断为恶性的概率也大,而腔内生长方式的胃肠道间质瘤诊断为恶性的概率最小;肿瘤直径在0.5~28cm。发生在胃部的胃肠道间质瘤的风险度较低,而发生在大肠和小肠的胃肠道间质瘤的风险度较高。免疫组织化学检测显示胃肠道间质瘤具有Vimentin、CD117、CD34高表达的特点,分别为100.0%(47/47)、93.6%(44/47)、85.1%(40/47),而SMA、S-100呈现出低表达的特点,分别为12.8%(6/47)和6.4%(3/47)。结论 胃肠道间质瘤主要发生在胃部,但是胃部的胃肠道间质瘤的风险度较低,而大肠和小肠部位的胃肠道间质瘤的风险度较高,需要引起临床的重视;CD117、CD34等免疫组化指标在胃肠道间质瘤的诊断中具有较高的应用价值,但是仍需结合患者的生物学行为、肿瘤组织学特点等方面确诊。
胃肠道间质瘤;临床病理;免疫组织化学特点
胃肠道间质瘤属于胃肠道间叶源性肿瘤,常见于中老年人群,研究认为胃肠道间质瘤的发生与饮食习惯、生活环境、遗传等因素存在紧密的联系[1]。良性胃肠道间质瘤早期无明显的症状体征,病程可能长达10~20年,而恶性胃肠道间质瘤的病程较短,且病情的进展速度快,容易出现癌细胞的转移。然而胃肠道间质瘤早期缺乏特异性的表现,且生物学行为变化较大,缺乏统一的诊断标准,因而临床上常常出现误诊的现象,延误了疾病治疗的最佳时机,故如何有效提高胃肠道间质瘤诊断的准确率是现阶段临床研究的热点[2]。研究发现结合组织形态学与免疫组织化学检测能够提高胃肠道间质瘤诊断的准确率,降低误诊率,但是目前临床上对胃肠道间质瘤临床病理与其免疫组织化学特点的研究报道并不多见[3],故本研究对胃肠道间质瘤临床病理及其免疫组织化学特点展开研究分析,旨在为胃肠道间质瘤的诊断提供参考和借鉴,现报道如下。
1 资料与方法
1.1 一般资料 选择2011年7月~2014年7月在新疆昌吉州人民医院接受治疗的胃肠道间质瘤患者46例作为研究对象,其中男21例,女25例;年龄18~82岁,平均年龄(58.3±7.1)岁;患者主要表现出腹部疼痛、消化道出血、失血贫血、腹部包块等症状体征,部分患者合并腹腔内出血、肿块感染、肝转移、黄疸等症状。45例患者均接受完整病灶切除手术,1例患者由于病变严重转移而接受姑息性减瘤治疗。
1.2 方法 收集46例胃肠道间质瘤的肿瘤标本,放置于4%中性甲醛溶液中固定,石蜡包埋切片,使用免疫组织化学与HE染色。其中免疫组化选择EnVision两步法,操作过程:切片脱蜡至水,然后通过高压修复,3%过氧化氢灭活内源性过氧化物酶15min,50μL稀释后的一抗4℃过夜,严格按照试剂盒操作步骤展开,二氨基联苯胺(DAB)显色,苏木精复染。免疫组化标记CD34、CD117、Vimentin、SMA以及S-100,使用已知阳性切片进行对照,磷酸盐缓冲液(PBS)则替代一抗作阴性对照。EnVision等试剂盒及一抗、二抗均购自福州迈新生物技术开发有限公司。
1.3 评价标准 细胞膜或细胞质呈现为棕黄色颗粒且阳性细胞数超过10%判定为阳性;肿瘤风险度分级:主要分为极低风险性、低风险性、中度风险性和高度风险性4个等级,极低风险性:核分裂数<5个/50HPF且肿瘤直径<2cm;低风险性:核分裂数<5个/50HPF且肿瘤直径在2~5cm;中度风险性:核分裂数6~10个/50HPF且肿瘤直径<5cm,或者核分裂数<5个/50HPF且肿瘤直径在5~10cm;高度风险性:核分裂数>5个/50HPF且肿瘤直径>5cm,或者满足肿瘤直径>10cm和核分裂数不计、核分裂>10个/50HPF肿瘤大小不计3个条件中的1个[4]。
2 结果
2.1 肿瘤发生部位 46例胃肠道间质瘤发生在胃部28例,占比为60.9%,发生在小肠10例,占比为21.7%,发生在大肠5例,占比为10.8%,发生在胃肠外3例,占比为6.6%。
2.2 肿瘤生长方式和直径 胃肠道间质瘤的生长方式主要分为腔内/外、腔内、腔外3种,其中腔内/外的生长方式占的比例最高为39.1%,且腔内/外生长方式的胃肠道间质瘤诊断为恶性的概率也大,而腔内生长方式的胃肠道间质瘤诊断为恶性的概率最小;肿瘤直径在0.5~28cm。见表1。

表1 肿瘤生长方式与肿瘤性质的关系[n(%)]
2.3 不同部位胃肠道间质瘤的肿瘤风险度 发生在胃部的胃肠道间质瘤的风险度较低,而发生在大肠和小肠的胃肠道间质瘤的风险度较高。见表2。

表2 不同部位胃肠道间质瘤的肿瘤风险度分析[n(%)]
2.4 胃肠道间质瘤组织学特征和免疫组织化学特点 显微镜下观察显示肿瘤的组织形态主要表现为上皮样细胞和梭形细胞,其中上皮样细胞肿瘤伴随透明样形态变异,梭形细胞肿瘤则伴有核端空泡;肿瘤组织的排列方式呈现出多样化,分别有束状(见图1)、弥漫状、旋涡状以及编织状(见图2);另外,肿瘤细胞存在明显的异型性与核分裂像,甚至部分肿瘤细胞与周围组织粘连、出血囊性变及坏死。免疫组织化学检测显示胃肠道间质瘤具有Vimentin、CD117、CD34高表达的特点,分别为100.0%(47/47)、93.6%(44/47)、85.1%(40/47),而SMA、S-100呈现出低表达的特点,分别为12.8%(6/47)和6.4%(3/47)。
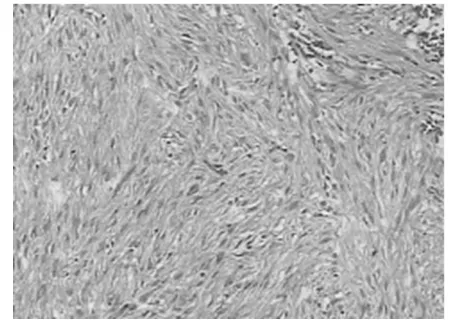
图1 小肠间质瘤,高度危险性图

图2 胃部间质瘤,中度危险性
3 讨论
胃肠道间质瘤是20世纪80年代才首次被命名的胃肠道肉瘤,虽然调查发现胃肠道间质瘤的发病率并不高,但是胃肠道间质瘤的形态表现较为复杂,可见于任何年龄段的人群,且发病率不受性别的影响[5]。
本研究结果显示,胃部的胃肠道间质瘤发生率最高为60.9%(28/46),其余依次是小肠、大肠等部位,与付娟娟等[6]的研究基本一致。
胃肠道间质瘤的肿瘤组织形态主要表现为上皮样细胞和梭形细胞,两种细胞可同时存在,上皮样细胞和梭形细胞会发生形态学上的变异,例如透明样、核端空泡等,而肿瘤的排列方式则包括束状、弥漫状、旋涡状以及编织状[7]。本研究结果显示,胃肠道间质瘤具有Vimentin、CD1l7、CD34高表达的特点,分别为100.0%、93.6%、85.1%,但是神经组织与平滑肌不表达CD34和CD117。CD34与CD117的阳性表达是胃肠道间质瘤诊断的重要参考条件,但是在各项标记呈现为阴性而组织学特征符合胃肠道间质瘤的情况下也不能完全排除胃肠道间质瘤的可能性,只有在SMA或S-100阳性且CD34与CD117为阴性的情况下,可以考虑为平滑肌肿瘤、神经源性肿瘤。虽然Vimentin的阳性表达率为100.0%,然而Vimentin几乎在大部分的间叶性肿瘤中均呈阳性,所以缺乏特异性。
研究表明,绝大部分的胃肠道间质瘤具有由小到大、从良性到恶性转变的特点,且胃肠道间质瘤的发生发展与PDGFRA、c-kit等基因突变存在密切的联系[8]。目前,临床上通过分析肿瘤细胞的组织形态表现和免疫组织化学特点,有效提高了胃肠道间质瘤的确诊率,但是如何判断胃肠道间质瘤的良性和恶性仍是临床上的一大难点。陈丹果等[9]研究发现,胃肠道间质瘤不同的生长方式会对肿瘤的性质产生影响,其中腔内/外生长方式的胃肠道间质瘤诊断为恶性的可能性最大,其余依次是腔外、腔内生长方式的胃肠道间质瘤[10]。本研究结果显示,腔内/外、腔外、腔内3种生长方式的胃肠道间质瘤的恶性率分别为61.1%、40.0%、30.8%,与王钧等[11]的报道结果基本相似,表明肿瘤的生长方式可以作为胃肠道间质瘤良性、恶性诊断的参考指标。苏海霞等[12]应用胃肠道间质瘤的4级分级标准分析不同部位肿瘤的风险度,发现发生在大肠和小肠的胃肠道间质瘤的风险度多为中高度,而发生在胃部的胃肠道间质瘤的风险度多为低风险[13],本研究结果与此吻合,说明肿瘤的发生部位也能作为胃肠道间质瘤良性、恶性诊断的参考指标之一。
综上所述,胃肠道间质瘤主要发生在胃部,但是胃部的胃肠道间质瘤的风险度较低,而大肠和小肠部位的胃肠道间质瘤的风险度较高,需要引起临床的重视;CD117、CD34等免疫组化指标在胃肠道间质瘤的诊断中具有较高的应用价值,但是仍需结合患者的生物学行为、肿瘤组织学特点等方面确诊。
[1] 吴莲香,刘月泉,邓作梅,等.胃肠道间质瘤手术的护理对策[J].当代医学,2014,20(34):129-130.
[2] Rediti M,Pellegrini E,Molinara E,et al.Complete pathological response in advanced extra-gastrointestinal stromal tumor after imatinib mesylate therapy:a case report[J].Anticancer Res,2014,34(2):905-907.
[3] 荣春红,王扬,凌斌,等.4例恶性胃肠道间质瘤妇科误诊分析(附文献复习)[J].中日友好医院学报,2014,28(3):131-133,138.
[4] Rotert JV,Leupold J,Hohenberger P,et al.Src activity is increased in gastrointestinal stromal tumors--analysis of associations with clinical and other molecular tumor characteristics[J].J Surg Oncol,2014,109(6):597-605.
[5] Huang Z,Li Y,Zhao H,et al.Prognositic factors and clinicopathologic characteristics of small gastrointestinal stromal tumor of the stomach:a retrospective analysis of 31 cases in one center[J].Cancer Biol Med,2013,10(3):165-168.
[6] 付娟娟,宋新兰,贺家勇.胃肠道间质瘤的临床病理特征分析和免疫组化研究[J].新疆医科大学学报,2011,34(2):155-157.
[7] 徐宏伟,刘庆猛,朱秀益,等.胃肠道间质瘤的CT表现与免疫组化分型的关系[J].中华肿瘤杂志,2014,36(6):440-445.
[8] Lee JH,Kim Y,Choi JW,et al.Correlation of imatinib resistance with the mutational status of KIT and PDGFRA genes in gastrointestinal stromal tumors:a meta-analysis[J].J Gastrointestin Liver Dis,2013,22(4):413-418.
[9] 陈丹果.胃肠道间质瘤MRI诊断价值及病理组织学特点分析[J].中国中西医结合消化杂志,2014,22(1):24-26.
[10] Zhou Z,Chen Z,Chen M,et al.Clinicopathologic factors predicting outcomes in patients with gastrointestinal stromal tumors of the rectum and colon[J].Tumour Biol,2014,35(5):4357-4362.
[11] 王钧.32例胃肠道间质瘤的病理学及免疫组化研究[J].当代医学,2012,18(12):4-5.
[12] 苏海霞,潘海虹,张蕾.胃肠道间质瘤CT影像特征对照病理危险度评估的相关性研究[J].中国医学计算机成像杂志,2014,20(6):511-516.
[13] Hellara O,Toumi O,Hadhri R,et al.Epidemiological,clinical features therapeutic results and evolution of gastrointestinal stromal tumour:about 25 cases[J].Tunis Med,2014,92(6):391-398.
10.3969/j.issn.1009-4393.2016.18.059
新疆 831100 新疆昌吉州人民医院病理科 (聂瑜 付耒 吕国庆)

