雷帕霉素对RAW264.7细胞6种miRNAs表达的影响及miR-20a对ATG16L1的靶向调控作用①
赵 瑾 刘宏鹏 段相国 张爱君 丁淑琴 徐广贤
(宁夏医科大学检验学院,银川750004)
·生物治疗·
雷帕霉素对RAW264.7细胞6种miRNAs表达的影响及miR-20a对ATG16L1的靶向调控作用①
赵瑾刘宏鹏段相国张爱君丁淑琴徐广贤
(宁夏医科大学检验学院,银川750004)
[摘要]目的:探讨雷帕霉素对miR-17-92簇中的6种miRNAs表达的影响,及miR-20a对ATG16L1基因的靶向调控作用。方法:利用qRT-PCR检测雷帕霉素对RAW264.7细胞miR-17-92簇中的miR-20a等6种miRNAs的表达水平;通过双荧光素酶报告系统、Western blot,验证miR-20a对ATG16L1的靶向调控关系。结果:与正常组相比,雷帕霉素组RAW264.7细胞的miR- 17、miR-18a、miR-20a表达水平显著上调(P<0.05);3-MA组RAW264.7细胞的miR-20a表达水平显著下调(P<0.05)。双荧光素酶报告系统结果显示,miR-20a可靶向ATG16L1-3′-UTR,抑制其表达;Western blot结果显示,miR-20a能明显抑制ATG16L1蛋白的表达,说明miR-20a可靶向抑制ATG16L1的表达,参与调控细胞自噬过程。结论:miR-20可靶向抑制Atg16L1的表达,参与调控RAW264.7细胞自噬过程。
[关键词]miR-20a;靶向调控;细胞自噬
微小RNA(microRNA,miRNA)是一类进化保守的非编码小RNA,在转录后水平对其靶向mRNA进行降解或抑制其表达。目前研究显示microRNAs可以通过调控一些基因信号分子(例如生长因子、转录因子、前程序性死亡细胞基因等),进而实现其对细胞生长、发育、分化、增殖和死亡的调控功能[1]。
自噬(Autophagy)是一种生物学代谢机制,主要功能就是降解蛋白等物质。即细胞吞噬自身胞质蛋白或细胞器,通过这个功能实现细胞本身的代谢需要,也实现某些细胞器的更新,从而维持细胞微环境和细胞功能的稳定。大量研究发现,自噬作为一种重要的免疫防御机制,对抵抗多种细胞内病原微生物感染起着积极作用[2]。
目前研究已经报道自噬的调控与许多miRNA相关。如miR-30a[3]可靶向作用于重要的自噬相关基因beclin 1,进而抑制细胞自噬;miR-375在肝癌细胞中通过靶向ATG7而抑制细胞自噬[4],揭示了miRNA与细胞自噬间存在着一些潜在的关系。本课题通过生物信息学分析预测发现,miR-17-92簇中的miR-20a与自噬相关基因ATG16L1存在着潜在的靶向调控关系。进一步经实时定量PCR (real-time quantitative PCR, qRT-PCR)、双荧光素酶报告系统检测及Western blot对靶向关系进行验证,将为深入研究 miR-20a、细胞自噬及后期与结核分枝杆菌之间的相互作用及其机制提供理论依据和研究思路。
1材料与方法
1.1材料
1.1.1主要材料T4 DNA连接酶、MluⅠ、HindⅢ限制性内切酶购自NEB公司;DNA凝胶回收试剂盒、质粒小提试剂盒购自天根(Qiangen)生化科技有限公司;反转录试剂盒购自Thermo Scientific公司;2×SYBR Green I Mix购自Life technology公司;RNAiso for Small RNA购自大连TaKaRa公司;雷帕霉素、3-甲基腺嘌呤(3-methyladenine,3-MA)购自Sigma公司;DMEM高糖培养基、PBS、胎牛血清购自Hyclone公司;双荧光素酶检测试剂盒购自Promega公司;转染试剂购自北京全式金生物技术有限公司;兔抗ATG16L1抗体购自Abgent公司;miR-17、miR-18a、miR-20a、miR-19a、miR-19b、miR-92a、ATG16L1及ATG16L1/mut引物序列由上海生工生物有限公司合成;miR-20a mimic/inhibitor引物序列由上海吉玛(GenePharma)有限公司合成。
1.1.2引物设计与合成依据成熟的miRNA序列来自miRBase数据库,依据该数据库中的miRNA序列分别设计miR-17-92簇中6种miRNA的茎环引物及其各自特异性上游检测引物(表 1、2) ,Real-Time PCR通用下游引物:CTCAACTGGTGTC-GTGGA;以U6作为内参并根据NCBI中U6的成熟序列设计U6的特异性引物。内参基因U6上游引物:CTCGCTTCGGCAGCACA;U6下游引物:AACGCTTCACGAATTTGCGT。所有引物及DNA测序均由上海生工生物有限公司合成。
1.2方法
1.2.1细胞以2×106ml-1的密度接种于25 cm2培养瓶中,当细胞生长汇合至80%~90% 时,细胞分别按以下方法进行处理:雷帕霉素处理细胞2 h、3-甲基腺嘌呤(3-MA)处理细胞12 h,正常对照组细胞不作处理,各组细胞于37℃、50 ml/L CO2条件下细胞培养箱中培养。
1.2.2RNA的提取与cDNA合成利用大连TaKaRa公司的RNAiso for SmallRNA试剂分别提取雷帕霉素组、3-MA组及正常对照组的RNA,并以此RNA为模板,利用miR-17、miR-18a、miR-20a、miR-19a、miR-19b、miR-92a 的茎环引物,经42℃,60 min;85℃,5 min完成反转录过程,合成其相应的cDNA。
1.2.3miRNA表达量的检测采用荧光定量PCR(qRT- PCR) 检测雷帕霉素组、 3-MA组及正常对照组等各组中上述6种miRNAs的表达量,同时检测各组U6的表达量作为内参,每组设3个平行复孔,结果采用相对定量法,公式:2-△△Ct,其中△△Ct=(待测样本Ct-待检测样本U6Ct)-(正常组Ct-正常组U6Ct),计算6种miRNA的相对表达量,并取三平行复孔的平均值
表2Real-time PCR上游检测引物
Tab.2List of primers used for qRT-PCR

NameSequences(5'-3')miR-17ACACTCCAGCTGGGCAAAGTGCTTACAGTGCAGGmiR-18aACACTCCAGCTGGGTAAGGTGCATCTAGTGCAGAmiR-19aACACTCCAGCTGGGTGTGCAAATCTATGCAAAACmiR-20aACACTCCAGCTGGGTAAAGTGCTTATAGTGCAGGmiR-19bACACTCCAGCTGGGTGTGCAAATCCATGCAAAACmiR-92aACACTCCAGCTGGGTATTGCACTTGTCCCGGCCTG
表1茎环引物
Tab.1List of primers used for reverse transcription

NameSequences(5'-3')miR-17CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTACCTGCmiR-18aCTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTATCTGCACTAGATGmiR-19aCTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCAGTTTTGCATAmiR-20aCTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTACCTGCACTATAAGmiR-19bCTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCAGTTTTGCATGmiR-92aCTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCAGGCCGG
1.2.4生物信息学分析预测应用PicTar、RNA22、Target Scan、miRanda等生物信息学软件及网站进行miR-20a的靶基因的预测及甄选。
1.2.5载体构建构建pMIR-Report-ATG16L1-3′UTR及pMIR-Report-ATG16L1-3′UTR-mut重组质粒。
1.2.6miR-20a与自噬相关基因ATG16L1靶向关系的验证
1.2.6.1双荧光素酶报告系统分析将miR-20a mimic和空白对照NC分别与pMIR-Report-Atg16L1、pMIR-Report-ATG16L1 mut(突变体)重组质粒共转染至RAW264.7细胞中,各组均共转染海肾荧光素酶(PRL-TK)作为内对照,48 h后根据双荧光素酶检测试剂说明操作,利用微孔板发光分析仪检测各组中萤火虫荧光素酶和海肾荧光素酶报告基因的活性,每组试验重复3次,并计算其平均值。
1.2.6.2ATG16L1蛋白表达水平的检测转染miR-20a mimic、NC和miR-20a inhibitor至RAW264.7细胞中,构建miR-20a过表达/抑制表达的细胞模型,分别提取各组细胞的蛋白质,BCA法测定各组蛋白质浓度,并利用Western blot法检测各组中ATG16L1蛋白表达情况。
2结果

2.2生物信息学分析及验证miRBase检索成熟 miR-20a序列,应用生物信息学软件进行miR-20a的靶基因预测(图 2)。成功将ATG16L1-3′UTR及其突变体插入pMIR-Report载体中,构建pMIR-Report-ATG16L1-3′ UTR及pMIR-Report-ATG16L1-3′ UTR-mut重组质粒,并经DNA测序验证 (图2) 。
2.3miR-20a与ATG16L1 靶向关系的验证
2.3.1miR-20a的相对表达量检测利用实时荧光定量PCR检测可知, miR-20a mimic组中的miR-20a表达水平与正常对照组相比,上调约8.75倍,而 miR-20a inhibitor 组中的miR-20a表达水平下调约2倍(图3),说明miR-20a mimic 及miR-20a inhibitor 转染成功。
2.3.2双荧光素酶报告系统检测分析双荧光素酶分析与正常对照组相比,转染miR-20a mimic组明显抑制ATG16L1的相对荧光素酶活性,下降约1.8倍 (P<0.05) ;而ATG16L1-mut组相对荧光素酶活性没有明显变化(图4)。表明miR-20a能靶向作用于ATG16L1-3′UTR的特异位点,抑制其表达。

图1 细胞自噬模型中6种miRNA的相对表达水平Fig.1 Results of expression of 6 kinds of miRNA in model of cell autophagyNote: 1.NC;2.Treated by rapamycin(50 ng/ml) for 2 h;3.Treated by 3-MA(10 nmol/L) for 12 h.*.P<0.05.

图2 miR-20a靶基因预测及重组质粒pMIR-Report-ATG16L1-3′UTR及其突变体测序验证Fig.2 Interaction sites of miR-20a with predicted target gene ATG16L1-3′UTR and sequencing results of pMIR-Report-ATG16L1-3′UTR plasmid
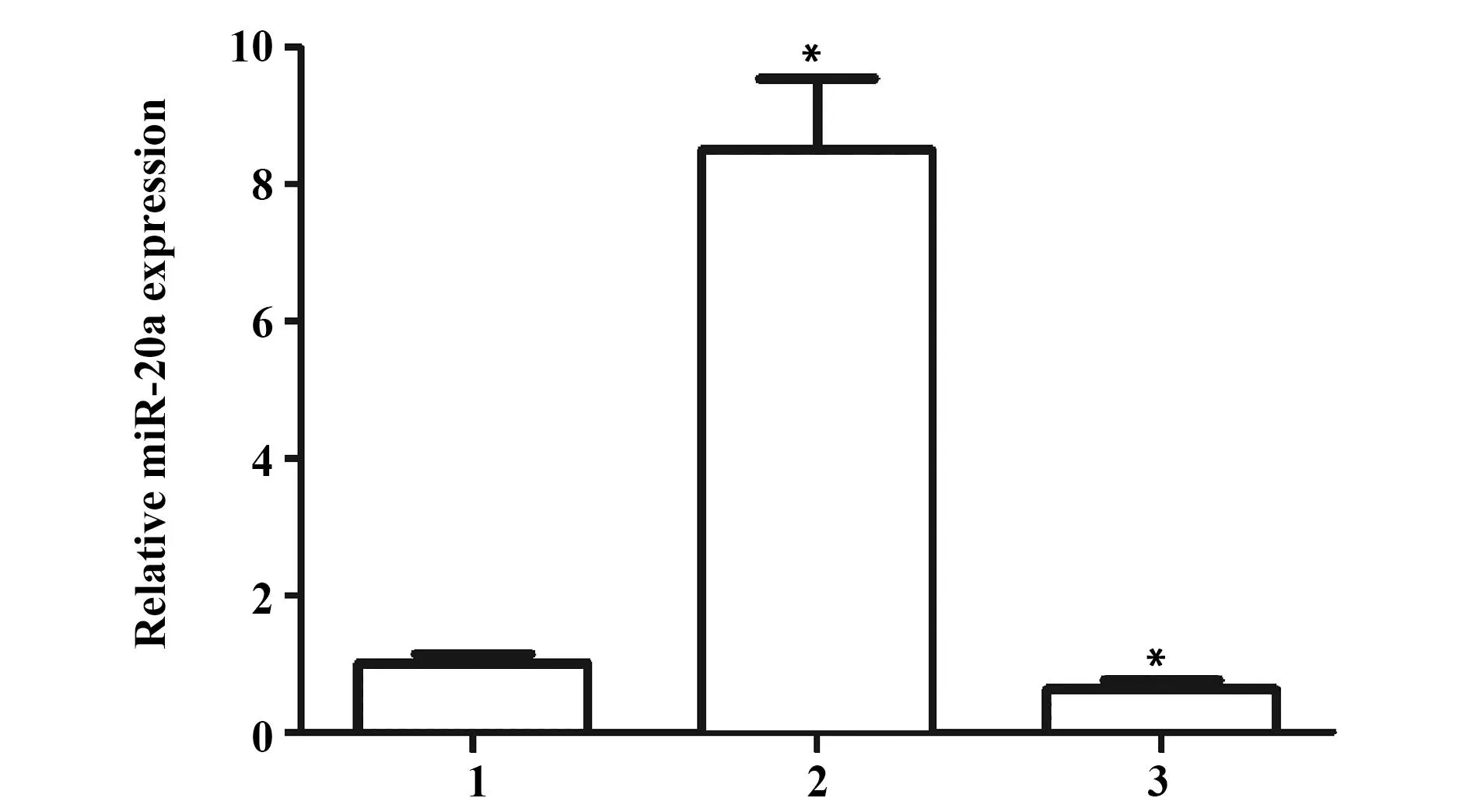
图3 实时荧光定量PCR检测miR-20a相对表达水平Fig.3 To detect relative expression level of miR-20a with real-time PCRNote: 1.NC;2.miR-20a mimic;3.miR-20a inhibitor;*.P<0.05.

图4 双荧光素酶报告系统验证miR-20a与ATG16L1靶向抑制作用Fig.4 To varify targeted inhibition between miR-20a and ATG16L1 with luciferase reporter systemNote: 1,3.miR-20a mimic;2,4.NC;*.P<0.05.

图5 Western blot法检测ATG16L1蛋白表达水平Fig.5 To detect protein expression level of ATG16L1 with Western blot analysis Note: β-actin as an internal reference.1.miR-20a mimic;2.miR-20a inhibitor;3.NC.
2.4Western blot法检测ATG16L1蛋白的表达通过Western blot法检测ATG16L1在蛋白水平上的表达,与正常对照组相比,转染miR-20a mimic 组能显著降低ATG16L1的表达量;而转染 miR-20a inhibitor组ATG16L1蛋白表达量又明显升高(P<0.05,图5) 。
3讨论
成熟的microRNA(miRNA) 是一种长约22nt的内源性非编码RNA,能够通过对其靶基因靶向降解或抑制其翻译起到调控靶基因的表达作用[5]。miR-17-92是一个高度保守的miRNA簇,位于人类第13号染色体上初级转录本C13orf25基因的第三个内含子上[6],编码6个成熟的miRNA :miR-17、miR-18a、miR-19a、 miR-20a、miR-19b和miR-92a。据已有报道研究显示,miR-17-92簇对肿瘤细胞的生长[7,8]、增殖[9,10]、分化[9]、凋亡[10]过程起着重要作用。
最近研究显示肿瘤、感染、神经退行性病变等疾病可能与细胞自噬异常有关[11]。已经报道的自噬与许多miRNA相关,如:miR-130a可以通过作用于靶基因ATG2B和DICER1调节自噬的发生,对慢性淋巴细胞白血病细胞的存活起到反馈调节的作用[12]; miR-199a-5p在不同细胞中可以抑制或者促进DRAM1和Beclin1基因的表达,使乳腺癌细胞对辐射更加敏感,在癌症生物学机制和癌症治疗过程中起到重要作用[13]。因此miRNA可为某些由于自噬异常引起的免疫等相关疾病的治疗提供新的思路。雷帕霉素作为细胞自噬发生常用的诱导剂之一,能够抑制mTOR途径,从而诱导自噬的发生[14]。3-MA可抑制PI3K,是一种常见的自噬抑制剂[15]。
近年来研究显示,巨噬细胞的自噬作为固有免疫和适应性免疫的重要组成部分可参与胞内感染病原体的清除。在结核分枝杆菌感染的巨噬细胞内,诱导自噬的发生能促进吞噬体和溶酶体的融合,从而抑制胞内结核分枝杆菌(Mtb)的存活[16,17]。而同时结核分枝杆菌分泌的蛋白可抑制吞噬小体与溶酶体的融合,从而使其能在巨噬细胞内长期存活造成潜伏感染[18,19]。
然而miRNA如何调控巨噬细胞自噬,进一步影响结核分枝杆菌胞内存活的机制目前尚不完全明确,因此本课题研究为下一步探究miR-20a在巨噬细胞中结核分枝杆菌的免疫调控作用及其机制,提供一定的研究基础和理论依据,对结核病预防与治疗的研究起到推动作用。
参考文献:
[1]Chen C.MicroRNAs as oncogenes and tumor suppressors[J].N Engl J Med,2005,353(17):1768-1771.
[2]Morris S,Swanson M,Lieberman A,etal.Autophagy-mediated dendritic cell activation is essential for innate cytokine production and APC function with respiratory syncytial virus responses[J].J Immunol,2011,187(8):3953-3961.
[3]Zhu H,Wu H,Liu X,etal.Regulation of autophagy by a beclin 1-targeted microRNA,miR-30a,in cancer cells[J].Autophagy,2009,5(6):816-823.
[4]Chang Y,Yan W,He X,etal.miR-375 inhibits autophagy and reduces viability of hepatocellular carcinoma cells under hypoxic conditions[J].Gastroenterology,2012,143(1):177-187.
[5]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[6]Ota A,Tagawa H,Karnan S,etal.Identification and characterization of a novel gene,C13orf25,as a target for 13q31-q32 amplification in malignant lymphoma[J].Cancer Res,2004,64(9):3087-3095.
[7]Sharifi M,Salehi R,Gheisari Y,etal.Inhibition of microRNA miR-92a induces apoptosis and inhibits cell proliferation in human acute promyelocytic leukemia through modulation of p63 expression[J].Mol Biol Rep,2014,41(5):2799-2808.
[8]Chen YJ,Thang MW,Chan YT,etal.Global assessment of Antrodia cinnamomea-induced microRNA alterations in hepatocarcinoma cells[J].PLoS One,2013,8(12):e82751.
[9]Sandhu S K,Fassan M,Volinia S,etal.B-cell malignancies in microRNA Emu-miR-17~92 transgenic mice[J].Proc Natl Acad Sci USA,2013,110(45):18208-18213.
[10]Olive V,Sabio E,Bennett M J,etal.A component of the mir-17-92 polycistronic oncomir promotes oncogene-dependent apoptosis[J].Elife,2013,15(2):e00822.
[11]Mijaljica D,Prescott M,Devenish R J.Autophagy in disease[J].Methods Mol Biol,2010,648:79-92.
[12]Kovaleva V,Mora R,Park Y J,etal.miRNA-130a targets ATG2B and DICER1 to inhibit autophagy and trigger killing of chronic lymphocytic leukemia cells[J].Cancer Res,2012,72(7):1763-1772.
[13]Yi H,Liang B,Jia J,etal.Differential roles of miR-199a-5p in radiation-induced autophagy in breast cancer cells[J].FEBS Lett,2013,587(5):436-443.
[14]张涛,郑锡铭,周林林等.雷帕霉素对RAW264.7巨噬细胞10种与细胞自噬相关的miRNAs表达的影响[J].中国免疫学杂志,2014,30(08):1055-1058,1063.
[15]Wang M,Yu T,Zhu C,etal.Resveratrol triggers protective autophagy through the ceramide/Akt/mTOR pathway in melanoma B16 cells[J].Nutr Cancer,2014,66(3):435-440.
[16]Gutierrez MG,Master SS,Singh SB,etal.Autophagy is a defense mechanism inhibiting BCG and Mycobacterium tuberculosis survival in infected macrophages[J].Cell,2004,119(6):753-766.
[17]Amano A,Nakagawa I,Yoshimori T.Autophagy in innate immunity against intracellular bacteria[J].J Biochem,2006,140(2):161-166.
[18]Condos R,Raju B,Canova A,etal.Recombinant gamma interferon stimulates signal transduction and gene expression in alveolar macrophages in vitro and in tuberculosis patients[J].Infect Immun,2003,71(4):2058-2064.
[19]Thompson C R,Iyer S S,Melrose N,etal.Sphingosine kinase 1 (SK1) is recruited to nascent phagosomes in human macrophages:inhibition of SK1 translocation by Mycobacterium tuberculosis[J].J Immunol,2005,174(6):3551-3561.
[收稿2015-09-10修回2015-09-28]
(编辑倪鹏)
Effects of rapamycin on expression of six kinds miRNAs in RAW264.7 macrophages and research on miR-20a′s targeted regulation of ATG16L1 gene expression
ZHAOJin,LIUHong-Peng,DUANXiang-Guo,ZHANGAi-Jun,DINGShu-Qin,XUGuang-Xian.
InstituteofLaboratoryMedicine,NingxiaMedicalUniversity,Yinchuan750004,China
[Abstract]Objective:To detect the influence of rapamycin on the expression of 6 kind of miRNAs of miR-17-92 cluster in macrophages.To study the relationship of miR-20a and ATG16L1 gene.Methods: The expression of miR-17,miR-18a,miR-20a,miR-19a,miR-19b and miR-92a was detected by Real-Time PCR.The targeting effect of miR-20a on ATG16L1 gene was verified by the dual-luciferase reporter assay system and Western blot.Results: After RAW264.7 cells was treated by rapamycin for 2 h,the expression of miR-17,miR-18a,miR-20a increased (P<0.05);After RAW264.7 cells was treated by 3-MA for 12 h,miR-20a was down regulated (P<0.05).The dual-luciferase reporter assay system and Western blot demonstrated that miR-20a could suppress ATG16L1 expression by targeting the specific 3′-untranslated region (3′ UTR) sequence of ATG16L1 gene.Conclusion: miR-20a can directly inhibit the autophagy-related gene ATG16L1 expression and participate in the regulation of autophagy process.It is negatively regulated at the post-transcriptional level.
[Key words]miR-20a;Target regulation;Cell autophagy
doi:10.3969/j.issn.1000-484X.2016.05.019
作者简介:赵瑾(1990年-) ,女,硕士,主要从事临床病原微生物与免疫学方面的研究,E-mail:524198608@qq.com。通讯作者及指导教师:徐广贤( 1973年-) ,男,博士,教授,硕士生导师, 主要从事临床病原微生物与免疫学方面的研究, E-mail:xuguangxian@nxmu.edu.cn。
中图分类号R392.12
文献标志码A
文章编号1000-484X(2016)05-0687-05
①本文为国家自然科学基金项目(31472168)。
——雷帕霉素