p21蛋白激活激酶4在三阴乳腺癌增殖中的作用及机制研究①
王子航 陈丽艳 米旭光
(延边大学临床学院,延吉133002)
p21蛋白激活激酶4在三阴乳腺癌增殖中的作用及机制研究①
王子航陈丽艳②米旭光③
(延边大学临床学院,延吉133002)
[摘要]目的:探讨p21蛋白激活激酶4(PAK4)在三阴乳腺癌细胞增殖存活中的作用机制。方法:在三阴乳腺癌BT549和MDA-MB-231细胞中转染PAK4干扰载体,荧光定量法和免疫印迹分析检测PAK4 mRNA和蛋白质表达量变化;MTT法检测转染PAK4干扰载体对三阴乳腺癌细胞存活率的影响;细胞周期分析检测,转染PAK4干扰载体对三阴乳腺癌细胞细胞周期的影响;免疫印迹分析,转染PAK4干扰载体对三阴乳腺癌细胞对细胞信号通路的影响。结果:干扰内源PAK4表达后,三阴乳腺癌BT549和MDA-MB-231细胞的增殖率分别下降(36.51±4.24)%和(38.54±5.43)%,G0/G1期细胞所占比例显著增加到(66.40±2.82)%和(72.01±3.13)%,ERK1/2磷酸化显著降低;ERK通路抑制剂PD98059处理后,三阴乳腺癌BT549细胞的增殖率显著下降(46.41±7.16)%。结论:PAK4在三阴乳腺癌增殖中发挥关键作用,其促增殖作用是通过ERK通路实现的。
[关键词]三阴乳腺癌;PAK4;增殖;ERK
三阴乳腺癌具有侵袭性强、进展快、生存时间短的临床特点[1],并且雌激素受体、孕激素受体和人表皮生长因子受体2在三阴乳腺癌中表达均为阴性[2],因此内分泌治疗和分子靶向治疗无效,化疗是其主要的治疗手段,仅约20%的三阴乳腺癌患者对化疗敏感[3]。由此可见,三阴乳腺癌预后较差可能与其缺乏有效的治疗手段有关,因此针对三阴乳腺癌治疗的新靶点寻找及相应药物的开发显得尤为重要。本文旨在探讨PAK4作为三阴乳腺癌细胞治疗靶点的可能性及相应的抑癌机制。
1材料与方法
1.1主要实验试剂耗材细胞周期与细胞凋亡检测试剂盒(碧云天生物技术研究所,中国)、Lipofecta-mineTM2000(Life Technologies公司,美国)、PVDF膜(Millipore,德国)、鼠抗PAK4、GAPDH和HRP标记羊抗鼠二抗(CST,美国)、pRNAT-U6.1/Hygro-PAK4干扰载体为本实验室构建、MTT(Sigma-Aldrich公司,美国)、SYBR GREEN Master mix(Roche,瑞典)、其他常规试剂(北京化工,中国)。
1.2方法
1.2.1细胞培养三阴乳腺癌MDA-MB-231细胞、BT549细胞,含10%新生牛血清(四季青生物公司,中国)的DMEM培养基(Invitrogen,USA),添加含青霉素 100 U/ml,链霉素 100 μg/ml),37℃5%CO2条件下培养, 细胞生长至对数期时传代。
1.2.2细胞的转染(脂质体法)在转染前24 h,1×106/孔在6孔细胞培养板中接种细胞。转染前将细胞培养液换成不含抗生素不含血清的不完全培养液。将待转染质粒按说明书加入到250 μl无双抗血清培养液中,吹打混匀。同时,将5~10 μl脂质体加入到250 μl无双抗血清培养液中,吹打混匀。室温静置5 min后,将两者混匀。室温孵育20 min后,将混合液加入到待转孔中并混匀。培养5 h后,将细胞培养液换成完全培养液。
1.2.3免疫印迹分析提取细胞总蛋白后,进行常规SDS-PAGE电泳转膜,TBST配制的脱脂奶粉封闭液封闭24 h,标记鼠抗PAK4一抗(1∶1 000)室温1.5 h,TBST清洗3次,标记HRP标记羊抗鼠二抗(1∶1 000),TBST清洗3次,ECL显影。
1.2.4荧光定量分析以Trizol法提取细胞RNA,逆转录成cDNA,以SYBR荧光染料定量检测PAK4表达量。根据试剂说明书添加各组分后,95℃预变性30 s,然后40循环的扩增反应(95℃ 5 s,60℃ 34 s),同时融解曲线分析。结果与内参β-actin作比表示mRNA拷贝数。定量检测引物序列:PAK4-F:5′-TCCCCCTGAGCCATTGTG-3′,PAK4-R:5′-TGACC-TGTCT CCCCA TCCA-3′;β-actin-F:5′-CCAACCGTGAAAAG-3′,β-actin-R:5′-GGCATACAGGGACA-3′。
1.2.5细胞增殖分析将处于生长对数期的细胞消化成单细胞悬液,以0.5×104~1×104个细胞/孔接种于96孔细胞培养板中。过夜培养后,更换新鲜培养基,每孔100 μl。按转染方法向细胞中加入脂质体-待转质粒混合物,每组设三个复孔,同时设对照组,5 h后更换培养基。培养48 h后,每孔加入20 μl MTT溶液(MTT浓度为5 μg/ml的PBS溶液),37℃避光培养4 h后,移除培养液,每孔加入100 μl DMSO,水平振荡10 min,放入酶标仪中检测波长570 nm处的光吸收值。代入下述公式计算细胞存活率:细胞存活率(%)=(实验组吸光值-空白孔吸光值)/(对照组吸光值-空白孔吸光值)×100%。实验独立重复三次后,将各转染组的细胞存活率导入SPSS软件,计算P值。
1.2.6细胞周期分析将PBS清洗过的待测细胞收集到15 ml尖底离心管中,1 000 r/min离心5 min。弃上清液后用70%乙醇重悬细胞,4℃固定24 h。1 000 r/min离心5 min,移除固定液,加入PI染液,重悬细胞。室温避光30 min后用流式细胞仪进行细胞周期分析。

2结果
2.1干扰PAK4表达抑制三阴乳腺癌细胞增殖在三阴乳腺癌BT549和MDA-MB-231细胞中,转染PAK4干扰载体24 h后,分别通过荧光定量和免疫印迹分析PAK4 mRNA和蛋白质表达量变化,PAK4 mRNA(图1A)和蛋白质(图1B)表达量均显著降低(P<0.01)。干扰内源PAK4表达后,三阴乳腺癌BT549和MDA-MB-231细胞的增殖率分别下降(36.51±4.24)%(图2A)和(38.54±5.43)%(图2B),均显著低于对照组(P<0.01)。
2.2干扰PAK4表达对三阴乳腺癌细胞周期的影响转染PAK4干扰载体24 h后,对三阴乳腺癌BT549和MDA-MB-231细胞的细胞周期进行检测。PAK4干扰组G0/G1期细胞所占比例为(66.40±2.82)%和(72.01±3.13)%,与对照组(49.35±0.95)%和(51.89±0.96)%相比均显著上升(图3),P<0.01,说明抑制PAK4表达可以将三阴乳腺癌细胞阻滞在G0/G1期。
2.3干扰PAK4表达抑制三阴乳腺癌细胞增殖的分子机制有研究显示PAK4通过激活MEK,进而促进ERK1/2的磷酸化。因此我们在三阴乳腺癌BT549细胞中,转染PAK4干扰载体24 h后,检测p-ERK1/2表达变化,与对照相比PAK4干扰组p-ERK1/2 表达显著降低(图4A);进一步,应用MEK激酶MEK1和MEK2的高效选择性抑制剂PD98059处理后,三阴乳腺癌BT549细胞的增殖率下降(46.41±7.16)%(图4B),与对照组差异显著,P<0.01。
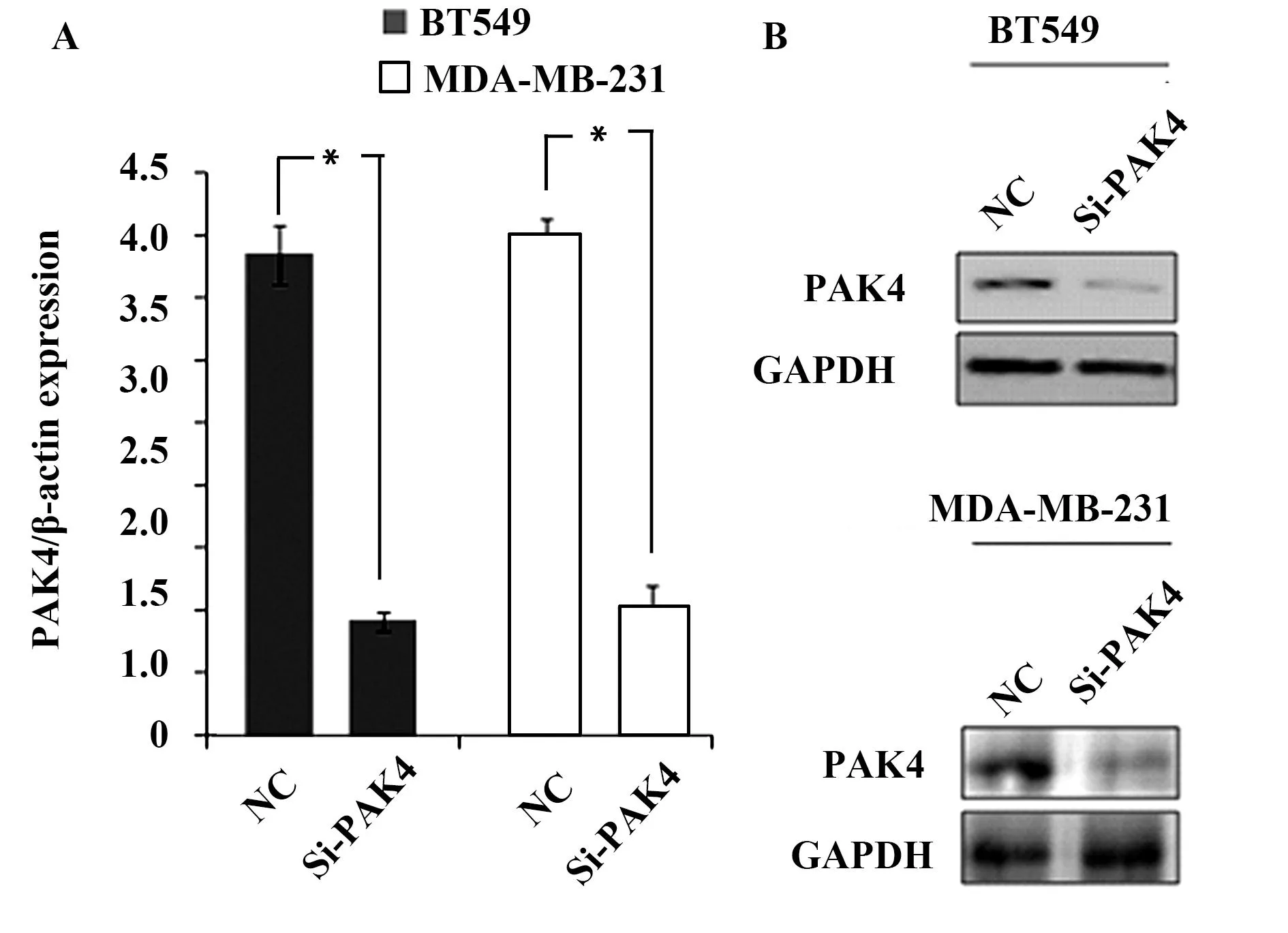
图1 PAK4在三阴乳腺癌BT549和MDA-MB-231细胞中表达量Fig.1 Expression of PAK4 in BT549 and MDA-MB-231 cell after PAK4 knockdownNote: mRNA(A)and protein(B)expression of PAK4 in BT549 and MDA-MB-231 cells transfected with siRNA(si-PAK4)or control siRNA(NC),*.P<0.01.

图2 干扰PAK4表达抑制三阴乳腺癌细胞增殖Fig.2 PAK4 knockdown suppressed proliferation of breast cancerNote: A.BT549 cells;B.MDA-MB-231 cells;*.P<0.01.

图3 干扰PAK4表达对三阴乳腺癌细胞周期的影响Fig.3 Cell-cycle(G0/G1,S and G2/M)analysis of breast cancer after PAK4 knockdownNote: A.BT549 cells;B.MDA-MB-231 cells.*.P<0.01.

图4 干扰PAK4表达抑制三阴乳腺癌细胞增殖的分子机制Fig.4 Mechanism of inhibition effect of PAK4 knockd-own in TNBC cellsNote: A.Protein expression of p-ERK1/2 in BT549 cells transfected with siRNA(si-PAK4)or control siRNA(NC).B.PD98059 suppressed the proliferation of BT549 cells,*.P<0.05
3讨论
乳腺癌发病率位居大城市女性肿瘤的第一位,并且其死亡率也增长迅速,目前乳腺癌已成为对妇女健康威胁最大的疾病[4]。随着乳腺癌分子生物研究的深入,开发了针对不同分子分型的乳腺癌的分子靶向药物,其临床应用大大提高了乳腺癌的治疗效果。目前临床以雌激素受体、孕激素受体、人表皮生长因子受体2及Ki67将乳腺癌分成4种亚型,采用不同治疗策略,取得了良好的治疗效果。主要手段是针对雌激素受体、孕激素受体阳性采用内分泌治疗[5];人表皮生长因子受体2阳性,采用抗HER2的分子靶向治疗[6]。然而,三者均为阴性的乳腺癌,内分泌治疗和分子靶向治疗均无效,主要治疗手段是化疗,但其临床特点为分级高、侵袭性强和进展快,又缺乏有效治疗手段,预后较差[3]。目前,三阴乳腺癌新治疗靶点为国内外研究热点,如表皮生长因子受体及趋化因子受体抑制剂的开发[7,8],但仍存在较多问题,所以新型靶点的开发对三阴乳腺癌未来的治疗策略具有重要意义。
p21蛋白激活激酶(PAK)为一类保守的丝氨酸/苏氨酸蛋白激酶,目前被认为在肿瘤细胞信号调控网中发挥关键作用[9]。PAK4是Ⅱ类PAK中最具有代表性的成员,其N末端不含自我抑制域(AID)[10]。PAK4在多数组织中具有表达,并且在多种肿瘤细胞系中过表达。在正常乳腺组织中低水平表达,在大多数乳腺癌中异常高表达,促进了乳腺肿瘤恶性进展,与肿瘤发生的多种标志现象密切相关,如非停泊性生长、促进肿瘤细胞存活、转移和侵袭等[11]。最新报道显示PAK4高表达是乳腺肿瘤细胞恶性转化的关键基因,还是上皮来源乳腺癌去腺泡样等上皮特征的原因,但是其在三阴乳腺癌中的作用机制尚不明确[12]。因此,本研究首先选择了三阴乳腺细胞株MDA-MB-231和BT549细胞,转染了PAK4的SiRNA干扰载体,抑制了细胞内源的PAK4表达,通过荧光定量和免疫印迹分析PAK4 mRNA和蛋白质表达量均显著降低(图1)。MTT分析发现,干扰内源PAK4表达显著抑制三阴乳腺癌BT549和MDA-MB-231细胞的增殖(图2),说明PAK4在三阴乳腺癌细胞的增殖存活中发挥重要作用。进一步,通过流式细胞术分析发现PAK4被抑制表达后,三阴乳腺癌细胞被阻滞在G0/G1期,细胞周期进程停滞(图3)。有研究显示PAK4通过激活ERK通路发挥促增殖作用[13]。因此,利用免疫印迹检测p-ERK1/2表达量发现,干扰PAK4表达被抑制ERK通路的激活(图4A)。但是,PAK4是否通过ERK通路在三阴乳腺癌细胞中发挥促增殖作用。我们进一步利用ERK通路激活抑制剂PD98059处理三阴乳腺癌细胞后发现,增殖同样受到抑制(图4B)。这些结果说明PAK4通过激活ERK通路,在三阴乳腺癌细胞增殖中发挥关键作用,抑制内源PAK4表达,可以抑制三阴乳腺癌增殖,这也提示PAK4可能是三阴乳腺癌治疗的新靶点,针对PAK4表达的抑制剂可能具有抑制三阴乳腺癌的临床价值。
参考文献:
[1]赖万强,曾健.三阴性乳腺癌的治疗靶点研究进展[J].医学综述,2015,21(19):3504-3506.
[2]王晓稼,Fox KR.受体三阴性乳腺癌的分子特征与治疗研究进展[J].癌症进展,2008,8(2):129-134.
[3]钟辉凤,陈晓品.三阴乳腺癌治疗现状[J].现代医药卫生,2015,31(4):488-490.
[4]郑莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561-569.
[5]单光莲.乳腺癌与雌激素及有关内分泌调节治疗研究[J].中国社区医师,2015,31(22):7-8.
[6]徐璐,曾雪,张志强,等.乳腺癌分子靶向治疗的现状与展望[J].中国实用外科杂志,2015,35(7):790-793.
[7]Lee KH,Hsu EC,Guh JH,etal.Targeting energy metabolic and oncogenic signaling pathways in triple-negative breast cancer by a novel adenosine monophosphate-activated protein kinase(AMPK)activator[J].J Biol Chem,2011,286(45):39247-39258.
[8]Stratford AL,Reipas K,Hu K,etal.Targeting p90 ribosomal S6 kinase eli minates tumor-initiating cells by inactivating Y-box binding protein-1 in triple-negative breast cancers[J].Stem Cells,2012,3(7):1338-1348.
[9]李冬霞,张慧,蔡松旺.p21活化激酶4在非小细胞肺癌中的表达及其临床意义[J].中国病理生理杂志,2015,31(11):1956-1960.
[10]Cammarano MS,Nekrasova T,Noel B,etal.Pak4 induces premature senescence via a pathway requiring p16INK4/p19ARF and mitogen-activated protein kinase signaling[J].Mol Cell Biol,2005,25(21):9532-9542.
[11]Yeo D,He H,Baldwin GS.The role of p21-activated kinases in pancreatic cancer[J].Pancreas,2015,44(3):363-369.
[12]李彦姝,张红艳,刘芙蓉,等.PAK4促进人乳腺肿瘤细胞G_1/S期转化机制探讨[J].中华肿瘤防治杂志,2015,22(3):165-168.
[13]王子航,李春实,康劲松,等.干扰PAK4表达对肝细胞癌迁移侵袭的影响[J].中国免疫学杂志,2015,31(9):1183-1185.
[收稿2016-01-20修回2016-02-19]
(编辑许四平)
Effect of PAK4 on cell proliferation of TNBC cells
WANGZi-Hang,CHENLi-Yan,MIXu-Guang.
YanbianUniversityMedicalCollege,Yanji133002,China
[Abstract]Objective:To analyze the mechanism of p21 Protein Activated Kinase 4(PAK4)on cell proliferation of triple negative breast cancer(TNBC)cells.Methods: The mRNA and protein expression of PAK4 was detected by qRT-PCR and western blot in TNBC cells transfected with siRNA PAK4;The proliferation of TNBC cells transfected with PAK4 Si were analysed by MTT assay;The related signaling pathways was detected by western blot in TNBC cells transfected with siRNA PAK4.Results: PAK4 knockdown could suppress the proliferation of BT549 and MDA-MB-231 cells.Comparing with normal control,the proliferation rate were down to(36.51±4.24)% and(38.54±5.43)%,the present of G0/G1 phase cells were uPto(66.40±2.82)% and(72.01±3.13)% and the expression of p-ERK1/2 was reduced.Treated with PD98059,ERK pathway inhibitor,the proliferation rate of BT549 cells were down to(46.41±7.16)%.Conclusion: PAK4 plays a key role in the proliferation of TNBC,and its promoting proliferation effect associated with activating ERK pathway.
[Key words]TNBC;p21 Protein Activated Kinase 4;Proliferation;ERK
doi:10.3969/j.issn.1000-484X.2016.05.007
作者简介:王子航(1994年-),男,临床医学专业2012级本科,主要从事抗肿瘤机制的研究,E-mail:1456825616@qq.com。通讯作者及指导教师:陈丽艳(1974年-),女,博士,教授,主要从事肿瘤分子病理学的研究,E-mail:lychen@ybu.edu.cn。
中图分类号R735.7
文献标志码A
文章编号1000-484X(2016)05-0636-04
①本文为吉林省科技厅青年基金项目(No. 20150520047JH)。
②延边大学医学院生物化学与分子生物学教研室,延吉133002。
③吉林省人民医院医学诊治实验中心,长春130021。