非小细胞肺癌患者EML4-ALK基因表达与临床特征及近期生存的关系
郑剑滔, 郑 斌, 郭朝晖, 朱 勇, 郑 炜, 陈 椿
福建医科大学 附属协和医院胸外科,福州 350001
非小细胞肺癌患者EML4-ALK基因表达与临床特征及近期生存的关系
郑剑滔, 郑斌, 郭朝晖, 朱勇, 郑炜, 陈椿
福建医科大学 附属协和医院胸外科,福州350001
摘要:目的探讨非小细胞肺癌(NSCLC)中棘皮动物微管蛋白4-间变性淋巴瘤激酶(EML4-ALK)融合基因突变情况与临床特征、生存时间的关系。方法回顾性分析82例NSCLC患者的临床资料,包括患者的年龄、性别、吸烟史、病理类型、肿瘤转移、临床分期或术后分期及表皮生长因子受体(EGFR)突变情况等,并通过阅览病例、电话随访等方式随访其生存情况。结果82例中,检测出EML4-ALK融合基因突变9例为突变阳性组,总突变率为10.98%,余为突变阴性组。2组在性别、肿瘤病理类型、肿瘤转移、病理分期等方面比较,差别无统计学意义(P>0.05);2组在吸烟史、EGFR基因突变情况的比较,差别有统计学意义(P<0.05)。突变阳性组与突变阴性组的中位生存期分别为21月(95%CI,18~24月)和23月(95%CI,22~24月),差别无统计学意义(P<0.05)。结论EML4-ALK融合基因突变多倾向于女性、不吸烟、腺癌与EGFR基因无突变的患者。EML4-ALK融合基因突变尚不能作为评估NSCLC近期预后的独立因素。
关键词:非小细胞肺癌; EML4-ALK融合基因; 临床特征; 生存
肺癌是当今全球最常见的恶性肿瘤之一,发病率逐年上升,发病率和死亡率位于世界恶性肿瘤首位[1]。由于其发病隐匿,症状缺乏特异性,超过半数以上的患者在首诊时已属肿瘤局部晚期或晚期,失去手术机会,如果不采取相应治疗,其1年生存率不足10%[2]。令人可喜的是,随着对肿瘤发病机制及其生物学行为的不断深入,人们越来越多的将治疗的焦点集中于特异性高、不良反应轻的分子靶向药物。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)的出现受到了肿瘤学界的普遍关注,其临床应用为非小细胞肺癌(non small cell lung cancer,NSCLC)的治疗带来了新的曙光[3-5]。2007年,Soda等在NSCLC中发现了棘皮动物微管蛋白4-间变性淋巴瘤激酶(microtubule-associated protein-like 4 and anaplastic lymphoma kinase,EML4-ALK)融合基因这另一种高活性的酪氨酸激酶类型[6]。目前ALK激酶抑制剂已经诞生,并被证实能够抑制EML4-ALK融合基因阳性细胞的生长。有报道EML4-ALK融合常发生于有特定临床特征的NSCLC患者中[7]。笔者采用RT-PCR法检测EML4-ALK 9个亚型融合基因突变情况,并分析基因突变状态与NSCLC患者临床特征及预后的关系,为NSCLC患者的个体化治疗、预后判断提供依据。
1对象与方法
1.1对象收集2010年10月—2013年11月经组织病理学证实的NSCLC患者,满足病理诊断后,完成EML4-ALK融合基因检测共82例。其中男性44例,女性38例,年龄(60.5±10.2)岁(36~82岁),≥60岁42例,<60岁40例;无吸烟史53例,有吸烟史29例;Ⅰ期20例,Ⅱ期3例,Ⅲ期23例,Ⅳ期36例;腺癌61例,鳞癌14例,大细胞癌1例,其他类型6例;出现肿瘤转移者60例,无肿瘤转移者22例;EGFR突变者38例,无EGFR突变者44例。
1.2仪器人类EML4-ALK融合基因检测试剂盒(厦门艾德生物医药科技有限公司);荧光PCR仪(Mx 3000 p,美国Stratagene公司)。
1.3EML4-ALK融合基因检测方法
1.3.1RNA提取取5片5 μm厚度石蜡切片组织,置于1.5 mL EP管内,甲醛固定,提取并纯化石蜡组织的RNA,具体步骤按试剂盒操作说明进行。
1.3.2逆转录反应取逆转录反应混合液18 μL,逆转录酶(EA)1 μL,加入无菌离心管中,混匀;加入待测样品RNA 6 μL(RNA总量0.1~5 μg,可用DEPC水进行RNA稀释);42 ℃保温1 h;95 ℃保温5 min后冰上冷却,得到的cDNA溶液用于PCR扩增。
PCR扩增:采用特异引物即时荧光PCR法,检测E13;A20、E6;A20、E20;A20、E15;A20、E14;A20、E18;A20、E2;A20、E17;A20、E2;insll7A20共9种融合突变。将从石蜡包埋组织中提取的RNA经逆转录生成cDNA,再进行即时荧光PCR。PCR
反应条件分别为:95 ℃ 5 min→95 ℃ 25 s→64 ℃ 20 s→72 ℃ 20 s,15个循环;93 ℃ 25 s→60 ℃ 35 s→72 ℃ 20 s,31个循环。收集荧光信号进行数据分析。
1.4统计学处理采用SPSS 19.0统计软件分析,采用χ2检验进行各种率的分析,对于理论频数<5的则采用Fisher确切概率法检验。采用Kaplan-Meier方法估计组间生存率和绘制累计生存曲线,组间对比使用Log-rank检验,P<0.05为差别具有统计学意义。
2结果
2.1一般资料初次诊断为NSCLC并行EML4-ALK融合基因检测患者82例,其具体临床资料详见表1。其中9例出现EML4-ALK融合基因突变为突变阳性组,突变率为10.98%,其突变病例详细临床资料见表2。余为突变阴性组。2组在性别、肿瘤病理类型、肿瘤转移、病理分期等方面比较,差别无统计学意义(P>0.05);2组在吸烟史、EGFR基因突变情况的比较,差别有统计学意义(P<0.05)。
2.2生存期本研究至2015年8月30日截止,随访时间为6~37月。共有29例患者死亡,其中突变阳性组4例,突变阴性组25例。突变阳性组与突变阴性组的中位生存期分别为23月(95%CI,22~24月)和21月(95%CI,18~24月)。2组中位生存期比较,差别无统计学意义(P<0.05),其生存曲线详见图1。
表1NSCLC患者的临床特征
Tab 1Clinical characteristics of patients with NSCLC
NSCLC:非小细胞肺癌;ALK:间变性淋巴瘤激酶;EGFR:表皮生长因子受体.
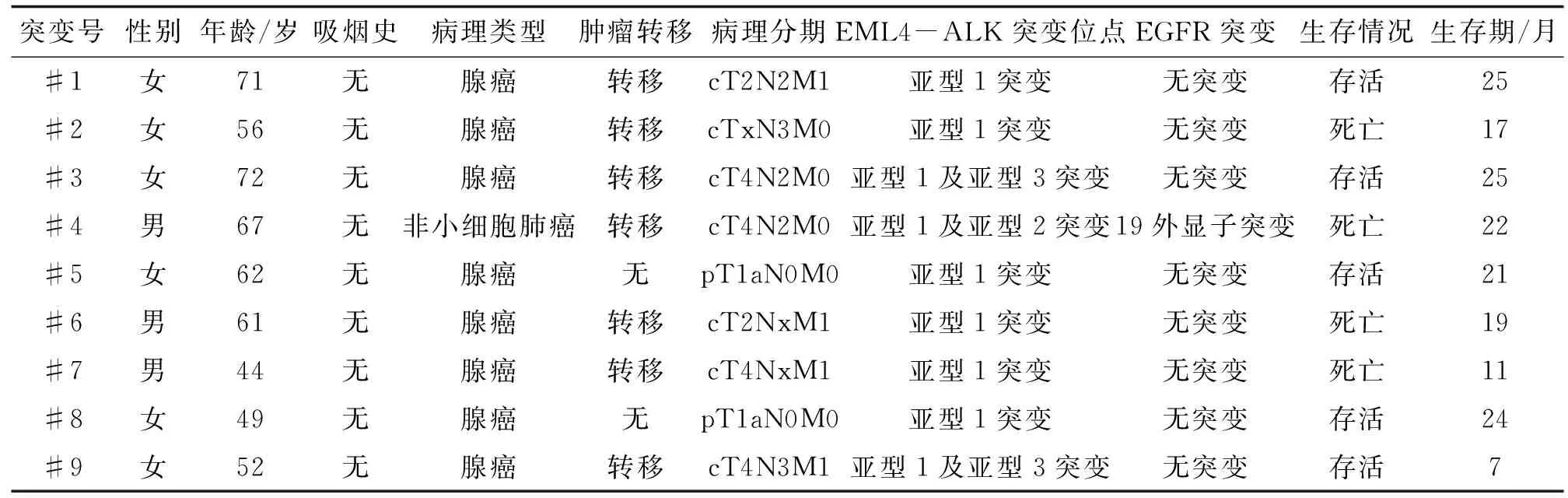
表2 EML4-ALK融合基因突变患者的临床特征
EML4-ALK:棘皮动物微管蛋白4-间变性淋巴瘤激酶; EGFR:表皮生长因子受体.
3讨论
肺癌是癌症死亡的首要原因,每年有超过一百万人死于该病[8]。虽然化疗仍然是NSCLC的主要治疗方法[9-10],但对于有EGFR基因突变的患者,酪氨酸激酶抑制剂(吉非替尼和厄洛替尼)已承担着越来越重要的作用[5,11]。2007年,Sode和他的同事在腺癌患者中发现了一个亚群,即EML4-ALK融合基因。EML4-ALK代表了一种NSCLC的新分子亚型,该类患者具有独特的临床特征[7]。
在Sasaki等的综述中,各种EML4-ALK融合基因突变类型中,以亚型1(E13;A20)最常见,检出率高达33%[12]。本研究中,突变数为9例,突变率为10.97%,其中双位点突变3例,具体为亚型1突变9例,亚型3突变1例,亚型2突变2例。本研究结果与上述报道基本一致,说明亚型1是EML4-ALK融合基因最常见的突变类型。关于为何会产生不同位点融合及其物质基础是否存在差异,其机制尚未完全阐述;同时融合基因各亚型之间的转化活性和激酶活性彼此之间是否存在差异,而这在肿瘤细胞的发生发展中又起到什么作用,每种不同的融合基因突变型对ALK抑制剂的应答水平是否存在差异,还值得不断深入探讨。值得关注的是,本研究存在3例双突变的病例,对如何产生双突变的机制仍未完全阐明,且其是否有不同于EML4-ALK融合基因单突变的临床病理特征,有待今后的大宗样本得以验证。
Amanda等报道EML4-ALK融合基因突变并不普遍,在NSCLC中突变率为5%。但经过临床特征筛选后(年轻女性患者、腺癌),其突变率可达到16.4%[13],提示EML4-ALK融合基因阳性多见于女性、不吸烟和腺癌患者。而Koh等报道在韩国人群中,EML4-ALK融合基因突变更倾向于年轻患者[14]。本组中,年龄组间区别并不明显,年龄≥60岁者和<60岁者的EML4-ALK融合基因阳性率分别为11.9%(5/42)和10.0%(4/40),差别无统计学意义。进一步分析,EML4-ALK融合基因突变阳性组的平均年龄为(59.3±9.5)岁,而突变阴性组的平均年龄为(60.6±10.3)岁,差别无统计学意义,分析其主要原因,考虑可能是实验样本量较少及其纳入标准等因素造成。
Amanda等报道,EML4-ALK融合基因突变与否和首次临床分期差别无统计学关联[13]。而Fallet等认为,EML4-ALK融合基因突变更倾向于淋巴结转移的中晚期病例[15]。本组中,各组在临床分期及肿瘤转移方面比较,差别无统计学意义,考虑为EML4-ALK融合基因突变组的病理分期分布不均造成。
Shaw等对5例EML4-ALK融合基因阳性的患者进一步进行了EGFR和KRAS突变状态的检测,发现并没有EGFR和KRAS基因突变,因此认为EML4-ALK融合基因与这两种基因突变的发生均不重合[16]。但Zhang等发现1例亚洲女性腺癌患者同时存在EML4-ALK与EGFR第19号外显子突变[17]。另外一组将厄洛替尼联合化疗作为EGFR阳性突变的欧洲患者一线治疗方案的研究中,15.8%的患者存在EGFR与EML4-ALK融合基因双突变,与37.89%发生EGFR T790M位点上基因突变和24.21%发生在TP53位点上的基因突变的患者在中位生存期上比较,差别无统计学意义[18]。但是区分EML4-ALK融合基因和EGFR突变对指导肿瘤的治疗仍具有重要意义,因为突变的EML4-ALK融合基因目前已被证实有增加EGFR-TKI耐药的潜在风险。而从本研究分析,也存在1例同时出现EML4-ALK融合基因与EGFR第19号外显子突变的病例,但该病例为男性NSCLC患者。因此,是否在少数中国肺癌患者中可能同时存在EML4-ALK与EGFR基因突变,发生同时突变时是否具有独特的临床病理特征,这些疑虑还需进一步的研究来证实。
2011年,Shaw等报道,EML4-ALK融合基因突变与未突变患者的总生存时间比较,差别无统计学意义[19]。2014年,Amanda等分析显示,尽管EML4-ALK融合基因突变组获得更为积极的治疗和较长的生存期,但与未突变组比较,差别无统计学意义[13]。本研究发现,在NSCLC中,2组总生存期比较,差别无统计学意义,与相关文献报道吻合。因此,在NSCLC中,EML4-ALK融合基因突变与否尚不能作为独立的预后影响因素。但考虑本研究的相关局限性,且2组确诊后治疗方案及一般情况不尽相同,并且本研究中部分EGFR突变患者有口服靶向药治疗病史,造成了偏倚。对此,可在后续研究中适当增加样本量,并延长随访时间及准确了解治疗方案以减少偏倚。
综上所述,靶向药物特别是针对NSCLC基因传导通路上的靶向药物为无数肺癌患者带来新的曙光。因此,关于EML4-ALK融合基因的研究必将是继EGFR之后在治疗NSCLC的又一个热点。本研究提示,EML4-ALK融合基因突变多倾向于女性、不吸烟、腺癌与EGFR基因无突变的患者。而年龄、疾病分期和肿瘤是否发生转移与EML4-ALK融合基因突变与否无统计学关联,这为今后筛选靶向药物获益人群提供了依据,同时也证明了EML4-ALK融合基因突变仍不能作为评价NSCLC预后的独立因素。在今后的研究中,可继续扩大样本量、完善相关随访内容,并延长随访时间,为NSCLC的个体化治疗提供更好的依据。
参考文献:
[1]Patz E F J r,Rossi S, Harpole D H,etal. Correlation of tumor size and survival in patients with stage IA non-small cell lung cancer[J].Chest,2000,117(6):1568-1571.
[2]Brambilla E. Lung cancer:multidisciplinary approach for management[J].EurRespirJ,2014,35(4):7173.
[3]Park D M,Bray F,Ferlay J,etal. Global cancer statistcs[J].CaACancerJClin,2005,55(2):74-108.
[4]Kris M G,Natale R B,Herbst R S,etal. Effiecacy of gefitinib,an inhibitor of the epidermal growth factor receptor tyrosine kinase,in symptomatic patients with non-small cell lung cancer:a randomized trial[J].JAMA,2003,290(16):2149-2158.
[5]Paez J G,Janne P A,Lee J C,etal. EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304(5676):1497-1500.
[6]Soda M,Choi Y L,Enomoto M,etal. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J].Nature,2007,448(7153):545-566.
[7]Inamura K,Takeuchi K,Togashi Y,etal. EML4-ALK fusion is linked to histological characteristics in a subset of lung cancers[J].JThoracOncol,2008,3(1):7-13.
[8]Shibuya K,Mathers C D,Boschi-Pinto C,etal. Global and regional estimates of cancer mortality and incidence by site:II. Results for the global burden of disease 2000[J].BMCCancer,2002,2(1):36.
[9]Schiller J H,Harrington D,Belani C P,etal. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J].NEnglJMed,2002,346(2):92-98.
[10]Sandler A,Gray R,Perry M C,etal. Paclitaxel carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].NEnglJMed,2006,355(24):2542-2550.
[11]Lynch T J,Bell D W,Sordella R,etal.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].NEnglJMed,2004,350(21):2129-2139.
[12]Sasaki T,Rodig S J,CHirieac L R,etal. The biology and treatment of EML4-ALK non-small cell lung cancer[J].EurJCancer,2010,46(10):1773-1780.
[13]Amanda L H,Martin E,Fernando G,etal. Preselection based on clinical characteristics in german non small-cell lung cancer patients screened for EML4-ALK translocation[J].JThoracOncol,2014,9(1):109-113.
[14]Koh Y,Kim D W,Kim T M,etal. Clinicopathologic characteristics and outcomes of patients with anaplastic lymphoma kinase-positive advanced pulmonary adenocarcinoma: suggestion for an effective screening strategy for these tumors[J].JThoracOncol,2011,6(5):905-912.
[15]Fallet V,Cadranel J,Doubre H,etal. Prospective screening for ALK: clinical features and outcome according to ALK status[J].EurJCancer,2014,50(7):1239-1246.
[16]Shaw A T,Yeap B Y,Mino-Kenudson M,etal. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK[J].JClinOncol, 2009,27(26):4247-4253.
[17]Zhang X C,Zhang S,Yang X N,etal. Multiple EML4-ALK fusion transcripts and concurrent EGFR kinase mutation in Chinese non-small cell lung cancer[J].JThoracOncol,2009,4(9):549.
[18]Cesare G, Solange P, Assunta S,etal. ALK inhibitors in the treatment of advanced NSCLC[J].CancerTreatmentReviews,2014,40(2):300-306.
[19]Shaw A T,Yeap B Y,Solomon B J,etal. Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis[J].LancetOncol,2011,12(11):1004-1012.
(编辑:张慧茹)
Expression of EML4-ALK Gene in Patients with Non Small Cell Lung Cancer with Clinical Characteristics and Survival Relations
ZHENG Jiantao, ZHENG Bin, GUO Chaohui, ZHU Yong, ZHENG Wei, CHEN Chun
Department of Thoracic Surgery, Fujian Medical University Union Hospital, Fuzhou 350001,China
ABSTRACT:ObjectiveTo study the relationship between EML4-ALK fusion gene mutations and clinical characteristics and survival in NSCLC.MethodsA total of 82 patients’ clinical data were collected, including the patient’s age, sex, smoking history, histological type, tumor metastasis, clinical stage or postoperative staging and EGFR mutations.The survival data were collected by chart study and telephone interview.ResultsOf all 82 patients, 9 were detected positive for EML4-ALK fusion gene mutations.Between the mutation positive group and the negative group there was no significant difference in gender, tumor histological type, tumor metastasis status, and pathologic stage(P>0.05).There was a statistically significant difference in smoking history and EGFR mutations(P<0.05).The median of survival time was 23 months for the gene mutation negative group and 21 months for the gene mutation positive group(P>0.05).ConclusionEML4-ALK fusion gene mutation is more inclined to occur in women, non-smokers, adenocarcinoma, and patients without EGFR gene mutation.The meanwhile of EML4-ALK fusion gene mutation can not yet be used as an independent factor in the assessment of non-small cell lung cancer prognosis.
KEY WORDS:non small cell lung cancer; EML4-ALK fusion gene; clinical characteristics; survival
收稿日期:2015-09-17
基金项目:福建省医学创新课题(2011-CX-9)
作者简介:郑剑滔(1987-),男,住院医师,医学硕士通讯作者: 陈椿. Email:chenchun0209@163.com
中图分类号:R394; R394.3; R730.26; R722.2
文献标志码:A
文章编号:1672-4194(2016)01-0020-05

