一株高效铁锰氧化细菌P1的分离鉴定及氧化条件优化
樊星 王淑婷 李春艳
(东北农业大学资源与环境学院,哈尔滨 150030)
一株高效铁锰氧化细菌P1的分离鉴定及氧化条件优化
樊星 王淑婷 李春艳
(东北农业大学资源与环境学院,哈尔滨 150030)
利用富集培养技术从富含铁锰的地下水井淤泥中分离得到1株能够氧化铁锰的细菌,命名为P1。经形态特征、生理生化特征和16S rDNA序列分析,将菌株P1鉴定为蜡状芽孢杆菌(Bacillus cereus)。利用单因素实验探讨菌株P1的生长及氧化特性;采用响应面分析方法考察接种量、温度、pH值3个因素对菌株P1氧化特性的影响,进一步优化菌株的氧化条件。结果表明,菌株P1的最佳氧化条件:温度28.54℃,pH7.23,接种量4.35%。在此条件下,菌株P1在锰含量为200 mg/L、铁含量为800 mg/L的选择性培养液中培养3 d后,锰氧化率达 93%以上,铁氧化率达100%。
铁锰氧化;Bacillus cereus;分离鉴定;氧化条件;响应面分析法
铁、锰是地壳的主要构成成分,广泛分布于自然界中。地下水在径流地下的过程中,由于化学作用、物理作用及生物作用溶解了不同浓度的铁、锰离子以及其他物质,地下水的优良品质受到了破坏[1]。我国北方地区地下水铁、锰超标相对于南方较严重,铁、锰超标的地区主要分布在松花江流域[2]。地下水中铁、锰含量过高会带来诸多危害,主要包括以下几个方面:易使衣物染色,水有铁腥异味,Fe2O3等铁质沉淀物会滋长铁细菌,阻塞管道,严重时会出现红水现象;作为造纸、纺织、印染、化工、食品等生产用水会降低产品质量,腐蚀生产设备及用具;长期饮用含铁、锰量过高的水还会严重影响身体健康,造成胰腺、肝脏、神经系统、呼吸系统疾病,甚至导致人体慢性中毒[3-6]。因此,含有过量铁、锰的地下水,需要处理后才能满足工业生产和人民生活的要求。
地下水除铁、锰技术经历了从自然氧化法、接触氧化法向生物氧化法的过渡阶段。由于自然氧化法和接触氧化法在实施过程中存在许多问题,如操作流程复杂、处理成本高、运行难度大,出水水质不稳定和易造成二次污染等弊端[7],而生物氧化法由于具有效果好,运行效果稳定,无有毒副产物之患,投资少等优点[8]更为人们所接受。目前,国内对于生物氧化法的研究主要集中在铁氧化菌、锰氧化菌的筛选上,而对于铁锰氧化菌的筛选研究较少,且筛选出的菌株对于锰离子的去除效果不理想[9,10]。因此,有针对性地筛选具有高效铁锰氧化能力的菌株,将其应用于地下水处理过程具有重要意义。
本研究通过富集培养,采用特异性培养基从地下水井淤泥中筛选出具有高效铁锰氧化能力的细菌,结合形态学、生理生化特性和16S rDNA序列分析等对其进行鉴定,利用单因素实验探讨菌株的生长及氧化特性,采用响应面分析法对该菌株的氧化条件进行优化。
1 材料与方法
1.1 材料
选用黑龙江省红旗农场富含高铁高锰污染物的地下水井淤泥作为微生物富集培养来源。
LB培养基:蛋白胨10.0 g,酵母膏5.0 g,NaCl 10.0 g,加去离子水至1 L,pH调至7.0。
PYCM改良培养基[11]:蛋白胨0.5 g,葡萄糖0.3 g,酵母浸膏0.2 g,MnSO4·H2O 0.2 g,K2HPO40.1 g,MgSO4·7H2O 0.2 g,NaNO30.2 g,CaCl20.1 g,(NH4)2CO30.1 g,柠檬酸铁铵0.8 g,去离子水1 000 mL,pH6.8-7.2,灭菌20 min。固体培养基添加2%琼脂,湿热灭菌后使用。
1.2 方法
1.2.1 高效铁锰氧化菌的富集与分离 无菌水稀释泥样,搅拌10 min,取0.2 mL稀释液加入到100 mL的LB培养基中,28℃、150 r/min 条件下培养24 h;取上述培养液5 mL加入到100 mL的铁离子浓度为80 mg/L,锰离子浓度为20 mg/L的PYCM改良培养基中,于28℃、150 r/min 的恒温摇床中振荡培养;然后每隔1周以10%(体积分数)的接种量接入到新鲜的PYCM改良培养液中,并逐渐提高铁锰离子浓度,至培养液中铁离子浓度达到800 mg/L,锰离子浓度达到200 mg/L,如此驯化约2个月。
取0.1 mL混合样涂布于PYCM改良培养基固体平板上,28℃培养至有明显单菌落。针对生长良好的单菌落,于铁离子浓度为800 mg/L,锰离子浓度为200 mg/L 的PYCM改良培养基固体平板上进一步划线培养,分离纯化3-4次,获得纯化后的多株铁锰氧化菌株。将菌株回接于PYCM改良培养液中,验证是否对铁、锰离子有氧化能力[12]。通过测定培养液中铁锰离子含量、比较所得功能菌株的氧化能力,筛选出1株高效铁锰氧化菌,命名为P1,并将其接种于PYCM改良斜面培养基上,培养48 h后,待长出明显菌落后,置于4℃冰箱保存备用。
铁/锰氧化率的计算公式如下:

式中,氧化率总铁/总锰:培养基接种培养后Fe2+/ Mn2+的总氧化率;氧化率对照组:未接种菌株培养基中Fe2+/ Mn2+氧化率;d(Fe2+/ Mn2+)初始:培养基中初始的Fe2+/ Mn2+质量浓度(mg/L);d(Fe2+/ Mn2+)剩余:接种培养基中剩余Fe2+/ Mn2+质量浓度(mg/L);d(Fe2+/ Mn2+)对照剩余:对照组培养基中剩余Fe2+/ Mn2+质量浓度(mg/L);氧化率铁/锰:培养基中菌株生物氧化作用的Fe2+/ Mn2+氧化率。
1.2.2 高效铁锰氧化菌的鉴定[13]
1.2.2.1 高效铁锰氧化菌的形态观察 将高效铁锰氧化菌P1采用平板涂布法接种于PYCM改良固体培养基上,28℃恒温培养24 h后观察菌落形态。用光学显微镜和透射电子显微镜观察菌体形态,参照《常见细菌系统鉴定手册》对其进行生理生化鉴定[14]。
1.2.2.2 高效铁锰氧化菌的16S rDNA序列测定 提取细菌总DNA[15], 采用细菌的16S rDNA通用引物[12],上游引物:5'-AGAGTTTGATCCTGGCTCAG-3',下游引物:5'-GGTTACCTTCTTACGACTT-3',引物由大连宝生物有限公司合成。以提取的总DNA作为模板,对该菌株的16S rDNA进行PCR扩增。反应体 系:dNTPs 4 μL(2.5 mmol/L)、10×buffer 5 μL、上游引物及下游引物各2 μL(50 μmol/L)、Ex Taq酶0.5 μL、模板DNA 2 μL,加去离子水至50 μL。PCR反应条件:94℃预变性5 min;94℃变性50 s,60℃退火90 s,72℃延伸2 min,35个循环;72℃延伸10 min[12]。PCR产物在质量分数为1%的琼脂糖凝胶中电泳,并于紫外光下观察,然后将纯化后的PCR扩增产物送上海生工测序[16]。测序结果用BLAST软件在GenBank中进行同源性比较,采用MEGA4.0软件构建系统发育树[17]。
1.2.3 高效铁锰氧化菌株生长及氧化条件的优化
1.2.3.1 单因素实验 分别以20℃、24℃、28℃、32℃和36℃作为温度实验组;以5.5、6.0、6.5、7.0、7.5和8.0作为pH实验组;以1.0%、2.0%、3.0%、4.0%、5.0%、6.0%和7.0%作为菌体接种量实验组;以12、24、36、48、60、72和84 h作为培养时间实验组。以上各实验组的PYCM改良培养液均为50 mL,接种用菌悬液OD600值均调至1.0,恒温摇床振荡培养,以不加菌作为阴性对照,以蒸馏水作为空白对照,在培养第3天测定铁锰氧化率及生长量OD600,分别采用过硫酸铵分光光度法和二氮杂菲分光光度法测定铁、锰浓度[18]。每个处理设3个平行重复。
1.2.3.2 铁锰氧化菌响应面分析实验 根据单因素实验结果,以温度(A)、pH(B)、接种量(C)为自变量,以培养液中铁离子的氧化率(Y1)和锰离子的氧化率(Y2)为响应值,利用Design-Expert 8.0.6软件中的Box-Behnken design(BBD)模型,设计三因素三水平的二次回归方程拟合自变量和铁锰氧化率之间的函数关系,优化铁锰氧化的最佳环境条件。其中实验设计因素水平见表1。二次回归方程用以拟合自变量和响应值之间的函数关系[19],公式如下:

式中,Y:预期响应值;A:常数;Aj:单因素直线系数;Ajj:单因素平方系数;Aij:两个因素的交互系数。
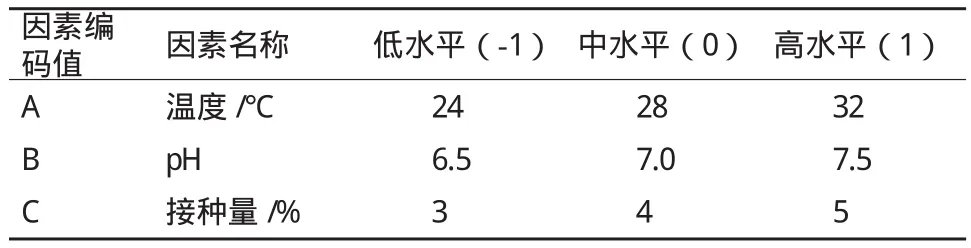
表1 菌株P1的响应面实验因子及水平列表
1.2.4 最佳培养及氧化条件验证实验 将菌株P1接种于PYCM改良培养液中,在最佳条件下培养3 d后,每12 h取样检测菌株的生长量OD600,同时,测定培养液中铁锰离子的剩余浓度,计算氧化率,设置3组平行验证实验。
2 结果
2.1 高效铁锰氧化菌的分离纯化
经分离与纯化获得1株高效铁锰氧化细菌,命名为P1。菌株P1菌落培养特征、革兰氏染色照片和透射电镜照片如图1所示。菌株P1菌落和菌体形态特征分别见表2,生理生化指标见表3。
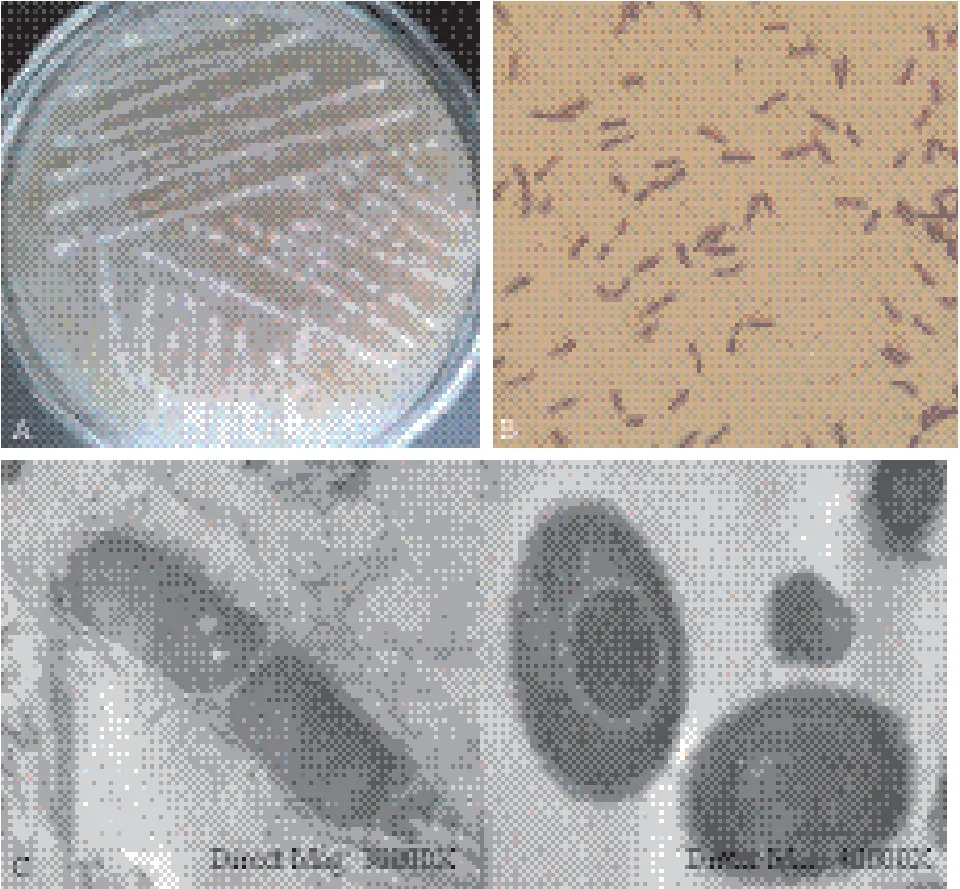
图1 菌株P1菌落及菌体形态
2.2 基于16S rDNA基因序列的系统发育分析
菌株P1序列已在GenBank中注册,登录号为KP241859。菌株P1与数据库中8个同源性较高的细菌模式株进行比较,菌株P1的16S rDNA序列与蜡状芽孢杆菌Bacillus cereus有较高的序列同源性,相似性高达99.0%。其系统发育关系见图2。目前,细菌分类学家的共识是当某两个细菌的16S rDNA的相似性大于95%时,可将其归为同一属。从系统发育树分析可知,菌株P1属于Bacillus cereus。

表2 菌株P1形态特征
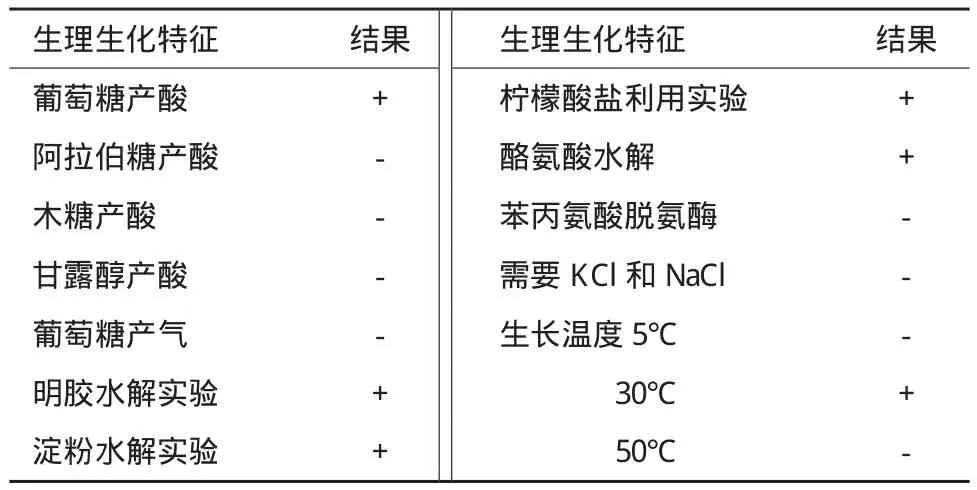
表3 菌株P1生理生化特征

图2 菌株P1的系统发育树
2.3 单因素实验结果
不同因素对菌株P1生长量及铁、锰氧化能力的影响情况,结果(图3)显示,当温度为28℃时,菌株P1生长量和铁、锰氧化率均达到最高点,生长量为1.812,铁、锰氧化率最大值分别为79.8%和 70.7%(图3-A)。菌株P1生长量及铁、锰氧化率均随pH增加先增大后减小,当pH7.0时,菌株铁、锰氧化率达最大值,分别为79.7%和68.5%。当pH为6.5-7.5时,菌株P1生长及氧化能力最佳(图3-B)。接种量为4%时,菌株P1生长量和铁、锰氧化率均达到最大值,分别为1.801、81.7%和70.5%,可知4%为最佳接种量(图3-C)。菌株P1生长量及铁、锰氧化率随培养时间延长呈现出先升高后下降趋势,当培养时间为72 h,菌株P1铁锰氧化率达到最大值,分别84.9%和68.2%(图3-D)。综上所述,影响菌株P1生长量和铁、锰氧化能力的最适条件为温度28℃、pH7.0、接种量4%、培养时间72 h。
2.4 响应面优化结果
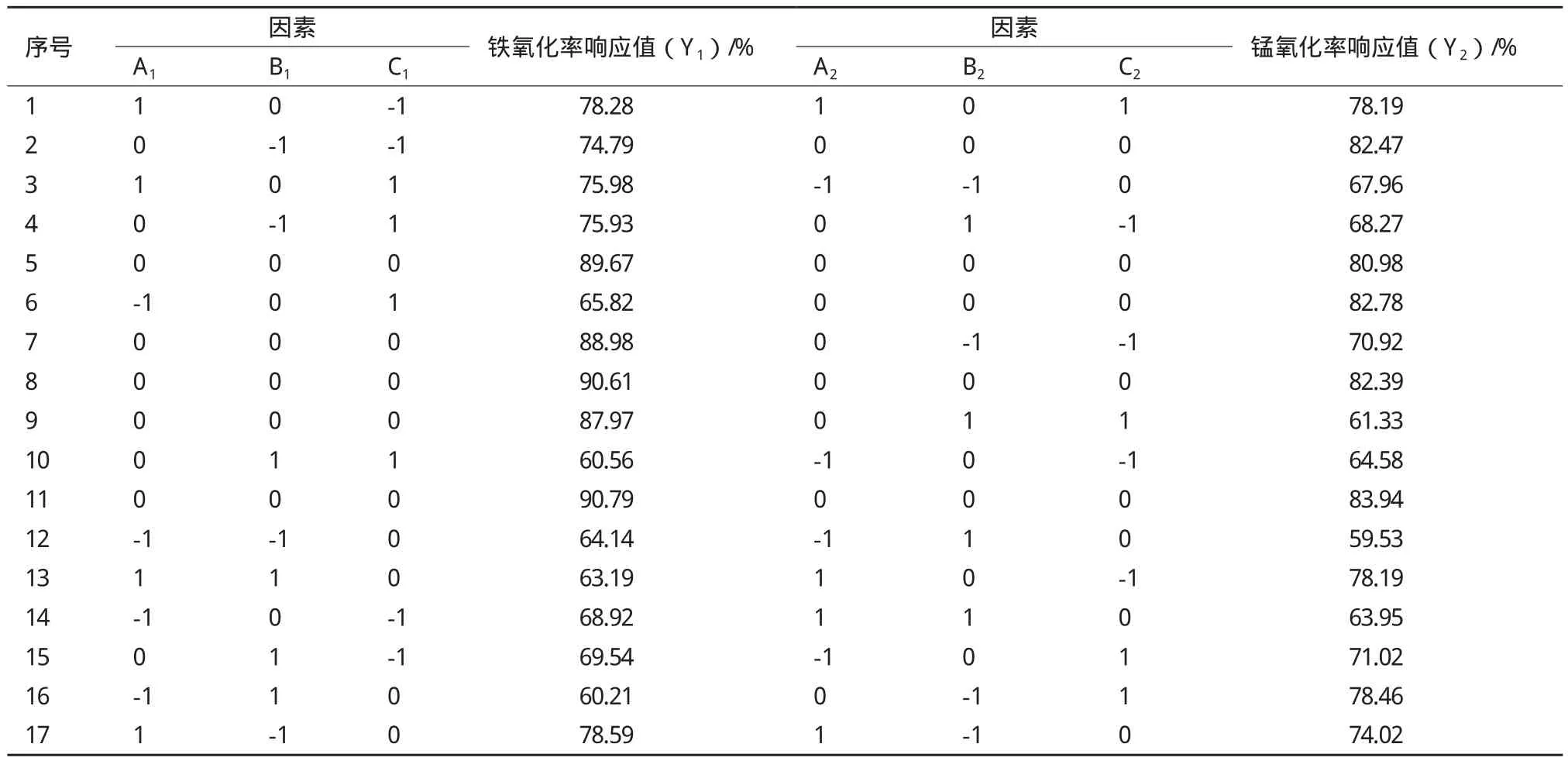
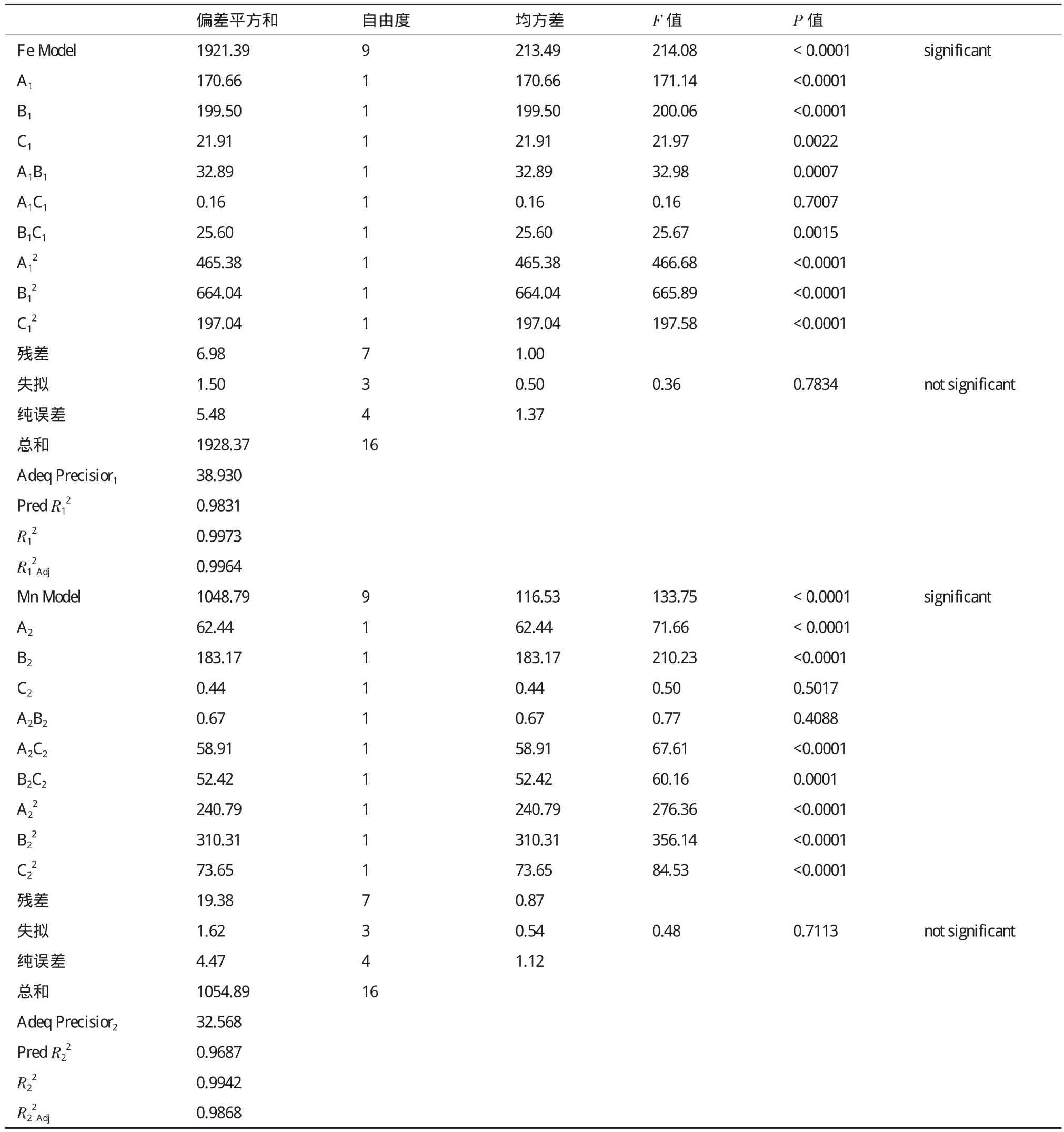
菌株P1的响应面实验设计方案及结果如表4所示,每个响应值实验总共17组,其中包括5组零点实验,以估计实验误差。利用Design-Expert 8.0.6软件,对BBD模型实验数据进行多项回归分析后,得到二次拟合模型为:

式中,Y1为菌株P1对铁的氧化率,Y2为菌株P1对锰的氧化率;A1、B1、C1和A2、B2、C2分别为温度、pH、接种量的编码值。表5是利用Design-Expert 8.0.6软件分析得出的菌株P1铁、锰氧化率响应分析实验的回归分析结果。
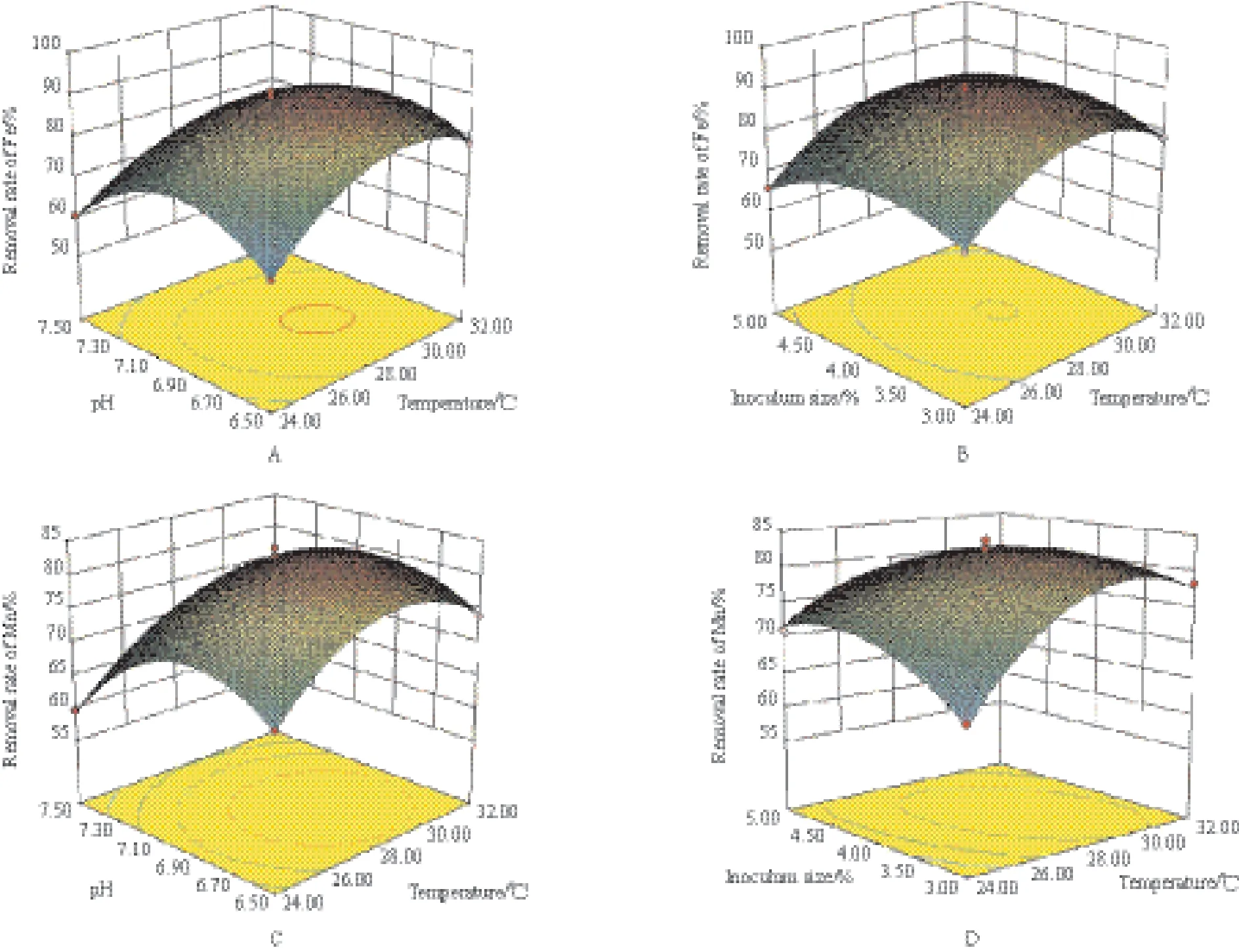
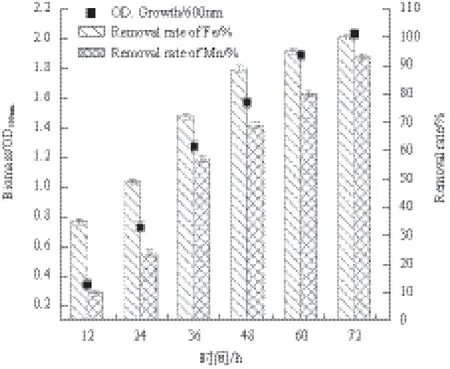
由菌株P1的回归分析结果可知,菌株铁氧化率、锰氧化率的失拟P值均>0.05,而铁氧化率、锰氧化率的模型P值均<0.000 1,表明方程与实际情况拟合良好。由模型预测拟合度Pred R2和模型拟合系数R2可知,铁、锰氧化率的实验值与预测值之间具有良好拟合度;其校正后的拟合系数表明方程模型具有很高的可信度。信噪比大于4时表明模型合理,模型的信噪比Adeq Precisior1=38.930、Adeq Precisior2=32.568, 表 明 模型合理[20]。由表5可知,在菌株P1的响应分析实验中温度、pH的P值均<0.000 1,说明它们对菌株P1铁、锰氧化率具有极显著影响,同时,在以铁氧化率为响应值的响应分析实验中,接种量的P值为0.002 2,表明温度和pH对菌株铁氧化率的影响较接种量大,从温度(F=171.14)与pH(F=200.06)的F值可以看出pH对铁氧化率的影响较温度更为显著。而在以锰氧化率为响应值的响应分析实验中,接种量P值为0.501 7,表明接种量对菌株锰氧化率没有显著影响,从温度与pH的F值可知F温度 图3 各因素对菌株P1生长量及氧化能力的影响 表4 菌株P1响应面实验设计与结果 表5 菌株P1响应分析实验方差分析结果 由上述结果可知,各因素对菌株铁、锰氧化率的影响作用由大到小依次为:pH>温度>接种量。 图4为不同交互组合对菌株P1铁锰氧化能力影响的响应曲面图。结合图中等高线图和响应曲面图能够很好地分析交互组合对响应值的影响情况。如图所示,当各因素固定在零水平时,较高氧化率集中在曲面的中心区域,且在此区域内均存在菌株氧化率的极值点,经软件分析可以得到曲面的最高点,即3个因子的最优实验点,所得菌株P1氧化铁离子的最优实验条件为:温度28.3℃,pH7.18,接种量4.27%;氧化锰离子的最优实验条件为:温度28.9℃,pH7.27,接种量4.46 %。 经Design-Expert 8.0.6软件分析可得菌株P1的铁锰氧化率最优条件为:接种量4.35%,pH7.23,温度28.54℃。 图4 不同因素对菌株P1氧化率产生交互影响的响应曲面图 2.5 最佳条件验证结果 在最佳条件下进行3组平行验证实验,所得菌株P1的生长量及铁锰氧化效果(图5)显示,通过对高效铁锰氧化株菌生长及氧化环境的优化,使得菌株在3 d内对铁的氧化率达到100%,而对锰的氧化率达到93%以上。 随着地下水中高铁锰污染情况的日益突出,近年来关于微生物应用于处理富含铁锰地下水的研究逐渐引起重视。国内对于铁锰生物氧化法的研究主要集中在铁氧化菌、锰氧化菌的筛选、铁锰氧化去除条件以及应用方面的研究上[22],已筛选的具有铁氧化能力和锰氧化能力的细菌主要包括弗氏柠檬酸杆菌(Citrobacter freundii)[21],节杆菌属(Arthrobacter)[23]和芽孢杆菌属(Bacillus sp.)[24]等。目前,对于同时具备铁氧化能力和锰氧化能力的铁锰氧化菌株的筛选、生理生化研究以及氧化条件优化等方面研究的较少[9-13]。而已筛选的具有铁锰氧化能力的细菌主要有假单胞菌属(Pseudomonas sp.)[11]和金黄杆菌属(Chryseobacterium sp.)[25],其铁氧化率均可达到90%以上,但锰氧化率均不理想,且氧化过程持续时间较长,一般为6 d左右。因此,筛选出在富含铁锰地下水条件下,具有高效铁锰氧化能力的细菌对高铁锰地下水处理至关重要。 本实验采用特异性的选择培养基从富含铁锰的地下水井淤泥中分离筛选具有铁锰氧化能力的菌株,同时,对菌株的铁、锰氧化条件进行优化。常用的优化方法主要有正交实验法和响应曲面法两种。正交实验法有一定局限性,它多采用线性模型,只能对一个个孤立的实验点进行分析,无法精确找出整个区域内因素最佳组合和最大响应值[26]。而响应曲面法则采用更为合理的实验设计方案,并同时考虑实验随机误差的影响,以回归分析方法作为函数估算工具,将多因素实验的回归因素和实验结果用简单的二次多项式模型来拟合,计算相对简便,它能够连续对实验各个水平进行分析,预测模型为一个曲面,并且能够在整个区域内获得最佳因素组合和最优响应值[27]。因此本实验采用响应面分析方法对菌株的铁、锰氧化条件进行优化。研究结果表明,各因素对菌株铁、锰氧化率的影响作用由大到小依次为:pH>温度>接种量。经响应面优化后铁、锰氧化率均比优化前明显提高。 在铁锰氧化反应体系中,主要存在两种氧化方式,分别为化学氧化和生物氧化[23]。在本研究过程中发现,两种氧化作用中生物氧化占主导地位。其中化学氧化随着pH值升高氧化率表现逐渐上升趋势。由于pH值为生物氧化中菌株氧化的主要影响因素,随着pH值的逐渐升高,生物氧化率表现为先升高后下降的情况,在菌株最适pH7.23时,生物氧化率最高。因此随着pH值的逐步升高,总氧化率呈现先升高后下降趋势。 另外,后续研究还将进一步考查多株高效铁锰氧化菌的复配并研究复配菌剂对富含铁锰地下水的处理效果,为富含铁锰地下水处理新方法的开发提供技术支持。 图5 菌株P1的生长量及铁锰氧化效果 本实验从富含铁锰的地下水井淤泥中分离获得1株能够氧化铁锰的细菌Bacillus cereus P1,在培养温度28℃,pH7,接种量4%的条件下,于锰含量为200 mg/L、铁含量为800 mg/L的选择性培养液中培养3 d后,铁、锰氧化率分别为82%和73%。 采用响应面分析方法对菌株P1铁、锰氧化条件进行优化,优化结果为:温度28.54℃,pH7.23,接种量4.35%,铁、锰氧化率最高分别可达100%和93.7%,经响应面优化后铁、锰氧化率比优化前分别提高18%和19.3%。 [1]江曙光. 中国水污染现状及防治对策[J]. 现代农业科技, 2010(7):313-315. [2] 郭秀红, 孙继朝, 李政红, 等. 我国地下水质量分布特征浅析[J]. 水文地质工程地质, 2005(3):51-54. [3]李欣, 王郁萍, 赵洪宾. 给水管网中细菌再生长的研究[J].哈尔滨工业大学学报, 2002, 34(3):337-340. [4] Monika P, Koen H. Investigation of assimilable organic carbon(AOC)in flemish drinking water[J]. Water Res, 2005, 39:2259-2266. [5]Soumya S, Gregory WH. Biostability analysis for drinking water distribution systems[J]. Water Res, 2007, 41:2127-2138. [6]Seidler RJ, Morrow JE, Bagley ST, et al. Klebsielleaein drinking water emanating from redwood tanks[J]. Appl Environ Microbiol, 1997, 33:893. [7]余健, 郭照光, 傅国楷. 两级过滤除铁除锰水厂的设计与运行[J]. 中国农村水利水电, 2002(1):4-5. [8]李冬, 杨宏, 张杰. 生物滤层同时去除地下水中铁、锰离子研究[J]. 中国给水排水, 2001, 17(8):1-5. [9]Yang H, Li D, Zhang J. Design of biological filter for iron and manganese removal from water[J]. Journal of Environmental Science and Health-Part A Toxic/Hazardous Substances and Environmental Engineering, 2004, 39(6):1447-1450. [10]Pacini VA, Ingallinella AM, Sanquinetti G. Removal of iron and manganese using biological roughing up flow filtration technology[J]. Water Research, 2005, 39(18):4463-4475. [11]姚远, 周志华, 许旭萍, 等. 铁锰氧化菌的筛选及其生物学特性研究[J]. 福建师范大学学报:自然科学版, 2009, 25(4):100-104. [12]Karen MK, Sherry LH, Douglas CN. Novel, attached, sulfuroxidizing bacteria at shallow hydrothermal vents possess vacuoles not involved in respiratory nitrate accumulation[J]. Appl Environ Microbiol, 2004, 70:7487-7496. [13]马放, 任南琪, 杨基先. 污染控制微生物学实验[M]. 哈尔滨:哈尔滨工业大学出版社, 2002. [14]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:2. [15]Cheng HR, Jiang N. Extremely rapid extraction of DNA from bacteria and yeasts[J]. Biotechnology Letters, 2006, 28:55-59. [16] Li CY, Xu CH, Pan JB, et al. Isolation of a chlorimuron-ethyl degradation bacterium and its bioremediation in contamination soil[M]. Bioinformatics and Biomedical Engineering(iCBBE)International Conference, 2011. [17]Kumar S, Nei M, Dudley J, et al. MEGA:A biologistcentric software for evolutionary analysis of DNA and protein sequences[J]. Briefings in Bioinformatics, 2008, 9(4):299-306. [18]美国公共卫生协会 / 美国自来水厂协会 /水污染控制联合会.水和废水标准检验法[M].第15版. 宋仁元等译. 北京:中国建筑工业出版社, 1985. [19]Ruan ZY, Zhou S, Jiang SH, et al. Isolation and characterization of a novel cinosulfuron degrading Kurthia sp. from a methanogenic microbial consortium[J]. Bioresour Technol, 2013, 147:477-483. [20]Hou N, Feng FZ, Shi Y, et al. Characterization of the extracellular biodemulsifiers secreted by Bacillus cereus LH-6 and the enhancement of demulsifying efficiency by optimizing the cultivation conditions[J]. Environ Sci Pollut R, 2014, 21:10386-10398. [21]李冬, 张杰, 王洪涛, 等. 生物除铁除锰滤池的快速启动研究[J]. 中国给水排水, 2006, 21(12):35-38. [22] Vandenabeele J, De Beer D, Germonpre R, et al. Manganese oxidation by microbial consortia from sand filterd[J]. Microb Ecol, 1992, 24(1):91-108. [23]张璐, 李婷婷, 王芳. 锰氧化细菌的分离鉴定及其锰氧化特性的分析[J]. 微生物学通报, 2011, 38(3):328-332. [24]刘颜军, 周静晓, 王革娇. 锰氧化菌 Bacillus sp. MK3-1 的 Mn(Ⅱ)氧化特性和除锰能力研究[J]. 微生物学通报, 2009, 36(4):473-478. [25]赵焱, 李冬, 李相昆, 等. 高效生物除铁除锰工程菌MSB-4的特性研究[J]. 中国给水排水, 2009, 25(1):40-44. [26]曾茂贵, 李颖. 正交设计与响应面优化法对瓜蒌桂枝解痉颗粒提取工艺的比较[J]. 福建中医药大学学报, 2014, 24(3):32-36. [27] Suhaila YN, Ramanan RN, Rosfarizan M, et al. Optimization of parameters for improvement of phenol degradation by Rhodococcus UKMP-5M using response surface methodology[J]. Ann Microbiol, 2013, 63:513-521. (责任编辑 李楠) The Isolation and Identification of an Efficient Fe/Mn-oxidizing Bacterial Strain P1,and the Optimization of Its Oxidizing Conditions FAN Xing WANG Shu-ting LI Chun-yan By enrichment culture,a Fe/Mn-oxidizing bacterial strain P1 was isolated from the sludge samples of groundwater well that was rich in Fe/Mn. According to morphologic and physiological-biochemical characteristics as well as 16S rDNA sequence analysis,strain P1 was identified as Bacillus cereus. Concurrently,single factor test was used to study the growth of strain P1 and its oxidation characteristics;and the response surface methodology(RSM)was employed to explore the effects of inoculation size,temperature and pH on the oxidation characteristics of strain P1 and further optimize the oxidation conditions. The results showed that the optimal oxidation conditions were temperature 28.54℃,pH 7.23,and inoculation size 4.35 %. At the optimal conditions,the removal ratios of Mn and Fe were 93 % and 100 % respectively in the selective medium containing 200 mg/L Fe and 800 mg/L Mn after strain P1 was cultured for 3 d. Fe/Mn-oxidizing;Bacillus cereus;isolation and identification;oxidation conditions;response surface methodology 10.13560/j.cnki.biotech.bull.1985.2016.04.023 2015-09-29 “十二五”国家科技支撑计划项目(2013BAJ12B01),东北农业大学大学生SIPT计划创新训练项目(201510224257) 樊星,男,研究方向:环境微生物;E-mail:good150030@sina.com 李春艳,女,博士,研究方向:环境微生物;E-mail:chunyanli@neau.edu.cn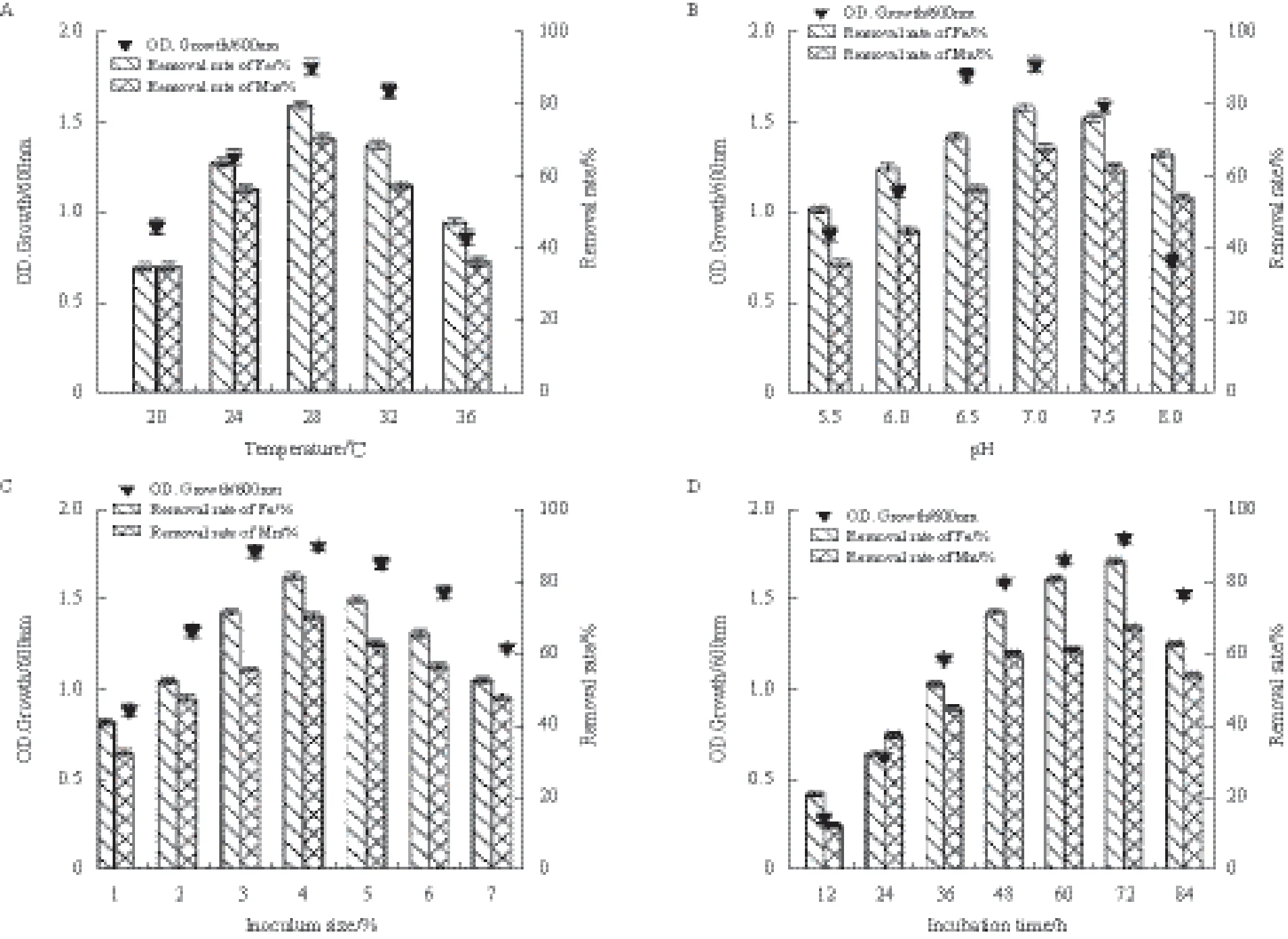
3 讨论
4 结论
(College of Resource and Environment,Northeast Agricultural University,Harbin 150030)

