植物MicroRNA介导的基因调控在作物改良中的应用潜能
刘伟灿 周永刚 王兴超 王法微 王南 董园园 李晓薇 李海燕
(吉林农业大学生命科学学院 生物反应器与药物开发教育部工程研究中心,长春 130118)
植物MicroRNA介导的基因调控在作物改良中的应用潜能
刘伟灿 周永刚 王兴超 王法微 王南 董园园 李晓薇 李海燕
(吉林农业大学生命科学学院 生物反应器与药物开发教育部工程研究中心,长春 130118)
植物MicroRNAs(miRNAs)是长度约22个核苷酸的內源、单链、非编码、小分子RNA,通过降解或抑制靶mRNA介导转录后沉默。随着高通量测序技术及各种研究技术的进步,越来越多的microRNA被测序和验证,为利用基因工程手段进行作物改良提供了丰富的候选基因资源。综述了miRNAs在生物胁迫、非生物胁迫和植物生长发育等方面的最新研究进展,同时分析了miRNAs介导的基因调控在作物改良中的应用潜能,并介绍了几种基于miRNA作用机制的植物基因工程改良作物的转基因新技术,如靶基因RNAi,人工miRNAs(amiRNAs),Target Mimics(TM),超表达miRNA-resistant tagerts;也讨论了基于miRNA作用机制的转基因技术所面临的风险和挑战。
MicroRNAs;靶基因;作物改良;RNAi;amiRNAs;Target mimics;miRNA-resistant tagerts
随着世界人口的增长,土地和水资源缺乏,全球气候变化,使人们担忧未来全球粮食产量能否满足人们日益增长的粮食需求。尤其,我国是世界人口最多的国家之一,满足13亿人口的粮食需求,一直是我国的头等大事。要解决这个问题,除了保持水土和利用传统育种方式提高作物产量和质量外,更需要一种新的快速有效的农业新技术。转基因技术是现代生物技术的核心,运用转基因技术培育高产、优质、多抗、高效的新品种,降低农药、肥料投入,对缓解资源约束,保护生态环境、改善产品品质、拓展农业功能等具有重要作用。目前,世界许多国家都把转基因生物技术作为支撑发展、引领未来的战略选择,转基因技术已成为各国抢占科技制高点和增强农业国际竞争力的战略重点[1]。
MicroRNA(miRNA)是生物体内普遍存在的一种内源、非编码、长度约21-25个核苷酸的小分子单链RNA。在植物中,miRNA通过与靶m RNA分子不完全互补配对来识别靶基因mRNA,降解靶mRNA或抑制靶mRNA的翻译,从而调节靶mRNA的丰度和功能[2]。miRNA的表达不受翻译过程影响,比蛋白基因更迅速,调控效率更高。同一个miRNA可抑制多个靶基因的功能,同一个靶基因又可被多个miRNA所调控。miRNA是1993年最早发现于线虫中[3]。此后,大量的miRNA被测序和验证。目前,miRBase(Release 21)数据库中共收录了223个物种的28 645个前体miRNAs序列和35 828个成熟miRNA序列信息。研究发现,miRNAs在病原体侵入,环境胁迫响应和植物生长发育等方面发挥着重要的调控作用,为利用基因工程手段进行作物改良提供了丰富的候选基因资源[4-8]。基于miRNA的转基因技术可通过增加植物耐受生物和非生物胁迫的能力及增加生物量来发展优质的作物品种,提高边际土地的利用率,减少农药的使用量,促进农业生产力发展[9]。
本文综述了miRNAs在生物胁迫、非生物胁迫和植物生长发育等方面研究的最新进展,同时分析了miRNAs介导的基因调控在作物改良中的应用潜能,并介绍了几种主要的基于miRNA作用机制的植物基因工程应用策略,也讨论了基于miRNA的转基因技术所面临的风险、挑战。旨在为利用植物基因工程技术改良作物提供理论参考。
1 植物MicroRNA研究进展
植物在生长过程中,不可避免地要耐受各种生物胁迫和非生物胁迫的影响。长期的进化也使植物形成了适应各种胁迫的机制。随着对大量胁迫处理材料小RNA数据信息的分析和对特定miRNAs功能鉴定研究数据的积累,植物miRNAs通过转录后的基因调控,在各种胁迫响应中发挥重要作用的潜在分子机制陆续被揭开。此外,miRNAs还参与调控植物开花、结实、分蘖等生长发育过程,进而影响植物形态构建和生物产量。近几年,基于miRNA机制的转基因技术成为新的研究热点,国内外学者都希望从中得到改善作物耐受胁迫能力和提高作物产量的新途径。本部分主要介绍miRNA介导的基因调控在生物胁迫、非生物胁迫和植物生长发育方面的最新研究进展(表1)。
1.1 植物miRNA和生物胁迫
目前,miRNA介导的植物抗生物胁迫相关研究主要集中在通过深度测序和计算机数据分析生物胁迫相关的miRNAs,特定miRNAs相应各种生物胁迫的相关功能的鉴定仍需进一步深入的研究。但迄今获得的数据可清楚地表明,miRNA与植物复杂的抗生物胁迫防御机制相关。
植物病菌(病毒、细菌和真菌)感染和病虫害(害虫和线虫)是影响植物生长发育的两个主要的生物胁迫。(1)植物miRNAs与病毒。在长期的进化过程中,植物形成了一种RNA沉默(RNA silencing)途径来抵抗病毒侵染。相反,植物病毒通过编码RNA沉默抑制子(viral suppressors of RNA silencing,VSR)来抵抗寄主的这种防御反应,达到顺利侵染目的。许多证据表明,植物miRNA与病毒侵染的这种防御过程有关。如miR160、miR166、miR167、miR171和miR396家族在水稻响应条叶枯病毒(RSV)感染时被积累[10]。(2)植物miRNAs与细菌。植物的固有免疫系统依赖于模式识别受体(PRRs)与病原相关模式分子(PAMPs)的相互作用对入侵病原体进行识别,导致PAMP触发的免疫反应PTI,从而参与免疫调节[11]。miRNA也是这种防御机制的一部分。拟南芥miR393 就是最早系统报导的通过调节生长素信号转导途径在植物抗丁香假单胞菌(Pseudomonas syringae)等细菌性病中起作用的miRNA[12,13]。另外,植物进化出NBS-LRR免疫受体,特异识别在感染过程中注入植物细胞内的病原体效应因子,导致触发免疫反应ETI,作为植物免疫的第二道防线[11]。MicroRNAs作为一种缓冲调节剂调控着NBS-LRR类R基因,使植物在正常生长状态下,NBS-LRR类基因的转录水平限制在最低水平。当植物(如棉花、番茄等)受到病毒,细菌或真菌等病菌感染时,某些MicroRNAs(如miR482)的表达下调,而其对应的靶基因NBS-LRR上调,从而调节植物相应疾病[14]。(3)植物miRNAs与真菌。miRNAs和植物与根瘤菌的共生固氮作用密切相关。例如,miR171和 miR397被鉴定与豆科植物生物固氮过程中的共生感染和结节有关[13]。(4)植物miRNAs与抗虫。研究表明,在烟草中超表达人工amiR-24,amiR-24可以靶向作用棉铃虫的几丁质酶基因,使棉铃虫幼虫停止蜕皮而死亡[15]。因此,MicroRNA介导的基因调控技术具有替代Bt毒素技术的潜能。(5)植物与线虫感染作用相关。比较分析大豆受大豆胞囊线虫(SCN)感染后的miRNA表达谱发现,在大豆胞囊线虫抗性品种和易感品种之间,有20个miRNAs特异表达[16]。
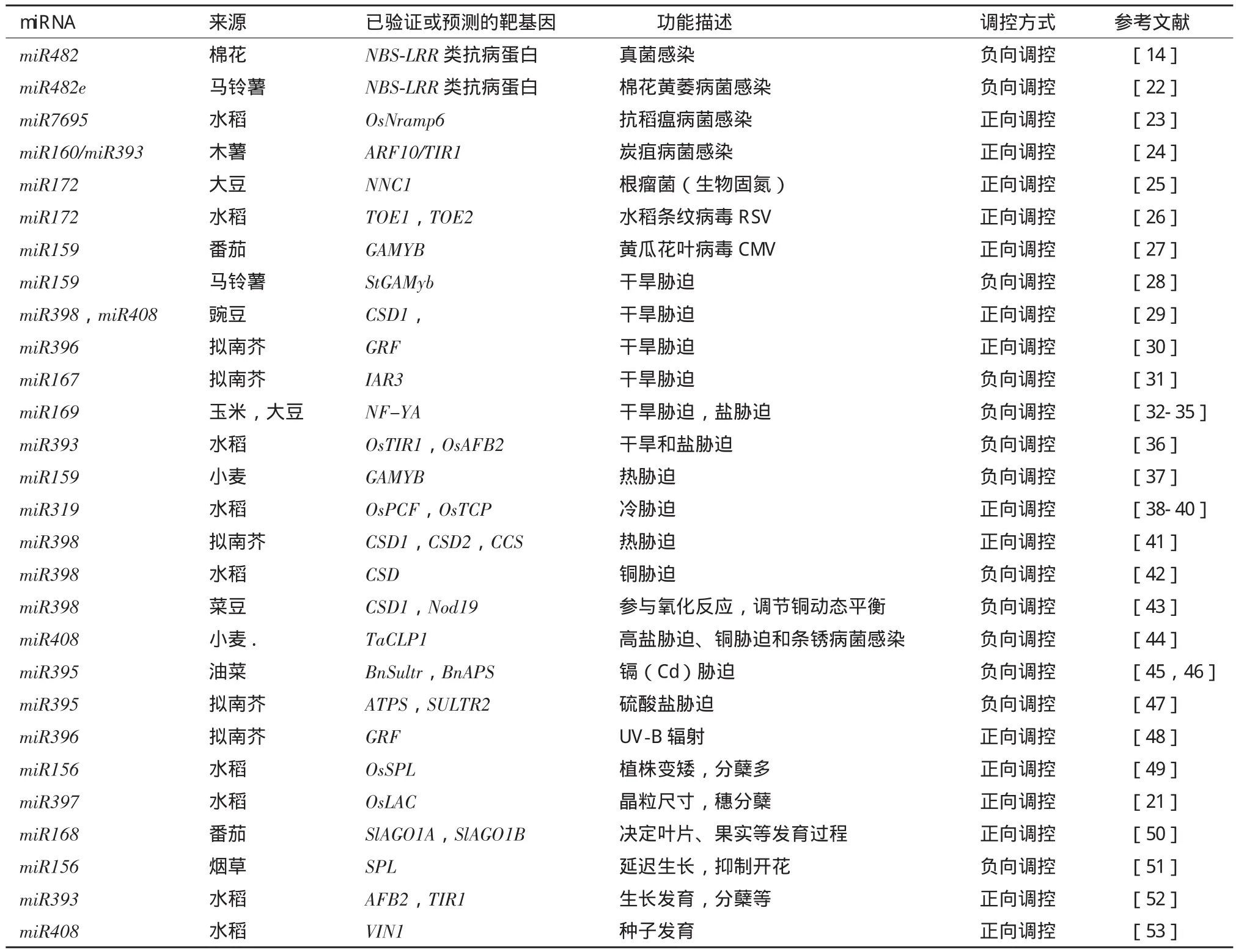
表1 植物MicroRNA在生物胁迫、非生物胁迫和植物生长发育方面的最新研究进展
1.2 植物miRNA与非生物逆境胁迫
在植物生长过程中,常会受到来自环境的多种非生物胁迫影响,非生物胁迫包括干旱、盐碱、高低温、氧化、营养缺失、重金属及UV-B辐射等。植物根据逆境种类及胁迫程度可自身诱导或抑制相应miRNA表达来调控相关基因表达水平,使植物改变生理状态而适应不同程度的逆境胁迫。目前,不同逆境条件下或相同逆境的不同胁迫程度处理下,已测序和鉴定出了大量与逆境相关的miRNA。2011年,Li等[17]对干旱、盐、碱胁迫下的大豆幼苗进行小RNA高通量测序,71、50和45个miRNA分别在3种胁迫下特异表达,表明在不同胁迫下有不同的miRNA被特异诱导表达。2014年,Li等[18]首次以芹菜为材料,利用qPCR对冷和热胁迫下的miR160、miR164、miR168、miR394、miR395 和miR408共6个miRNAs进行分析,结果显示,这6个miRNAs在短时间内与温度胁迫响应有关。2015年,Panda等[19]对营养缺失胁迫条件下的miRNA进行了综述,一些植物在磷缺失的土壤基质中可诱导miR399,硫缺失可诱导miR395,铜缺失可诱导miR398、miR397和miR408。作者推论植物中被营养缺失胁迫诱导的miRNAs可能参与氧化还原和活性氧信号(ROS)途径。此外,Ultraviolet-B(UV-B)辐射也是影响作物生长和发育的主要因素。Northern blotting发现在小麦中6个miRNAs高度响应UV-B,其中,miR159、miR167a和miR171上调,miR156、miR164和miR395下调[20]。
1.3 MicroRNA与植物生长发育
MicroRNA在植物生长发育过程中,可参与调控植物分蘖、开花、结实、果粒尺寸等过程,进而影响植物生物产量与生物量。挖掘与水稻产量相关的miRNA分子,阐明其生物学功能与作用机理,对了解作物产量的遗传调控机制、提高作物产量有重要意义。0smiR397是第一个被发现能够正调控水稻产量性状的miRNA,在水稻中过表达OsmiR397可以显著增大种子的体积及千粒重,还能促进穗分支,使每穗粒数显著增多,以及促使开花提前等。研究OsmiR397增加水稻产量的分子机制发现,OsmiR397是通过切割其靶基因OsLAC实现功能的[21]。miR397在许多物种中都是高度保守的,这一发现不仅可以为水稻增产提供新的分子生物学方法,而且可以应用到其他物种中。
2 相关miRNA的转基因应用策略
随着高通量测序技术和生物信息学技术的发展,越来越多的植物miRNAs与其靶基因被预测和验证,植物miRNAs为利用基因工程手段进行作物改造提供了新的丰富候选基因资源。一些基于miRNA作用机制的转基因技术也进一步发展并被成功应用于植物品种的改造,为开发优良农艺性状的基因工程作物新品系提供新的技术手段。目前,基于miRNA与其靶基因作用机制的植物品种改良转基因技术大致分为两种策略(图1):(1)当候选miRNA正向调节目标农艺性状时,可以采用超表达miRNAs或人工amiRNAs的方式加强miRNA对靶基因的调控作用,也可以采用RNAi直接敲除靶基因的方式,削弱靶基因作用,从而促进期望的优良农艺性状;(2)当候选miRNAs负向调节目标农艺性状时,可以采用人工Target Mimics方式吸附miRNA,降低miRNA对其内源靶基因的沉默作用,也可超表达靶基因或miRNA-resistant靶基因来直接增强靶基因的有效活性,最终促进目标性状。此外,以上转基因技术可灵活配用组成型,胁迫诱导型或组织特异型启动子,从而使以上基因表达在特定时期和特定的组织中实现时空调控,也可通过更换强或弱启动子调控基因表达程度,使以上转基因技术更将合理的运用于改良经济作物的遗传性状。本部分针对基于miRNA与其靶基因作用机制的几种重要的转基因技术具体介绍如下。
2.1 靶基因RNAi
RNA干扰技术(RNAi)是由互补的内源或外源双链RNA(dsRNA)切割而成的反义siRNA形成的沉默复合体(RISC),降解同源互补mRNA的现象,RNA干扰技术可以敲除或沉默某特定基因的表达。当候选miRNA通过作用的靶基因正向调控目标性状时,通常采用miRNA的超表达策略增强转基因植物的性能。然而,由于miRNA的基因多效性(即同一miRNA可靶向负调控多种mRNA)会导致非目的靶基因被同时调控,而造成负面影响。因此,此时可采用RNAi干扰技术操纵特定miRNA靶基因的沉默来避免miRNA超表达导致的边缘效应影响。例如,在水稻中下调两个miR319靶标基因OsPCF5和OsPCF8中任意一个表达的RNAi植株,都导致低温驯化后冷抗性的增强[33]。
2.2 amiRNAs
amiRNAs(artificial microRNAs) 是 模 拟 内源miRNA的生成途径人工设计合成的miRNA。amiRNA技术的原理就是将内源pre-miRNA序列中的miRNA:miRNA*置换为人工设计好的amiRNA:amiRNA*转化到植物中,形成的pre-amiRNA在植物体内按照内源miRNA的生物合成途径可产生成熟的amiRNAs,从而介导靶基因的沉默表达。amiRNA技术可针对同一基因的不同靶位点设计多个amiRNA干扰载体,以此增强基因的沉默效率;也可针对多个基因构建多个amiRNA串联的表达载体,实现多基因的同时沉默。WMD3(http://wmd3.weigelworld. org/)设计平台即可实现植物amiRNA序列,载体及扩增引物的自动化设计。近期研究发现,转基因衍生或病毒诱导的siRNA能通过植物大分子运输系统扩散到其他组织,因此可能会对正常植物组织和器官造成损伤,而amiRNAs却很少有非期望的沉默信号的传播发生,具有较高的生物安全性[54-56]。此外,siRNAs不仅靶向候选的RNA,也影响那些不能精确互补的RNA(脱靶效应),而amiRNAs设计可选择与靶mRNA序列作用特异性高的序列,提高作用的精准性[57]。因而,amiRNA可能成为作物改良的最有效工具之一,具有广阔的应用前景。目前,amiRNA技术已被成功应用于水稻[58],马铃薯[59]、棉花[60]及烟草[61]等多种作物的抗病毒品种培育研究中。在实际生产中,作物常常遭遇多种病毒联合侵染,传统的RNAi干扰技术只能使作物抵抗部分病毒株系,无法培育获得具有持久广谱病毒抗性的作物。amiRNA与靶mRNA之间允许存在一定数量的错配碱基,针对病毒基因组保守区设计amiRNA,能使转基因作物有效抵抗大多数病毒株系,并且即使病毒基因发生了突变也依然保持对该病毒的抗性。
2.3 MiRNA Target Mimics(TM)
在miRNAs负调控目标农艺性状时,抑制miRNAs的表达或上调它们的靶基因是改良作物的有效策略,采用的手段分别是超表达MiRNA Target Mimics(TM)和超表达抗miRNA作用的同义突变靶基因。MiRNA Target Mimics是一种调节內源特定miRNA丰度的miRNA缺失技术。具体方法是通过超表达mimicry RNA,使其吸附大量与其互补配对的成熟miRNA,降低miRNA与其相应靶mRNA的结合机会,从而阻止miRNA对其内源靶基因的沉默作用。针对不同miRNA家族成员形成的成熟miRNA,设计相应的Target Mimics,可以对miRNA特定家族成员进行抑制沉默,也可用来沉默整个miRNA家族成员[62]。Target Mimics的作用最早是在研究Pi平衡时被发现的。植物在缺磷胁迫下,miR399被诱导降解靶基因PHO2,PHO2编码的E2泛素相关结合蛋白能够影响植物中磷的含量及磷的再利用过程[63]。还发现IPS1家族基因在缺磷条件下被诱导产生,其可通过保守区的互补序列与miR399互补结合,占据miR399,却不被降解,从而减少了miR399与靶基因PHO2的结合,影响miR399调节PHO2基因的能力[64]。在拟南芥中,miR165/miR166调控的REVALUTA(REV)基因是顶端分生组织的一个关键调节因子,该基因的突变将影响植株的侧枝数量,是分支性状的一个正调控因子。MIM165/MIM166可吸附miR165/miR166而不被降解,增加靶基因REVALUTA(REV)的作用[65]。如果这种作用被应用到单子叶植物的分蘖,可提高作物产量而获得农业收益。
Target Mimics植株对研究miRNA功能提供了一个很好的研究材料和手段。Target Mimics作为调节內源miRNAs水平的一项新技术可应用于改良农业性状和提高作物产量。然而,需要明确的是Target Mimics对某一miRNA的限制作用,会导致miRNA对应所有靶基因的水平提高,而不是特定的某一目的靶基因[54]。并且內源Target Mimics是否仅限于非编码区尚不明确。所以,应用这项技术面临挑战。例如,拟南芥miR319 和 miR159 序列相近但属于不同的miRNA家族,它们的靶基因分别是TCP 和MYB基因。在MIM319 和 MIM159植株中,miR159和miR319 表达水平均减少,相应MYB 和TCP 表达水平均提高,说明两种Target Mimics产生了意外的交叉脱靶效应,对序列相近的miR159和miR319同时产生了抑制作用[66]。
另外,已经证实通过miRNA基因缺失来研究microRNA基因的功能是很难的,因为大多数miRNA家族具有遗传冗繁性[67]。利用miRNA诱捕技术,如target MIMICs(MIMs)、short tandem target MIMICs(STTMs)和molecular SPONGEs(SPs),可通过影响内源性miRNA的活性而产生miRNA功能缺失表型[67]。如cmSP165/166 与 STTM165/166和MIM165/166相比表现出较强的效应。MIM159比cmSP159与 STTM159效应强。总之,没有哪一种方法能保证最强的miRNA抑制,而不同的miRNA家族对各种方式有不同的反应。建议多种方式相结合,可以获得期望的功能缺失结果[67]。
2.4 超表达miRNA-resistant tagerts
miRNA-resistant tagerts即抗miRNA作用的同义突变靶基因,指的是通过改变靶基因与miRNA互补区的核苷酸序列(不改变氨基酸序列),而打断miRNA与靶基因之间的序列配对连续性关系,从而得到新的不受內源miRNA调节的靶基因。在植物中超表达miRNA-resistant tagerts与直接超表达植物miRNA的內源靶基因相比,它们翻译产生的蛋白质编码序列不变从而保证了靶基因功能的性质不变,但由于miRNA-resistant tagerts基因可以避免内源miRNA的调控影响,因此,miRNA-resistant tagerts可以在转基因植物中积累更高的表达水平,功能更显著。在实际研究中发现,在植物中超表达miRNA-resistant tagerts与超表达MiRNA target mimicry所展现的表型相似,但和超表达miRNA/amiRNAs与靶基因RNAi展现的表型相反。例如,在拟南芥中超表达miR394和其靶基因LCR突变体均表现出盐敏感性和抗寒性增强,但超表达抗miR394作用的同义突变靶基因mLCR,转基因植株则表现出耐盐性增强和抗寒性降低[68,69]。在水稻中,鲁玉柱等成功克隆出了水稻的OsCSD2基因,并根据密码子的兼并性,突变了miR398作用的位点,但不改变其氨基酸序列,得到了新的抗miR398的OsmCSD2,构建过表达载体并转入水稻中。结果表明,在重金属铜胁迫下,过表达抗miR398的OsmCSD2转基因株系表现出良好的抗逆性,H2O2含量显著低于野生型(图2)[42]。
3 基于miRNA的转基因技术所面临的风险和挑战
转基因技术自诞生时起,争论就从未停息过。基于miRNA原理的转基因技术是进行作物改良的有效技术手段之一。其安全性问题同常规的转基因技术一样是社会各界争论的焦点,至今悬而未决。2012年,Zhang等[70]研究发现,水稻MIR168a基因是中国人血清中含量较高的一种植物小RNA,它可以负调控人和小鼠的低密度脂蛋白受体衔接蛋白的mRNA,从而减缓低密度脂蛋白从血浆中的清除。这项研究证明了外源的植物miRNA可以通过日常摄取食物的方式进入动物的血液和组织器官,并且可通过调控人体内靶基因表达的方式影响人体的生理功能。这项研究结论引发了多方关注。一方面,如果真的存在一种高效的小分子RNA进入动物体内而实现体内基因表达沉默的方式,将对小分子RNA传输的治疗手段有重要的意义;另一方面,又让人担心植物miRNA进入人体内后是否会调控非目标基因而对人体生理产生不良影响。
4 展望
在转基因技术的激烈争论中,美国抢占先机,成了转基因产业的全球霸主,其他国家也一直保持着转基因技术的快速发展态势。我国是世界第一人口大国,解决吃饭问题始终是国家的头等大事。目前,推进转基因技术研究与应用是确保国家粮食安全和促进农业生产力的必然要求和重要途径,我国也明确了“积极研究、慎重推广、自主创新”的国家态度。
在近十几年来,miRNA的研究越来越备受国内外学者的关注。目前,在植物中,大量的miRNA已被测序和鉴定。随着miRNA研究手段的不断进步,一些miRNA在植物体中的生物学功能及分子作用机制也逐渐被阐明。miRNA具有调控植物适应各种胁迫及生长发育的能力。miRNA已成为分子生物学领域的研究热点。MiRNA及其靶基因为利用转基因技术手段进行作物改良提供了新的丰富候选基因资源。国内外学者都希望从中找到作物品种改良的新途径。
另外,一些人可能会担忧在转基因植物中改变miRNAs表达可能导致目标物种中某些基因的非目的调控,使miRNA转基因作物的商业化和发展也面临风险和挑战[71]。建议要大力加强miRNA介导的基因调控机制研究,加强序列同源性检测,促进转基因技术的正确设计,降低脱靶效应,并开发组织特异性或诱导型表达策略,更全面的进行实验室和田间试验。基于miRNA的转基因技术匹配国家风险评估和管理办法,促进植物MicroRNA介导的基因调控转基因技术在作物改良中的应用得到充分的发展。
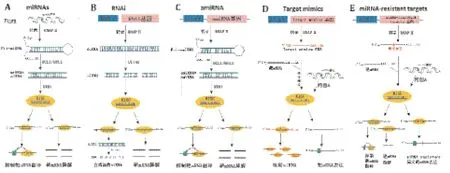
图2 基于miRNA与其靶基因作用机制的转基因技术
[1]农业部农业转基因生物安全管理办公室. 农业转基因技术与生物安全问答[J]. 科学咨询(决策管理), 2010, 4:68-69.
[2]吕帝瑾, 赵佳媛, 陈婧, 等. 植物microRNA的研究进展[J].植物生理学报, 2013, 9:847-854.
[3]Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5):843-854.
[4]Zhang B. MicroRNA:a new target for improving plant tolerance to abiotic stress[J]. J Exp Bot, 66(7):1749-1761.
[5]Ferdous JHS, Shi BJ. Role of microRNAs in plant drought tolerance[J]. Plant Biotechnol J, 2015, 13(3):293-305.
[6]Kumar R. Role of microRNAs in biotic and abiotic stress responses in crop plants[J]. Appl Biochem Biotechnol, 174(1):93-115.
[7]Khraiwesh B ZJ, Zhu J. Role of miRNAs and siRNAs in biotic and abiotic stress responses of plants[J]. Biochim Biophys Acta, 2012, 1819(2):137-148.
[8] 王维, 张玉娟, 陈洁, 等. 植物逆境胁迫相关miRNA研究进展[J]. 生物技术通报, 2015(1):1-10.
[9] Zhou M, Luo H. MicroRNA-mediated gene regulation:potential applications for plant genetic engineering[J]. Plant Mol Biol, 2013, 83(1-2):59-75.
[10]Du P, Wu J, Zhang J, et al. Viral infection induces expression of novel phased microRNAs from conserved cellular microRNA precursors[J]. PLoS Pathog, 2011, 7(8):e1002176.
[11]陈英, 谭碧玥, 黄敏仁. 植物天然免疫系统研究进展[J]. 南京林业大学学报:自然科学版, 2012, 1:129-136.
[12]Navarro L, Dunoyer P, Jay F, et al. A plant miRNA contributes to antibacterial resistance by repressing auxin signaling[J]. Science, 2006, 312(5772):436-439.
[13]Navarro L, Jay F, Nomura K, et al. Suppression of the microRNA pathway by bacterial effector proteins[J]. Science, 2008, 321(5891):964-967.
[14]Zhu QH, Fan L, Liu Y, et al. miR482 regulation of NBS-LRR defense genes during fungal pathogen infection in cotton[J]. PLoS One, 2013, 8(12):e84390.
[15]Agrawal A, Rajamani V, Reddy VS, et al. Transgenic plants over-expressing insec t-specific microRNA acquire insecticidal activity against Helicoverpa armigera:an alternative to Bt-toxin techno logy[J]. Transgenic Res, 2015, 24(5):791-801.
[16]Li X, Wang X, Zhang S, et al. Identification of soybean microRNA s involved in soybean cyst nematode infection by deep sequencing[J]. PLoS One, 2012, 7(6):e39650.
[17]Li H, Dong Y, Yin H, et al. Characterization of the stress asso ciated microRNAs in Glycine max by deep sequencing[J]. BMC Plant Biol, 2011, 11:170.
[18]Li MY, Wang F, Xu ZS, et al. High throughput sequencing of two celery varieties small RNAs identifies microRNAs involved in temperature stress response[J]. BMC Genomics, 2014, 15:242.
[19] Panda SK, Sunkar R. Nutrient- and other stress-responsive microRNAs in plants:Role for thiol-based redox signaling[J]. Plant Signal Behav, 2015, 10(4):e1010916.
[20]Wang B, Sun YF, Song N, et al. Identification of UV-B-induced microRN As in wheat[J]. Genet Mol Res, 2013, 12(4):4213-4221.
[21]Zhang YC, Yu Y, Wang CY, et al. Overex pression of microRNA OsmiR397 improves rice yield by increasing grain size and promoting panicle branching[J]. Nat Biotechnol, 2013, 31(9):848-852.
[22]Yang L, Mu X, Liu C, et al. Overexpression of potato miR482e enhanced plant sensitivity to Verticillium dahliae infection[J]. J Integr Plant Biol, 2015, 57(12):1078-1088.
[2 3]Campo S, Peris-Peris C, Sire C, et al. Identification of a novel microRNA(miRNA)from rice that targets an alternatively spliced transcript of the Nramp6(Natural resistance-associated macrophage protein 6)gene involved in pathogen resistance[J]. New Phytol, 2013, 199(1):212-227.
[24]Pinweha N, Asvarak T, Viboonjun U, et al. Involvement of miR160/ miR393 and their targets in cassava responses to anthracnose di sease[J]. J Plant Physiol, 2015, 174:26-35.
[25]Wang Y, Wang L, Zou Y, et al. Soybean miR172c targets the repressive AP2 transcription factor NNC1 to act ivate ENOD40 expression and regulate nodule initiation[J]. Plant Cell, 2014, 26(12):4782-4801.
[26] 郭西贵. 水稻miR172基因遗传转化及其功能分析[D]. 金华:浙江师范大学, 2012.
[27]徐艳. 人工miR159介导的番茄抗黄瓜花叶病毒遗传转化研究[D]. 杭州:浙江理工大学, 2011.
[28]Yang J, Zhang N, Mi X, et al. Identificat ion of miR159s and their target genes and expression analysis under drought stress in potato[J]. Comput Biol Chem, 2014, 53:204-213.
[29]Jovanovic Z, Stanisavljevic N, Mikic A, et al. Water deficit downregulates miR398 and miR408 in pea(Pisum sativum L. )[J]. Plant Physiol Biochem, 2014, 83:26-31.
[30]杨凤玺. MiR396在烟草 中的功能分析[D]. 昆明:中国科学院研究生院(西双版纳热带植物园), 2009.
[31]Kinoshita N, Wang H, Kasahara H, et al. IAA-Ala Resistant3, an evolutionarily conserved target of miR167, mediates Arabidopsis root architecture changes during high osmotic stress[J]. Plant Cell, 2012, 24(9):3590-3602.
[32]Ni ZY, Hu Z, Jiang QY, et al. GmNFYA3, a target gene of miR169, is a positive regulator of plant tolerance to drought stress[J]. Plant Mol Biol, 2013, 82(1-2):113-129.
[33]Luan MD, Xu MY, Lu YM, et al. Expression of zm a-miR169 miRNAs and their target ZmNF-YA genes in response to abiotic stress in maize leaves[J]. Gene, 2015, 555(2):178-185.
[34]尹海龙. 大豆miR169d的表达分析及功能验证[D]. 长春:吉林农业大学, 2013.
[35]倪志勇. 大豆抗逆相 关miR169c及其靶位点GmNFYA3和miR394a的功能研究[D]. 北京:中国农业科学院, 2013.
[36]Xia K, Wang R, Ou X, et al. OsTIR1 and OsAFB2 downregulation via OsmiR393 overexpression leads to more tillers, ear ly flowering and less tolerance to salt and drought in rice[J]. PLoS One, 2012, 7(1):e30039.
[37]Wang Y, Sun F, Cao H, et al. TamiR159 directed wheat TaGAMYB cleavage and its involvement in anther development and heat response[J]. PLoS One, 2012, 7(11):e48445.
[38]Wang ST, Sun XL, Hosh ino Y, et al. MicroRNA319 positively regulates cold tolerance by targeting OsPCF6 and OsTCP21 in rice(Oryza sativa L. )[J]. PLoS One, 2014, 9(3):e91357.
[39]Yang C, Li D, Mao D, et al. Overexpression of microRNA319 impacts leaf morphogenesis and leads to enhanced cold tolerance in rice(Oryza sativa L. )[J]. Plant Cell Environ, 2013, 36(12):2207-2218.
[40]贾蓓. 水稻miR319的耐冷功能分析 与分子机制研究[D].齐齐哈尔:东北农业大学, 2012.
[41]Lu X, Guan Q, Zhu J. Downregulation of CSD2 by a heat-inducible miR398 is required for thermotolerance in Arabidopsis[J]. Plant Signal Behav, 2013, 8(8). pii:e24952.
[42]鲁玉柱, 封振, 边黎颖, 等. 过表达抗miR398的OsmCSD2基因提高水稻的重金属抗性[J]. 植物生理学报, 2011, 11:1064-1068.
[43]Naya L, Paul S, Valdes-Lopez O, et al. Regulation of copper hom eostasis and biotic interactions by microRNA 398b in common bean[J]. PLoS One, 2014, 9(1):e84416.
[44]Feng H, Zhang Q, Wang Q, et al. Target of tae-miR408, a chemocyan in-like protein gene(TaCLP1), plays positive roles in wheat response to high-salinity, heavy cup ric stress and stripe rust[J]. Plant Mol Biol, 2013, 83(4-5):433-443.
[45]Zhang LW, Song JB, Shu XX, et al. miR395 is involved in detoxification of cadmium in Brassica napus[J]. J Hazard Mater, 2013, 250-251:204-211.
[46] 张 柳伟. miR395调节油菜(Brassica napus)耐镉功能的研究[D]. 南京:南京农业大学, 2012.
[47]Kawashima CG, Matthewman CA, Huang S, et al. Interplay of SLIM1 and miR395 in the regulation of sulfate assimil ation in Arabidopsis[J]. Plant J, 2011, 66(5):863-876.
[48]Casadevall R, Rodriguez RE, Debernardi JM, et al. Repression of growth regulating factors by the microRNA396 inhibits cell proliferation by UV-B radiation in Arabidopsis leaves[J]. Plant Cell, 20 13, 25(9):3570-3583.
[49]Liu Q, Shen G, Peng K, et al. A T-DNA insertion mutant Osmtd1 was altered in architecture b y upregulating MicroRNA156f in rice[J]. J Integr Plant Biol, 2015, 57(10):819-829.
[50]Xian Z, Huang W, Yang Y, et al. miR168 influences phase transition, leaf epinasty, and fruit development via SlAGO1s in tomato[J]. J Exp Bot, 2014, 65(22):6655-6666.
[51]Zhang T, Wang J, Zhou C. The role of miR156 in developmental transitions in Nicotiana tabacum[J]. Sci China Life Sci, 2015, 58(3):253-260.
[52]解亚坤. 水稻miR393基因家族的表达模式及其对植株生长发育的影响[D]. 杭州:浙江大学, 2011.
[53]马圣运. Os-miR408的表达模式及其在水稻种子发育中的功能[D]. 杭州:浙江大学, 2012.
[54]Liu Q, Chen YQ. A new mechanism in plant engineering:the pot ential roles of microRNAs in molecular breeding for crop improvement[J]. Biotechnol Adv, 2010, 28(3):301-307.
[55]Duan CG, Wang CH, Fang RX, et al. Artificial MicroRNAs highly accessible to targets con fer efficient virus resistance in plants[J]. J Virol, 2008, 82(22):11084-11095.
[56]Khraiw esh B, Ossowski S, Weigel D, et al. Specific gene silencing by artificial MicroRNAs in Physcomitrella patens:an alternative to targeted gene knockouts[J]. Plant Physiol, 2 008, 148(2):684-693.
[57]Tiwari M, Sharma D, Trivedi PK. Artificial microRNA mediated gene silencing in plants:progress and p erspectives[J]. Plant Mol Biol, 2014, 86(1-2):1-18.
[58]Carbonell A, Fahlgren N, Mitchell S, et al. Highly specific gene silencing in a monocot species by artificial microRNAs derived from chimeric miRNA precursors[J]. Plant J, 2015, 82(6):1061-1075.
[59]Chi M, Bhagwat B, Lane WD, et al. Reduced polyphenol oxidase gene expression and enzymatic browning in potato(Solanum tuberosum L. )with artificia l microRNAs[J]. BMC Plant Biol, 2014, 14:62.
[60]Ali I, Amin I, Briddon RW, et al. Artificial microRNA-mediated resistance against the monopartite begomovirus Cotton leaf curl Burewala virus[J]. Virol J, 2013, 10:231.
[61]Song YZ, Han QJ, Jiang F, et al. Effects of the sequence characteristics of miRNAs on multi-viral resistance mediated by single amiRNAs in transgenic tobacco[J]. Plant Physiol Biochem, 2014, 7 7:90-98.
[62]Todesco M, Rubio-Somoza I, Paz-Ares J, et al. A collection of target mimics for comprehensive analysis of microRNA function in Arabidopsis thaliana[J]. PLoS Genet, 2010, 6(7):e1001031.
[63]Fujii H, Chiou TJ, Lin SI, et al. A miRNA involved in phosphatestarvation response in Arabidopsis[J]. Curr Biol, 2005, 15(22):2038-2043.
[64]Franco-Zorrilla JM, Valli A, Todesco M, et al. Target mimicry provides a new mechanism for regulation of microRNA activity[J]. Nat Genet, 2007, 39(8):1033-1037.
[65]Wang Y, Li J. Genes controlling plant archite cture[J]. Curr Opin Biotechnol, 2006, 17(2):123-129.
[66]Reichel M, Millar AA. Specificity of plant microRNA target MIMICs:Cross-targeting of miR159 and miR319[J]. J Plant Physiol, 2015, 180:45-48.
[67]Reichel M, Li Y, Li J, et al. Inhi biting plant microRNA activity:molecular SPONGEs, target MIMICs and STTMs all display varia ble efficacies against target microRNAs[J]. Plant Biotechnol J, 2015, 13(7):915-926.
[68]Song JB, Gao S, Sun D, et al. miR394 and LCR are involved in Arabidopsis salt and drought stress responses in an abscisic aciddependent manner[J]. BMC Plant Biol, 2013, 13:210.
[69]Song JB, Shu XX, Shen Q, et al. Altered fruit and seed development of transge nic rapeseed(Brassica napus)over-expressing microRNA394[J]. PLoS One, 2015, 10(5):e0125427.
[70]Zhang L, Hou D, Chen X, et al. Exogenous plant MIR168a specifically targets mammalian LDLRAP1:evidence of crosskingdom regulation by microRNA[J]. Cell Res, 2012, 22(1):107-126.
[71]Ramesh SV. Non-coding RNAs in crop genetic modification:considerations and predictable environmental risk assessments(ERA)[J]. Mol Biotechnol, 2013, 55(1):87-100.
(责任编辑 狄艳红)
The Potential Application of microRNA-mediated Gene Regulation in Crop Improvement
LIU Wei-can ZHOU Yong-gang WANG Xing-chao WANG Fa-wei WANG Nan DONG Yuan-yuan LI Xiao-wei LI Hai-yan
(College of Life Sciences,Engineering Research Center of Chinese Ministry of Education for Bioreactor and Pharmaceutical Development,Jilin Agricultural University,Changchun 130118)
Plant microRNAs(miRNAs)are small RNAs of approximate 22 nt,endogenous,single-strand,and non-coding. They play regulatory roles at post-transcription level by inhibiting translation or promoting the degradation of target mRNAs. With the advances in highthroughput sequencing technology and a variety of research techniques,more and more microRNAs have been predicted and validated,which provide a rich candidate gene resources for crop improvement through genetic engineering. This review highlights the recent advances in studies of biotic stress,abiotic stress,as well as plant growth and development,and then analyzes the potential of miRNA-mediated gene regulation for crop improvement. In addition,several transgenic technologies for genetically modified crops in plant genetic engineering with miRNA-based gene regulation are introduced,including RNAi of target gene,artificial miRNAs(amiRNAs),target mimics(TM)and over-expressing miRNA-resistant targets. Also the potential risks and challenges of miRNA-based genetic modification technology are discussed.
microRNAs;target gene;crop improvement;RNAi;amiRNAs;target mimics;miRNA-resistant targets
10.13560/j.cnki.biotech.bull.1985.2016.04.001
2015-8-24
农业部国家转基因生物新品种培育重大专项(2014ZX08010-002),国家自然科学基金项目,(31271746,31201144,31101091),吉林省科技厅重点科技攻关项目(20150204027NY)
刘伟灿,女,博士研究生,研究方向:植物抗逆分子生物学与基因工程,E-mail:liuweican602@163.com;周永刚同为本文第一作者
李海燕,女,博士,教授,研究方向:植物抗逆分子生物学与基因工程;E-mail:hyli99@163.com

