宫颈微偏腺癌12例临床病理分析
于晶功 姜丹 王亚萍
宫颈微偏腺癌12例临床病理分析
于晶功 姜丹 王亚萍
目的 回顾性研究宫颈微偏腺癌(MDA)的临床病理学及免疫组化特征。方法 对收治的12例MDA患者临床表现、宫颈细胞学、组织学、免疫组织化学等材料进行回顾性分析。结果 MDA临床特征性表现为阴道大量排液及不规则流血,妇科检查常见宫颈肥大及糜烂。病理学特征为宫颈管壁深层可见大小及形状不规整的腺体,腺腔被覆上皮细胞类似正常的宫颈腺上皮细胞。免疫组织化学:P53+、CEA+、Ki-67+>50%、ER-、PR-。结论MDA缺乏特异性临床表现,组织分化程度高,病理易漏诊,临床发现晚,预后差。回顾本院10年来发现的12例宫颈微偏腺癌行临床病理分析,以期提高病理诊断的及时性及正确性。
宫颈微偏腺癌;病理学;细胞学;诊断;免疫组织化学
宫颈微偏腺癌(MDA)又称恶性腺瘤,是宫颈高分化腺癌,温和的组织学特征使其与良性病变难以区分。早期诊断困难,淋巴结转移常有发生,预后不好。早期准确诊断以及时治疗MDA至关重要。收集12例MDA患者,对其临床、病理组织学形态,细胞学,免疫组织化学进行回顾性研究,结合相关文献进行报道,以期提高病理诊断的准确性,辅助临床早期诊断,提高5年生存率。
1 资料与方法
1.1 一般资料 收集2005年1月~2015年7月经大连市妇幼保健院病理科2名主治以上病理医师确诊为MDA的12例手术标本,患者年龄48~61岁,中位年龄54岁,均已婚已孕。10年内本院共诊断宫颈腺癌1153例,其中微偏腺癌12例,占宫颈腺癌1%。7例患者主诉阴道排液、不规则出血来诊,其余患者无自觉症状,常规妇科检查或子宫肌瘤行全子宫切除时偶然发现。12例妇科检查均未见特异性临床症状,仅4例出现宫颈肥大,僵硬,5例宫颈重糜,其余无特殊。12例病例超声检查,大部分提示宫颈管肥大,血流局部丰富,局部呈宫颈囊性改变。
1.2 方法 所有标本经10%中性福尔马林固定,常规取材,脱水,石蜡包埋,常规切片、HE染色、免疫组化。组化采用EnVison 两步法,光镜观察。 所用抗体购自迈新公司。
2 结果
2.1 大体12例手术标本 均见宫颈肥大,中糜,宫颈质地偏硬,局部见纳囊,粘液样物,10例标本未见明显肿物,1例标本见溃疡性肿物,1例标本局部宫颈呈结节样改变。
2.2 细胞学特点 12例患者9例行宫颈HPV检测,仅有2例HPV阳性,其中1例HPV58+、另1例HPV52+。10例患者行TCT检测,6例回报未见鳞状上皮内病变,2例回报未见明确意义的不典型鳞状上皮,仅有2例TCT回报不典型腺细胞,AGC待除外。细胞特点见图1。可见异常的腺细胞片状排列,局部胞浆可见粘液样物。细胞核大,卵圆形,拥挤重叠,胞浆粗颗粒状,可见明显核仁。
2.3 显微镜下病变特点 宫颈管壁见大小、形状不一的腺体成分。腺体的深度常超出宫颈正常腺体所在范围。可以出现血管、神经周围侵犯。腺腔被覆的上皮细胞为高分化宫颈腺上皮细胞,细胞柱状,富含粘液,细胞核位于基底,核仁不明显,核分裂象罕见。见图2。

图1 微偏腺癌细胞学特点(×100)

图2 微偏腺癌组织学(HE,×100)
2.4 免疫组化结果 12例患者均行免疫组化检测作为辅助诊断,结果如下,CEA均呈现肿瘤细胞胞质阳性,P53均呈现肿瘤细胞细胞核阳性,Ki-67+>50%,ER-、PR-,正常宫颈腺体仅在腔缘有CEA若阳性表达,P53阴性,Ki-67+<5%,ER+、PR+。见图3~8。

图3 微偏腺癌免疫组织化学CEA表达(×400)

图4 正常宫颈腺体免疫组织化学CEA表达(×400)
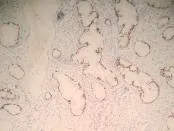
图5 微偏腺癌免疫组织化学P53表达(×400)

图6 微偏腺癌免疫组化Ki-67表达(×400)

图7 微偏腺癌及正常宫颈腺体组化ER表达(×400)

图8 微偏腺癌及正常宫颈腺体组化PR表达(×400)
3 讨论
3.1 临床特点 宫颈微偏腺癌是宫颈罕见的高侵袭性恶性肿瘤,仅占宫颈腺癌1%~3%[1-2],1975年由Silverberg和Hurt[3]首次提出,2003年WHO进一步描述其为颈管型粘液腺体,具有明显侵袭性的腺癌,并且将其归类为宫颈粘液腺癌的特殊亚型[4]。MDA主要临床表现为大量的阴道流液及不规则流血,多数患者可无自觉症状,妇产科查体仅见宫颈肥大、变硬、糜烂。MDA由于缺乏特异性的临床特点,容易漏诊,导致临床发现晚,预后差。关于宫颈MDA的发病机制目前尚不明确,有文献报道部分微偏腺癌可能与肿瘤抑制基因STK11基因突变有关[5]。
3.2 病理特点 本报道以2005年至2015年宫颈腺癌为研究对象,进行回顾性研究,10年内本院共诊断宫颈腺癌1153例,其中微偏腺癌12例,占宫颈腺癌1%,与文献[1-2]报道一致。患者年龄48~61岁,中位年龄54岁。12例MDA均为手术标本,所有病例均由病理科2名主治医师以上病理医师诊断。大部分病例大体宫颈没有明确肿物,仅有宫颈管壁变厚,质地变硬,肥大及轻至中度糜烂,宫颈局部见纳囊,粘液样物。宫颈细胞学检测以及人乳头瘤病毒HPV筛查和宫颈活检是早期筛查宫颈病变的主要检测手段,但这三种方法对于MDA的诊断没有统一标准。宫颈细胞学检测对于MDA的诊断价值说法不一,Hirai等[6]报道认为细胞学检查对诊断宫颈偏微腺癌是至关重要的。而Odashiro DN[7]等认为细胞学诊断不能反映MDA特点,MDA的细胞学表现与宫颈原位腺癌和宫颈子宫内膜样腺癌重叠,诊断没有特异性,细胞学诊断率偏低的另一个原因是取材位置局限,不易刷取理想标本,MDA没有明确外生肿物,异型的腺体出现位置较深,当细胞学筛查或者活检的时候取材局限,而MDA又为高分化腺癌,所以容易误诊为正常宫颈腺体[8]。在本病理报道中经确诊的MDA共12例,10例患者行TCT检测,6例回报未见鳞状上皮内病变,2例回报未见明确意义的不典型鳞状上皮,仅有2例TCT回报不典型腺细胞,AGC待除外。人乳头瘤病毒HPV与宫颈浸润性癌及癌前病变有明确的关联性,持续的高危型HPV感染经常用来检测宫颈癌及癌前病变。然而在MDA中HPV病毒检测一般难以有异常发现,HPV检测阴性。关于宫颈MDA发病的原因至今尚不明确,但它并不像普通的宫颈癌一样,与HPV感染并无关联[9-10]。本组报道12例患者9例行宫颈HPV检测,仅有2例HPV阳性,其中1例HPV58+、另1例HPV52+无特异性,余HPV检测报告均为阴性,与文献[9-10]报道相符。
3.3 显微镜下特点 MDA侵犯的深度常超出宫颈正常腺体所在范围(>7mm)甚至深达宫颈间质层,几乎弥漫于整个宫颈及部分颈管间质。在深部血管和神经周围,可见肿瘤侵犯。肿瘤组织周围出现间质纤维组织增生,炎症反应,淋巴细胞增生,水肿等。宫颈管壁中可见大小,形态不规则的腺体成分,排列不规整,形态多样,腺体可以呈鸡爪样、尖角状或树枝状突出,一些腺体可以呈囊性,腔内有乳头突入,腺腔被覆柱状细胞,胞质富含粘液,细胞核位于基底,仅有少数核移至腺腔表面,核大,形态不规则,核仁不明显,核分裂象罕见,细胞浆内充满粘液,分泌旺盛,这些腺体类似正常宫颈腺上皮细胞[11]。本组病例报告中共有MDA12例,形态学符合以上总结,与文献[11]报道一致。
3.4 免疫组化特点 MDA是一种比较少见的宫颈恶性肿瘤,由于细胞学诊断没有特异性、组织学分化好,异型性轻微,单靠病理学形态诊断容易漏诊,免疫组织化学辅助诊断可提供必要的参考价值,提高诊断正确性。本组报告12例患者均行免疫组织化学检测作为辅助诊断,结果如下,CEA均呈现肿瘤细胞胞质阳性,P53均呈现肿瘤细胞细胞核阳性,12例MDA腺癌细胞细胞质CEA均呈弥漫阳性,>80%腺癌细胞细胞核表达P53,Ki-67+>50%,ER-/+,PR-/+。作为对照的正常宫颈腺体仅在腔缘有CEA弱阳性表达,P53阴性,Ki-67+<5%,ER+、PR+。阳性表现为细胞核呈棕褐色。可见免疫组织化学可以作为辅助诊断宫颈MDA[12]。
3.5 鉴别诊断
3.5.1 隧道样腺丛 增生的腺体呈小叶状分布,排列紧密,有时病变深在于宫颈管,腺体周围是正常的宫颈间质,无促纤维结缔组织增生,也无浸润性生长,腺上皮细胞无异型性,罕见核分裂象。
3.5.2 小叶状宫颈内膜腺体增生 增生的腺体形成多个小叶状结构,腺体被覆良性粘液上皮,细胞可以伴有轻度的非典型性,病变部位表浅,限于宫颈管壁的内1/2。
3.5.3 中肾管增生 病变位置较深,但不累及宫颈粘膜,缺乏复杂的腺体结构,增生腺体小而规则,细胞质内有嗜酸性物质,缺乏粘液性胞质。
3.5.4 宫颈高分化腺癌 腺体明显异型性,结构复杂,背靠背及共壁,细胞异型性明显,核分裂象增多。
4 治疗与预后
MDA治疗方法及预后文献报道不一致,目前主要沿用了同期宫颈腺癌的治疗手段,采用广泛性子宫、双侧附件切除,加盆腔淋巴结清扫,术后辅以放化疗[13-14]。关于宫颈MDA预后一般认为不佳,主要原因是临床诊断缺乏特异性,病理易漏诊,未能早发现、早诊断、早治疗。MDA是高分化宫颈恶性肿瘤,病例少见,临床症状不典型,诊断缺乏特异性,早期诊断困难,而在病理诊断中由于组织分化好,异型性小,极易漏诊,预后不佳。因此如何提高MDA的诊断水平,达到早期诊断,早期治疗,是值得广大临床医生进一步探讨。
[1] Kusuda T,Kawauchi Shigeto,Liu Xu-Ping,et al.Is lobular endocervical glandular hyperplasia a cancerous precursor of minimal deviation adenocarcinoma? A comparative molecular-genetic and immunohistochemical study[J].Surg Pathol,2008,32(12):1807-1815.
[2] Mittal KR,Liang J,Wei Jian jun,et al.Utility of p16INK4a,CEA,Ki67,P53 and ER/PR in the differential diagnosis of benign,premalignant, and malignant glandular lesions of the uterine cervix and their relationship with Silverberg scoring system for endocervical glandular lesions[J].Int J Gynecol Pathol,2007,26(1):71-75.
[3] Silverberg SG,Hurt W.Minimal deviation adenocarcinoma (adenoma malignum) of the cervix:a reappraisal[J].Am J Obstet Gynecol,1975,121(7):971-975.
[4] Mikami Yoshiki,Tsuda Hitoshi,Kaku Tsunehisa,et al.Reproducible and clinically meaningful differential diagnosis is possible between lobular endocervical glandular hyperplasia and ‘adenoma malignum’ based on common histopathological criteria[J].Pathol Int,2005,55(7):412-418.
[5] Enomoto Takayuki,Kuragaki Chie,Ueno Yuko,et al.Mutations in the STK11 gene characterize minimal deviation adenocarcinoma of the uterine cervix[J].Lab Invest, 2003,83(1):35-45.
[6] Hirai Y,Takeshima N,Hanga A,et al.Clinicocytopatho- logic study of adenoma malignum of the uterine cervix[J].Gynecol Oncol,1998,70(2):219-233.
[7] Odashiro DN,Alexandre N,Nguyen Gia-Khanh.Minimal deviation endometrioid adenocarcinoma of the cervix report of three cases with exfoliative cytology[J].Diagn Cytopathol,2006,34(2):119-123.
[8] Ferenczy A,Wright TC,Kurman RJ.Pathology of the female genital tract[M].New York:Springer Verlag,1994:219-326.
[9] Schumacher Valerie,Hearle Nicholas,Menko FH,et al.Frequency and spectrum of cancers in the Peutz-Jeghers syndrome[J].Clin Cancer Res, 2006,12(10):3209-3215.
[10] Hashi Akihiko,Xu Jia-Ying,Kondo Tetsuo,et al.Absence of human papillomavirus infection in minimal deviation adenocarcinoma and lobular endocervical glandular hyperplasia[J].Int J Gynecol Pathol,2005,24(3):296-302.
[11] 刘小艳,巩丽,李艳红,等.子宫颈微偏腺癌1例报道及文献回顾[J].现代肿瘤医学,2013,21(4):852-854.
[12] McCluggage WG.Immunohistochemistry as a diagnostic aid in cervical pathology[J].Pathology,2007,(39):97-111.
[13] 郑璐,马晓欣,李彤,等.宫颈微偏腺癌临床与病理分析[J].现代肿瘤医学,2014,22(2):390-392.
[14] Li GL,Jiang W,Gui Sq,et al.Minimal deviation adenocarcinoma of the uterine cervix[J].Int J Gynecol Obste,2010,110(2):89-92.
Objective To retrospective study the clinical, pathological and immunohistochemical features of minimal devia-tion adenocarcinoma (MDA) of the uterine cervix. Methods The clinical pathological and immunohistochemical features were retrospectively reviewed by conducting a retrospective study of 12 cases over 10 years. Results The main clinical manifestations were vaginal watery and irregular bleeding. Signs were cervical hypertrophy or thickening. The pathological features are massive anomalous glands invade cervical deep muscularis, glandular epithelial cells many similarities with common cervix gland. Immunohistochemical staining features are P53+、CEA+、Ki-67+>50%、ER-、PR-. Conclusion MDA lack of specificity for pahotlogical features. It possesses deceptively benign histological appearance and is difficult to distinguish with the be-nign lesions, easily missed diagnosis. Retrospectively reviewed by conducting a retrospective study of 12 cases treated in Dalian maternal and Child Health Hospital over 10 years, improved the accuracy and timeliness of diagnosis.
MDA; Pathology; Cytology; Diagnosis; Immunohistochemistry
10.3969/j.issn.1009-4393.2016.23.002
辽宁 116033 大连市妇幼保健院病程科(于晶功 姜丹 王亚萍)

