Th22型免疫反应在动脉粥样硬化疾病中的动态变化
万军,石磊,吉庆伟,施莹,刘伶,陆政德,冯颖,叶晶,林英忠
Th22型免疫反应在动脉粥样硬化疾病中的动态变化
万军,石磊,吉庆伟,施莹,刘伶,陆政德,冯颖,叶晶,林英忠
摘要
目的:探讨Th22型免疫反应与动脉粥样硬化(AS)之间的关系,为治疗AS提供新的理论依据。
方法:8周龄C57BL/6J背景的载脂蛋白E缺陷型(ApoE-/-)小鼠为实验组(n=24),同龄C57BL/6J小鼠为对照组(n=24),两组小鼠均给予高脂饮食,分别于0周、4周、8周、12周处死,并采用油红O染色检测不同时间点主动脉根部斑块的进展,流式细胞术检测Th22细胞在两组小鼠脾脏中比例变化,实时荧光定量反转录聚合酶链式反应(RT-PCR)检测主动脉中白细胞介素-22(IL-22)、白细胞介素-22受体1(IL-22R1)及其转录因子芳香烃受体(AhR)、T盒21转录因子(T-bet)的信使核糖核酸(mRNA)表达量变化,酶联免疫吸附测定法(ELISA)检测血清中的IL-22含量变化。
结果:实验组小鼠主动脉根部粥样斑块面积[主动脉根部斑块面积/主动脉管腔面积(%)]、Th22细胞[CD4+IL-22+/ CD4+(%)]数量、IL-22、IL-22R1、AhR、T-bet的 mRNA在主动脉中的表达量以及IL-22在血清中的含量均高于同时间点对照组小鼠,且各时间点(0周除外)差异有统计学意义(P<0.05)。实验组组内前后两时间点对比,主动脉粥样斑块面积及AhR、T-bet的 mRNA表达量:4周与0周、8周与4周、12周与8周比较差异均有统计学意义;Th22细胞数量:4周与0周、8周与4周比较差异均有统计学意义,12周与8周比较差异无统计学意义;IL-22、IL-22R1的 mRNA表达量及血清中IL-22含量:4周与0周比较差异有统计学意义,8周与4周、12周与8周比较差异无统计学意义。
结论:亢进的Th22型免疫反应具有促进AS进程的作用,其机制有待进一步探讨。
关键词动脉粥样硬化;Th22细胞;白细胞介素-22
作者单位:430000湖北省武汉市,武汉大学人民医院心血管内科(万军、石磊、冯颖、叶晶);广西壮族自治区人民医院心血管内科(吉庆伟、施莹、刘伶、陆政德、林英忠)
(Chinese Circulation Journal,2016,31:454.)
动脉粥样硬化(AS)是一种多因素的动脉血管壁的慢性炎症性疾病,大量研究表明,其与先天性免疫和获得性免疫密切相关[1]。研究发现,在AS 进展的各个时期,斑块处都发现有T 淋巴细胞的浸润[2],且主要为是CD4+ T 淋巴细胞浸润[3,4]。Th22 是一种新型 CD4+ T 细胞,其生物学效应由白细胞介素(IL)-22实现。IL-22属于IL-10 家族,其受体是由IL-22受体1(IL-22R1)和IL-10受体2(IL-10R2)组成。IL-10R2广泛分布于机体组织上,IL-22R1则主要表达于肠道、呼吸道的上皮细胞,皮肤角质细胞以及肝脏细胞等。IL-22功能的实现主要通过作用于IL-22R1来实现。芳香烃受体(AhR)和T盒21转录因子(T-bet)是Th22 的特征性转录因子,在诱导Th22分化及IL-22的生成中起着重要作用。 Th22被认为主要参与皮肤的自稳和病理过程,其在牛皮癣及类风湿关节炎等慢性炎性病变过程中发挥着重要的促炎症作用[5,6]。相关研究表明,冠心病患者外周血Th22比例、AhR表达、IL-22含量显著高于对照组,这提示Th22 可能通过分泌功能因子IL-22 参与AS 进程[7]。本实验拟采用载脂蛋白E缺陷型(ApoE-/-)小鼠建立AS模型,检测疾病进展过程中Th22细胞数量,IL-22含量,IL-22、IL-22R1、AhR、T-bet的 mRNA的动态变化,初步探讨Th22型免疫反应是否参与AS进程。
1 材料与方法
主要试剂:异硫氰酸荧光素(FITC)标记的CD4荧光抗体、藻红素(PE)标记的IL-22荧光抗体及其同型抗体、细胞刺激剂(含蛋白阻滞剂)、IL-22酶联免疫吸附测定法( ELISA)试剂盒(Ebioscience ,美国),逆转录试剂盒、核酸染料SYBR Green RTPCR一步法试剂盒(Takara Biotechnology ,日本)。
实验动物分组及处理:C57BL/6J背景的ApoE-/-雄性小鼠为实验组(n=24); C57BL/6J雄性小鼠为对照组(n=24);两组小鼠均为8周龄,体重20~25 g,高脂饲料饲养0周、4周、8周、12周后分别处死作如下检测(小鼠与饲料均购自北京华阜康生物科技股份有限公司)。
组织准备:3% 戊巴比妥钠(10 μl/g)麻醉小鼠,摘除眼球取血,剪取心脏、脾脏,取、分离主动脉,均-80℃低温保存。
两组小鼠AS斑块面积的测定:将主动脉窦进行OCT包埋,低温冰冻,连续8 μm切片,取相隔100 μm的5片切片组织用4%的福尔马林固定后进行油红O染色,用图像软件(Image-Pro Plus 6.0)分析斑块面积。
流式细胞术(FACS)检测脾脏中Th22细胞数量[CD4+IL-22+/CD4+(%)]:新鲜脾脏在预冷的磷酸盐缓冲液(PBS)[0.1%NaN3+0.5%牛血清蛋白(BSA)+2 mmol/L乙二胺四乙酸(EDTA),pH 7.2]中充分研磨,用100目的钢丝网过滤,加等体积淋巴细胞分离液降速离心,分离出中间层淋巴细胞;PBS清洗2遍,再用PBS 100 μl重悬,得到淋巴细胞悬液(细胞数量105~106),细胞根据计数等分为测定管和同型对照管。按说明书加入FITC标记的CD4荧光抗体4℃避光孵育30 min,清洗2遍,用RPMI-1640培养基和10%灭活的胎牛血清重悬,转移到24孔板中(1 ml/孔),加入细胞刺激剂(2 μl/孔),充分混合,在37℃ 5% CO2环境中孵育6 h,转移至5 ml 的EP管中,清洗2遍,固定和破膜后进行胞内细胞因子染色,测定管按说明书要求加入PE标记的IL-22荧光抗体,对照管加入相应的同型对照抗体,4℃避光孵育30 min,清洗2遍,重悬,上机检测Th22细胞数量。使用FlowJo 7.6流式软件进行分析。
RT-PCR检测IL-22、IL-22R1、AhR和T-bet 的mRNA表达水平:用组织剪将分离的主动脉剪碎,Trizol研磨至组织完全溶解,按说明书提取总RNA。以提取的总RNA 为模板,按照逆转录试剂盒说明书进行逆转录反应,合成cDNA 第一链,-20℃保存。在NCBI 数据库中查询β-肌动蛋白(β-actin)、IL-22、IL-22R1、AhR、T-bet 基因序列,应用primer 5.0设计引物与探针(表1),交由上海英骏生物技术有限公司合成。以制备的cDNA 为模板,根据核酸染料SYBR Green RT-PCR一步法试剂盒说明书分别扩增β-actin、IL-22、IL-22R1、AhR、T-bet,并得出荧光曲线和相应的△Ct值。以4周龄的C57BL/6J小鼠中各值为参照,采用2-△△Ct法分析目标基因的相对表达量。每个样品设置3 个复孔。RT-PCR 反应在Bio-Rad CFX Manager 2.1系统上进行,重复3 次。

表1 引物序列
ELISA 法检测小鼠血清中IL-22含量:取已制备好的血清,按ELISA 试剂盒说明书操作,即刻测量标本A450值,根据说明书绘制标准曲线,并根据标准曲线查找其对应的浓度范围。每组样品点3孔。
统计学方法:采用SPSS 18.0统计学分析软件对数据进行分析,结果以±s表示,多组间比较采用单因素方差分析,组内两两比较采用Newman-Keuls检验,以P<0.05为差异有统计学意义。
2 结果
两组小鼠AS斑块面积进展变化的比较:随着高脂饲养时间的延长,实验组小鼠AS斑块面积不断增加,0周、4周、8周、12周时AS斑块面积的前后时间点对比差异均有统计学意义(P<0.05,图1)。而对照组小鼠并无AS斑块形成。除0周外,其它3个时间点实验组小鼠的AS斑块面积均显著高于同期对照组小鼠,差异均有统计学意义(P<0.05,表2)。
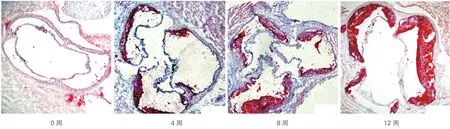
图1 实验组小鼠主动脉根部粥样斑块油红O染色及斑块面积进展变化图(×10)
表2 两组小鼠各项指标组间及组内对比(n=24,±s)
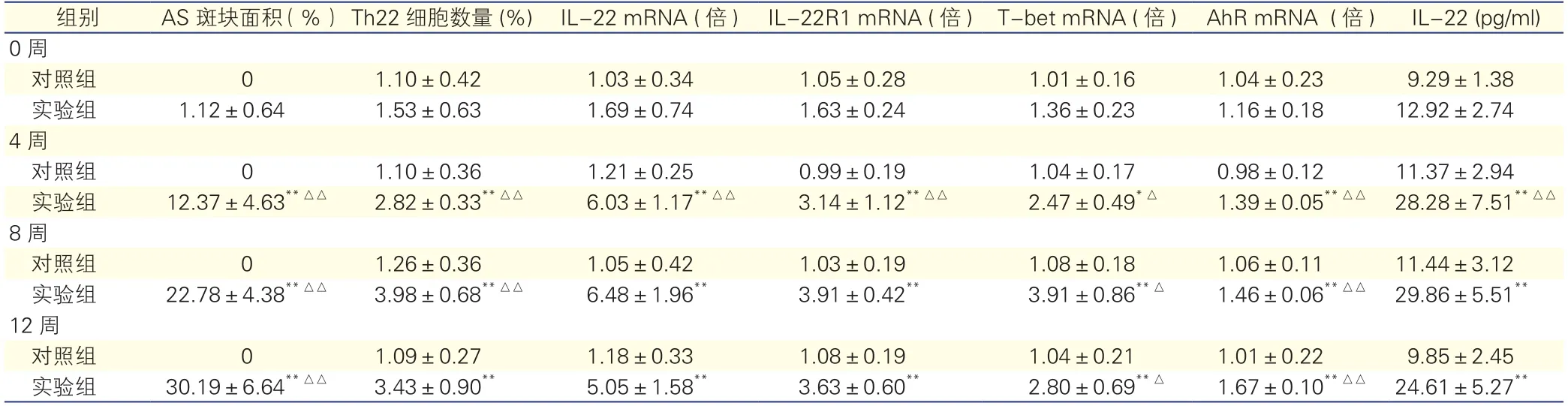
表2 两组小鼠各项指标组间及组内对比(n=24,±s)
注:AS:动脉粥样硬化;IL-22:白细胞介素-22;IL-22R1:白细胞介素-22受体1;T-bet:T盒21转录因子;AhR:芳香烃受体。与对照组相比*P<0.05**P<0.01 ;实验组组内前后时间点比较△P<0.05△△P<0.01
组别 AS 斑块面积 (%)Th22细胞数量 (%)IL-22 mRNA (倍)IL-22R1 mRNA (倍)T-bet mRNA (倍)AhR mRNA (倍)IL-22 (pg/ml)0周对照组 0 1.10±0.42 1.03±0.34 1.05±0.28 1.01±0.16 1.04±0.23 9.29±1.38实验组 1.12±0.64 1.53±0.63 1.69±0.74 1.63±0.24 1.36±0.23 1.16±0.18 12.92±2.74 4周对照组 0 1.10±0.36 1.21±0.25 0.99±0.19 1.04±0.17 0.98±0.12 11.37±2.94实验组 12.37±4.63**△△ 2.82±0.33**△△ 6.03±1.17**△△ 3.14±1.12**△△ 2.47±0.49*△ 1.39±0.05**△△ 28.28±7.51**△△8周对照组 0 1.26±0.36 1.05±0.42 1.03±0.19 1.08±0.18 1.06±0.11 11.44±3.12实验组 22.78±4.38**△△ 3.98±0.68**△△ 6.48±1.96** 3.91±0.42** 3.91±0.86**△ 1.46±0.06**△△ 29.86±5.51**12周对照组 0 1.09±0.27 1.18±0.33 1.08±0.19 1.04±0.21 1.01±0.22 9.85±2.45实验组 30.19±6.64**△△ 3.43±0.90** 5.05±1.58** 3.63±0.60** 2.80±0.69**△ 1.67±0.10**△△ 24.61±5.27**
两组小鼠Th22细胞数量在AS中的动态变化的比较(图2、表2):除0周外,实验组小鼠Th22细胞数量在各个时间点均显著高于对照组小鼠;本组内8周较4周升高,差异有统计学意义(P<0.05)。
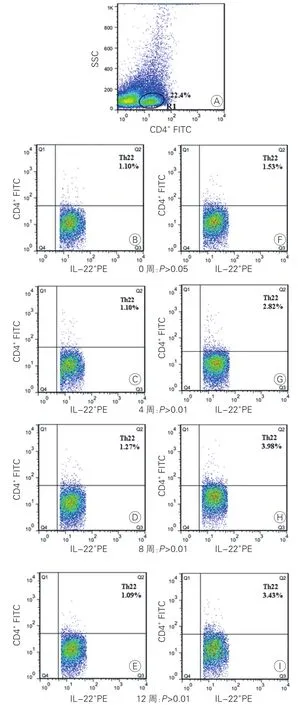
图2 两组大鼠流式细胞术检测脾脏中Th22细胞[CD4+IL-22+/CD4+T(%)]数量变化对比图
IL-22、IL-22R1、AhR和T-bet的 mRNA在主动脉中表达水平的动态变化(表2):实验组小鼠与对照组比较,0周时,IL-22、IL-22R1、AhR和T-bet 的mRNA在主动脉中表达水平差异均无统计学意义(P>0.05);经高脂饮食后4、8、12周,观察各项指标差异均有统计学意义(P<0.05)。在变化趋势上,实验组IL-22、IL-22R1和T-bet的 mRNA均在8周时达到最大值;实验组IL-22及IL-22R1的mRNA在主动脉中表达水平在4周时即达到较高值,且组内前后两时间点对比:8周与4周、12周与8周比较差异无统计学意义(P>0.05)。T-bet的 mRNA在0~8周呈持续上升趋势,12周时有所下降,同8周时相比,差异有统计学意义(P<0.05)。实验组小鼠AhR 的 mRNA在0~12周的高脂饮食过程中呈现持续上升趋势,4周时与0周时相比,差异有显著统计学意义(P<0.01),至12周时,较前均有明显升高,差异有统计学意义(P<0.05)。
两组小鼠IL-22在血清中含量的动态变化(表2):实验组血清中IL-22含量在各时间点均高于同期对照组,且4周、8周、12周时差异有显著统计学意义(P<0.01)。实验组小鼠血清中IL-22含量于8周达到最大值,组内前后两时间点对比,4周与0周比较差异有统计学意义,8周与4周、12周与8周比较差异无统计学意义(P>0.05)。
3 讨论
目前已有大量关于AS与CD4+T细胞各细胞亚群之间关系的研究。Th1、Th17细胞已被证实有促进AS的作用,而Treg则可预防AS的发生,Th2 的特征因子IL-4具有促AS 作用,但Th2 另两种细胞因子IL-5和IL-33已证实具有显著地抑制AS进程的作用,因此Th2 型免疫反应在AS的进程中所起的总体作用仍有待明确[8-10]。
Th22 是2009 年在人体发现的独立于Th1、Th2 和Th17 的一种新型效应性T 细胞[11]。AhR在诱导Th22分化及IL-22的生成中起着主要作用,而这一作用的发挥需要的T-bet的协同作用,二者相互补充,共同实现Th22分化及IL-22的生成的最佳效应,当AhR高度表达时,T-bet可对以上效应起主要调节作用[12]。本实验中二者在实验组小鼠中的表达水平均高于同条件下对照组小鼠,二者呈现出的动态变化在一定程度上互补,12周Th22及IL-22稍有下降趋势(差异无统计学意义),很可能是由于T-bet的调节作用主导。Basu 发现,在炎症的早期,IL-22 主要由淋巴组织诱导细胞分泌,在炎症的中晚期则主要由Th22 细胞分泌,提示Th22 可能在慢性炎症性疾病中扮演了重要的角色。IL-22 的靶细胞为非免疫细胞,主要是上皮细胞,也作用于内皮细胞[13]和平滑肌细胞[14]等组织细胞。
研究发现,Th22 细胞通过分泌IL-22 作用于不同的靶细胞,诱导细胞生长因子及炎性因子产生,并发挥其多种生物效应。IL-22可以促进类风湿关节炎患者滑膜成纤维细胞增殖和生成单核细胞趋化蛋白(MCP-1)[15];在牛皮癣疾病中,IL-22可促进角化细胞的分化和迁移并上调多种促炎因子的表达[16]。此外,多项研究表明IL-22下游信号是由JAK-STAT通路和丝裂原活化蛋白激酶(MAPK)通路介导。而JAK-STAT已明确证实与AS 进程中氧化应激、细胞损伤与凋亡有关,并参与凋亡因子Fas、IL-8和IL-6的基因调控,而MAPK 更是与血管平滑肌细胞的表型转换、迁移和增殖密切相关,并参与不少炎症因子的基因调控。由此我们推测Th22可能通过其细胞因子IL-22激活JAK-STAT 通路和MAPK 通路,诱导细胞生长因子及炎性因子产生,参与机体的病理性免疫应答反应,从而加剧AS进程。
Th22作为一种最新发现的新型CD4+T细胞,其在AS中的作用及机制研究尚处在初级阶段。相关免疫组化证实IL-22存在于AS患者粥样斑块中,且有症状患者斑块中IL-22含量约为无症状患者的7.5倍[17]。而我们一项临床研究发现急性心肌梗死、不稳定性心绞痛患者外周血中Th22细胞、IL-22因子含量及转录因子AhR的 mRNA表达量均明显高于稳定性心绞痛患者和正常对照组。本实验结果显示实验组小鼠中Th22细胞的数量、IL-22、IL-22R1、AhR、T-bet的mRNA在主动脉中表达水平显著高于同条件下的对照组小鼠,这表明,Th22型免疫反应可能在AS的发生发展中发挥着重要作用,具有促进AS进程的作用。
本实验初步证实Th22型免疫反应存在于AS进程中,且很可能发挥着促进AS的作用,为进一步探索其病理机制提供了理论依据。对Th22型免疫反应在冠心病中作用的认识,进一步证实和完善了AS 发病的炎症学说和Th 细胞亚群功能失衡理论,加深我们对AS 这一免疫介导的慢性炎症性疾病的病理生理机制的理解,有望成为急性冠状动脉综合征炎症干预的新靶点。
参考文献
[1]Lundberg AM,Hansson GK.Innate immune signals in atherosclerosis .Clin Immunol,2010,134:5-24.
[2]李梦豪,卢浩,熊浩伟,等.以T淋巴细胞为靶点抗动脉粥样硬化的新进展.中国循环杂志,2015,08:807-810.
[3]Oliveira RT,Silva RM,Teo FH,et al.Detection of TCD4+ subsets in human carotid atheroma.Cytokine,2013,1:131-140.
[4]Eid RE,Rao DA,Zhou J,et al.Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells.Circulation,2009,119:1424-1432.
[5]Benham H,Norris P,Goodall J,et al.Th17 and Th22 cells in psoriatic arthritis and psoriasis.Arthritis Res Ther,2013,15:R136.
[6]Zhao L,Jiang Z,Jiang Y,et al.IL-22+ CD4+ T cells in patients with rheumatoid arthritis.Int J Rheum Dis,2013,16:518-526.
[7]Lin YZ,Wu BW,Lu ZD,et al.Circulating Th22 and Th9 levels in patients with acute coronary syndrome.Mediators Inflamm,2013,2013:635672.
[8]Davenport P,Tipping PG.The role of interleukin-4 and interleukin-12 in the progression of atherosclerosis in apolipoprotein E-deficient mice.Am J Pathol,2003,163:1117-1125.
[9]Binder CJ,Hartvigsen K,Chang MK,et al.IL-5 links adaptive and natural immunity specific for epitopes of oxidized LDL and protects from atherosclerosis.J Clin Invest,2004,114:427-437.
[10]Miller AM,Xu D,Asquith DL,et al.IL-33 reduces the development of atherosclerosis.J Exp Med,2008,205:339-346.
[11]Eyerich S,Eyerich K,Pennino D,et al.Th22 cells represent a distinct human T cell subset involved in epidermal immunity and remodeling.J Clin Invest,2009,119:3573-3585.
[12]Basu R,O'Quinn DB,Silberger DJ,et al.Th22 cells are an important source of IL-22 for host protection against enteropathogenic bacteria.Immunity,2012,37:1061-1075.
[13]Bae ON,Ahn S,Jin SH,et al.Chemical allergens stimulate human epidermal keratinocytes to produce lymphangiogenic vascular endothelial growth factor.Toxicol Appl Pharmacol,2015,283:147-155.
[14]Rattik S,Hultman K,Rauch U,et al.IL-22 affects smooth muscle cell phenotype and plaque formation in apolipoprotein E knockout mice.Atherosclerosis,2015,242:506-514.
[15]Ikeuchi H,Kuroiwa T,Hiramatsu N,et al.Expression of interleukin-22 in rheumatoid arthritis:potential role as a proinflammatory cytokine.Arthritis Rheum,2005,52:1037-1046.
[16]Hao JQ.Targeting interleukin-22 in psoriasis.Inflammation,2014,37:94-99.
[17]Xia Q,Xiang X,Patel S,et al.Characterisation of IL-22 and interferon-gamma-inducible chemokines in human carotid plaque.Int J Cardiol,2012,154:187-189.
(编辑:曹洪红)
临床研究
Dynamic Changes of Type Th22 Cell Immunological Response During Atherosclerosis Process in Experimental Mice
WAN Jun,SHI Lei,JI Qing-wei,SHI Ying,LIU Ling,LU Zheng-de,FENG Ying,YE Jing,LIN Ying-zhong.
Department of Cardiology,Wuhan University People’s Hospital,Wuhan (430000),Hubei,China
Abstract
Objective:To study the dynamic changes of type Th22 cell immunological response during atherosclerosis process in experimental mice in order to provide a new theoretical basis for atherosclerosis therapy.
Methods:8 weeks C57BL/6J mice were divided into 2 groups:Experiment group,n=24 ApoE-/-mice and Control group,n=24 normal mice.All animals received high fat diet and the following indexes were compared between 2 groups at 0,4,8,12 weeks after treatment:aortic atherosclerotic lesions were defined by Oil red O staining,dynamic changes of Th22 cells in spleen were measured by flow cytometry,mRNA expressions of interleukin-22 (IL-22),IL-22R1,AhR and T-bet in aorta were examined by RT-PCR,blood levels of IL-22 was detected by ELISA.
Results:Compared with Control group,Experiment group had the increased area of aortic atherosclerosis (the ratio of plaque area/lumen area) and Th22 cell (CD4+IL-22+/CD4+T cell) amount,elevated mRNA expressions of IL-22,IL-22R1,AHR,T-bet in aorta and higher blood levels of IL-22 at all time points,the differences between each time point (except 0 week)had the statistic meaning,P<0.05.In Experiment group,the differences between 2 adjacent time points,for the area of aortic atherosclerosis and mRNA expressions of AHR,T-bet:4 weeks vs 0 week,8 weeks vs 4 weeks,12 weeks vs 8 weeks all had statistic meaning; for Th22 cell amount:4 weeks vs 0 week,8 weeks vs 4 weeks had statistic meaning and 12 weeks vs 8 weeks had no real distinction; for mRNA expressions of IL-22,IL-22R1 and blood levels of IL-22:4 weeks vs 0 week had statistic meaning and 8 weeks vs 4 weeks,12 weeks vs 8 weeks had no real distinctions.
Conclusion:Hyperactive immunological response of Th22 cells might be involved in atherosclerosis process,the relevant mechanism should be further studied.
Key wordsAtherosclerosis; Th22 cells; Interleukin-22
基金项目:国家自然科学基金项目(81360055,81460061和81560085),广西医疗卫生重点科研课题(重2011119),广西自然科学基金项目(2013GXNSFAA019265)
作者简介:万军主任医师博士主要从事心肌病和心律失常的基础与临床研究Email:wanjun1963@126.com通讯作者:林英忠Email:yingzhonglin@126.com
中图分类号:R541
文献标识码:A
文章编号:1000-3614(2016)05-0454-05
doi:10.3969/j.issn.1000-3614.2016.05.009
Corresponding Author:LIN Ying-zhong,Email:yingzhonglin@126.com
收稿日期:(2015-09-22)

