三株栅藻属藻株光合自养产油脂的比较研究
陈传红 吴洪 李青 尹顺吉 罗少敬 崔春莉
(新奥科技发展有限公司 煤基低碳能源国家重点实验室,廊坊 065001)
三株栅藻属藻株光合自养产油脂的比较研究
陈传红 吴洪 李青 尹顺吉 罗少敬 崔春莉
(新奥科技发展有限公司 煤基低碳能源国家重点实验室,廊坊 065001)
通过柱式光生物反应器培养,比较研究三株栅藻(Scenedesmus sp简写S. sp、Scenedesmus deserticola、Scenedesmus dimorphus)的生长及油脂含量情况,得出3株藻生物量最高的是S. deserticola 为0.48 g/(L·d);其次是S. sp为0.41 g/(L·d);S. dimorphus产量最低为0.35 g/(L·d)。且培养后期经尼罗红染色清楚可见油脂分布,其中S. deserticola总脂含量达到了干重的55.3 %,总脂产量为0.29 g/(L·d);S. dimorphus为46.7 %,0.18 g/(L·d);S. sp为43.6 %,0.20 g/(L·d)。三株栅藻主要脂肪酸为C18和C16,占总脂肪酸组成的85 %以上,符合生物柴油的生产要求。综合比较,S. deserticola是一株性能优良的产油藻株。
栅藻;生长;尼罗红;生物量;油脂
生物质能源因其可再生、无污染已成为研究的热点[1],而微藻能源以其独有特性在众多生物质能源中备受关注。微藻具有光合效率高、生长快、产油率高、不受养殖季节限制、不占用耕地农田等优势,这是其它生物质能源原料所不具备的。因此,利用微藻油脂生产生物燃料成为了潜在的替代能源研究热点[2-4]。许多研究者以生产微藻生物燃料为目标,对产油微藻进行了大量的筛选工作[5-8]。而栅藻作为一种单细胞微藻,具有生长快、环境适应性强、油脂含量高等优点,可能成为微藻生物燃料的候选微藻种类之一[1,9]。栅藻属于绿藻门,绿球藻目,栅藻科,是淡水中极为常见的种类。目前对栅藻的研究主要集中在污水处理[10-12]、有机物或重金属毒理及吸附等研究方面[13-15]。
本实验对不同的栅藻藻株进行生长、油脂含量及分布情况研究,旨在获得生长速度快,油脂含量高的栅藻藻株,建立栅藻生长和产油性能的基本评价方法,为栅藻生产生物燃料提供依据。
1 材料与方法
1.1 材料
藻 种:栅 藻(Scenedesmus sp, 简 写S. sp)、荒 漠 栅 列 藻(Scenedesmus deserticola, 简 写 S. deserticola)、双形栅藻(Scenedesmus dimorphus,简写S. dimorphus)3株藻种,均由本公司藻种库保存。
培养基:BG11培养基。
1.2 方法
1.2.1 培养方法 将对数期的藻种接种到500 mL的三角瓶中通气培养,达到一定的OD值后,转接到Ф4 cm×60 cm柱式反应器中进行生长和产油性能评价,初始OD750值在0.8左右。采用单根玻璃管通气,所通入气体为空气和CO2混合气(CO2含量:1.5%-2.0%),培养期间通气不间断。温度(28±1)℃,光强约为200 μmol·m-2·s-1,24 h光照,pH值控制在7-9之间;定期取适量藻液,进行相应参数的测定。
1.2.2 分析测试与计算
1.2.2.1 比生长速率 采用干重计算,利用公式:比生长速率μ=(LnNt-LnN0)/t,其中 N0为初始干重值,Nt为培养第t 天的干重值,t 为培养时间[16]。
1.2.2.2 叶绿素a含量 移取一定体积(V)的藻液放置在15 mL的离心管中,3 500 r/min转离心5 min,去上清液;然后加入一定体积(U)的甲醇震荡混匀留下的藻团,将离心管放置在70℃的水浴中加热提取 5 min,3 500 r/min离心5 min,取上清液在665 nm 和750 nm下测定吸光值[17]。
叶 绿 素a含 量(mg/L)= 13.9(OD665-OD750)*U/V
1.2.2.3 细胞干重 Ø 25 mm 或47 mm的Whatman(GF/F,GF/C)滤纸,空白滤纸事先烘干(105℃)称重,移取一定体积的藻液(根据所培养的藻液的浓度来确定取样的体积)真空抽滤,放置在105℃的烘箱中过夜烘干,取出放置在干燥器中冷却后称重。
1.2.2.4 尼罗红染色 收集培养完成的藻液(0.5 mL),4 000 r/min离心5 min,去上清,并用去离子水洗涤2次,后用20% DMSO水溶液重悬浮至0.5 mL,加入尼罗红,使尼罗红的浓度为1 μg/L,35℃水浴10 min,后用去离子水洗涤一次,此时将染色的藻细胞置于荧光显微镜下观察[18]。
1.2.2.5 油脂含量及脂肪酸组成测定
(1)总脂提取:参照文献方法[19],取50 mg或100 mg冻干藻粉(dw)放置在具Telfnon螺口瓶盖的体积为15-20 mL的小玻璃瓶中,再放置一小磁力棒,加入2-4 mL 10% DMSO-Methanol 溶液,40℃砂浴(盛砂的烧杯放置恒温加热磁力搅拌器上)5 min;然后在4℃下磁力搅拌抽提30 min,3 500 r/min离心,转移上清液到另一小瓶中。剩下藻渣再加入1∶1的乙醚、正己烷4-8 mL 4℃下磁力搅拌抽提1 h,3500 r/min离心,转移上清液到上述一小瓶中。可重复上述过程直到藻渣变白。在上述合并抽提液中加入纯水使四者(水、DMSO-Methanol、乙醚、正己烷)体积比例为 1∶1∶1∶1,震荡分相,移取有机相转移到另一小玻璃瓶中,在通风橱中用氮气吹至成浓缩液,然后转移到事先称重过的1.5 mL塑料离心管(dw1)中,再用氮气吹干至恒重(dw2)。
总脂含量(%)=(dw2-dw1)*100%/dw
总脂产量(g/(L·d))=总脂含量(%)*细胞干重(g/L)/培养时间(d)
(2)脂肪酸分析:参照文献[20]方法,使用Agilent 6820气相色谱仪进行气相色谱分析(色谱条件为载气:氮气流量1 mL/min、氢气流量30 mL/ min、空气流量300 mL/min,进样口温度:280℃,检测器温度:280℃,检测器类型:Agilent FID,色谱柱:Agilent DB-5毛细管色谱柱(30 m × 0.25 mm,0.25 μm),分流比:4∶1。分析方法:内标法GB/T 17377-1998(气相色谱用氮气作载气,相当于液相色谱的流动相)。
1.2.2.6 数据分析 使用Excel和SPSS11软件对所有数据进行分析
2 结果
2.1 三株栅藻生长特性比较
三株栅藻在柱式反应器中培养16 d,分别于2、4、6、8、10、13、16 d取样测定OD值和生物量。结果(图1)显示,3株栅藻都经过了在2-4 d的快速生长阶段,而4 d后进入较缓慢的增长阶段。在培养16 d中,S. deserticola生长最快,产量达到了0.48 g/(L·d);其次是S. sp,产量为0.41 g/(L·d);最后是S. dimorphus,产量为0.35 g/(L·d)。三株藻的生物量在16 d的培养中持续增加(图2),S. deserticola的最高生物量为8.27 g/L;其次是S. sp为7.24 g/L;S. dimorphus生物量最低,为6.13 g/L。S. deserticola的最大生物量显著高于S. sp(P<0.05),而极显著高于S. dimorphus(P<0.01)。三株藻最大比生长速率出现在2-4 d,均达到了0.43 d-1以上;S. deserticola 16 d平均比生长速率为0.165 d-1,S. sp为0.153 d-1,S. dimorphus为0.145 d-1。上述结果表明,S. deserticola的生物量积累速度比其它两株栅藻更快,同样培养时间积累的生物质更多。
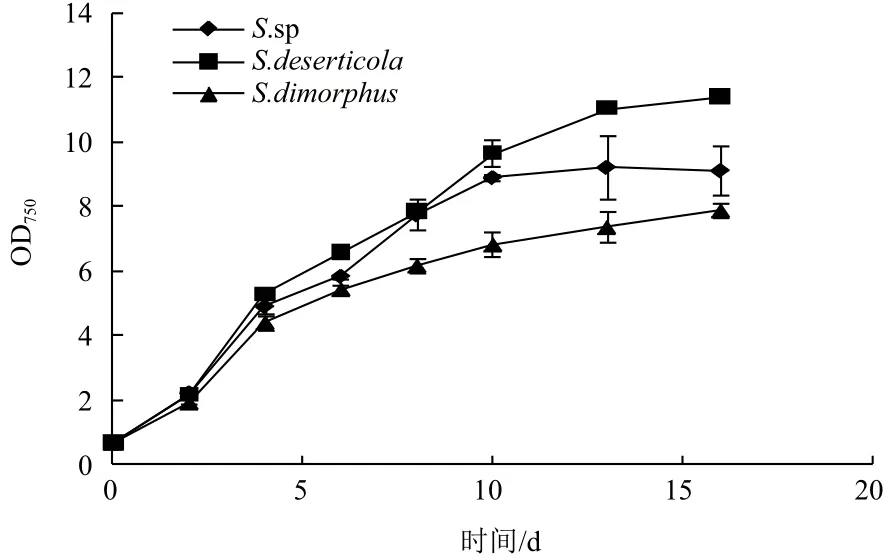
图1 三株栅藻OD750值的变化

图2 三株栅藻生物量的变化
2.2 三株栅藻叶绿素a含量的变化
在培养过程中,3株栅藻的叶绿素a含量(图3)在经过4 d的快速增加后达到最高值:S. sp为63.0 mg/L,S. deserticola为 80.8 mg/L,S. dimorphus为66.3 mg/L。3株藻在0-4 d叶绿素a含量增长最快,S. sp和S. deserticola在4-10 d持续维持高值后分别下降54.4%和43.7%;而S. dimorphus在第4天达到最高值后即开始迅速下降,在16 d时仅为16.6 mg/L,与最高含量相比下降了74.9%。
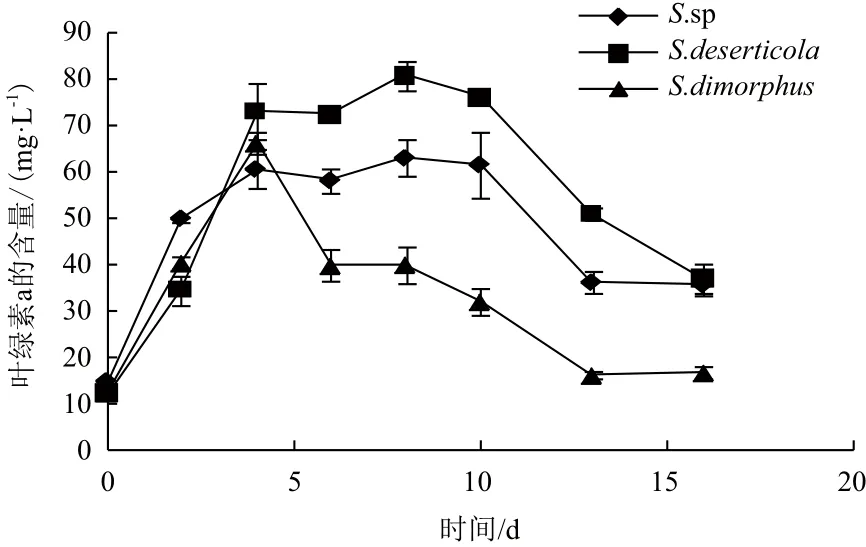
图3 三株栅藻叶绿素a含量的变化
2.3 三株栅藻细胞形态和油脂积累位置观察
三株栅藻在经过16 d的培养后进行了尼罗红染色,结果(图4)表明,3株栅藻从原来的绿色细胞转变为黄色细胞,细胞的个体明显增大,其中S. deserticola和S. sp的细胞由早期的卵形向圆形转变,而S. dimorphus细胞长与宽的比值逐渐缩小,细胞形态由长梭形变化为椭圆形。同时,在3株栅藻的细胞质内积累了大量的油脂,并且3株栅藻油脂积累的部位存在差异,其中,S. deserticola和S. sp的油脂主要积累在细胞的一侧,而S. dimorphus主要在细胞的两端及细胞壁边缘。
2.4 三株栅藻总脂含量及脂肪酸组成分析
在培养16 d后3株栅藻的总脂含量都超过了干重的40%(图5-A),S. deserticola的总脂含量最高,达到55.3%,S. dimorphus为46.7%,S.sp为43.6%。S. deserticola的总脂含量显著高于S. dimorphus(P<0.05),极显著高于S. sp(P<0.01)。S. deserticola的16 d平均总脂产量最高,达到了0.29 g/(L·d),其次是S. sp为0.20 g/(L·d),最低为S. dimorphus,产量为0.18 g/(L·d)(图5-B)。
对培养16 d时的脂肪酸组成分析结果(表1)显示,3株栅藻的主要脂肪酸均为C18和C16,占总脂肪酸组成的85%以上。S. sp三种主要脂肪酸为C18∶1、C16∶0、C18∶2,占总脂肪酸的62.7%;S. deserticola三种主要脂肪酸为C18∶1、C16∶0、C18∶3α,占总脂肪酸的64.6%;S. dimorphus三种主要脂肪酸为C18∶1、C16∶0、C18∶4,占总脂肪酸的68.3%。3株栅藻的C20以上脂肪酸的总和均低于总脂肪酸组成的2%。

图4 三株栅藻培养前期图(a-1、b-1、c-1)和培养16 d的细胞形态(a-2、b-2、c-2)与油脂分布图(a-3、b-3、c-3)

图5 三株栅藻培养16 d时的总脂含量(A)以总脂产量(B)

表1 三株栅藻培养16 d时脂肪酸组成
3 讨论
本研究对3株栅藻的生长特性进行了比较,在相同的接种浓度和培养条件下,3株栅藻在生长上能够表现出不同的差异,S. deserticola的最大生物量显著高于其它两株,达到了8.27 g/L,比S. sp高出14.2%,比S. dimorphus高出34.9%。说明了相同属的藻株,由于生长环境不同或藻株自身的特性差异等原因,藻株的生长速度和生物量积累能力存在差异,这与王元丽[21]对不同的真眼点藻的生长研究结果一致。同时,3株藻在叶绿素a含量的变化差异,与许多研究者结果类似[7,22],其中展望[22]认为叶绿素a含量在培养过程中呈现的先上升后下降的趋势,可能是由于细胞密度的增加使每个细胞接受到的光暗频率下降,光照强度相对降低所造成的。
一般情况下,随着藻类培养时间的延长,藻细胞在色素含量上发生变化,同时由于细胞浓度的不断增加和营养盐的减少,藻细胞的形态会发生改变,油脂也不断积累,到培养后期达到较高的水平。尼罗红作为一种脂溶性荧光燃料,常用于微生物的油脂含量的评估。当藻细胞积累大量的油脂后,通过尼罗红染色可以清楚观察到油脂的分布及积累情况[23]。
用于生物柴油生产的原料油脂,其脂肪酸组成和含量将直接影响生物柴油的品质。油脂中的三酰甘油酯是油脂加工的主要原料,故微藻中三酰甘油酯的脂肪酸组成和含量是评估该藻能否作为生物柴油生产藻株的重要因素。在生物柴油的生产中,要求作为原料的脂质应有较高含量的饱和脂肪酸和单不饱和脂肪酸,同时尽可能少的多不饱和脂肪酸含量[23,24]。在本研究中,三株栅藻的饱和脂肪酸和单不饱和脂肪酸含量均在60%以上,且主要脂肪酸的C18和C16占总脂肪酸组成的85%以上,同时C20以上脂肪酸的总和均低于总脂肪酸组成的2%,表明这3株栅藻的油脂特性符合生物柴油生产的要求[25]。
4 结论
利用柱式反应器在相同的培养条件下,通过对三株栅藻进行生长速率、生物量及油脂含量和组成等参数的测定和分析比较,建立了优良产油栅藻藻种的性能评价方法。结果显示,3株藻积累最高生物量的是S. deserticola 为8.27 g/L;其次是S. sp为7.24 g/L;S. dimorphus产量最低为6.13 g/L。S. deserticola总脂含量和产量分别为达到了55.3%,和产量为0.29 g/(L·d),S. dimorphus为46.7%,产量为和0.18 g/(L·d),S. sp为43.6%,产量为和0.20 g/(L·d)。3株栅藻的主要脂肪酸为C18和C16,占总脂肪酸组成的85%以上,C20以上脂肪酸的总和低于总脂肪酸组成的2%。综合生物量、总脂产量和脂肪酸组成的比较结果,S. deserticola是三株栅藻中最优良的产油藻株。
[1]Mandal S, Mallick N. Microalga Scenedesmus obliquus as a potential source for biodiesel production[J]. Appl Microbiol Biotechnol, 2009, 84(2):281-291.
[2]Williams P, Laurens L. Microalgae as biodiesel and biomass feedstocks:review and analysis of the biochemistry and economics[J]. Energy Envion Sci, 2010, 3(5):554-590.
[3]Chisti Y. Biodiesel from microalgae[J]. Biotechnol Adv, 2007, 25(3):294-306.
[4]Singh J, Gu S. Commercialization potential of microalgae for biofuels production[J]. Renew Sustain Energy Rev, 2010, 14(9):2596-2610.
[5]Rodolfi L, Zittelliv C G, Bassi N, et al. Microalgae for oil:strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor[J]. Biotechnol Bioeng, 2009, 102(1):100-112.
[6]王金娜, 严小军, 周成旭, 等. 产油微藻的筛选及中性脂动态积累过程的检测[J]. 生物物理学报, 2010, 26(6):472-480.
[7]李涛, 李爱芬, 桑敏, 等. 富油能源微藻的筛选及产油性能评价[J]. 中国生物工程杂志, 2011, 31(4):98-105.
[8]王玉荣, 师文静, 佟明友. 产油微藻的筛选及其产油性能评价的研究[J]. 当代化工, 2015, 44(4):680-683.
[9]Prabakaran P, Ranvindran AD. Scenedesmus as a potential source of biodiesel among selected microalgae[J]. Curr Sci, 2012, 102(4):616-620.
[10]Pittman JK, Dean AP, Osundeko O. The potential of sustainable algal biofuel production using wastewater resources[J]. Bioresource Technology, 2011, 102(1):17-25.
[11]高保燕, 沈丹丹, 何思思, 等. 富油微藻— —尖状栅藻生物质生产与奶牛场废水处理相结合的效果研究[J]. 可再生能源, 2014, 32(5):673-679.
[12]安晓雯, 张恩栋, 王起华. 固定化栅藻对市政污水中氮、磷营养盐的深度净化[J]. 中南民族大学学报:自然科学版, 2006, 25(4):14-17.
[13]洪华嫦, 周海云, 蓝崇钰. 五氯酚对斜生栅藻的毒性效应研究[J]. 环境科学研究, 2003, 16(6):23-28.
[14]邱伟建, 陈敏东, 葛顺, 等. 斜生栅藻对草甘膦异丙胺盐的毒性响应[J]. 环境科学与技术, 2013, 36(12):24-28.
[15] 曹维维, 王恒, 李湘鸣, 等. 汞对斜生栅藻的急性毒性研究[J].上海农业科技, 2010(3):22-23.
[16]Richmond A. Handbook of Microalgal Culture:Biotechnology and Applied Phycology[M]. UK, Iowa:Blackwell, publishing, 2004.
[17]Azov Y. Effect of pH on inorgannic carbon uptake in algal cultures[J]. Applied and Environmental Microbiology, 1982, 43(6):1300-1306.
[18]Chen W, Zhang CW, Song LR, et al. A high throughput Nilered method for quantitative measurement of neutral lipids in microalgae[J]. Journal of Microbiological Methods, 2009, 77(1):41-47.
[19]Khozin-Goldberg I, Shrestha P, Cohen Z. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incisa[J]. Biochimica et Biophysica Acta, 2005, 1738(1-3):63-71.
[20]Solovchenko AE, Khozin-Goldberg. I, Didi-cohen S, et al. Effects of light intensity and nitrogen starvation on growth, total fatty acids and arachidonic acid in the green microalga Parietochloris incisa[J]. J Appl Phycol, 2008, 20(3):245-251.
[21]王元丽, 李其雨, 李爱芬, 等. 株真眼点藻的生长及光合生理特性[J]. 生物技术, 2014, 24(2):91-95.
[22]展望, 桑敏, 李爱芬, 等. 不同光径对两株土壤绿藻生长及脂类积累的影响[J]. 可再生能源, 2010, 28(3):67-71.
[23]Wang H, Gao LL, Chen L, et al. Integration process of biodiesel production from filamentous oleaginous microalgae Tribonema minus[J]. Bioresource Technology, 2013, 142:39-44.
[24]Gao YY, Yang MC, Wang CH. Nutrient deprivation enhances lipid content in marine microalgae[J]. Bioresource Technology, 2013, 147:484-491.
[25]孙远, 刘文彬, 周铁柱, 等. Fe3+对小球藻的生长及油脂含量的影响[J]. 生物技术通报, 2014(4):181-186.
(责任编辑 李楠)
Lipid Production from the Photoautotrophy of Three Strains of Scenedesmus Species
CHEN Chuan-hong WU Hong LI Qing YIN Shun-ji LUO Shao-jing CUI Chun-li
(State Key Laboratory of Coal-based Low-carbon Energy,Xin’ao Scientific & Technological Developmental Co.,Ltd.,Langfang 065001)
The growth and the lipid content of 3 strains of Scenedesmus were compared by column photobioreactor,and it was concluded that the strain of producing the highest biomass was Scenedesmus deserticola with 0.48 g/(L·d),followed by Scenedesmus sp(S. sp)0.41 g/(L·d),and the lowest by S. dimorphus with 0.35 g/(L·d). In the late culture stage,the lipid distribution was clearly visible by Nile red staining. The total lipid content and the lipid productivity of S. deserticola were 55.3 % of DCW and 0.29 g/(L·d),respectively,followed by S. dimorphus in 46.7 % and 0.18 g/(L·d),S. sp in 43.6 % and 0.20 g/(L·d). The main fatty acid composition of 3 Scenedesmus were C18 and C16,accounting for over 85% of total fatty acids,satisfying the requirements of biodiesel production. Comprehensive comparison revealed that the S. deserticola was a lipid-producing strain with high performance.
Scenedesmus species;growth;Nile red;biomass;lipid
10.13560/j.cnki.biotech.bull.1985.2016.06.035
2015-09-30
国家“973”计划重点项目(2012CB723606)
陈传红,女,硕士,助理研究员,研究方向:微藻藻种选育和微藻养殖等;E-mail:chench@enn.cn
吴洪,女,博士,研究方向:微藻藻种选育和高效养殖方式;E-mail:wuhong@enn.cn

