栅藻作为生物指示剂的生物延迟发光研究*
张玉风,杨美娜,庞靖祥,周宝宸,韩金祥△
(1.济南大学山东省医学科学院医学与生命科学学院,山东 济南 250020; 2.山东省医学科学院医药生物技术研究中心,山东 济南 250062)
1 引 言
生物光子辐射又称超微弱发光,是生命系统的本质现象,存在于各种动物、植物、藻类及微生物系统中,是生命新陈代谢的产物,来自生物分子从高能态向低能态的跃迁[1],是一个典型的量子效应。大量实验结果表明,生物光子辐射可以反映生物系统内部的微观信息及外界环境的微弱变化,且具有很高的灵敏度[2]。生物光子辐射包括自发发光和延迟发光,延迟发光是指一个生物系统被光照射后的长时间迟豫现象,其迟豫动力学过程不可用指数函数描述[3],延迟发光作为一种特殊的生物光子辐射,被认为是反映生物系统内部状态的一个指标[4-5]。
有报道称[6],通过检测加入生物指示剂(一种标准的生物发光样品)的水的延迟发光行为可以获得关于水质量与水污染的信息。栅藻是一种极喜在营养丰富的静水中繁殖的淡水单细胞绿藻,对除草剂等农药十分敏感[7],常用于重金属对藻类的毒性研究中[8-11],可敏感感知不同液体环境,快速、高效区分多种水质污染,常用作水质评价的指示生物。基于此,本研究选用栅藻作为生物指示剂,探索其最优使用条件,并探讨加入不同中药煎煮液的栅藻延迟发光动力学行为演化,为用栅藻作为生物指示剂来研究中药药性奠定基础。
2 材料和方法
2.1 材料
生物指示剂:栅藻(Scenedesmus sp.) 购自中国科学院武汉水生生物研究所 (编号FACHB-933),使用BG11培养基进行培养。
主要仪器设备:YPMS-2生物光子测量仪,UV-2802型紫外可见分光光度计,GXZ智能光照培养箱,超净工作台,MLS-3780高压灭菌锅,尚朋堂电陶炉,康舒砂锅,石英比色皿,ACCULAB电子天平,锥形瓶,烧杯,量筒,离心管,移液枪。
2.2 方法
2.2.1栅藻浓度的优化 本研究选用光密度法测定栅藻浓度。测量波长为680 nm,栅藻的吸光度A与细胞浓度C的线性回归方程为C=(A×11.995+0.1502)×106个/ml (R2=0.9766)[12-13],根据测得的栅藻吸光度,计算出栅藻的浓度。
选取生长状态良好的栅藻,摇匀,分别取适量藻液置于16个15 mL离心管中,加入适量BG11培养基稀释,得到吸光度为1~3的藻液。分别取3 mL藻液置于4 cm×1 cm×1 cm的石英比色皿中,放于YPMS-2生物光子测量仪的暗室内,测其自然延迟(点间隔0.1 s,测量时间5 min)及激发延迟(点间隔0.1 s,测量时间5 min,激发光源为White-LED,激发时间为10 s,重复测量7次,两次测量间隔20 min)。
2.2.2栅藻生长阶段的优化 分别选取生长至16、21、30、40、51、60、70 d的生长状态良好的栅藻,均调节至栅藻液的吸光度为2.5,取3 mL置于4×1×1 cm的石英比色皿中,放于YPMS-2生物光子测量仪的暗室内,测其自然延迟及激发延迟,每个生长阶段的栅藻平行测定3次以减少测量误差。
自然延迟参数设置:点间隔0.1 s,测量时间15 min;激发延迟参数设置:点间隔0.1 s,测量时间5 min,激发光源为White-LED,激发时间10 s,重复测量7次,两次测量间隔20 min。
2.2.3加入中药煎煮液的栅藻延迟发光测量 本研究选用黄连和吴茱萸2味中药进行初步研究。
(1)中药煎煮液的制备[14]
用电子天平秤取中药材10 g,置于砂锅中,加入200 mL水浸泡30 min,用电陶炉加热,功率调至2000 W,煮沸后调至800 W,共煎煮15 min,用6层纱布过滤药液,药渣重复上述煎煮流程,将2次煎煮的药液合并浓缩,放凉至室温,最终得中药煎煮液50 mL。
(2)中药煎煮液的延迟发光测量
选取生长40 d的状态良好的栅藻,调至吸光度为2.5,取3 mL置于4 ×1×1 cm的石英比色皿中,分别加入中药煎煮液20、40、60、80、100 μL,迅速放于YPMS-2生物光子测量仪的暗室内,5 min后测其激发延迟。
激发延迟参数设置:点间隔0.1 s,测量时间5 min,激发光源为White-LED,激发时间10 s,重复测量7次,两次测量间隔20 min。
2.2.4数据处理分析 本研究采用“顾参数”模型对数据进行分析处理。“顾参数”模型运用了量子光学理论和非平衡统计物理的概念,可以对延迟发光数据进行很好的拟合。目前已被发现其能够刻画许多不同生物样品延迟发光的实验结果,如动物组织、种子、食品、水藻、微生物系统、甚至化妆品等[15]。
将测得的延迟发光数据导入Statistica 10.0软件,拟合公式编辑为顾参数公式
I(t)=Acsch2(t/B+C)
(1)
得到3个拟合参数,即“顾参数”A、B、C,然后带入平均强度的计算公式
IW=AB/W[coth C-coth(W/B+C)]
(2)
得到每次延迟发光的辐射强度在总的测量时间W内的平均值即平均强度,然后将7次激发延迟发光的平均强度IW与时间t进行线性拟合得到线性拟合方程IW=kt+b,其中斜率k扮演了刻画样品性质的可靠参数。
3 结果与讨论
3.1 栅藻浓度的优化
将理论结果式(1)与栅藻的实际延迟发光数据相比较,见图1、图2,自然延迟发光和激发延迟发光的理论值与观察值均有相当好的拟合,相关系数分别为0.9982和0.9863,说明 “顾参数”模型是处理延迟发光数据的可靠模型,具有相当高的精确性。

图1栅藻自然延迟的理论值与观察值的线性相关(A=2.483)
Fig1Linearcorrelationbetweenthescenedesmusnaturaldelaytheoreticalandobservedvalue(A=2.483)

图2栅藻激发延迟的理论值与观察值的线性相关(A=2.483)
Fig2Linearcorrelationbetweenthescenedesmusexcitationdelaytheoreticalandobservedvalue(A=2.483)
表1给出了不同浓度栅藻的自然延迟发光平均强度及7次激发延迟发光的平均强度对时间的线性拟合斜率k及拟合度R2。我们发现,自然延迟发光的平均强度基本上随栅藻浓度的增大而增大(见图3),激发延迟发光的斜率k和拟合度R2在栅藻浓度低于2.5×107个/mL时波动较大,在2.5~3.5×107个/mL浓度范围内较稳定(见图4),因此,我们选定栅藻使用的浓度范围为2.5~3.5×107个/mL。考虑到栅藻的培养周期及使用量,实验中我们选用的栅藻浓度为3.0×107个/mL,即调节栅藻的吸光度为2.5。
表1不同浓度栅藻延迟发光的参数对比
Table1Thecontrastofdelayedluminescenceparametersofdifferentconcentrationsofscenedesmus

编号栅藻吸光度栅藻浓度(107个/ml)自然延迟平均强度激发延迟线性拟合k线性拟合R210.9591.165645.0582.2640.95521.0751.3051272.8894.9140.98031.2881.5601033.4120.9020.79541.3831.6741310.6071.0070.74051.4911.8041079.6313.8690.96161.6061.9411820.9650.3740.24371.7052.0601607.0268.2310.98581.8782.2681360.8629.7050.99892.0292.4492125.9462.3640.799102.1012.5351798.5856.0770.989112.2232.6821764.3815.8290.944122.3092.7851828.3316.6850.976132.4832.9931700.7466.3780.953142.6793.2292057.6846.1890.916152.8853.4761929.1736.0100.986163.0143.6302201.4387.7010.952

图3栅藻自然延迟平均强度随栅藻浓度的变化
Fig3Scenedesmusnaturaldelayaverageintensityalongwiththechangeofalgalcellsconcentration
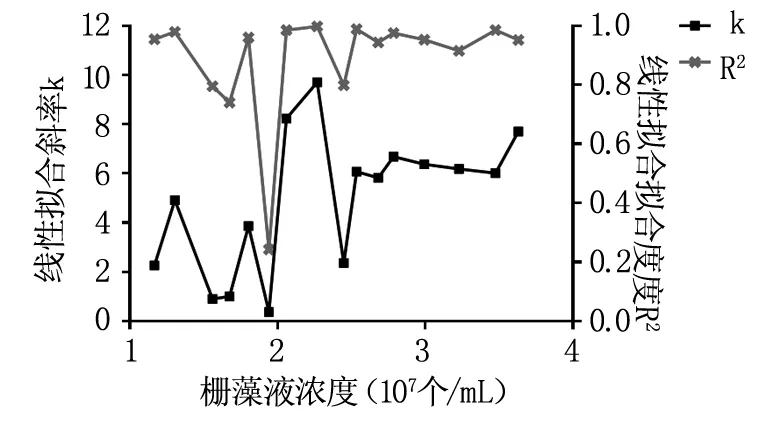
图4栅藻激发延迟斜率及拟合度随栅藻浓度的变化
Fig4Scenedesmusexcitationdelayslopeandfittingdegreealongwiththechangeofalgalcellsconcentration
3.2 栅藻生长阶段的优化
本研究测定了7个生长阶段的栅藻的自然延迟发光,并计算了其平均强度。见图5,生长70 d的栅藻自然延迟发光的平均强度较其他几组较低,且与生长21、30、51、60 d的栅藻自然延迟发光平均强度相比有统计学差异。除生长70 d的栅藻,其余各组两两比较均无显著性差异。

图5不同生长阶段栅藻自然延迟平均强度对比
Fig5Thecontrastofscenedesmusnaturaldelayaverageintensityindifferentgrowthstages
图6给出了7个生长阶段的栅藻7次激发延迟发光的平均强度对测量时间的线性拟合斜率k,可以看出,生长16~30 d的栅藻k值较高,且组间无显著性差异,生长40~70 d的栅藻k值较低,组间无显著性差异,生长16、21、30 d的任意一组栅藻与生长40、51、60、70 d的任意一组栅藻两两比较均有显著性差异。

图6不同生长阶段栅藻激发延迟k值对比
Fig6Thecontrastofscenedesmusexcitationdelaykvalueindifferentgrowthstages
生物光子辐射能够反映系统内部新陈代谢的状态,随着栅藻培养时间的延长,细胞的生命力减弱,表现为k值的降低。但考虑到栅藻的使用浓度较高时k值较为稳定,生长70 d的栅藻自然延迟平均强度较低,第七次激发延迟初始强度较高,故本研究选用栅藻使用的最佳生长阶段为40~60 d。
3.3 加入中药煎煮液的栅藻延迟发光测量
本研究选择了黄连、吴茱萸进行中药煎煮液延迟发光的初步研究。图7、图8分别给出了加入不同体积黄连、吴茱萸煎煮液的栅藻7次激发延迟发光平均强度对时间的线性拟合斜率k和拟合度R2,从图中可以看出,加药体积为20 μL时拟合度最高,加入黄连煎煮液的栅藻k值低于加入吴茱萸煎煮液的栅藻k值,加入20 μL的吴茱萸煎煮液的栅藻k值约为加入20 μL的黄连煎煮液的栅藻k值的3倍。本实验结果说明检测加入中药煎煮液的栅藻延迟发光时,中药煎煮液加入的最适体积为20 μL;栅藻对其所处的液体环境非常敏感,k值可反映栅藻所处液体环境的差异。

图7加入不同体积黄连煎煮液的栅藻激发延迟斜率和拟合度对比
Fig7ThecontrastofscenedesmusexcitationdelayslopeandfittingdegreeafteraddingdifferentvolumeofCoptidisrhizomadecoctionfluid

图8加入不同体积吴茱萸煎煮液的栅藻激发延迟斜率和拟合度对比
Fig8ThecontrastofscenedesmusexcitationdelayslopeandfittingdegreeafteraddingdifferentvolumeofEuodiaefructusdecoctionfluid
4 结论
本研究主要研究了栅藻的延迟发光,并对其使用条件进行优化,主要得到如下结论:
(1)通过检测不同浓度栅藻的延迟发光,我们发现,栅藻激发延迟发光的k值在2.5~3.5×107个/mL浓度范围内较稳定,为了减少误差,实验中我们选用同等浓度的栅藻,其浓度为3.0×107个/mL,即调节栅藻的吸光度为2.5。
(2)栅藻在不同的生长阶段,延迟发光会有所不同。通过对不同生长阶段栅藻自然延迟发光平均强度、第7次激发延迟发光的初始强度、7次激发延迟发光k值的综合分析,实验选用生长40~60 d栅藻。
(3)通过检测不同中药煎煮液对栅藻延迟发光的影响,我们选定中药煎煮液加入的最适体积为20 μL;同时,我们发现加入不同中药煎煮液的栅藻k值有较大差异。
韩金祥等[16-17]基于生物光子相干理论提出中药药性量子假说,提出机体电磁辐射(量子)可以表征中医之气,四气是调节机体电磁辐射量子叠加态的度量,通过检测不同药性中药生物光子辐射行为的差异,可从整体上获得表征中药药性的生物光子量化指标。本研究在优化栅藻使用条件的基础上,检测了加入不同中药煎煮液的栅藻激发延迟发光行为,发现其k值有较大差异。黄连和吴茱萸的寒热药性不同,加入栅藻中后,改变了栅藻所处的液体环境,从而改变了栅藻的生命状态,表现为其动力学行为的变化,而这种变化可由k值刻画。由此我们构想,用栅藻作为生物指示剂,检测其加入不同药性中药煎煮液后的延迟发光行为,其k值用于表征不同药性中药的差异。当然,这只是我们基于实验结果的猜想,还需要大量数据的验证,但这为中药药性的研究提供了新的方向。

