香辛料提取物对猪肉肌原纤维蛋白功能性质的影响
贾娜,王乐田,马露,王欢,邵俊花,宋立,刘登勇
(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)
香辛料提取物对猪肉肌原纤维蛋白功能性质的影响
贾娜*,王乐田,马露,王欢,邵俊花,宋立,刘登勇
(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)
摘要将迷迭香、肉桂和丁香提取物分别添加到猪肉糜中,4 ℃冷藏9 d,通过测定肌原纤维蛋白的溶解度、表面疏水性、乳化性、凝胶性和流变学特性,研究不同香辛料提取物对蛋白功能性质的影响。结果表明:冷藏时间增加,未添加香辛料对照组的溶解度逐渐降低,表面疏水性增加,乳化活性和乳化稳定性降低,凝胶强度和凝胶保水性降低,且形成凝胶网络能力降低。而不同香辛料提取物对肌原纤维蛋白功能特性的影响不同,总体来说,能够提高溶解度,降低表面疏水性增加的程度,较好地维持乳化活力和乳化稳定性,但提取物对蛋白凝胶特性无改善作用。因此,在肉制品加工过程中要考虑选用的香辛料及其使用量对产品功能性质的影响,避免对产品质构产生不利影响。
关键词香辛料;提取物;猪肉;肌原纤维蛋白;功能性质
肉及肉制品中含有丰富的蛋白质,其在加工、贮藏、销售过程中易被氧化,引起肉制品感官品质发生变化,影响其风味和口感。肌原纤维蛋白是肌肉中重要的盐溶性蛋白,其功能性质与肉制品硬度、黏弹性等感官和质构特性息息相关,也能影响肉制品的保水性、乳化性、产品风味和出品率等。肌原纤维蛋白氧化导致肽主链断裂,氨基酸残基侧链羰基化以及促使蛋白分子间相互交联[1],降低了肉制品品质和消费者可接受度。因此,添加抗氧化剂成为避免肉制品过分氧化的手段之一。
近年来,天然抗氧化剂以其安全、健康和环保的优势逐渐取代人工抗氧化剂在肉制品中的应用。研究表明,没食子酸、迷迭香、桂皮提取物、丁香提取物等物质对肉制品脂肪和蛋白氧化具有显著的抑制效果[2-4]。尽管香辛料提取物对蛋白氧化具有一定的抑制作用,但其对肌原纤维蛋白功能特性的影响仍不明确。故本实验将迷迭香、丁香、肉桂这3种常用香辛料的提取物添加至冷藏肉糜中,测定肌原纤维蛋白的溶解度、表面疏水性、乳化特性和凝胶特性等指标的变化,来研究香辛料提取物对肌原纤维蛋白功能特性的影响,从而为香辛料在肉制品中应用提供理论指导。
1材料与方法
1.1材料与试剂
猪背最长肌、肥膘,购于当地超市;迷迭香、丁香、肉桂,购于当地药房;丁基羟基茴香醚(BHA),购自于国药试剂公司。
MgCl2、NaH2PO4、乙二胺四乙酸二钠、三氯甲烷、甲醇、NaCl等试剂均为国产分析纯。
1.2仪器及设备
Allegra 64R冷冻离心机,美国Beckman公司;FE20 pH计,梅特勒-托利仪器(上海)有限公司;T25数显型均质机,德国IKA集团;UV2550紫外-可见光分光光度计,日本Shimadzu公司;FW-200高速万能粉碎机,北京中兴伟业仪器有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;TA-XT2i质构仪,英国Stable Micro Systems公司;Discovery DHR-1流变仪,美国TA公司。
1.3实验方法
1.3.1 香辛料提取物的制备
香辛料提取按照张慧芸[5]的方法。最终迷迭香、丁香和肉桂等香辛料的提取率分别是14.70%、13.56%和10.30%。香辛料提取物置于4 ℃冰箱中冷藏保存。
1.3.2肉糜的制备
基本配方为70%的猪背最长肌、10%的肥膘,18%水和2% NaCl。用绞肉机将猪肉绞碎后,按比例分为5个处理组,第1组为空白对照组,第2~4组分别含0.10%迷迭香、肉桂和丁香提取物,第5组含0.02%BHA。混匀后,将肉糜制成50 g重的肉饼,直径约7 cm,厚度约1 cm,每3个肉饼放入一个包装盒(CT盒)中,用保鲜膜封好,置于4 ℃冰箱冷藏,在第1,3,6和9天提取肌原纤维蛋白,测定各项指标。
1.3.3肌原纤维蛋白提取方法
肌原纤维蛋白提取按照Park[6]的方法进行。蛋白质浓度用双缩脲法测定,牛血清蛋白作为标准蛋白。
1.3.4蛋白质溶解性的测定
参照JOO等[7]的方法并略加修改。分别用pH值 7.0的10 mmol/L磷酸缓冲溶液配成10 mg/mL的蛋白质溶液,量取5 mL于15 mL离心管中,在4 ℃的冰箱放置2 h,在10 000 r/min下冷冻离心20 min。量取1 mL上清液,用双缩脲法测定蛋白质的浓度[公式(1)]。

(1)
1.3.5蛋白质表面疏水性的测定
参照Chelh[8]的方法,将2 mL 10 mg/mL肌纤维蛋白溶于pH值为7.0的 20 mmol/L磷酸缓冲溶液,使蛋白液浓度为5 mg/mL,取1 mL蛋白溶液加入200 μL的1 mg/mL溴酚蓝(BPB),混匀,室温下搅拌10 min,然后在6 000 r/min的条件下离心15 min,取上清液稀释10倍,在595 nm波长处测定吸光值,对照组为无蛋白溶液添加的磷酸盐缓冲溶液。表面疏水性可用公式(2)表示:
(2)
1.3.6蛋白质乳化活性和乳化稳定性的测定
将2 mL 10 mg/mL的肌原纤维蛋白溶解在18 mL 0.1 mol(pH 6.5)的磷酸缓冲溶液中,蛋白浓度配制成1 mg/mL,将2.0 mL大豆油和8.0 mL蛋白质溶液置于离心管中,用匀浆机高速8 000 r/min匀浆1 min,立即从距离离心管底0.5 cm的地方取匀浆液50 μL,加入到5 mL质量分数0.1%SDS溶液中,振荡混匀后用分光光度计在500 nm处测定吸光值记为A0;剩下的匀浆静置10 min再次在相同的位置取匀浆液50 uL,加入到5 mL 0.1% SDS溶液中,振荡混匀后用分光光度计在500 nm处测定吸光值记为A10,用0.1%SDS溶液为空白对照。肌原纤维蛋白匀浆液的乳化活力EAI(m2/g)和乳化稳定性ESI(%),分别由以下的公式来表示:
(3)
(4)
式中:A500,500 nm处的吸光值;φ:油相体积分数(φ=0.2);C:蛋白质量浓度(mg/mL);A0、A10为乳状液在0.10 min的吸光度值。
1.3.7凝胶特性的测定
1.3.7.1蛋白热诱导凝胶的制备
将肌原纤维蛋白用0.6 mol/L pH 6.0 NaCl配制成40 mg/mL的蛋白溶液,将溶液分装于密封的玻璃瓶中(25 mm×40 mm,Dia.×L),在水浴锅中由30 ℃加热至80 ℃,并在80 ℃下保持30 min,形成凝胶后取出,放在冰浴中冷却1 h,将所有的凝胶样品贮存在2~4 ℃的冰箱中备用。制备好的凝胶在每次分析前要放在室温下(25~27 ℃)放置30 min 。
1.3.7.2凝胶保水性的测定
采用SALVADOR[9]的方法测定凝胶保水性,并做适当修改。准确称取离心管的质量,记为m0,取一定质量凝胶(5~8 g)放入离心管底部,准确称取此时离心管的质量,记为m1。在4 ℃下3 000 r/min离心10 min,离心后小心用中性滤纸吸干离心管中凝胶析出的水分,再次准确称取离心管质量,记为m2。每组样品进行3次平行试验,取平均值。计算公式如下:
(5)
1.3.7.3凝胶强度的测定
用TA-XT2i型质构分析仪测定肌原纤维蛋白凝胶的质构特性。质构分析仪参数如下:测定模式选择下压距离,测试前速度为5mm/s,测试速度为2mm/s,测试后速度为2mm/s,下压距离为凝胶高度的4mm,引发力为5g,探头型号选择P/0.5。将待测样品置于测定平台上固定好,在室温下进行测定,每组样品进行3次平行试验,取平均值。
1.3.8动态流变测定
将样品均匀的涂抹在测试平台上,赶走气泡。测试参数设置为:频率0.1Hz,应变力为2%,上下板的夹缝为1mm,升温程序为30~80 ℃,升温速率为1 ℃/min。测试平板外蛋白与空气接触处,用盖板密封。每个处理组3个重复,测定流变储能模量G’的变化。
1.4统计分析
2结果与分析
2.1香辛料提取物对肌原纤维蛋白溶解度的影响
在肉制品加工中蛋白质溶解性具有重要的作用,如凝胶性、乳化性和保水性等功能性质只有在蛋白质处于高度溶解状态时才能表现出来[10]。由图1可知,随贮藏时间延长,各组肌原纤维蛋白的溶解度呈下降趋势(P<0.05),这主要是由于氧化导致蛋白质变性,促使分子间或分子内的巯基交联成二硫键,蛋白质之间发生聚集和沉淀[11]。贮藏第1天时,各组之间溶解度差异不显著(P>0.05);而到第3天时,迷迭香、丁香和BHA组的溶解度显著高于对照组(P<0.05),肉桂组也高于对照组,但差异不显著(P>0.05),有研究表明,迷迭香提取物可降低蛋白巯基的减少,抑制蛋白质的氧化速率[12],因而也改善了肌原纤维蛋白的溶解度;贮藏延至第6天时,肉桂处理组溶解度低于对照组,而其他各组仍高于对照组,但差异不显著(P>0.05);第9天时,迷迭香处理组的溶解度仍显著高于对照组(P<0.05),其他各组与对照组之间差异不显著(P>0.05)。总体来看,香辛料提取物对猪肉糜冷藏过程中蛋白质溶解度的下降具有一定的改善作用,其中迷迭香提取物的效果较为明显,有研究表明,3种香辛料中,迷迭香抑制脂肪氧化的效果最好[13],因此,迷迭香提取物可能是通过清除氧化自由基,降低脂肪和蛋白氧化程度,从而阻止了氧化导致的蛋白质分子之间的交联和聚集,增加了蛋白质的溶解度。

图1 香辛料提取物对肌原纤维蛋白溶解度的影响Fig.1 Effect ofspice extracts on the solubility of myofibrillar protein注:小写字母a~d为不同冷藏时间之间比较,大写字母A~D为不同处理组之间比较。图2~图5同。
2.2香辛料提取物对肌原纤维蛋白表面疏水性的影响
溴酚蓝可以与蛋白质的疏水性氨基酸残基相结合,通过测定溴酚蓝结合的量可以表示表面疏水性,结合量越大,则说明蛋白疏水性越强[14]。由图2可知,肌原纤维蛋白的表面疏水性随贮藏时间的延长而不断增加(P<0.05),说明在贮藏期间肌原纤维蛋白被氧化,致使蛋白质结构改变,埋藏于蛋白质内部的疏水基团暴露[15]。在贮藏前3 d,对照组的表面疏水性增加显著(P<0.05),而迷迭香、肉桂、丁香提取物和BHA处理组的表面疏水性与第1天相比,差异不显著(P>0.05),说明贮藏前期香辛料提取物与BHA对蛋白质氧化具有一定的抑制作用,降低了疏水基团的暴露程度。贮藏第6天和第9天时,香辛料提取物和BHA处理组的表面疏水性均低于对照组,一方面提取物和BHA可以通过抑制蛋白氧化的作用保护疏水基团,另一方面也可能通过与蛋白发生疏水相互作用而掩蔽了疏水基团。JONGBERG等研究了迷迭香对博洛尼亚香肠蛋白氧化的抑制作用,发现迷迭香能够显著抑制氧化产物羰基类化合物的生成,减少巯基间的氧化交联[16],从而保护了疏水基团,抑制表面疏水性的增加,这与本研究的结果相类似。但是,将绿原酸添加到肌原纤维蛋白中,表面疏水性增加,尤其是高浓度绿原酸作用更明显,说明促进了蛋白质结构的展开[17],而本研究所用香辛料降低了表面疏水性,可能是由于所用提取物为粗提物,其中含有的多种成分可能会与蛋白发生疏水结合,掩蔽了疏水基团。此外,疏水基团过多暴露,会引起溶解度的降低,而香辛料提取物和BHA能够降低疏水性,因此这一结果也与溶解度的提高相一致。
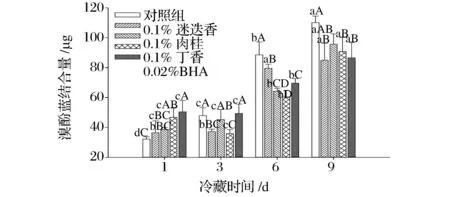
图2 香辛料提取物对肌原纤维蛋白表面疏水性的影响Fig.2 Effect ofspice extracts on surface hydrophobicity of myofibrillar protein
2.3香辛料提取物对肌原纤维蛋白乳化特性的影响
肌原纤维蛋白分子是两性分子,既有亲水基团又有疏水基团,既有亲油性又有亲水性,可降低水和油界面的表面张力,形成稳定的乳化体系[18]。乳化活力(EAI)和乳化稳定性(ESI)是衡量蛋白乳化性能的重要指标。图3是不同香辛料提取物和BHA对肌原纤维蛋白的EAI和ESI的影响。随冷藏时间的增加,各组蛋白质的EAI和ESI均显著下降(P<0.05),表明冷藏过程中的蛋白质被氧化严重影响肌原纤维蛋白的乳化能力。冷藏第1天,香辛料组和BHA组的EAI和ESI与对照差异均不显著(P>0.05),说明贮藏时间较短,蛋白氧化和变性程度较轻,对EAI和ESI的影响较小。第3天时,丁香和BHA组的EAI显著高于对照组(P<0.05),而迷迭香和肉桂提取物处理组EAI虽高于对照组,但差异不显著(P>0.05)。当贮藏至第6天时,丁香组的EAI仍显著高于对照组(P<0.05),说明丁香提取物对蛋白乳化能力具有一定促进作用。对于ESI,在第3天和第6天时,丁香也表现出较高的ESI。第9天时,香辛料组和BHA组的EAI和ESI与对照差异不显著(P>0.05),说明蛋白氧化严重,香辛料改善乳化能力的作用有限。KIOKIAS等[19]研究表明,黄酮类天然提取物对蛋白质氧化具有一定的抑制作用,其天然抗氧化物的存在有利于蛋白乳化能力的提高。从本实验来看,不同香辛料提取物改善蛋白乳化能力的效果不同。理论上来讲,乳化能力与溶解度呈正相关,但是迷迭香处理组的溶解度虽然较高,乳化能力却最差,这可能是由于迷迭香提取物降低疏水性的效果较好,因此界面吸附蛋白浓度较低,导致乳化能力较差。
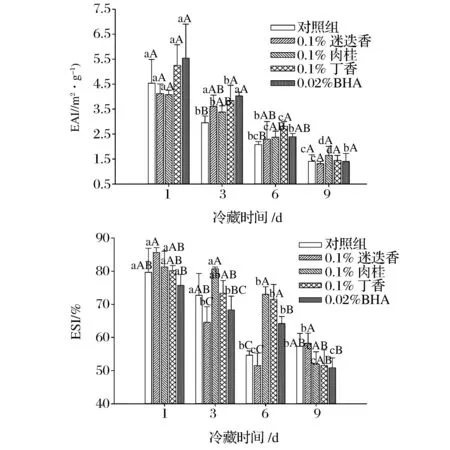
图3 香辛料提取物对肌原纤维蛋白乳化活性和乳化稳定性的影响Fig. 3 Effect ofspice extracts on the EAI and ESI of myofibrillar protein
2.4香辛料提取物对肌原纤维蛋白凝胶强度的影响
凝胶性是蛋白质最重要的功能特性之一,对肉制品尤其是肉糜类制品的食用品质具有重要影响。由图4可知,随着贮藏时间的延长,所有组的凝胶强度均呈现不同程度的降低。蛋白质凝胶的形成主要涉及到疏水作用力、氢键等物理作用力,此外巯基和二硫键的交换反应对凝胶形成也有贡献,而在冷藏过程中蛋白质氧化改变了原有蛋白结构,导致在凝胶网络结构形成过程中的各种作用力发生改变,降低了蛋白凝胶形成能力,产生了较弱的凝胶网络结构。从图4中还可以看出,第1天时,肉桂组和BHA组的凝胶强度显著高于对照组(P<0.05),而随着贮藏时间的延长,香辛料提取物对蛋白的凝胶强度不但没有改善作用,反而降低了凝胶强度。这可能有两方面的原因,一方面香辛料提取物能够起到抗氧化作用,从这一角度来看,可以提高蛋白的凝胶性,但是其添加量相对于BHA较多,另一方面可能会破坏肌原纤维蛋白之间的相互作用力,掩盖蛋白相互作用位点,从而促使蛋白凝胶强度下降,且下降程度较抗氧化提高的程度大。而BHA能够提高肌原纤维蛋白的凝胶强度,可能是因为BHA能够有效地抑制蛋白的氧化,并且BHA添加量较少,因此对蛋白结构影响较小。
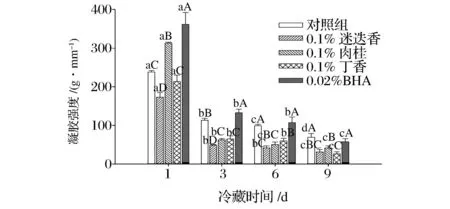
图4 香辛料提取物对肌原纤维蛋白凝胶强度的影响Fig.4 Effect ofspice extracts on strength of myofibrillar protein gel
刘文娟等[20]将胡柚皮粉添加到带鱼鱼糜中制备鱼糜凝胶,发现凝胶强度增加,原因为胡柚皮粉中的酚类物质可以与蛋白交联,利于凝胶网络结构的形成。这与本研究的结果不一致,可能是由于肉糜凝胶体系比纯蛋白凝胶体系更复杂,更利于凝胶的形成,并且不同来源提取物和不同蛋白之间的相互作用也不尽相同。JONGBERG[21]等将绿茶提取物添加到猪肉糜中,发现高浓度的提取物(0.15%)使肉糜的保水性降低,质构变差,主要是由于提取物中的酚类物质破坏了肉糜的乳化特性,而低浓度的提取物(0.01%、0.05%)则没有影响。本研究所用的提取物浓度为0.1%,因此,有可能是浓度过高破坏了蛋白之间的交联作用。PRODPRAN等[22]利用咖啡酸、儿茶素、阿魏酸和单宁酸与大眼鲷肌原纤维蛋白交联制备蛋白膜,发现所用酚类物质尤其是单宁酸与蛋白具有很好的交联能力,能够提高膜的机械性能,但是其在制备膜的过程中,将酚类物质氧化成醌,而醌类物质在碱性条件下能够与氨基酸反应,是良好的交联剂。
2.5香辛料提取物对肌原纤维蛋白凝胶保水性的影响

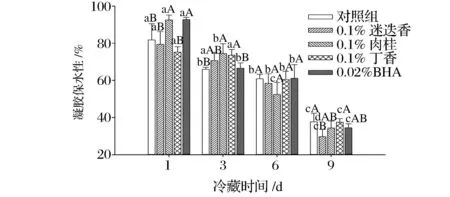
图5 香辛料提取物对肌原纤维蛋白凝胶保水性的影响Fig.5 Effect ofspice extracts on water-holding capacity of myofibrillar protein gel
2.6香辛料提取物对肌原纤维蛋白流变性质的影响
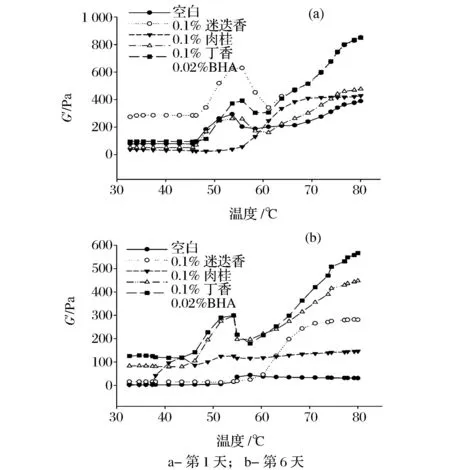
图6 香辛料提取物对肌原纤维蛋白流变特性的影响Fig.6 Effect of spice extracts on rheological properties of myofibrillar protein gel
肌原纤维蛋白质在加热形成凝胶时要经历变性、结构被打开、互相聚合的过程,最终形成凝胶的网络结构,是一个不稳定的动态流变过程[25]。由于第9天蛋白凝胶劣变严重,因此本实验对第1天和第6天蛋白的流变特性进行比较分析。如图6-a和6-b所示,整体来看,弹性模量G’随贮藏时间的增加呈下降趋势,其趋势与凝胶强度的结果相类似,说明蛋白被氧化变性,凝胶能力逐渐被减弱。由图6-a中空白对照组流变曲线可得,其在45~50 ℃有一次凝胶转变,在55~60 ℃间有微弱的第二次凝胶转变。第一次凝胶转变为肌球蛋白开始变性,内部疏水基团暴露,蛋白间疏水作用力增加,蛋白凝胶网络开始形成,G’开始升高,容易形成较硬的凝胶;随后其他蛋白变性,分子热运动加剧,流动性增强,G’下降[26]。由此可得,在第1天时,除肉桂外其他处理组蛋白质在45~60 ℃形成不可逆的相互作用,从而转变成凝胶。而肉桂在45~55 ℃时的G’变化平缓,而在55 ℃之后开始迅速上升,说明肉桂与蛋白质之间相互作用可能延缓了蛋白凝胶的速率,在较高温度下蛋白质分子间开始交联;而凝胶终点略高于空白对照,说明肉桂组最终也形成了较完整的凝胶结构,这与凝胶强度相一致。而贮藏第6天时,丁香和BHA添加组的凝胶流变弹性储能均高于其他处理组,经历了2次凝胶的转变过程,说明丁香与BHA对蛋白凝胶能力具有一定的促进作用。而在整个凝胶变温区间对照组和肉桂处理组的G’变化平缓,去典型的“几”字形曲线,说明随蛋白氧化加剧,蛋白凝胶能力不断的下降。CAO等[17]将绿原酸添加到肌原纤维蛋白中,检测其蛋白凝胶的流变特性,发现高浓度绿原酸破坏蛋白质结构,抑制其形成有序紧密的凝胶结构。
3结论
不同香辛料提取物对猪肉中肌原纤维蛋白功能性的影响不同。迷迭香提取物对溶解度具有促进作用;迷迭香、丁香和肉桂提取物对表面疏水性的提高具有较好的抑制作用;丁香提取物能有效提高蛋白乳化活性;而3种香辛料均降低了蛋白的凝胶特性。在今后的研究中,应进一步研究植物来源的提取物在肉制品加工过程中对蛋白的功能性有何影响,以及对蛋白的结构有何影响,蛋白结构的改变如何导致功能性的降低或提高。
参考文献
[1]PARK D,XIONG Y L. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2007, 103(2): 607-616.
[3]MOVILEANU L, D E GONZLEZM T N, BRIAN H B, et al. Comparison of Dried Plum Puree, Rosemary Extract, and BHA/BHT as Antioxidants in Irradiated Ground Beef Patties[J]. International Journal of Food Science, 2013(231), 2013: 1-7.
[4]SHAN B,CAI Y Z, BROOKS J D, CORKE H,et al.Antibacterial and antioxidant effects of five spice and herb extracts as natural preservatives of raw pork[J]. Journal of the Science of Food and Agriculture, 2009, 89(11): 1 879-1 885.
[5]张慧芸, 孔保华, 孙旭. 香辛料提取物抗氧化活性及其作用模式的研究[J]. 食品科学, 2010,31(5):111-115.
[6]PARK D,XIONG Y L, ALDERTONA L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food chemistry, 2007, 101(3): 1 239-1 246.
[7]JOO S T, KAUFFMAN R G, KIM B C, et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and water-holding capacity in porcine longissimus muscle[J]. Meat science, 1999, 52(3): 291-297.
[8]CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[9]SALVADOR P, TOLDRA M, SAGUER E, et al. Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J]. Food Hydrocolloids, 2009, 23(7): 1 654-1 659.
[11]SUN W, CUI C, ZHAO M, et al. Effects of composition and oxidation of proteins on their solubility, aggregation and proteolytic susceptibility during processing of Cantonese sausage[J]. Food Chemistry, 2011, 124(1): 336-341.
[12]NIETO G, JONGBERG S, ANDERSEN M L, et al. Thiol oxidation and protein cross-link formation during chill storage of pork patties added essential oil of oregano, rosemary, or garlic[J]. Meat Science, 2013, 95(2): 177-184.
[13]刘骞, 陈璐, 孔保华. 香辛料提取物对冷藏牛肉丸微生物变化和抗氧化效应的研究[J]. 食品科技, 2013,38(4):112-120.
[14]李艳青, 孔保华, 杨赫鸿, 等. 自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J]. 食品科学, 2012, 33(13):70-74.
[15]孔保华, 孙妍, 熊幼翎. 抗氧化剂对羟自由基引起的乳清分离蛋白氧化抑制效果的研究[J]. 食品科学, 2010,31(3): 5-10.
[16]JONGBERG S, T∅RNGREN M A, GUNVIG A, et al. Effect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J]. Meat Science, 2013, 93(3): 538-546.
[17]CAO Y, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180: 235-243.
[18]LIU Q, LU Y, HAN J,et al. Suructure-modification by moderate oxidation in hydroxyl radical-generating systems promote the emulsifying properties of soy protein isolate[J]. Food Structure, 20105,10(6):21-28.
[19]KIOKIAS, S. VARZAKAS,T.Activity of flavonoids and b-carotene during the auto-oxidative deterioration of model food oil-in water emulsions[J]. Food Chemistry, 2014, 150(5): 280-286.
[20]刘文娟, 木尼热, 吴春华,等. 胡柚皮粉对带鱼肌原纤维蛋白凝胶特性的影响[J]. 现代食品科技, 2015, 31(1):77-83.
[21]JONGBERG S, TERKELSEN L S, MIKLOS R, et al. Green tea extract impairs meat emulsion properties by disturbing protein disulfide cross-linking[J]. Meat Science, 2015, 100(2): 2-9.
[22]PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782.
[23]李明清, 孔保华, 王宇, 等. 菊粉对鲤鱼肌原纤维蛋白凝胶特性的影响[J]. 食品工业科技, 2010(10):105-108.
[24]李银, 李侠, 张春晖,等. 羟自由基导致肉类肌原纤维蛋白氧化和凝胶性降低[J]. 农业工程学报, 2013, 29(12):286-292.
[25]王鹏, 陈林, 孙健, 等. 钠替代条件下鸡胸腿肉肌原纤维蛋白热致凝胶性质的流变及拉曼光谱研究[J]. 食品科学, 2013,34(21):30-35.
[26]付湘晋, 许时婴, 王璋. 酸碱处理对鲢鱼肌原纤维蛋白热变性, 聚集, 胶凝性质的影响[J]. 食品科学, 2008, 29(6):100-103
Effect of spice extracts on functional properties of myofibrillar protein in minced pork
JIA Na*, WANG Le-tian, MA Lu, WANG Huan, SHAO Jun-hua, SONG Li, LIU Deng-yong
(College of Food Science and Technology, Bohai University; Food Safety Key Lab of Liaoning Province; National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products; Jinzhou 121013, China)
ABSTRACTRosemary, cinnamon and cloves extracts were added to minced pork at 4 ℃ for 9 days. The solubility, surface hydrophobicity, emulsifying, gel and rheological properties of myofibrillar protein were tested to find the effect of spice extracts on the functional properties of proteins. The results show that with the extension of the storage time, the control without spice extracts, had lower solubility and increased surface hydrophobicity; the emulsifying activity and emulsion stability, gel strength and water-holding capacity of the control were decreased. And its gel formation was more difficult. The minced pork with spice extracts had different effects: the solubility was increased and surface hydrophobicity increasing was reduced. The spice extracts had a positive effect on maintaining the emulsifying activity and emulsion stability, but not on gel properties. Therefore, the types and amounts of spices need to be considered during meat processing to avoid disadvantage effect on textural properties.
Key wordsspices; extracts; pork; myofibrillar protein; functional properties.
收稿日期:2015-06-19,改回日期:2015-07-14
基金项目:国家自然科学青年基金(31301509),辽宁省食品安全重点实验室开放课题(LNSAKF2013014)
DOI:10.13995/j.cnki.11-1802/ts.201602015
第一作者:博士,副教授(本文通讯作者,E-mail:jiana_2010@163.com)。

