基于iTRAQ标记结合IPA生物分析平台筛选异常黏液质型阳痿病证大鼠血清蛋白质组学研究*
马文静毛吾兰•买买提依明张盼盼斯依提•阿木提刘凤霞薛志琴蒋 萍阿莱•巴合提汗阿地力江•伊明**
1. 新疆医科大学中心实验室(乌鲁木齐 830011); 2. 新疆医科大学基础医学院生物学教研室; 3. 新疆医科大学基础医学院人体解剖教研室; 4. 新疆医科大学基础医学院生理学教研室
·论 著·
基于iTRAQ标记结合IPA生物分析平台筛选异常黏液质型阳痿病证大鼠血清蛋白质组学研究*
马文静1毛吾兰•买买提依明2张盼盼3斯依提•阿木提3刘凤霞3薛志琴3蒋 萍4阿莱•巴合提汗3阿地力江•伊明3**
1. 新疆医科大学中心实验室(乌鲁木齐 830011); 2. 新疆医科大学基础医学院生物学教研室; 3. 新疆医科大学基础医学院人体解剖教研室; 4. 新疆医科大学基础医学院生理学教研室
目的 应用 iTRAQ 标记技术结合IPA生物分析平台,筛选异常黏液质型阳痿病证特异性差异表达蛋白候选标志物,并探讨其分子机制。方法 建立异常黏液质证候模型,并筛选阳痿病证模型后,分为正常组(N)、证候组(B1)和病证组(A1)共3组(n=10),分离血清, 进行iTRAQ标记结合LC-MS-MS蛋白质组学分析,应用IPA在线生物平台对异常黏液质型阳痿病证组大鼠血清差异表达蛋白进行蛋白质调控网络分析、生物功能分析、典型通路分析和生物标志物筛查分析。结果 通过蛋白质组学技术获得61种异常黏液质型阳痿病证血清差异蛋白,IPA 分析结果为,候选差异表达蛋白质中6种与血管内皮功能相关;3 种与平滑肌活动相关;10种与炎症相关。参与的主要生物学过程为损伤反应、炎症反应和防御反应等,涉及的主要通路为LXR/RXR通路和FXR/RXR通路等,并获得与勃起功能障碍疾病相关的标志物4个,分别是C反应蛋白、血管紧张素原、T-激肽原1以及β-2-糖蛋白1。结论 炎症和血管内皮功能改变可能在该病证发生发展中发挥着关键性作用, 上述4种蛋白可能可以作为异常黏液质型阳痿病证大鼠与勃起功能障碍疾病相关的血清候选差异蛋白。
异常黏液质; 阳萎; IPA 生物信息学分析; 血清生物标志物
阴茎勃起作为一种正常的生理反应,是在内外信息刺激下,由多种生物活性因子综合调节的神经-血管性生物活动。勃起功能障碍(erectile dysfunction,ED),指男子阴茎不能勃起或不能维持足够勃起而完成满意性生活的病症,并可伴发早泄,在传统医学中又称阳痿, ED发生的具体机制可因内分泌、神经、血管、营养和环境等各种内外因素,或(和)全身性疾病与局部阴茎疾病影响阴茎勃起相关环节而发生。
维吾尔医学(维医)是祖国传统医学中一颗靓丽瑰宝,在长年的维医临床实践中,对生殖疾病表现出极大的优势,并以临床疗效著称。本研究以阳痿维医临床4种证型中发病率最高的异常黏液质型阳痿为切入点,再依据维医理论,“病因”造模理念指导下,建立异常黏液质型阳痿病证动物模型基础上,应用蛋白质组学中的iTRAQ 标记技术,对该病证模型大鼠血清特异性差异表达蛋白标志物进行了鉴定与筛选,并结合IPA(Ingenuity PathwayAnalysis)生物分析平台分析了该病证发生和发病机理,寻找疾病候选蛋白,开展蛋白质调控网络分析、生物功能分析、典型通路分析和生物标志物筛查分析。为建立该病证特异性血清蛋白标志物体系,开展阴茎勃起功能相关的蛋白及信号转导调控网络研究奠定了基础,具体报道如下。
材料与方法
一、实验动物
随机选取具有正常性功能的雄性 Sprague-Dawley(SD)大鼠70只(由交配实验和阴茎勃起实验证实),体质量(195±16)g;雌性大鼠20只,由新疆医科大学实验动物中心提供。
二、实验试剂与材料
湿寒性饲料(新疆医科大学实验动物中心制备);阿扑吗啡(Apomorphine,APO,美国Sigma公司);黄体酮(浙江仙琚制药股份有限公司,批号:I20804);雌二醇(宁波市三生药业有限公司,批号:B130613);戊巴比妥钠;尿素购自于GibcoBRL公司;乙二胺四乙酸(EDTA)、PMSF、过硫酸胺和考马斯亮蓝染料 G250均为Amesco公司产品;二硫素糖醇(DTT)和碘乙酰胺(IAM)购自于Promega 公司;丙烯酰胺、SDS、N,N,N’,N-四甲基乙烯二胺(TEMED)和溴酚蓝购自SIGMA 公司;乙醇、乙酸和甲酸购自北京化工厂;乙腈和甲醇购自 Fisher Scientifc公司;iTRAQ®Reagent-8Plex Multiplex Kit购自于 Biosystem公司;strata-X C18 除盐柱和SCX 强阳离子交换柱购自于phenomenex公司。
三、实验仪器及分析软件
BIC-400 型人工气候箱(上海博迅实业有限公司医疗设备厂);BS-1105型电子天平(北京赛多科斯天平有限公司);DHG-9245A型电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);岛津常规液相;戴安纳升液相;Q-Exactive 质谱仪(Thermo fisher);UMAX Powerlook 2100XL-USB 扫描仪;IKA 振荡器;Tanon 电泳槽;DYY-7C 型电泳仪(北京六一仪器厂);恒温加热块(鼎国昌盛生物技术有限公司);离心机(eppendorf centrifuge 5417R型); LX-100 手掌式离心机(其林贝尔仪器);电热恒温水浴锅(长安科学仪器) ;数据采集软件:Thermofisher Proteome Discoverer 1.3 ;Mascot 软件版本:2.3.0; IPA 在线生物信息软件平台(Ingenuity Systems公司)。
四、实验方法
(一)实验动物分组
将田口法正交应用于五阶恒流快速充电方法中,进行电池充放电实验,测量充电时间和充电容量的百分比将其作为模糊控制器的输入量,从而提高充电效率。
取70只雄性SD大鼠,适应性饲养 1 周,自由饮水、进食,12/12 h 昼夜交替饲养,饲养环境温度(20±2)℃、湿度40%~60%,并对大鼠生物学表征进行动态观察和记录,一周后行交配实验和APO实验证实具有正常的性功能后,从中随机挑选出10只为正常对照组(N),余60只为造模组,并开始造模。
(二)异常黏液质证与阳痿病证大鼠模型的建立
以“湿寒性环境+湿寒性饲料”符合干预方法建立异常黏液质证候模型,并从中筛选ED模型后分组为病证组(A1)和病证药物干预组(A3),未成ED者分为证候组(B1)和证候药物干预组(B3),并设立正常对照组,经维药伊木萨克片口服干预2周后取材(其中证候药物干预组和病证药物干预组用于其他实验) ,具体方法见文献[1,2]。
(三)取材
实验终结时,用1%戊巴比妥钠腹腔注射(50mg/ kg)麻醉,快速从腹主动脉取血,置于4℃环境30min后,在4℃离心机离心(1000~1400×g)15min获取血清,分装后冻存于-80℃冰箱备用。
(四)低丰度蛋白样品的制备和血清蛋白质组学分析
各组大鼠分别取10份血清样本,进行等体积混样制备N组、B1组和A1组大鼠血清样品,每组体积为1000μL,利用低丰度蛋白富集试剂盒(多肽配体亲和层析柱)特异性吸附并制备血清低丰度蛋白组,测定总蛋白含量。每组样品取 50μg 蛋白体积,并用胰蛋白酶酶解得到相应各组肽段,按照说明书操作及标记消化后的各组肽段,对照组和造模组样品分别加入iTRAQ 113、114和115试剂进行标记。标记结束后,用HPLC强阳离子交换柱进行分离分级,收集穿流以及洗脱部分合并,之后予C18 反相色谱除盐,除盐后的肽段经Q-Exactive 质谱仪进行质谱分析。Q-Exactive 质谱仪检测肽段信号,参数为离子模式为阳离子模式,毛细管温度为320℃,检测方式为正离子。质谱扫描完毕,将质谱图输入到 PD(Proteome discoverer 1.3,thermo)软件,PD 提取后的谱图用mascot 进行搜索,PD 软件根据 mascot 搜索结果和第一步筛选后的谱图进行定量分析,最终得到经鉴定的蛋白数量及种类。
(五)差异蛋白的IPA 生物信息学分析
在 iTRAQ标记技术结合LC-MS-MS基础上,结合维医理论筛选出异常黏液质型阳痿病证组大鼠模型血清差异候选蛋白,通过IPA 在线生物信息学分析平台对获得的差异候选蛋白进行调控网络分析(Networks analysis)、生物功能分析(Biofuction analysis)、 典型通路分析(Canonical pathways)和IPA生物标志物筛查分析(IPA-biomarker~Filter),并进一步探讨其可能的作用网络与候选生物标志物。
结 果
一、iTRAQ技术鉴定血清蛋白结果
经iTRAQ标记技术结合LC-MS-MS,结合维医理论,筛选出异常黏液质型阳痿病证差异候选血清蛋白为血管紧张素原、T-激肽原1、T-激肽原2、心房利钠肽受体2、β-2-糖蛋白1、黏着斑蛋白、铜转运ATP酶1、血小板-白细胞C激酶底物、 突触小泡磷酸酶-2、α-1-酸性糖蛋白、α-1-抗蛋白酶、丝氨酸蛋白酶抑制剂A3N、α-1-3抑制剂、C反应蛋白、肌红蛋白-1、蛋白质UNC-13同源D等61种蛋白,其中上调表达蛋白40种,下调表达蛋白21种。
二、IPA生物信息学分析结果
(一)差异蛋白调控网络分析
结果显示,该病证大鼠模型血清中的差异蛋白集中参与的相互作用功能子网络主要集中在(1)细胞装配和形成、组织发育、细胞与细胞的信号传导和相互作用;(2)心血管系统发育和功能、器官形态、细胞间信号和互动;(3) 细胞死亡和生存、DNA复制和重组与修复、细胞形态;(4)癌症、血液疾病、免疫疾病等4个功能模块,见表1。
(二)生物功能分析
1. 蛋白质功能注释:结果显示,差异表达蛋白质中与血管内皮相关蛋白质为血管紧张素原、T-激肽原1、T - 激肽原2、心房利钠肽受体2、β-2-糖蛋白1和黏着斑蛋白等6 种;与平滑肌活动相关蛋白质为铜转运ATP酶1、β-2-糖蛋白1和心房利钠肽受体2等 3 种;与脂质代谢相关蛋白质为血管紧张素原、 β-2-糖蛋白1、 血小板-白细胞C激酶底物和突触小泡磷酸酶-2 等4种,与炎症相关蛋白质有T-激肽原1、 α-1-酸性糖蛋白、α-1-抗蛋白酶、T - 激肽原2、丝氨酸蛋白酶抑制剂A3N、血清铁传递蛋白、α-1-3抑制剂、C反应蛋白、肌红蛋白-1和蛋白质UNC-13同源D等 10种。
2. 生物学过程分布:结果显示,该病证大鼠模型血清中的差异蛋白主要参与了损伤反应、急性期和炎症反应、防御反应、蛋白质复合物合成以及血液循环等过程。图1只列出前l0位主要涉及的生物学过程。
3. 分子功能分析:结果显示,上述候选蛋白质主要发挥肽酶抑制剂活化、氧气结合、运输、肌动蛋白质结合以及有机酸结合等功能。图2只列出前l0位主要涉及的分子功能。
(三)典型通路分析
结果显示,上述差异表达的蛋白主要涉及的信号通路为急性炎症反应通路、LXR/RXR通路、FXR/ RXR通路、上皮黏着连接通路、生殖细胞-睾丸支持细胞连接信号通路、肝纤维化/肝星状细胞活化通路、14-3-3 介导的信号传导、凝血系统通路及吞噬体成熟通路。图3只列出主要涉及的前l0位通路。

表1 异常黏型阳痿病证大鼠模型血清中差异蛋白涉及的4个功能模块
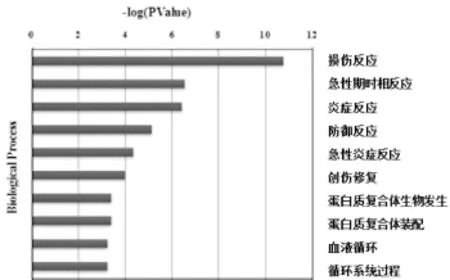
图1 血清差异表达蛋白质生物学过程分布
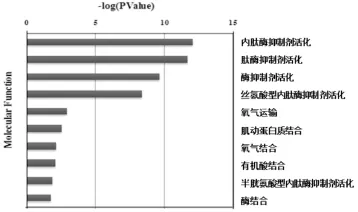
图2 血清差异表达蛋白质分子功能分布
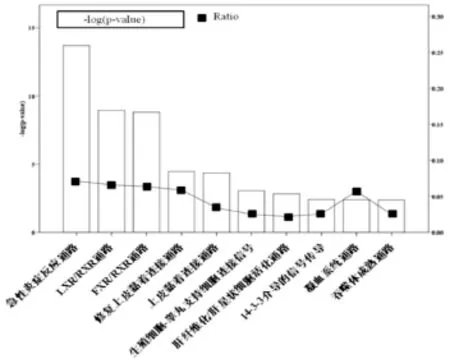
图3 血清差异表达蛋白质信号通路分布
(四)生物标志物的筛选分析
1. 蛋白标志物筛选:结果显示,上述差异表达的候选血清蛋白标志物,经IPA疾病标志物分析模块分析,其中C反应蛋白(CRP)、血管紧张素原(AGT)、T-激肽原1(MAP1)和 β-2-糖蛋白1(β2GP1)属于ED血清蛋白标志物 (表2)。
2. 生物标志物的相互作用网络:对通过IPA疾病库获得的与ED相关4种蛋白构建了相互作用网络图(图4),结果显示,上述4种蛋白质存在直接或间接的相互作用关系,其中IL-6间接的影响了这4个蛋白表达, 4个差异蛋白均呈现上调表达趋势。网络中的红色点为实验数据中的上调差异表达蛋白,实线表示直接信号通路,虚线表示间接信号通路。
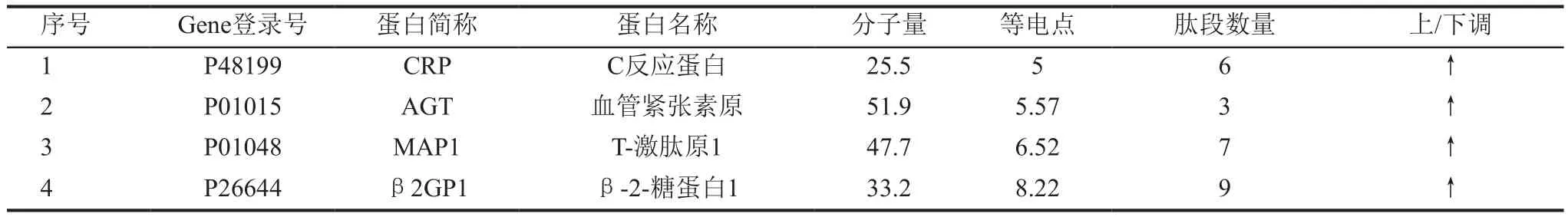
表2 异常黏液质型阳痿病证大鼠血清中ED生物标志物的IPA筛选分析
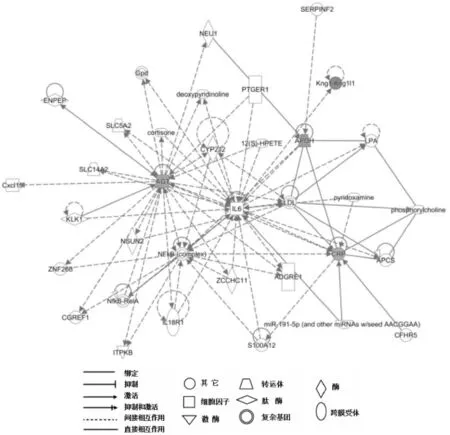
图4 勃起功能障碍候选蛋白质标志物相互作用网络
讨 论
维吾尔医学(维医)作为祖国传统医学宝库中的重要成员,经历史积淀,形成了其独特的诊疗体系,对阳痿、早泄和少弱精子症等生殖类疾病表现出极大的疗效优势。前期工作中,本研究团队在成功建立异常黏液质型阳痿病证大鼠模型的基础上,结合对应药物干预开展了其生殖生物学基础研究,从神经内分泌免疫网络(NEI)与阴茎勃起相关传导通路方面初步揭示了该病证的科学内涵与对应药物的作用机制。但异常黏液质型阳痿作为全身性疾病,远未能揭开其发生发展规律,阐明其核心机制,需进一步深入研究。蛋白质组学的出现与发展为该领域的研究提供了新的途径,使疾病的研究思路和方法从个别或单一基因表达调控差异研究层次发生了跳跃,转入更高层次,使我们从整体水平层次上对机体与环境之间的相互影响开展研究,并做出全面而系统评价成为可能。维医辨证分型的起点和核心是维医“体液论”,其出发点是人体内在体液动态变化的外在表现,而维医药学所推崇的辨证施治也是依据个体的整体水平上发生的体液表型差异,这与系统生物学整体研究思路也不谋而合。
本研究中,本团队通过同位素标记相对和绝对定量(iTRAQ)技术结合LC-MS-MS研究了异常黏液质型阳痿病证,并获得大鼠血清候选差异蛋白61种,其中上调表达蛋白40种,下调表达蛋白21种。通过IPA的蛋白质功能注释,发现其中有6种蛋白质与血管内皮功能相关,3种蛋白质与平滑肌功能相关,提示,该病证发生发展过程当中血管内皮功能和平滑肌功能改变发挥着关键性作用,更可能是其核心病理机制,这一点与以往的研究报道[3-5]相吻合。同时有10种蛋白质与炎症相关,其中T-激肽原1,α-1-酸性糖蛋白和C反应蛋白均属于急性时相期蛋白;生物功能分析结果表明,该病证差异蛋白的生物功能主要集中在损伤反应、炎症反应、防御反应等,提示,该病证的发生发展中炎症可能发挥着重要作用。典型通路分析结果表明,差异蛋白主要涉及LXR/RXR通路和FXR/ RXR通路,结合文献[6,7]研究发现,上述通路与炎症和脂质代谢、糖代谢密切相关。结合我们以往的研究结果[8-10],我们认为该病证发生发展可能与慢性炎症引发的NEI紊乱和代谢功能改变有关,并可进一步影响血管内皮功能,但尚需进一步验证,尤其是需要结合本研究差异蛋白调控网络分析的结果,就其具体机制进行进一步探索。
本研究中,在筛查出的差异蛋白质中,经IPA进一步筛查,得出CRP、AGT、MAP1和β2GP1 4种蛋白是ED血清标志物,其中CRP是体内重要的促炎症细胞因子,能使内皮细胞及血管平滑肌细胞等一氧化氮(NO)表达及分泌降低,内皮素-1(ET-1)表达和分泌增加。另有学者报道[11,12],ED患者较高的CRP水平可通过下调 eNOS的表达,促使内皮细胞凋亡,减弱血管内皮损伤后的内皮细胞再生,影响血管内皮功能。AGT在肾素的作用下可以产生血管紧张素Ⅰ、Ⅱ、Ⅲ和Ⅳ,其中血管紧张素Ⅱ具有强烈的缩血管的作用,调节阴茎勃起功能[13]。有研究报道[14],血管紧张素Ⅱ主要分布在阴茎海绵体血管内皮细胞的内层及平滑肌束中,器质性 ED患者的海绵体局部和外周血液中Ang-Ⅱ浓度均显著增高。激肽原属于激肽释放酶-激肽系统(KKS),是生物体内重要的炎性调节系统,参与心血管、肾和中枢神经系统等各组织器官的炎症过程,分为高分子量(HMW)、低分子量(LMW)、T-激肽原1(MAP1)和T-激肽原2(MAP2)[15]。 激肽原作为作为活性肽和缓激肽的前体,可影响平滑肌收缩,诱导低血压和血管通透性增加。体外实验证实[16],KKS系统的活性成分可以舒张人阴茎海绵体,但其是否存在于生理状态下的阴茎海绵体组织中尚未见报道。β2GP1 作为一种生理性蛋白在糖尿病、动脉粥样硬化及血管新生过程中发挥着重要作用,其中β2GP1与血小板之间的关系研究较多,有报道[17]称,内皮细胞的损伤使血小板活化后,释放的炎症递质及细胞因子可诱导并促进动脉粥样硬化的发生、发展,进而促使ED发生,并认为血小板及其相关功能指标也作为 ED诊疗中的一类重要指标。本研究结果显示,CRP、AGT、MAP1和β2GP1 4种蛋白作为异常黏液质型阳痿病证大鼠血清候选标志物,均显著上调,且在IPA分析中显示它们是ED血清标志物,结合以往的研究,我们认为,其可能直接或间接参与了该病证的发生发展过程,并可作为异常黏液质型阳痿病证重要的血清标志物之一。
综上所述,本研究基于生物信息学IPA平台对iTRAQ技术结合LC-MS-MS获得的蛋白质组学数据进行进一步挖掘与分析,我们认为异常黏液质型阳痿病证属于全身性疾病,炎症-NEI紊乱和代谢功能改变在其发生发展中可能发挥着关键性的作用,在候选指标中,可在将CRP、AGT、MAP1和Β2GP1作为异常黏液质型阳痿病证血清标志物基础上,进一步对其它候选蛋白标志物进行验证后,确定其他蛋白标志物,并建立相应体系,为进一步开展功能网络调控研究,以揭示该病证的发生发展规律,并为基于标志物基础上的临床基础研究和药物筛选奠定基础。
1 阿地力江•伊明, 潘建春, 哈木拉提•吾甫尔, 等. 几种不同方法建立维医异常黏液质阳痿病证模型的研究. 新疆医科大学学报 2010; 33(11): 1275-1280
2 阿地力江•伊明, 范强, 潘建春, 等. 维医异常黏液质阳痿病证动物模型的建立. 中国男科学杂志 2011; 25(9): 3-9
3 任黎刚, 李铮. 保护阴茎血管内皮功能:勃起功能障碍治疗新途径. 中华男科学杂志 2011; 17(2): 160-164
4 Blick C, Ritchie RW, Sullivan ME. Is erectile dysfunction an example of abnormal endothelial function?. Curr Vasc Pharmacol 2016; 14(2): 163-167
5 刘本春, 林桂亭, 辛钟成. 阴茎海绵体平滑肌收缩的分子机理研究进展. 中国男科学杂志 2006; 20(9): 52-55, 58
6 Tang H, Mirshahidi S, Senthil M, et al. Down-regulation of LXR/RXR activation and negative acute phase response pathways in colon adenocarcinoma revealed by proteomics and bioinformatics analysis. Cancer Biomark 2014; 14(5): 313-324
7 Vavassori P, Mencarelli A, Renga B, et al. The bile acid receptor FXR is a modulator of intestinal innate immunity. J Immunol 2009; 183(10): 6251-6261
8 阿地力江•伊明, 张盼盼, 阿丽艳•阿合麦提, 等. 糖尿病对大鼠阴茎组织中eNOS和nNOS的影响及胰岛素的治疗作用. 新疆医科大学学报 2008; 31(8): 923-927
9 阿地力江•伊明, 潘建春, 哈木拉提•吾甫尔, 等. 维医异常黏液质证侯与阳痿病证大鼠模型生殖激素的改变及其生物学意义. 新疆医科大学学报 2012; 35(11): 20-23
10 顾亚楠, 沙地克•沙吾提, 阿地力江•伊明. 半去势雄性大鼠外周血中睾酮代偿性变化的研究. 新疆医科大学学报 2010; 33(11): 1280-1282
11 Shwartz R, Osborne-Lawrence S, Hahner L, et al. C-reactive protein downregulates endothelial NO synthase and attenuates reendothelialization in vivo in Mice. Circ Res 2007; 100(10): 1452-1459
12 Arrabal-Polo MÁ, Arias-Santiago S, López-Carmona Pintado F, et al. Metabolic syndrome, hormone levels, and inflammation in patients with erectile dysfunction. Sci World J 2012; 2012: 272769
13 Maas R, Schwedhelm E, Albsmeier J, et al. The pathophysiology of erectile dysfunction related to endothelial dysfunction and mediators of vascular function. Vasc Med 2002; 7(3): 213-225
14 Becker AJ, Uckert S,Stief CG, et al. Possible role of bradykinin and angiotensin II in the regulation of penile erection and detumescence. Urology 2001; 57(1): 193-198
15 Joe B, Nagaraju A, Gowda LR, et al. Mass-spectrometric identification of T-Kininogen I/Thiostatin as an acutephase infammatory protein suppressed by curcumin and capsaicin. PLoS One 2014; 9(10): e107565
16 Teixeira CE, Moreno RA, Ferreira U, et al. Pharmacological characterization of kinin-induced relaxation of human corpus cavernosum. Br J Urol 1998;81(3):432-436.
17 姜睿, 龙皓. 血小板与阴茎勃起功能障碍. 中华男科学杂志 2015; 21(9): 771-774
(2016-10-08收稿)
Serum proteomics analysis of abnormal phlegmatic rats model with impotence disease using iTRAQ and IPA bioanalysis platform*
Ma Wenjing1, Maowulan Maimaiti2, Zhang Panpan3, Siyiti Amuti3, Liu Fengxia3, Xue Zhiqin3, Jiang Ping4, Alai Bahetihan3, Adilijiang Yiming3**
1. Central Laboratory, Xinjiang Medical University, Urumqi 830011, China; 2. Department of Biology, College of Basic Medicine, Xinjiang Medical University; 3. Department of HumanAnatomy, College of Basic Medicine, Xinjiang Medical University; 4. Department of PhysiologyCollege of Basic Medicine, Xinjiang Medical University Corresponding author: Adilijiang Yiming, E-mail: adljym@163.com
Objective To screen the candidate serum biomarkers for abnormal phlegmatic syndrome with impotence disease using iTRAQ and IPA bioanalysis platform, and explore its molecular mechanism. Methods Rats with abnormal phlegmatic syndrome model were established, and abnormal phlegmatic syndrome rats model with impotence were selected and divided into three groups: the control group(N), phlegmatic syndrome model group(B1) and phlegmatic syndrome model group with impotence (A1) (n=10). Serum proteomics of these rats among three groups were comparatively analyzed by iTRAQ labeling combined with LC-MS-MS. Differentially expressed serum proteins were further analyzed by IPA online bioinformatics software,including networks analysis, biofunction Analysis, canonical Pathways and IPA Biomarker~Filter analysis. Results Total of 61 differentially expressed serum proteins were identifed by iTRAQ. IPA bioanalysis showedthat 6 different proteins were associated with vascular endothelial function, 3 proteins of smooth muscle activity,10 proteins associated with infammation. The main biological processes of differential proteins were injury, infammation reaction and defense response. The pathways involved in LXR/RXR activation and FXR/RXR activation. Four candidate biomarkers associated with Erectile Dysfunction disease were found, including C-reactive protein, Angiotensinogen, T-kininogen-1 and β-2-glycoprotein 1. Conclusion Infammation and vascular endothelial function may play a key role in the development of this disease, four proteins can be used as candidate proteins related to abnormal phlegmatic with impotence disease.
Abnormal phlegmatic syndrome; Impotence; IPA@bioinformatics analysis; biological markers
10.3969/j.issn.1008-0848.2016.12.001
R 698.1
资助:国家自然科学基金项目(81260581)**
,E-mail: adljym@163.com

