TMPRSS2-ERG融合基因在国人前列腺癌组织中的表达及其临床意义
陶 晶张豪杰肖 立盛 璐钱伟庆孙忠全
1. 华东医院泌尿外科(上海 200040); 2. 华东医院病理科
TMPRSS2-ERG融合基因在国人前列腺癌组织中的表达及其临床意义
陶 晶1张豪杰1肖 立2盛 璐1钱伟庆1孙忠全1
1. 华东医院泌尿外科(上海 200040); 2. 华东医院病理科
目的 探讨TMPRSS2-ERG融合基因在中国人群前列腺癌中的发生率以及其临床病理特征和对内分泌治疗的预后价值。方法 收集2010年10月到2014年12月前列腺癌穿刺活检标本96例及病例临床病理资料。所有患者均接受内分泌治疗。利用荧光原位杂交技术检测标本中TMPRRS2-ERG融合基因。比较融合基因阳性和阴性患者的临床病理资料分布及预后差异。结果 患者年龄范围为51~93岁,中位年龄为77岁;PSA范围为5.0-5000.0ng/ mL。Gleason评分<7分的有6例(6.3%),Gleason评分=7分的有38例(39.6%),Gleason评分>7分的有52例(54.2%)。临床分期T1-T2有32例,T3-T4有64例;M0为35例,M1为61例。穿刺标本TMPRSS2-ERG阳性有19例(19.8%)。缺失型重排有11例,易位型重排亦有11例,同时含有缺失型和易位型重排患者共3例。融合基因阳性和阴性患者在年龄、PSA、Gleason评分、主要Gleason分级、T分期及M分期的临床分布及内分泌治疗预后方面差异均不具有统计学意义(P>0.05)。结论 中国人群的前列腺癌TMPRSS2-ERG融合基因的发生率与日韩等亚洲国家人群基本一致,约为20%,远低于欧美人群。TMPRSS2-ERG融合基因阳性和阴性患者的年龄、治疗前PSA水平、Gleason评分、主要Gleason分级以及临床分期的分布不存在差异,同时其对内分泌治疗患者的预后不具备预测价值。
前列腺肿瘤; 融合基因; 内分泌疗法; 预后
前列腺癌是男性常见的恶性肿瘤,据统计,前列腺癌的肿瘤发病率在世界范围内位居第二位,其中在欧美国家高居第一位[1]。近年来我国前列腺癌发病率明显呈现上升趋势,在北京、上海、广州三城市均已超过男性膀胱癌的发病率,居男性泌尿生殖系肿瘤发病率第一位[2]。自2005年Tomlin等首次报道前列腺癌的跨膜丝氨酸蛋白酶编码基因TMPRSS2(transmembrane protease serine 2)与ETS转录因子家族成员ERG、ETV1之间发生融合后,国内外对融合基因及其蛋白表达在前列腺癌发病机制、检测、诊断及预后判断等方面做出了广泛的研究,但目前其预后价值仍存在争议。本文利用FISH检测96例前列腺癌穿刺标本中的TMPRSS2-ERG融合基因,并对其与前列腺癌临床病理资料及治疗预后的关系进行分析。
材料和方法
一、临床资料
收集2010年10月到2014年12月于复旦大学附属华东医院行超声引导下经会阴前列腺穿刺确诊的前列腺癌标本96例。所有患者均行6~14针穿刺,并接受MAB治疗,其中34例接受手术去势,62例接受LHRHa治疗。所有穿刺标本均根据标准步骤制备石蜡切片,并由两位资深病理科医师独立进行阅片,均使用Gleason评分系统分级,同时按照2002年AJCC的TNM分期系统进行临床分期。要求患者治疗后的前6个月每个月复查一次PSA,此后每3个月进行PSA等相关检查。随访终点为病情进展成去势抵抗性前列腺癌(castrateresistant prostate cancer, CPRC):(1)血清睾酮达到去势水平(<50ng/dL);(2)连续3次PSA较最低值升高超过50%,且PSA值>2ng/dL。
二、试剂和方法
荧光原位杂交(FISH)所用两种探针分别为RP11-476D17(5’ERG:标记为红色)和RP11-95I21(3’ERG:标记为绿色)(购自北京金菩嘉医疗科技有限公司)。石蜡切片经脱蜡水化,200μL蛋白酶K消化液(20 mg/mL)38℃消化4 min,后经2×SSC溶液漂洗,再于l%甲醛溶液中固定并再脱水后,滴加10μL探针混合液,经87℃变性15 min后,放入湿盒42℃杂交16h,再次经冲洗脱水并暗处干燥后,用15μL的4,6-联脒-2一苯基吲哚二盐酸盐(4’,6’-diamidino•2-phenylindole dihydrochloride,DAPI)复染,复染剂滴加于杂交区域,盖上盖玻片。最后在OLYMPUS BX51荧光显微镜下进行观察。
三、FISH结果判读
TMPRSS2和ERG基因都位于22号染色体,因此TMPRSS2-ERG融合可有易位型(translocation)和缺失型(deletion)两种形式。缺失型由于两个基因组间的区域遗失,而易位型则通过复杂的染色体间的基因重排。正常信号为两黄色信号点(2Y);易位型:一黄一绿一红(1Y1G1R),且红绿分开至少两个信号点;缺失型:一黄一绿(1Y1G);其中若一黄信号同时伴有两个或两个以上绿信号为2+Del型(图1),即缺失型融合基因扩增。随机计数400个细胞,TMPRSS2-ERG异常细胞>5个为阳性。

图1 FISH 检测结果
四、统计方法
融合基因检测结果阳性和阴性的患者在年龄、PSA水平、Gleason评分、主要Gleason评分、TNM分期的分布差异采用x2检验(不满足条件时用Fisher精确检验),患者疾病无进展生存期(PFS)采用Kaplan-Meier法。以P<0.05为差异有统计学意义。所有数据分析均应用SPSS.20软件进行统计分析。
结 果
96例患者中,融合基因阳性有19例(19.8%),其中缺失型重排有11例,易位型重排亦有11例,同时含有缺失型和易位型重排患者共3例,一例患者存在缺失型重排基因扩增(2+Del)。
患者年龄范围为51~93岁,中位年龄为77岁。治疗前PSA范围为5.0~5000.0ng/mL, PSA≤20ng/ mL 13例(13.5%), 20ng/mL<PSA≤100ng/mL 33例(34.4%),PSA>100ng/mL 50例(52.1%)。Gleason评分<7分的有6例(6.3%),Gleason评分=7分的有38例(39.6%),Gleason评分>7分的有52例(54.2%)。临床分期T1-T2有32例,T3-T4有64例;M0患者35例,M1患者61例。对融合阳性和阴性患者的年龄、PSA、Gleason评分、主要Gleason评分及临床分期进行比较,经过统计分析,融合阳性和阴性患者在上述各项指标的分布上不具有统计学意义(表1)。
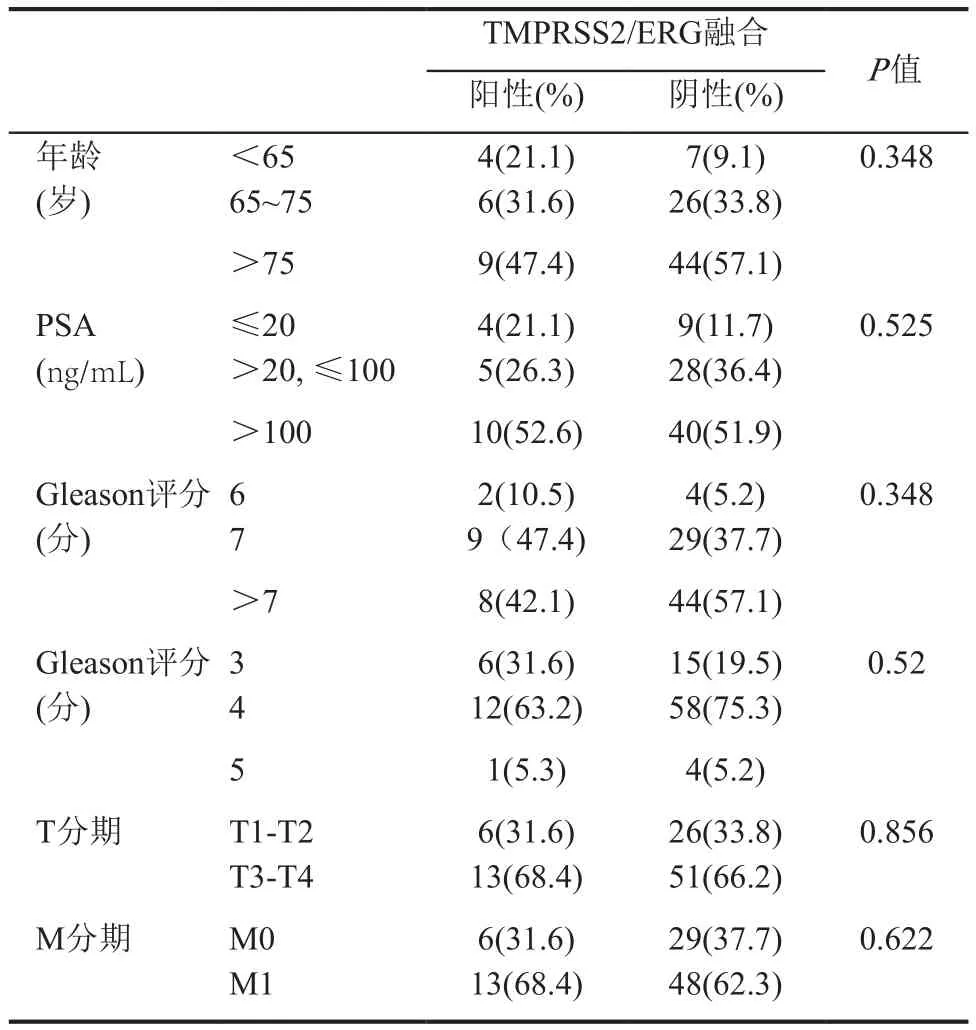
表1 TMPRSS2-ERG融合阳性与阴性患者的临床病理特征比较
患者最长随访时间70个月,最短5个月,平均随访30.3个月,中位随访27个月。其中37例患者在随访期内进展为CPRC,5例患者在随访期内死于车祸或其他疾病,此外有6例患者失访。融合基因阳性组患者中位无进展生存时间为(32.0±6.0)个月,平均生存时间为(39.2±7.0)个月,阴性组平均生存时间为(45.9±3.2)个月,同时未达到中位无进展生存时间。统计学研究显示TMPRSS2-ERG融合基因阳性组和阴性组在肿瘤无进展生存(PFS)方面差异无统计学意义(P>0.05),(图2)。
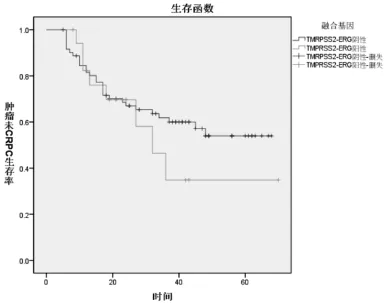
图2 TMPRSS2-ERG融合基因阳性组和阴性组肿瘤无进展生存曲线
讨 论
TMPRSS2-ERG融合基因是前列腺癌常见的分子事件,TMPRSS2-ETS融合基因能诱导转基因小鼠前列腺正常上皮细胞出现上皮内瘤变(PIN),但不转化为侵袭性癌。但动物实验显示在同时伴有抑癌基因PTEN缺失时,小鼠前列腺可产生侵袭性癌[3],因而推测其可能是前列腺癌的前期重要驱动因素,而其临床价值亦值得深入研究。融合基因可致ERG蛋白过度表达,目前检测融合基因主要有3种方法:反转录PCR(RT-PCR)、荧光原位杂交(FISH)和免疫组化(IHC),检测结果具有良好的一致性。
TMPRSS2-ERG融合基因发生率有明显的种族差异。欧美几个研究中心样本量超过500例的研究显示TMPRSS2-ERG融合基因发生率约为50%[4]。Furusato等利用ERG蛋白免疫组化检测230例日本前列腺癌标本(包括穿刺和根治标本)发现阳性率为20.1%[5],Suh等同样利用ERG免疫组化检测303例前列腺癌标本显示阳性率为24.4%[6]。本研究中其阳性率为19.8%,与日本与韩国基本一致,远低于西方国家。TMPRSS2-ERG融合基因较低的发生率也限制了其在前列腺癌筛查方面的应用价值。
TMRPSS2-ERG融合基因有缺失型重排和易位型重排两种形式。Mehra等研究30例融合阳性病例中,缺失型和易位型分别占63%和27%,剩余10%为同时出现缺失型和易位型[7],Qi等研究国内190例前列腺癌经尿道前列腺电切术(TURP)标本,44例融合基因阳性中缺失型有24例(54.5%)[8]。本研究中两种基因重排的发生率基本一致,与他们结果存在差异,但由于融合基因阳性例数较少,目前尚不能明确缺失型和易位型重排发生率以及其预后是否有差异,有待进一步大样本的研究。
前列腺癌具有明显的异质性,目前临床上对于前列腺癌的治疗方案制定和预后判断主要依靠对患者年龄、PSA、Gleason评分及临床病理分期等临床病理资料进行综合分析。但即使相同临床指标的患者,其预后可能也存在巨大差异。因此,当前临床上需要有更加准确的预后评判的生物学指标。TMPRSS2-ERG融合基因目前仅在前列腺癌及前列腺高级上皮内瘤变中存在,对前列腺癌具有高度特异性。研究者对前列腺癌中TMPRSS2-ERG融合基因与临床病理特征也做出了大量研究,但结论目前尚存在争议。
本研究中TMPRSS2-ERG 融合阳性和阴性患者在年龄、治疗前PSA水平、Gleason评分及主要Gleason分级、临床分期的分布上均不存在差异。这与当前部分研究相一致[9]。一项国内研究结果显示融合基因在治疗前的PSA水平分布存在差异,与其他临床病理指标无关,但他们研究的标本来自TURP确诊前列腺癌的患者[8]。Bismar 等利用ERG蛋白免疫组化检测293例TURP前列腺癌病例发现融合基因仅与Gleason评分相关[10],Fine等利用FISH检测521例根治标本发现融合基因与低Gleason评分相关[11],Darnel等指出其在Gleason3级的前列腺癌中更常见[12]。然而Berg等通过免疫组化检测282例前列腺癌穿刺患者指出融合基因阳性患者肿瘤分期更晚,提示其更具有进展性,但与Gleason评分却无相关[13],最新研究表明TMPRSS2-ERG融合基因能促进肿瘤细胞骨转移[14]。这些研究结果的差异可能由于所研究的人群种族、检测方法、样本量大小和标本种类不同造成的。穿刺患者多基于PSA筛查,经尿道电切的前列腺标本则多为偶发癌,而根治标本主要是早期局限性前列腺癌。
目前有较多针对于前列腺癌根治术后患者的预后研究,但研究结果差异较大。部分研究显示融合基因阳性患者的生化复发风险低[15],但其余研究显示预后无差异或者肿瘤复发风险更大[16]。TMPRSS2-ERG融合基因与前列腺癌内分泌治疗的预后相关性同样也存在争议。本研究中融合基因阳性与阴性患者的肿瘤无进展生存不存在统计学差异,这与Leinonen等的研究结果相一致[17]。国内Qi等研究发现融合基因重排的患者前列腺癌的特异性死亡率高于阴性组[8]。不同的标本类型及随访终点可能导致了研究结果的差异。此外,本研究中内分泌治疗融合基因阳性的患者例数偏少,可能影响对结果的判定。ERG蛋白的表达具有雄激素依赖性,体外研究证实ERG蛋白的过度表达能抑制雄激素介导的正常分化,反而促使细胞去分化。这表明TMPRSS2-ERG在前列腺癌的形成中扮演重要角色,且与AR及其相关基因相互作用,可能对内分泌治疗及CRPC患者的预后判断有价值。因而有学者提出利用TMPRSS2-ERG、AR及PTEN三联FISH组合作为前列腺癌危险度分级的工具[18]。此外,有学者认为缺失型融合基因的扩增(2+Del型)的患者预后差[19],本研究仅检测出一例2+Del患者,且其在随访期内进展成CRPC。综合所述,TMPRSS2-ERG融合基因的预后价值尽管目前尚不明确,但值得作进一研究。
结 论
本研究证实了中国人群的前列腺癌TMPRSS2-ERG融合基因的发生率与日韩等亚洲国家人群基本一致,约为20%,远低于欧美人群。TMPRSS2-ERG融合基因阳性和阴性患者在年龄、治疗前PSA水平、Gleason评分、主要Gleason分级以及分期等临床病理指标的分布上不存在差异。同时对于前列腺癌内分泌治疗患者,两者的预后亦不存在差异,但其预后价值值得进一步研究。
1 Center M M, Jemal A, Lortet-Tieulent J, et al. International variation in prostate cancer incidence and mortality rates. Eur Urol 2012; 61(6): 1079-1092
2 韩苏军, 张思维, 陈万青. 中国前列腺癌发病现状和流行趋势分析. 临床肿瘤学杂志 2013; 18(4): 330-334.
3 Chen Y, Chi P, Rockowitz S, et al. ETS factors reprogram the androgen receptor cistrome and prime prostate tumorigenesis in response to PTEN loss. Nat Med 2013;19(8): 1023-1029
4 Minner S, Enodien M, Sirma H, et al. ERG Status is unrelated to PSA recurrence in radically operated prostate cancer in the absence of antihormonal therapy. Clin Cancer Res 2011; 17(18): 5878-5888
5 Furusato B, van Leenders GJ, Trapman J, et al. Immunohistochemical ETS-related gene detection in a Japanese prostate cancer cohort: Diagnostic use in Japanese prostate cancer patients. Pathol Int 2011; 61(7): 409-414
6 Suh JH, Park JW, Lee C, et al. ERG Immunohistochemistry and clinicopathologic characteristics in korean prostate adenocarcinoma patients. Korean J Pathol 2012; 46(5): 423-428
7 Mehra R, Han B, Tomlins SA, et al. Heterogeneity of TMPRSS2 gene rearrangements in multifocal prostate adenocarcinoma: molecular evidence for an independent group of diseases. Cancer Res 2007; 67(17): 991-7995
8 Qi M, Yang X, Zhang F, et al. ERG Rearrangement is associated with prostate cancer-related death in Chinese prostate cancer patients. PLoS ONE 2014; 9(2): e84959
9 Rubio-Briones J, Fernández-Serra A, Calatrava A, et al. Clinical implications of TMPRSS2-ERG Gene Fusion Expression in Patients With Prostate Cancer Treated With Radical Prostatectomy. J Urol 2010; 183(5): 2054-2061
10 Bismar TA, Dolph M, Teng LH, et al. ERG protein expression reflects hormonal treatment response and is associated with Gleason score and prostate cancer specifc mortality. Eur J Cancer 2012; 48(4): 538-546
11 Fine SW, Gopalan A, Leversha MA, et al. TMPRSS2-ERG gene fusion is associated with low Gleason scores and not with high-grade morphological features. Mod Pathol 2010; 23(10): 1325-1333
12 Darnel AD, Lafargue CJ, Vollmer RT, et al. TMPRSS2-ERG fusion is frequently observed in Gleason pattern 3 prostate cancer in a Canadian cohort. Cancer Biol Ther 2009; 8(2): 125-130
13 Berg KD, Vainer B, Thomsen FB, et al. ERG Protein Expression in Diagnostic Specimens Is Associated with Increased Risk of Progression During Active Surveillance for Prostate Cancer. Eur Urol 2014; 66(5): 851-860
14 Deplus R, Delliaux C, Marchand N, et al. TMPRSS2-ERG fusion promotes prostate cancer metastases in bone. Oncotarget 2016; doi: 10.18632/oncotarget.14399
15 Saramaki OR, Harjula AE, Martikainen PM, et al. TMPRSS2:ERG fusion identifes a subgroup of prostate cancers with a favorable prognosis. Clin Cancer Res 2008; 14(11): 3395-3400
16 Nam RK, Sugar L, Yang W, et al. Expression of the TMPRSS2:ERG fusion gene predicts cancer recurrence after surgery for localised prostate cancer. Br J Cancer 2007; 97(12): 1690-1695
17 Leinonen KA, Tolonen TT, Bracken H, et al. Association of SPINK1 expression and TMPRSS2: ERG fusion with prognosis in endocrine-treated prostate cancer. Clin Cancer Res 2010; 16(10): 2845-2851
18 Qu X, Randhawa G, Friedman C, et al. A three-marker FISH panel detects more genetic aberrations of AR, PTEN and TMPRSS2/ERG in castration-resistant or metastatic prostate cancers than in primary prostate tumors. PLoS One 2013; 8(9): e74671
19 Attard G, Clark J, Ambroisine L, et al. Duplication of the fusion of TMPRSS2 to ERG sequences identifies fatal human prostate cancer. Oncogene 2007; 27(3): 253-263
(2016-11-08收稿)
TMPRSS2-ERG fusion gene in a cohort of chinese prostatectomy patients and its relevence with clinicopathologic characters and prognosis for endocrine therapy
Tao Jing1, Zhang Haojie1, Xiao Li2, Sheng Lu1, Qian Weiqing1, Sun Zhongquan1
1. Department of Urology, Huadong Hospital, Shanghai 200040, China; 2. Department of Pathology, Huadong Hospital Corresponding author: Sun Zhongquan, E-mail: drzhongquan@sina.com
Objective To investigate the prevalence of TMPRSS2-ERG gene fusion in Chinese prostate cancer and its correlation with clinicopathologic parameters, as well as its prognostic significance for patients with endocrine therapy. Methods Total of 96 needle biopsy samples of patients with prostate cancers were collected from October, 2010 to December, 2014, and their clinical data was collected. All patients
endocrine therapy and were followed up. Fluorescence in situ hybridization (FISH) was used to detect TMPRSS2-ERG gene fusion in these specimens. Results TMPRSS2-ERG gene fusion accounted for 19.8% (19 cases), deletion pattern 57.9% (11cases) and translocation pattern 57.9% (11). 3(15.8%) had both deletion and insertion pattern. There were no signifcant differences between fusion positive and negative cases in the distribution of age (0.348), PSA(0.525), Gleason score(0.348), primary Gleason pattern (0.52), T stage (0.856) and metastasis (0.622). Similarly, no difference was observed between fusion positive and negative cases in progression free time (PFS) of these patients. Conclusion The prevalence of TMPRRSS2-ERG gene fusion is signifcantlylower in Chinese population than the western countries. TMRPSS2-ERG gene fusion is not correlated with age, PSA, Gleason score, primary Gleason pattern and TNM stage. It has no prognostic value for patients who received endocrine therapy.
prostatic neoplams; fusion gene; endocrine therapy; prognosis
10.3969/j.issn.1008-0848.2016.12.003
R 737.25
*通讯作者,E-mail: drzhongquan@sina.com

