睾丸体积、卵泡刺激素和精浆中性α-糖苷酶在无精子症分型诊断中的应用*
颜秋霞陈润强周秀琴陈彩蓉郭晓燕赵晓英蔡志明唐爱发马 义
1. 广州医科大学附属第六医院,清远市人民医院生殖医学中心(清远 511518);
2. 暨南大学生物医药研究院/细胞生物学系,广东省生物工程药物重点实验室;
3. 深圳市第二人民医院暨深圳大学第一附属医院科教科
·研究简报·
睾丸体积、卵泡刺激素和精浆中性α-糖苷酶在无精子症分型诊断中的应用*
颜秋霞1,2陈润强1周秀琴1陈彩蓉1郭晓燕1赵晓英1蔡志明3唐爱发3马 义2**
1. 广州医科大学附属第六医院,清远市人民医院生殖医学中心(清远 511518);
2. 暨南大学生物医药研究院/细胞生物学系,广东省生物工程药物重点实验室;
3. 深圳市第二人民医院暨深圳大学第一附属医院科教科
世界范围内不孕不育人口约占育龄夫妇的15%,无精子症是男性不育症中较为严重的一种类型,占男性不育的10%~ 20%[1]。无精子症分为梗阻性无精子症(obstructive azoospermia,OA)和非梗阻性无精子症(non-obstructive azoospermia,NOA)[2]两种。以往鉴别无精子症类型主要通过睾丸活检、阴囊探查和输精管造影等有创方法,其临床应用受到制约。因此,寻找无创、简便、准确的无精子症分型的诊断方法实属必要。睾丸体积[3]、血清生殖激素[4,5]和精浆生化[6,7]检测,因其方便快捷、经济实惠的特点,近年来在男性不育临床治疗中逐渐被重视。本研究采用睾丸体积测量、血清卵泡刺激素(FSH)和精浆中性α-糖苷酶(NAG)3项指标联合对无精子症患者做OA和NOA的分型诊断,探讨无创技术在无精子症鉴别诊断中的应用价值。
材料与方法
一、材料
选择2013年1月至2015年12月在我院生殖中心就诊的47例无精子症患者,年龄18~44岁,平均(32.00±6.01)岁。常规询问病史、生殖系统体检,排除患有生殖系统感染、隐睾、精索静脉曲张、染色体异常等疾病者。按照第五版世界卫生组织(WHO5)标准[8],标本经过3次以上精液常规检查,3 000×g,离心15min后沉淀物在显微镜下未发现精子,确定为无精子症。除此以外,所有47例无精子症患者均经过睾丸活检临床确诊为26例梗阻性无精子症和21例非梗阻性无精子症。同时选择30例正常对照组,年龄22~ 42岁,平均(31.47±5.28)岁,按照WHO5精液分析标准检测,精液各项参数均为正常的已生育至少一个健康子女的健康男性。
二、方法
(一)睾丸体积测量
严格按照《WHO男性不育标准化诊疗手册》[2]的要求和方法,室温下,患者取站立位,采用弗安企业生产的睾丸体积测量器进行双侧睾丸体积测量,睾丸体积在2个实木丸之间者采用小的实木丸的体积计算。均未行内分泌治疗。
(二)睾丸活检
常规消毒,铺洞巾,2%利多卡因精索阻滞,左手无名指和中指固定于活检对侧,使活检侧阴囊皮肤处于紧张状态;左手拇指和食指紧拈于睾丸中部,对冲活检压力,右手持输精管分离钳在精索阻滞时的针眼处缓慢分离皮肤及皮下组织达睾丸白膜,继续钝性摩擦白膜,使白膜渐薄,有突破感时,输精管分离钳已进入睾丸,钳夹少许睾丸组织送实验室镜检。术毕,轻压片刻止血。
(三)精浆NAG检测
禁欲2~7d后手淫取精于专用的一次性取精容器内,放置在37℃恒温平板上液化,然后以3 000×g,离心15min,留取上层精浆,分装后-20℃保存,避免标本反复冻融。采用酶联免疫法检测精浆NAG含量,试剂为深圳华康生物医学工程有限公司产品,检测仪器为Rayto公司RT-6000酶标分析仪,实验操作依照试剂盒说明书;精浆中性α-葡萄糖苷酶正常参考值为≥20mU/一次射精[7]。
(四)血清FSH、LH和T检测
检测前3个月内未服用激素类药物,上午8~ 10时抽取受检者肘静脉血5mL,分离血清,采用贝克曼DXI800全自动化学发光免疫分析仪检测,试剂盒为罗氏公司试剂。我院男性生殖激素的正常参考范围为:卵泡刺激素(follicle-stimulating hormone,FSH)1.5~12.4 IU/L,黄体生成素(luteinising hormone,LH)1.7~8.6 IU/L,睾酮(testosterone,T)8.64~29.0 nmol /L。
(五) 统计学处理
结 果
一、年龄、睾丸体积和NAG在3组患者中的比较
3组患者的年龄差异没有统计学意义(P>0.05)。OA患者与正常对照组的睾丸体积比较无统计学意义(P>0.05),而NOA组患者的睾丸体积明显比OA组和正常对照组小,差异具有统计学意义(P<0.01)。OA和NOA组NAG含量均低于正常对照组(P<0.01),且OA组较NOA组更低(P<0.01)见表1。
表1 3组患者的年龄、睾丸体积、精浆NAG的比较(±s)
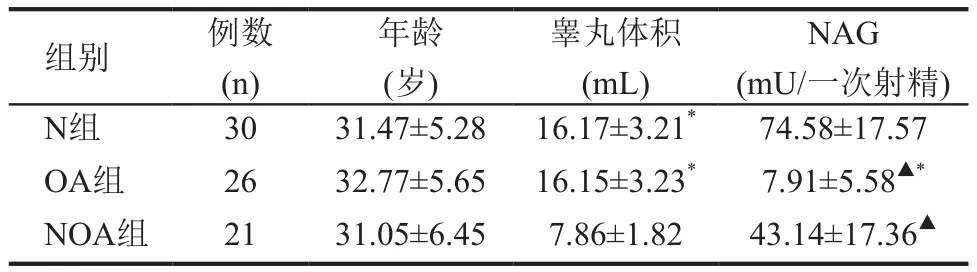
表1 3组患者的年龄、睾丸体积、精浆NAG的比较(±s)
注:与NOA组比较,*为P<0.01;与N组比较,▲为P<0.01
年龄(岁)组别 例数(n)睾丸体积(mL) NAG (mU/一次射精) N组 30 31.47±5.28 16.17±3.21*74.58±17.57 OA组 26 32.77±5.65 16.15±3.23*7.91±5.58▲*NOA组 21 31.05±6.45 7.86±1.82 43.14±17.36▲
二、血清生殖激素检测结果
OA和NOA组FSH和LH含量均高于正常对照组(P<0.01),且NOA组较OA组血清FSH和LH水平明显增高(P<0.01)。NOA组的T明显低于OA组和正常对照组,差异具有统计学意义(P<0.01)见表2。
表2 3组患者血清中FSH、LH和T的比较(±s)

表2 3组患者血清中FSH、LH和T的比较(±s)
注:与N组比较,*为P<0.01;与NOA组比较,▲为P<0.01
组别 例数(n) FSH(IU/L) LH(IU/L) T( nmol/L) N组 30 4.57±1.51 4.52±1.37 15.54±6.15▲OA组 26 15.69±7.52*▲6.68±1.29*▲14.08±5.05▲NOA组 21 30.55±8.13*9.87±2.13*11.37±5.98
三、利用ROC曲线优选睾丸体积和FSH水平的切点值
假设以睾丸活检结果作为“金标准”,优选睾丸体积和FSH水平作为鉴别OA与NOA的切点值。以睾丸活检为状态变量、分别以睾丸体积和FSH水平为检验变量建立ROC曲线,见图1和图2。利用ROC曲线分析各切点的敏感度和特异性。当睾丸体积切点值为13.5mL时,其敏感度和特异性分别是84.6%和95.2%;当FSH的切点值为15.85 IU/L,其敏感度和特异性分别是80.8%和90.5%。睾丸体积的ROC曲线下的面积(AUC)为0.971,表明其诊断准确性较高;FSH水平ROC曲线的AUC为0.872,表明其诊断准确性中等;另外,NAG、LH、T等的AUC为均小于0.7,表明其诊断准确性较低。本研究结果提示睾丸体积比FSH 水平的诊断准确性更高,预测价值更大。

图1 睾丸体积诊断OA与NOA时的ROC曲线
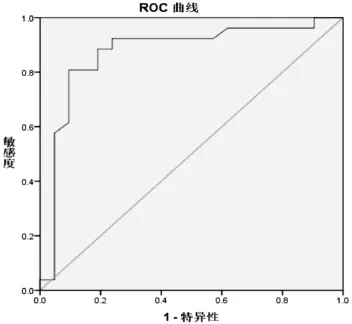
图2 血清
FSH 诊断OA与NOA时的ROC曲线
讨 论
精液由精浆与精子构成,精浆由精囊、前列腺、附睾和尿道球腺产生的分泌物组成。精液中任何附属性腺分泌物的总量反映该腺体的整体分泌功能。精浆生化标志物在输送过程中可被其组织水平以下的病变(附性腺及输送管道的缺如、阻塞等)所阻断,其含量变化可作为鉴别无精子症和输精管道梗阻部位的依据。精浆生化检测已成为OA定位诊断的重要辅助手段。精浆生化检测指标中,中性α-葡糖苷酶被认为是附睾的特异性酶。人体精液中有6种葡糖苷酶,其中中性α-葡糖苷酶绝大部分来自于附睾,被认为是附睾的特异性酶[9]。中性α-葡糖苷酶在附睾的头、体、尾部均有分泌,其活性最高的部分位于睾丸输出小管至附睾的移行区域[10]。很多研究发现双侧输精管及双侧附睾尾部梗阻患者的精浆中性α-葡糖苷酶水平均明显下降[9,10]。袁谦等[11]研究认为精浆NAG与附睾梗阻部位具有显著相关性,可用于判断附睾的梗阻部位、手术愈后和缩短探查手术时间,具有较大的临床指导意义。本研究结果表明,OA和NOA组NAG含量均低于正常对照组(P<0.01),且OA组较NOA组更低,说明附睾特异性NAG下降与无精子症的类型有关系。
下丘脑-垂体-睾丸轴在精子的发生与调控中起到重要作用,其相互作用维持着正常的男性生殖内分泌及睾丸功能,任何因素引起生殖激素改变都会影响男性的生育能力。下丘脑分泌的促性腺激素释放激素(GnRH)作用于脑垂体, 使其合成和分泌FSH、LH。FSH的作用主要是促进精母细胞发育成精子细胞和成熟精子。睾丸的生精功能发生障碍时,生精细胞因为发育阻滞而停留在精子发生的某一发育阶段,FSH值会有所改变[12]。FSH受睾丸支持细胞分泌的抑制素(inhibin)的负反馈调节,当睾丸上皮细胞正常时,支持细胞分泌的inhibin抑制FSH的分泌,使FSH维持在正常水平;无精子症患者存在睾丸发育不良、生精细胞发育不良和纤维组织化等病理改变,生精小管上皮受损和支持细胞被破坏,使得inhibin分泌减少,导致FSH水平升高,从而引起NOA[13]。血液FSH水平能反映睾丸的生精情况,FSH 水平超过正常水平2倍以上的大部分患者存在睾丸生精障碍[14]。LH 的主要作用是促进睾丸间质细胞生长,促其合成和分泌睾酮(T),促进T扩散入生精小管,供精子生成所需。T由间质细胞合成分泌,是生精过程中的主要调节激素,约占人体雄激素的95%。T通过反馈调节抑制垂体和下丘脑, 使LH分泌减少[15]。因此, 检测生殖激素可反映下丘脑-垂体-睾丸轴的生精功能。
无精子症按照病因分为OA和NOA。前者是睾丸有正常的生精功能,但因精子通路阻塞导致精子无法正常排出;后者通常指睾丸生精功能障碍,不能产生或只能产生极少量精子,导致精液中无精子。由于睾丸生精功能异常导致无精子症伴有血清生殖激素水平的紊乱,通过对无精子症血清生殖激素水平的分析,判断其睾丸功能是否受到损伤及其程度。张雅君等[16]认为当 FSH>17.63U/L也可以作为临床睾丸穿刺处理的一个预测指标;冯科等[17]发现在各个参数中FSH 对预测NOA患者睾丸内是否存在精子价值最大,通过ROC曲线分析其切点值为13.31 IU/L,大于此值即认为睾丸内无可利用精子,小于此值认为睾丸内能发现可利用精子,其敏感度为74.1%,特异性为96. 2%。本研究显示,梗阻性和非梗阻性无精子症组FSH和LH含量均高于正常对照组, 且非梗阻性无精子症组较梗阻性无精子症组血清FSH和LH水平明显增高,T含量明显降低,提示血清生殖激素可作为反映睾丸生精功能损伤程度的指标,其中FSH区分OA和NOA更为明确。本文采用ROC曲线分析,当FSH的切点值为15.85 IU/L,诊断为梗阻性无精子症的灵敏度和特异度分别是80.8%和90.5%。
睾丸体积测定在鉴别OA和NOA中同样起着重要的作用。睾丸是男性性腺,是产生精子和雄性激素的场所,睾丸大小是睾丸发育是否正常的重要标志。一般认为测量睾丸容积可大约估计睾丸生精小管的发育情况,初步判断其生精功能。有研究指出睾丸体积和血清FSH结合对于预测非梗阻性无精和睾丸穿刺取精结果有重要意义,并且睾丸体积诊断准确性明显优于FSH[18];桂文武等[19]报道, 经皮附睾穿刺取精术( Percutaneous epididymal sperm aspiration,PESA )和睾丸细针穿刺抽吸术( Testicular sperm aspiration,TESA )联合睾丸体积、血清FSH水平,对无精子症进行诊断符合率为91.3%,是诊断无精子症的可靠方法。唐文豪等[20]研究显示,睾丸体积、FSH 水平与TESA 结果分别呈显著的正相关和负相关(P均<0.001)。因此,临床工作中确实可以使用睾丸体积、FSH水平判断睾丸生精功能状况。本研究结果显示,正常对照组和OA患者的睾丸体积正常,而NOA患者的睾丸明显偏小且质地软,表明睾丸组织生精功能状态损害的严重程度与睾丸体积有关。当睾丸体积切点值为13.5mL时,其灵敏度和特异度分别是84.6%和95.2%,睾丸体积的ROC曲线下的面积(AUC)为0.971,表明其诊断准确性较高,而FSH水平ROC曲线的AUC为0.872,表明其诊断准确性中等。综上所述,本研究的结论与其他多数研究是一致的,即睾丸体积、FSH 水平和NAG水平对于鉴别OA与NOA有重要的参考价值,并且睾丸体积诊断准确性明显优于FSH和NAG,参考价值更大。目前报道较多的无创性诊断指标有睾丸体积、FSH及抑制素B等,但预测的效果并不理想,且存在较大争议(可能与不同研究纳入标准不同或样本量较小有关),联合指标预测可能成为今后研究的方向。
总之,联合应用睾丸体积、FSH和精浆NAG等无创技术,为无精子症鉴别诊断提供了一种经济、快速、无创的有效指标,对于区分OA与NOA以及OA中梗阻部位的判定具有重要的临床应用价值。
无精子症; 睾丸体积; 卵泡刺激素; α葡糖苷酶类
1 Murray KS, James A, McGeady JB, et al. The effect of the new 2010 World Health Organization criteria for semen analyses on male infertility. Fertil Steril 2012;98(6): 1428-1431
2 World Health Organization. WHO manual for the standardized investigation, diagnosis and managerment of the infertile male. Cambridge: Cambridge University Press 2000
3 黄宇烽, 李宏军 主编.实用男科学.北京: 科学出版社, 2009: 37-83
4 朱晓斌, 冯云, 纪冬梅, 等. Y染色体微缺失检测及生殖激素水平研究在非梗阻性无精子症患者睾丸穿刺中的意义. 中国男科学杂志 2010; 24(4): 30-32, 35
5 聂群, 俞冬熠, 韩美艳, 等. 无精子及少精子症患者染色体及生殖激素水平分析. 中国男科学杂志 2016; 30(3): 38-41
6 房军领, 曹翠娟. 无精子症患者血清生殖激素和精浆生化指标变化特点. 临床合理用药 2016; 9(17):112-113
7 谢军, 刘继红, 陈俊, 等. 精浆弹性硬蛋白酶、果糖和中性α-葡萄糖苷酶测定在梗阻性无精子症诊断中的意义. 中国男科学杂志 2007; 21(3): 47-50
8 世界卫生组织主编. WHO人类精液检查与处理实验室手册. 第5版. 北京: 人民卫生出版社, 2011
9 Corrales JJ, Burgo RM, Miralles JM, et al. Abnormalities in sperm acid glycosidases from infertile men with idiopathic oligoasthenoteratozoospermia. Fertil Steril 2000; 73(3): 470-478
10 Pena P, Risopatrón J, Villegas J, et al. Alpha-glucosidase in the human epididymis: Topographic distribution and clinical application. Andrologia 2004;36(5) : 315-320
11 袁谦, 江洪涛, 宿颖岚, 等. 精浆中性α-葡糖苷酶与附睾梗阻性无精子症梗阻部位的相关性研究. 中华男科学杂志 2013; 19(8): 719-721
12 陈荣安, 房秉仁, 欧阳贵, 等. 不同病因无精子症的生殖激素水平. 生殖与避孕 2002; 22(2): 111-113
13 Amr AR, David R. Male infertility: causes and investigations. Trends in Urol men's Health 2011; 2(1): 8-11
14 郭应禄, 李宏军 主编.男性不育症.北京: 人民军医出版社, 2003: 240
15 刘锋, 邹彦, 邓志华, 等. 人类无精子症研究现状. 广西医学 2003; 25(3): 376-379
16 张雅君, 卢实, 刘琳, 等. 男性无精子症患者血清生殖激素水平与睾丸生精功能的相关分析. 生殖医学杂志2014; 23 (11): 913-916
17 冯科, 张翠莲, 李杭生, 等. 生殖激素水平和睾丸体积对非梗阻性无精症患者精子存在的预测价值. 第三军医大学学报 2015; 37(1): 69 -73
18 刘新贵. 遗传基因、睾丸体积及内分泌激素水平检测分析对无精子症患者穿刺获精结果的预测作用. 郑州:郑州大学, 2012: 17-20
19 桂文武, 丘彦, 蒲军, 等. 经皮附睾和睾丸细针穿刺抽吸术在诊断无精子症中的应用. 重庆医科大学学报 2010; 35(9): 1439-1441
20 唐文豪, 姜辉, 马潞林, 等. 非梗阻性无精子症患者睾丸体积生殖激素水平与睾丸穿刺取精结果的相关性研究.
中华男科学杂志 2012; 18(1): 48-51
(2016-11-05收稿)
10.3969/j.issn.1008-0848.2016.12.011
R698.2
资助: 清远市科技计划项目资助(2014B012);广东省医学科研基金资助(B2014426);国家自然科学基金资助(81270740);深圳市战略新兴产业发展专项基金(JSGG20160301162913683);深圳市知识创新计划基础研究项目(JCYJ20140416180323426)**
, E-mail: tmayi@jnu.edu.cn

