阿托伐他汀通过下调NLRP1炎性体表达抑制IL-1β和IL-18的释放*
喻思扬, 王 燕, 曾高峰, 刘 洋, 徐健强, 曾梦雅, 唐业华, 曾志英, 石小桥, 陈 莹, 赵国军
(南华大学附二医院 1心血管内科, 2麻醉科, 3衡阳市中心医院,湖南 衡阳 421001; 4桂林医学院组胚教研室,广西 桂林 541004)
阿托伐他汀通过下调NLRP1炎性体表达抑制IL-1β和IL-18的释放*
喻思扬1▲,王燕2▲,曾高峰1,刘洋1,徐健强1,曾梦雅1,唐业华3,曾志英2,石小桥2,陈莹2,赵国军4△
(南华大学附二医院1心血管内科,2麻醉科,3衡阳市中心医院,湖南 衡阳 421001;4桂林医学院组胚教研室,广西 桂林 541004)
[摘要]目的: 探讨核苷酸结合寡聚化结构域样受体蛋白1(NLRP1)炎性体在阿托伐他汀抑制THP-1巨噬细胞白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)分泌中的作用。方法: 用10 μg/L脂多糖诱导THP-1巨噬细胞分泌IL-1β和IL-18,以不同浓度阿托伐他汀(1、10和20 μmol/L)孵育细胞24 h,或以10 μmol/L阿托伐他汀处理细胞不同时间(12、24和48 h),或转染NLRP1 siRNA以沉默细胞内NLRP1的表达。采用RT-PCR检测细胞内NLRP1炎性体mRNA的表达,Western blot检测细胞内NLRP1炎性体蛋白的表达,ELISA检测细胞上清液中IL-1β和IL-18的含量。结果: 阿托伐他汀可抑制THP-1巨噬细胞NLRP1炎性体mRNA和蛋白的表达,且这种效应呈浓度和时间依赖性。转染NLRP1 siRNA后,THP-1巨噬细胞NLRP1的蛋白表达明显下降,且阿托伐他汀对IL-1β和IL-18分泌的抑制作用明显增强。结论: 阿托伐他汀通过抑制NLRP1炎性体表达减少巨噬细胞IL-1β和IL-18的释放,发挥抗炎作用,进而延缓动脉粥样硬化进展。
[关键词]阿托伐他汀; 核苷酸结合寡聚化结构域样受体蛋白1炎性体; 白细胞介素-1β; 白细胞介素-18; 动脉粥样硬化
动脉粥样硬化(atherosclerosis,As)是一种血管的慢性炎症性疾病,脂质堆积伴固有免疫激活是As的特征性病理改变之一[1]。阿托伐他汀能有效预防和延缓As形成,这一效果除得益于调脂作用外,还与其抗炎作用密切相关[2]。然而,阿托伐他汀是通过何种机制发挥抗炎效应,目前不甚清楚。
核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptors,NLRs)是一类新发现的固有免疫模式识别受体,其能调控炎性体活化,参与As等疾病的发展[3-4]。核苷酸结合寡聚化结构域样受体蛋白1(nucleotide-binding oligomerization domain-like receptor protein 1,NLRP1)是第一个被发现参与炎性体组成的NLRs成员,广泛存在于单核-巨噬细胞中[5-6],被细菌脂多糖(lipopolysaccharide,LPS)等物质激活后,NLRP1可协同半胱天冬酶-1(caspase-1)和凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase-recruitment domain,ASC)完成炎性体组装,促进白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-18(interleukin-18,IL-18)的释放,对炎症反应起重要作用[7]。本研究旨在通过观察阿托伐他汀对THP-1巨噬细胞NLRP1炎性体表达及其下游IL-1β和IL-18分泌的影响,探讨阿托伐他汀的抗炎机制,为深入认识阿托伐他汀的非调脂作用提供新依据。
材料和方法
1细胞、主要试剂和仪器
THP-1细胞购于中国科学院上海生物化学与细胞生物学研究所细胞中心;RPMI-1640培养基、胎牛血清和佛波酯(phorbol 12-myristate 13-acetate,PMA)、LPS购于Sigma;阿托伐他汀钙购自大连美仑生物技术有限公司;RNA抽提试剂购自GeneCopoeia;Reverse Transcription System购自Promega;TaqMan® Gene Expression Master Mix购于Applied Biosystems;NLRP1、caspase-1、ASC和β-actin引物由生工生物工程(上海)股份有限公司合成;NLRP1、caspase-1和ASC兔抗人 I 抗购自Life Technologies;β-actin antibody购于Immunechem;辣根过氧化酶标记山羊抗兔 II 抗购自Santa Cruz;jetTEI转染试剂购于Polyplus;人IL-1β和IL-18酶联免疫检测试剂盒购自生工生物工程(上海)股份有限公司;CO2培养箱为BiNEDER CB150;电泳装置及凝胶成像分析系统购自Bio-Rad。
2实验方法
2.1细胞培养THP-1细胞用含10%胎牛血清的RPMI-1640培养基于37 ℃、5% CO2培养箱中静置培养。培养基中含青霉素和链霉素各1.0×105U/L。培养2~4代后,将状态良好、呈对数生长的细胞用于实验。实验前以100 nmol/L PMA刺激细胞24 h,诱导其分化为贴壁的巨噬细胞,换不含血清的RPMI-1640培养基继续培养,根据实验分组,予以相应的处理因素。
2.2RT-PCR采用TRIzol法提取总RNA,测定RNA样品的纯度和含量。取1 μg RNA样品进行逆转录反应,合成cDNA。以cDNA为模板,建立20 μL反应体系,PCR反应循环为50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min(40个循环)。取5 μL反应底物,琼脂糖凝胶电泳,电泳后凝胶成像分析系统采集图像。引物序列和PCR产物片段大小见表1。
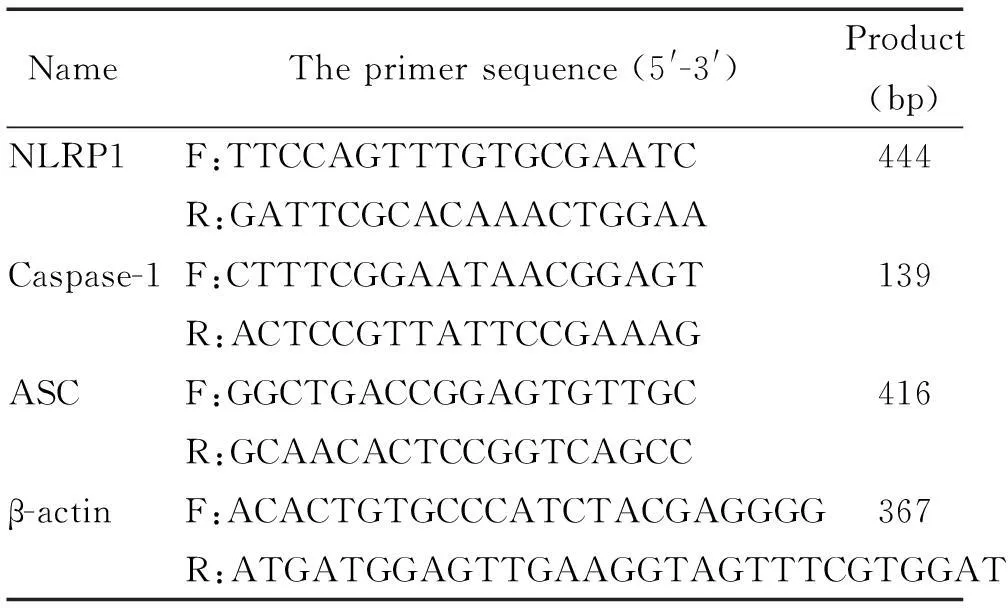
表1 RT-PCR的引物序列
F: forward; R:reverse.
2.3Western blot提取细胞总蛋白,测定蛋白浓度。进行SDS-PAGE分离蛋白,电泳后将蛋白转移至PVDF膜,S-丽春红染色观察PVDF膜上的蛋白条带,以明确转膜效率。将PVDF膜置入用TBST配制的含5%脱脂牛奶的封闭缓冲液中,室温封闭2 h,加入TBST稀释过的 I 抗,4 ℃冰箱中孵育过夜。室温复温后,TBST洗膜3次,每次10 min,加入TBST稀释过的 II 抗,室温封闭1 h,TBST洗膜3次,每次10 min。使用高灵敏ECL发光试剂进行显色,采集图像后保存。
2.4RNA干扰根据GenBank中人NLRP1 mRNA序列设计siRNA,经BLAST明确其特异性。人NLRP1 siRNA的正义链序列为5’-UUAAAAUCCUCAUUUUUCCAG-3’,反义链序列为5’-GGAAAAAUGAGGAUUUUAACC-3’;另设计阴性对照siRNA的正义链序列为5’-UUCUCCGAACGUGUCACGUTT-3’,反义链序列为5’-ACUUGACACGUUCGGAGAATT-3’;并在BLAST中对其进行同源性分析,确定与其它基因无同源性。用jetTEI转染试剂将siRNA转染至THP-1巨噬细胞(具体操作按照试剂盒说明进行),48 h后采用Western blot鉴定转染效率。
2.5ELISATHP-1巨噬细胞培养在6孔板中,加入各种处理因素后,收集各孔上清液,IL-1β、IL-18含量的测定严格按照ELISA试剂盒操作说明书进行,以450 nm波长测量各孔吸光度,根据标准曲线计算出样品实际浓度,并进行统计学分析。
3统计学处理
各组数据均采用均数±标准差(mean±SD)表示,采用SPSS 18.0软件对数据进行统计学分析,组间比较采用单因素方差分析, 两两比较使用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1不同浓度阿托伐他汀对THP-1巨噬细胞NLRP1炎性体表达的影响
THP-1巨噬细胞经10 μg/L LPS及不同浓度(1、10和20 μmol/L)的阿托伐他汀处理24 h后,采用RT-PCR和Western blot分别检测NLRP1、caspase-1和ASC mRNA和蛋白质的表达。结果显示LPS组NLRP1、caspase-1和ASC的mRNA和蛋白质表达较对照组显著上调(P<0.05);经不同浓度阿托伐他汀处理后NLRP1、caspase-1和ASC的mRNA和蛋白质表达较LPS组则明显下降(P<0.05),且浓度越大,下降越明显,表明阿托伐他汀可呈浓度依赖性抑制THP-1巨噬细胞NLRP1炎性体mRNA和蛋白质的表达,见图1、2。
2阿托伐他汀作用不同时间对THP-1巨噬细胞NLRP1炎性体表达的影响
以10 μg/L LPS及10 μmol/L阿托伐他汀处理THP-1巨噬细胞不同时间(12 h、24 h和48 h)后,采用RT-PCR和Western blot分别检测NLRP1、caspase-1和ASC的mRNA和蛋白质表达。结果显示LPS组NLRP1、caspase-1和ASC的mRNA和蛋白质表达较对照组显著上调(P<0.05);经阿托伐他汀处理不同时间后NLRP1、caspase-1和ASC的mRNA和蛋白质表达较LPS组则明显下降(P<0.05),且作用时间越长,下降越明显,表明阿托伐他汀可呈时间依赖性抑制THP-1巨噬细胞NLRP1炎性体mRNA和蛋白质的表达,见图3、4。

Figure 1.The effect of different concentrations of atorvastatin on mRNA expression of NLRP1 inflammasome in THP-1 macrophages. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsLPS.
图1不同浓度阿托伐他汀对THP-1巨噬细胞NLRP1炎性体mRNA表达的影响
3NLRP1 siRNA对阿托伐他汀抑制THP-1巨噬细胞IL-1β和IL-18分泌的影响
为了进一步研究NLRP1炎性体在阿托伐他汀抑制THP-1巨噬细胞IL-1β和IL-18分泌中的作用,我们转染NLRP1 siRNA以沉默细胞内NLRP1的表达。然后观察各组细胞IL-1β和IL-18水平的变化,结果显示与单纯LPS组比较,LPS+ATO组或LPS+NLRP1 siRNA组的IL-1β和IL-18分泌显著减少(P<0.05);而且,与LPS+ATO组或LPS+NLRP1 siRNA组比较,ATO+NLRP1 siRNA共处理细胞可使LPS诱导的IL-1β和IL-18分泌进一步减少(P<0.05),表明转染NLRP1 siRNA下调NLRP1表达能够促进阿托伐他汀对THP-1巨噬细胞IL-1β和IL-18分泌的抑制作用,见图5。
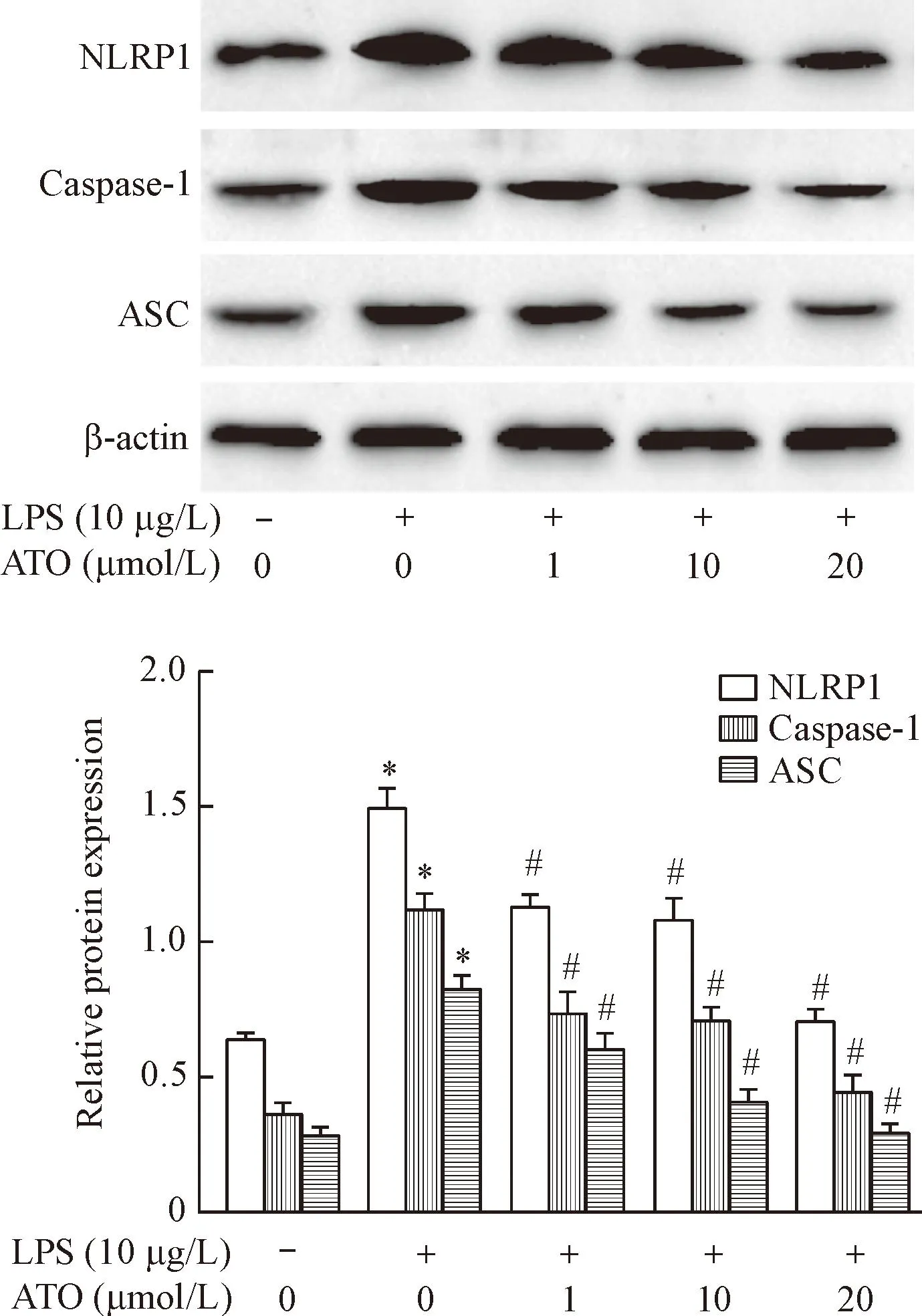
Figure 2.The effect of different concentrations of atorvastatin on protein expression of NLRP1 inflammasome in THP-1 macrophages. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsLPS.
图2不同浓度阿托伐他汀对THP-1巨噬细胞NLRP1炎性体蛋白表达的影响
讨论
血脂代谢异常可通过启动免疫应答和诱发炎症反应,促进血管内壁斑块形成,进而加速As的发生发展[8]。降脂药阿托伐他汀作为目前最有效的抗As药物之一,已被证实具备明显的抗炎效应[9],但其中的具体机制仍不清楚。NLRP1炎性体是一个由NLRP1、caspase-1和ASC构成的多蛋白寡聚体,受体蛋白NLRP1是其活化和发挥功能的关键分子,与相关配体结合后,NLRP1能启动炎性体的自我激活,促使IL-1β和IL-18前体分子转变为成熟的促炎细胞因子[10-11]。本实验选用THP-1源性巨噬细胞作为模型,观察了阿托伐他汀对NLRP1炎性体表达的影响,结果显示阿托伐他汀可呈浓度、时间依赖性抑制NLRP1炎性体mRNA和蛋白质的表达。此外,我们运用siRNA对NLRP1进行沉默,发现NLRP1表达下调能够促进阿托伐他汀对IL-1β和IL-18分泌的抑制作用,提示NLRP1炎性体可能在阿托伐他汀的抗炎及抗As作用中扮演了关键角色。

Figure 3.The effect of atorvastatin on mRNA expression of NLRP1 inflammasome in THP-1 macrophages for different time. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsLPS.
图3阿托伐他汀作用不同时间对THP-1巨噬细胞NLRP1炎性体mRNA表达的影响

Figure 4.The effect of atorvastatin on protein expression of NLRP1 inflammasome in THP-1 macrophages for different time. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsLPS.
图4阿托伐他汀作用不同时间对THP-1巨噬细胞NLRP1炎性体蛋白表达的影响
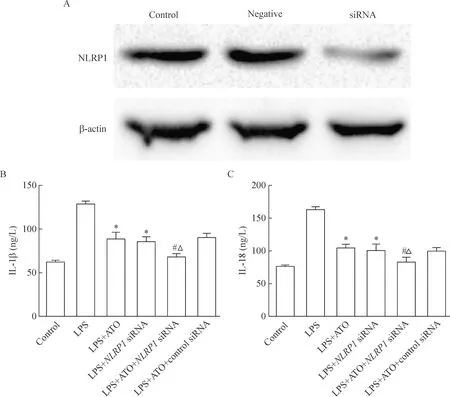
Figure 5.The effect of NLRP1 siRNA on atorvastatin-induced reduction of IL-1β and IL-18 releases from THP-1 macrophages. Western blot was employed to examine the transfection efficiency of NLRP1 siRNA (A). ELISA was used to quantify the secretion of IL-1β (B) and IL-18 (C) in each group. Mean±SD.n=3.*P<0.05vsLPS;#P<0.05vsLPS+ATO;△P<0.05vsLPS+NLRP1 siRNA.
图5NLRP1 siRNA对阿托伐他汀抑制THP-1巨噬细胞IL-1β和IL-18分泌的影响
NLRP1炎性体参与炎症反应及As的发生发展[12]。外周动脉疾病(peripheral arterial disease,PAD)是一种由As导致,多因素共同参与的慢性疾病,Bleda等[13]发现NLRP1炎性体参与PAD患者内皮功能紊乱与炎症反应过程,并与血管损伤和修复密切相关。阿司匹林是临床上治疗As性疾病的常用药。Bleda等[14]又发现NLRP1炎性体表达的下调可能在阿司匹林的抗As过程中发挥了关键作用,这间接验证了NLRP1炎性体与As的关系,并提示以NLRP1炎性体为靶点治疗As存在可能性。固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBP)可调节脂质合成,是As过程的重要参与者。动物实验结果显示,LPS能通过诱导小鼠巨噬细胞SREBP-1a表达上调,促进其下游NLRP1炎性体激活及促炎细胞因子释放,表明NLRP1炎性体可能是SREBP参与As的途径之一[15]。我们的研究结果显示,THP-1巨噬细胞经LPS处理后,NLRP1炎性体mRNA和蛋白表达均显著增加,这与在小鼠巨噬细胞上的发现一致。此外,我们还发现,LPS对NLRP1炎性体的促进作用能被阿托伐他汀有效抑制。
近年来,阿托伐他汀的抗炎效应已成为As防治领域的新热点,但其所涉及的分子机制却尚未明了。有学者指出NLRP3(NLR family,pyrin domain containing 3)炎性体参与As发病过程[16],且阿托伐他汀可通过干预NLRP3炎性体延缓As进展[17]。但是,亦有学者认为炎症反应及As进展并不依赖于NLRP3炎性体[13, 15, 18]。鉴于NLRP1炎性体在促炎细胞因子分泌中的重要作用及其与As的密切关联性,我们观察了阿托伐他汀对LPS诱导THP-1巨噬细胞NLRP1炎性体表达的影响,发现阿托伐他汀可明显下调NLRP1炎性体表达,且伴有IL-1β和IL-18分泌的减少;此外,当NLRP1被siRNA沉默后,阿托伐他汀对IL-1β和IL-18分泌的抑制作用更加明显。这些研究结果表明NLRP1炎性体是阿托伐他汀抗炎及抗As作用的重要靶点之一。
综上所述,阿托伐他汀具备抗炎作用,可减少巨噬细胞IL-1β和IL-18的释放,且其作用途径与抑制NLRP1炎性体表达有关。这有助于深入认识他汀类药物的非调脂作用,并为临床联合用药治疗As提供新依据。此外,不断深化对炎性体的研究不仅有益于As的早期诊断,以炎性体为靶点设计单克隆抗体、小分子拮抗物等或许能为As的治疗开辟新的途径。
[参考文献]
[1]赵国军,唐朝克. 固有免疫应答与动脉粥样硬化关系的研究进展[J]. 生物化学与生物物理进展, 2013, 40(5):406-415.
[2]边云飞,赵欣,李茂莲,等. 阿托伐他汀对TNF-α和IL -1β诱导的大鼠主动脉内皮细胞PAPP-A表达的影响[J]. 中国病理生理杂志, 2011, 27(7):1335-1341.
[3]Li X, Deroide N, Mallat Z. The role of the inflammasome in cardiovascular diseases[J]. J Mol Med, 2014, 92(4):307-319.
[4]Robbins GR, Wen H, Ting JP. Inflammasomes and metabolic disorders: old genes in modern diseases[J]. Mol Cell, 2014, 54(2):297-308.
[5]Martinon F, Burns K, Tschopp J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta[J]. Mol Cell, 2002, 10(2):417-426.
[6]Mcintire CR, Yeretssian G, Saleh M. Inflammasomes in infection and inflammation[J]. Apoptosis, 2009, 14(4):522-535.
[7]鲁战平,孙剑. NLRP1炎性体[J]. 生命的化学, 2012, 32(4):381-384.
[8]Zernecke A, Weber C. Improving the treatment of atherosclerosis by linking anti-inflammatory and lipid modulating strategies[J]. Heart, 2012, 98(21):1600-1606.
[9]钱宗杰,张连舫,曾秋棠,等. 阿托伐他汀对巨噬细胞肝X受体表达及胆固醇外流的影响[J]. 中国病理生理杂志, 2010, 26(3):446-451.
[10]Schroder K, Tschopp J. The inflammasomes[J]. Cell, 2010, 140(6):821-832.
[11]Chavarría-Smith J, Vance RE. The NLRP1 inflammasomes[J]. Immunol Rev, 2015, 265(1):22-34.
[12]喻思扬,王燕,刘洋,等. 炎性体在动脉粥样硬化等心血管疾病中的作用及机制[J]. 中国动脉硬化杂志, 2014, 22(12):1281-1286.
[13]Bleda S, de Haro J, Varela C, et al. NLRP1 inflammasome, and not NLRP3, is the key in the shift to proin-flammatory state on endothelial cells in peripheral arterial disease[J]. Int J Cardiol, 2014, 172(2):e282-e284.
[14]Bleda S, De Haro J, Varela C, et al. Aspirin therapy inhibits NLRP1 (nucleotide-binding domain-like receptor protein 1) inflammasome gene expression in patients with peripheral artery disease[J]. J Vasc Surg, 2015, 61(4):1103-1104.
[15]Im SS, Yousef L, Blaschitz C, et al. linking lipid metabolism to the innate immune response in macrophages through sterol regulatory element binding protein-1a[J]. Cell Metab, 2011, 13(5):540-549.
[16]Rajamöki K, Lappalainen J, Oärni K, et al. Cholesterol crystals activate the NLRP3 inflammasome in human macrophages: a novel link between cholesterol metabolism and inflammation[J]. PLoS One, 2010, 5(7):e11765.
[17]马全鑫,杨钦钦,陆晔枫, 等. NLRP3炎症小体在早期动脉粥样硬化ZDF大鼠中的表达及阿托伐他汀的干预[J]. 中国比较医学杂志, 2015, 25(2):1-6.
[18]Menu P, Pellegrin M, Aubert JF, et al. Atherosclerosis in ApoE-deficient mice progresses independently of the NLRP3 inflammasome[J]. Cell Death Dis, 2011, 2:e137.
(责任编辑: 林白霜, 罗森)
Atorvastatin inhibits IL-1β and IL-18 releases via lowering the expression of NLRP1 inflammasome
YU Si-yang1, WANG Yan2, ZENG Gao-feng1, LIU Yang1, XU Jian-qiang1, ZENG Meng-ya1, TANG Ye-hua3, ZENG Zhi-ying2, SHI Xiao-qiao2, CHEN Ying2, ZHAO Guo-jun4
(1DepartmentofCardiovascularMedicine,2DepartmentofAnesthesiology,TheSecondAffiliatedHospital,UniversityofSouthChina,3TheCentralHospitalofHengyang,Hengyang421001,China;4DepartmentofHistologyandEmbryology,GuilinMedicalUniversity,Guilin541004,China.E-mail:zzhcsu@163.com)
[ABSTRACT]AIM: To explore the role of nucleotide-binding oligomerization domain-like receptor protein 1 (NLRP1) inflammasome in atorvastatin-induced reduction of interleukin-1β (IL-1β) and interleukin-18 (IL-18) releases from the THP-1 macrophages. METHODS: Lipopolysaccharide (LPS, 10 μg/L) was used to trigger the secretion of IL-1β and IL-18 in the THP-1 macrophages. The cells were incubated with different concentrations of atorvastatin (1, 10 and 20 μmol/L) for 24 h, or treated with 10 μmol/L atorvastatin for different time (12 h, 24 h and 48 h). NLRP1 siRNA was transfected into the THP-1 cells. The mRNA expression of NLRP1 inflammasome was detected by RT-PCR. The protein expression of NLRP1 inflammasome was determined by Western blot. The secretion of proinflammatory cytokines IL-1β and IL-18 was quantified by ELISA. RESULTS: Atorvastatin inhibited the mRNA and protein expression of NLRP1 inflammasome in the THP-1 macrophages in a dose- and time-dependent manner. Transfection of NLRP1 siRNA significantly decreased the protein expression of NLRP1 and promoted the suppressive effect of atorvastatin on IL-1β and IL-18 secretion in the THP-1 macrophages. CONCLUSION: Atorvastatin inhibits the production of IL-1β and IL-18 in the macrophages through decreasing NLRP1 inflammasome expression, possibly contributing to the anti-inflammatory effect of atorvastatin on atherosclerosis.
[KEY WORDS]Atorvastatin; Nucleotide-binding oligomerization domain-like receptor protein 1 inflammasome; Interleukin-1β; Interleukin-18; Atherosclerosis
[文章编号]1000- 4718(2016)05- 0863- 06
[收稿日期]2015- 12- 04[修回日期] 2016- 02- 04
*[基金项目]湖南省自然科学基金资助项目(No. 14JJ5016)
通讯作者△Tel: 0773-3680365; E-mail: zzhcsu@163.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.016
杂志网址: http://www.cjpp.net
▲并列第1作者

