鹿回头多孔鹿角珊瑚与丛生盔形珊瑚性腺组织学研究
张诗泽, 黄晖, 张浴阳, 周国伟,2, 江雷, 陈标
1. 中国科学院南海海洋研究所, 广东, 广州 510301
2. 中国科学院海南热带海洋生物实验站, 海南, 三亚 572000
3. 中国科学院大学, 北京 100039
鹿回头多孔鹿角珊瑚与丛生盔形珊瑚性腺组织学研究
张诗泽1,2,3, 黄晖1,2,*, 张浴阳1, 周国伟1,2, 江雷1,2,3, 陈标1,2,3
1. 中国科学院南海海洋研究所, 广东, 广州 510301
2. 中国科学院海南热带海洋生物实验站, 海南, 三亚 572000
3. 中国科学院大学, 北京 100039
造礁石珊瑚繁殖生物学是开展珊瑚有性修复技术的基础, 对珊瑚礁生态系统修复具有重要的指导意义。本研究选取三亚鹿回头多孔鹿角珊瑚(Acropora millepora)与丛生盔形珊瑚(Galaxea fascicularis)作为研究对象, 观察它们性腺特征, 明确多孔鹿角珊瑚与丛生盔形珊瑚有性繁殖类型。结果表明: (1) 多孔鹿角珊瑚是雌雄同体产卵型珊瑚, 丛生盔形珊瑚是假雌全异株产卵型珊瑚; (2) 多孔鹿角珊瑚和丛生盔形珊瑚的虫黄藻都由后天获取; (3)多孔鹿角珊瑚在其卵母细胞和精母细胞发育到Ⅳ时相后, 卵巢与精巢之间肠表皮消失, 并在随后的5 d左右产卵; 丛生盔形珊瑚在其卵母细胞发育到Ⅲ时相后的20 d左右产卵。本研究结果, 为三亚海域造礁石珊瑚繁殖生物学的深入研究提供基础数据支持。
造礁石珊瑚; 有性繁殖; 多孔鹿角珊瑚; 丛生盔形珊瑚; 性腺
1 前言
珊瑚礁生态系统是生物多样性最高的海洋生态系统之一, 它不仅为人类的生产和生活提供各种资源, 而且具有巨大的生态功能和价值, 对保障生物多样性、生物生产力和生态平衡具有重要作用[1]。然而, 海水中二氧化碳浓度升高、表层海水升温、臭氧层破坏加剧以及人类破坏性活动导致珊瑚礁生态系统逐渐衰退[2-8], 这使得珊瑚礁生态系统的恢复和修复工作越来越受到人们关注。近年来, 利用造礁石珊瑚的有性繁殖进行珊瑚礁生态系统修复, 受到越来越多研究者的认可[9-11]。造礁石珊瑚繁殖生物学的深入研究, 是开展造礁石珊瑚有性繁殖的基础, 具有重要的指导意义。
造礁石珊瑚分为雌雄同体(Hermaphroditic)、雌雄异体(Gonochoric)[12]和假雌全异株(Pseudogynodioecious)[13]。迄今, 国外对珊瑚的繁殖生物学有较多研究, 雌雄同体[14]、雌雄异体[15]和假雌全异株[13]的珊瑚都有相关研究。国内在珊瑚的繁殖生物学研究方面较少, 李元超等[16]进行了三亚鹿回头佳丽鹿角珊瑚(Acropora pulchra)卵母细胞发育的组织学研究; 黄洁英等[17]研究了三亚鹿回头膨胀蔷薇珊瑚(Montipora turgescen)和壮实鹿角珊瑚(Acropora robusta)的胚胎和幼虫发育过程; 杨小东[18]等做了徐闻珊瑚礁保护区澄黄滨珊瑚(Porites lutea)、大管孔珊瑚(Goniopora djiboutiensis)和丛生盔形珊瑚的繁殖生物学研究。多孔鹿角珊瑚和丛生盔形珊瑚的的性腺组织学方面已有研究[13,18,19.20], 然而, 丛生盔形珊瑚的有性繁殖类型存在争议。多孔鹿角珊瑚与丛生盔形珊瑚是三亚鹿回头海域常见优势种[21], 加大其繁殖生物学的深入研究, 厘清它们有性繁殖特征, 为珊瑚礁生态恢复工作提供理论依据。所以, 本研究对三亚鹿回头多孔鹿角珊瑚与丛生盔形珊瑚性腺特征进行了研究, 研究结果明确了多孔鹿角珊瑚与丛生盔形珊瑚有性繁殖类型, 丰富了造礁石珊瑚繁殖生物学的基础资料。
2 材料与方法
2.1 材料
多孔鹿角珊瑚采集时间分别为2012年3月19日、2012年3月27日和2012年4月1日; 丛生盔形珊瑚样品采集时间为2013年4月13日。多孔鹿角珊瑚与丛生盔形珊瑚均采自海南省三亚市鹿回头海域(图1), 水深3—5 m。样品取于丛径大于15 cm,健康珊瑚的顶端, 其大小为 5 cm, 每次每种珊瑚各10株。
2.2 方法
珊瑚样品用5%海水甲醛固定24 h, 连续5 d用50%甲酸脱钙。然后用50%乙醇、70%乙醇、80%乙醇、90%乙醇、95%乙醇和无水乙醇逐级脱水。性腺用二甲苯透明, 54 ℃石蜡包埋, 制成4 μm的连续切片。用无水乙醇、95%乙醇、90%乙醇、80%乙醇、70%乙醇和50%乙醇逐级水化, 经H-E(hematoxylineosinstaining)染色, 凝胶树脂封片, 在Leika DMIRB显微镜下观察, 并用Leica DC500拍照。
3 结果与分析

图1 采样站位图(★代表采样区域)Fig. 1 Maps of the sampling location (marked by ★)
3.1 多孔鹿角珊瑚性腺组织学观察
3.1.1 多孔鹿角珊瑚无性繁殖期内部结构特征
多孔鹿角珊瑚属于六放珊瑚亚纲, 其生殖腺来源于内胚层, 位于口道内侧隔膜内。多孔鹿角珊瑚消化循环腔被隔膜隔成 6个部分, 无精巢与卵巢发育, 含有 6个独立的萎缩生殖腺; 消化循环腔体壁由外胚层、中胶层、内胚层及肠表皮等结构组成; 造礁石珊瑚共生虫黄藻位于体壁内; 消化循环腔外有刺丝囊结构(图2)。
3.1.2 多孔鹿角珊瑚性腺特征
多孔鹿角珊瑚的卵母细胞与精母细胞在同一个消化循环腔内, 卵巢与精巢之间由肠表皮隔开, 生殖腔内未发现虫黄藻(图2b, 图3a)。按Bernardo[14]的标准, 将2012年3月19日和3月27日的多孔鹿角珊瑚卵母细胞划分为Ⅲ时相卵母细胞, 其细胞核光滑, 带有明亮的核仁, 未开始向动物极移动。卵黄松散, 囊泡充满脂质。肠表皮内能看到虫黄藻, 肠系膜内未见虫黄藻。多孔鹿角珊瑚卵母细胞直径大小由3月19日的250—300 μm增至3月27日的300—400 μm(图2c, 图3b)。2012年3月19日和3月27日的多孔鹿角珊瑚精母细胞可划分为Ⅱ时相精母细胞, 已发展到楔形细胞, 组织完善, 封闭在中胶层,具有明显的细胞核。肠表皮内能清晰看到虫黄藻,肠系膜内未见虫黄藻。精巢直径大小由3月19日的50 μm—70 μm左右增至3月27日的60—90 μm(图2d, 图3c)。3月27日多孔鹿角珊瑚精母细胞有少数发育较快的发育至Ⅲ时相, 精巢的中心开始形成一个腔隙(图3d)。2012年3月19日和3月27日的多孔鹿角珊瑚卵母细胞发育均比精母细胞发育快。2012年4月1日多孔鹿角珊瑚卵巢与精巢之间的肠表皮消失, 由肠系膜隔开, 且肠系膜内未见虫黄藻(图4a)。2012年4月1日多孔鹿角珊瑚卵母细胞可划分为Ⅳ时相卵母细胞, 其细胞核偏位并向相邻的卵黄膜靠近, 卵黄相当均匀, 卵黄膜从中胶层局部回缩, 直径大小在 300—450 μm之间, 已经发育成熟(图4c)。2012年4月1日多孔鹿角珊瑚精巢直径大小在120—200 μm之间, 精母细胞可划分为Ⅳ时相精母细胞, 其大小较小, 数量较多, 已经看不出Ⅲ时相精巢的中间空隙, 精母细胞发育跟卵母细胞发育已经同步(图4b)。
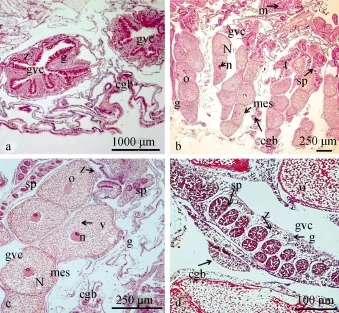
图2 2012年3月19日采集的多孔鹿角珊瑚性腺组织切片Fig. 2 The gonads of Acropora millepora sampled on 19th, March 2012 by H & E staining

图3 2012年3月27日采集的多孔鹿角珊瑚性腺组织切片Fig. 3 The gonads of Acropora millepora sampled on 27th, March 2012 by H & E staining

图4 2012年4月1日采集的多孔鹿角珊瑚性腺切片照片Fig. 4 The gonads of Acropora millepora sampled on 1st, April 2012 by H & E staining
3.2 丛生盔形珊瑚性腺组织学观察
3.2.1 丛生盔形珊瑚无性繁殖期内部结构特征
丛生盔形珊瑚属于六放珊瑚亚纲, 其生殖腺来源于内胚层, 位于口道内侧隔膜内。其消化循环腔被隔膜隔成12(6的倍数)个部分, 无精巢与卵巢发育,含有12个独立的萎缩生殖腺; 消化循环腔体壁由外胚层、中胶层、内胚层及肠表皮等结构组成; 造礁石珊瑚共生虫黄藻位于体壁内; 消化循环腔外有刺丝囊结构(图6a)。
3.2.2 丛生盔形珊瑚性腺特征
丛生盔形珊瑚具有发育完全的红色卵子和发育不完全的白色卵子(图5, 图7a)。具有红色卵子的丛生盔形珊瑚生殖腔内未发现精母细胞, 仅有卵母细胞(图 6b)。卵母细胞发育到Ⅲ时相, 其细胞核光滑, 带有明亮的核仁, 未开始向动物极移动。卵黄松散, 囊泡充满脂质。肠表皮内能看到虫黄藻, 肠系膜内未见虫黄藻。卵母细胞直径大小在150—200 μm之间(图6c)。具有白色卵子的丛生盔形珊瑚经过暂养, 于2013年4月27日出现排卵行为(图 7b), 卵子未能发育成幼体且两天后破裂。
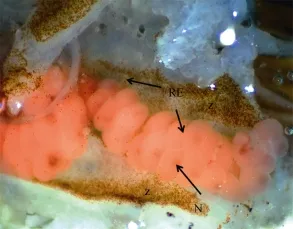
图5 2013年4月13日丛生盔形珊瑚的红色卵子Fig. 5 Red eggs of Galaxea fascicularis sampled on 13th, Apr, 2013

图6 2013年4月13日采集的丛生盔形珊瑚性腺组织切片Fig. 6 The gonads of Galaxea fascicularis sampled on 13th, April 2013 by H & E staining

图7 2013年4月27日采集的即将产卵的丛生盔形珊瑚和已排的白色卵子Fig. 7 Galaxea fascicularis spawning and the white eggs on 27th, Apr, 2013
4 结论
4.1 多孔鹿角珊瑚和丛生盔形珊瑚有性繁殖类型
多孔鹿角珊瑚精巢与卵巢保持在同一个消化循环腔内发育, 即多孔鹿角珊瑚为雌雄同体产卵型珊瑚。此结果与Baria等人推断多孔鹿角珊瑚的有性繁殖类型相符[22]。丛生盔形珊瑚为假雌全异株型珊瑚,有两种性腺, 分别发育红色卵子和白色卵子, 两种性腺生理功能不一致。具有红色卵子的丛生盔形珊瑚消化循环腔内仅有卵巢, 没有精巢, 具有明显卵黄颗粒, 其红色卵子具有繁殖能力, 说明可育红色卵子的丛生盔形珊瑚为全雌株珊瑚, 另一类丛生盔形珊瑚其白色卵子不具有繁殖能力, 说明可育白色卵子的丛生盔形珊瑚为假雌雄同体株珊瑚; 此结果与 Harrison[13]一致, 丛生盔形珊瑚为假雌全异株型珊瑚, 即丛生盔形珊瑚有全雌株和假雌雄同体株珊瑚, 丛生盔形珊瑚白色卵子为不完全发育卵子, 不具有繁殖能力。
关于丛生盔形珊瑚为雌雄同体型珊瑚[18]和雌全异株型珊瑚[19]的说法不全面。杨小东[18]未能获得丛生盔形珊瑚的两种卵子, 仅凭其中一种珊瑚性腺的石蜡切片并不足以说明丛生盔形珊瑚有性繁殖类型。Shashank等[19]未能观察到精巢结构, 单纯靠颜色和大小区分红色卵子与白色卵子, 并不科学; 其研究需单独对白色卵子进行受精才能有效证明其繁殖能力, 而不是采取白色卵子和红色卵子混合受精的方式进行验证, 缺乏严谨。
4.2 多孔鹿角珊瑚和丛生盔形珊瑚珊瑚性腺特征和规律
产卵型珊瑚Ⅱ时相卵母细胞、Ⅲ时相卵母细胞、Ⅳ时相卵母细胞发育时间分别为3个月、5个月、1个月; Ⅱ时相精母细胞、Ⅲ时相精母细胞发育、Ⅳ时相精母细胞发育时间分别为4个月、1个月、1个月[13]。前期卵母细胞发育比精母细胞发育快, 但最终达到同步。目前国际对珊瑚性腺的组织学研究主要用于繁殖力计算等[14,23,24], 只能大概推断珊瑚产卵时间, 但不够精确, 李元超仅推断出三亚鹿回头佳丽鹿角珊瑚排卵时间为 4月底至5月初。
确认珊瑚排卵时间的关键在于珊瑚性腺发育后期的一个月, 因此本研究仅采集性腺发育后期的珊瑚母体作为样品。2012年3月19日和3月27日多孔鹿角珊瑚卵巢与精巢之间由肠表皮隔开; 2012年4月1日多孔鹿角珊瑚卵巢与精巢之间的肠表皮已经消失, 它们仅由肠系膜隔开; 2012年4月6日三亚鹿回头多孔鹿角珊瑚发生大规模集体产卵。因此,多孔鹿角珊瑚卵巢与精巢之间的肠表皮消失是即将产卵的标志。2013年4月13日丛生盔形珊瑚的卵母细胞处于Ⅲ时相, 其卵母细胞相对多孔鹿角珊瑚同时期卵母细胞较小, 推测在20 d左右, 即5月初产卵。我们后续的调查发现进一步证实相关推测,即2013年5月2日三亚鹿回头丛生盔形珊瑚发生大规模集体产卵。
4.3 多孔鹿角珊瑚和丛生盔形珊瑚性腺发育期间虫黄藻的观察
多孔鹿角珊瑚在性腺发育后期阶段, 其虫黄藻不存在于卵母细胞和精母细胞内, 仅存在体壁之内。因此, 本研究进一步证实多孔鹿角珊瑚虫黄藻由后天获取的推断[22]。本研究采集丛生盔形珊瑚时其虫黄藻不存在于卵母细胞内, 只存在体壁之内。所以, 丛生盔形珊瑚虫黄藻也是由后天获取, 与Babcock等人研究结果一致[22]。
[1] 邹仁林. 中国动物志-造礁石珊瑚[M]. 北京: 科学出版杜, 2001: 9-18.
[2] GATES R D. Seawater temperature and sublethal bleaching in Jamaica[J]. Coral Reefs, 1990, 8: 193-197.
[3] PRATCHETT M S. Dynamics of an out break population of Acanthaster planci at Lizard Island, northern Great Barrier Reef (1995-1999)[J]. Coral Reefs, 2005, 24:453-462.
[4] HOEGH G O, MUMBY P J, HOOTEN A J, et al. Coral reefs under rapid climate change and ocean acidification[J]. Science, 2007, 318: 1737-1742.
[5] HELEN S, ANDREW B, ANDREA M. Impact of the live reef fish trade on populations of coral reef fish off northern Borneo[J]. Proceeding of the Roval Society Biology, 2007, 274: 989-994.
[6] KUFFNER I B. Effects of ultraviolet radiation and water motion on the reef coral, Porites compressa Dana: a transplantation experiment[J]. Joural of Experimental Marine Biology and Ecology, 2002, 270:147-169.
[7] DULVY N K, ZHANG K S. The exploitation of coral reefs in Tanzania’s Mafia Island: the administrative dilermma[J]. Ambio, 1995, 24(6): 358-365.
[8] ANGELA D, ROBERT V W. Survival under chronic stress from sediment load: spatial patterns of hard coral communities in the southern islands of Singapore[J]. Marine Pollution, 2006, 52: 1340-1354.
[9] OMORI M, FUJIWARA S. Manual for restoration and remediation of coral reefs nature conservation bureau[J]. Ministry of Environment, 2004, 1-84.
[10] ROEROE K A, YAP M, et al. Development of a coastal environment assessment system using coral recruitment[J]. Fisheries Science, 2009, 75(1): 215-224.
[11] RAYMUNDO L J, MAYPA A P. Getting bigger faster:mediation of size-specific mortality via fusion in juvenile coral transplants[J]. Ecological Applications, 2004, 14(1):281-295.
[12] SZMANT A M. Reproductive ecology of Caribbean reefcorals[J]. Coral Reefs, 1986, 5: 43-54.
[13] HARRISON P L. An unusual breeding system in the scleractinian coral Galaxea fascicularis[J]. Proceedings of the 6th International Coral Reef Symposium, 1988, 2:669-705.
[14] BERNARDO V A, SUSAN B, COLLE S, et al. The reproductive seasonality and gametogenic cycle of Acropora cervicornis off Broward County, Florida, USA[J]. Coral Reefs, 2006, 25: 110-122.
[15] ELENA Q, JOSEP M G, PABLO J, et al. Sexual reproductive cycle of the epibiotic soft coral Alcyonium coralloides(Octocorallia, Alcyonacea)[J]. Aquatic Biology, 2013, 18: 113-124.
[16] 李元超, 黄晖, 董志军, 等. 鹿回头佳丽鹿角珊瑚卵母细胞发育的组织学研究[J]. 热带海洋学报, 2009, 1(28):56-60.
[17] 黄洁英, 黄晖, 张浴阳, 等. 膨胀蔷薇珊瑚和壮实鹿角珊瑚的胚胎和幼虫发育[J]. 热带海洋学报, 2011, 2(30):67-73.
[18] 杨小东. 澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚性腺发育与生长规律的研究[D]. 湛江: 广东海洋大学, 2013:22-29.
[19] SHASHANK K, HSU CHIAMIN, KUO CHAOYANG, et al. Larval development offertilized “Pseudo-Gynodioecious”eggs suggests a sexual pattern of gynodioecy in Galaxea fascicularis (Scleractinia: euphyllidae)[J]. Zoological Studies, 2012, 51(2): 143-149.
[20] ANDREW H B, JAMES R G, BETTE L. Systematic and biogeographical patterns in the reproductive biology of scleractinian corals [J]. Reviews in Advance, 2009, 40:551-571.
[21] 练健生, 黄晖, 黄良民, 等. 三亚珊瑚礁及其生物多样性[M]. 北京: 海洋出版杜, 2001: 87-90.
[22] BARIA M V B, DELA CRUZ D W, VILLANUEVA R D, et al. Spawning of three-year-old Acropora Millepora corals reared from larvae in Northwestern Philippines[J]. Bulletin of Marine Science, 2012, 88:61-62(2).
[23] BABCOCK R C, HEYWARD A J. Larval development of certain gamete-spawning scleractinian corals[J]. Coral Reefs, 1986, 5(3): 111-116.
[24] SHLESINGER Y, GOULET T L, OYA Y L. Reproductive patterns of scleractinian corals in the northern Red Sea[J]. Marine Biology, 1998, 132: 691-701.
Histological analyses of the gonad for Acropora millepora and Galaxea fascicularis from Sanya Luhuitou of Hainan Island
ZHANG Shize1,2,3, HUANG Hui1,2, ZHANG Yuyang1, ZHOU Guowei1,2, JIANG Lei1,2,3, CHEN Biao1,2,3
1. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, CAS, Guangzhou 510301, China
2. National Experiment Station of Tropical Marine Biology, Hainan Island, Sanya 572000, China
3. University of Chinese Academy of Sciences, Beijing 100039, China
Reproductive biology is the basis of the sexual reproduction for scleractinian coral. It is very important in the rehabilitation and restoration of coral reef ecosystem. In this study, histological analyses were firstly performed on scleractinian coral Acropora millepora and Galaxea fascicularis from Sanya Luhuitou of Hainan Island. The characteristics of gonad and sexual reproduction were described and compared for both coral species. The results were as follows. (1) A. millepora was hermaphroditic spawning coral, but G. fascicularis was pseudo-gynodioecious spawning coral. (2) Symbiotic zooxanthellae were primary acquired after nature for both coral speices. (3) A. millepora spawned about 5 days after the stage Ⅳ of the developing oocytes and spermatocytes, when the gasrtodermis between ovary and testis disappeared. However, G. fascicularis spawned about 20 days after the stage Ⅲ of the developing oocytes. This study provided useful formation for the reproductive biology of scleratinian coral in Sanya.
scleratinian coral; sexual reproduction; A. millepora; G. fascicularis; gonad
10.14108/j.cnki.1008-8873.2016.01.006
A
1008-8873(2016)01-041-06
2014-04-30;
2014-05-18
国家自然基金项目(41206140, 41306144); 海洋公益性行业科研专项经费项目(201305030-3, 201105012-2); 海南省重大科技项目(ZDZX2013014);国家科技支撑计划项目(2012BAC19B08)
张诗泽(1988—), 男, 广东汕头人, 硕士研究生, 主要从事珊瑚生物学研究, E-mail: zhangshize1988@qq.com
*通信作者:黄晖; 研究员, 主要从事珊瑚生物学与珊瑚礁生态学研究, E-mail: huanghui@scsio.ac.cn
张诗泽, 黄晖, 张浴阳, 等. 鹿回头多孔鹿角珊瑚与丛生盔形珊瑚性腺组织学研究[J]. 生态科学, 2016, 35(1): 41-46.
ZHANG Shize, HUANG Hui, ZHANG Yuyang, et al. Histological analyses of the gonad for Acropora millepora and Galaxea fascicularis from Sanya Luhuitou of Hainan Island[J]. Ecological Science, 2016, 35(1): 41-46.

