深圳石岩水库浮游植物群落时空动态特征及其影响因素分析
盛萧, 徐海升, 邓培雁*, 毛建忠, 刘威
1. 华南师范大学化学与环境学院, 广东, 广州 510631
2. 深圳市铁岗·石岩水库管理处, 广东, 深圳 518034
3. 云南省水文水资源局, 云南, 昆明 650106
4. 珠江流域水环境监测中心, 广东, 广州 510611
深圳石岩水库浮游植物群落时空动态特征及其影响因素分析
盛萧1, 徐海升2, 邓培雁1*, 毛建忠3, 刘威4
1. 华南师范大学化学与环境学院, 广东, 广州 510631
2. 深圳市铁岗·石岩水库管理处, 广东, 深圳 518034
3. 云南省水文水资源局, 云南, 昆明 650106
4. 珠江流域水环境监测中心, 广东, 广州 510611
于2013年5月至2014年4月对深圳石岩水库进行采样, 研究了深圳石岩水库浮游植物群落组成、时空动态及其主要的环境影响因素, 以期为该水库水质的保障和改善提供科学依据。石岩水库全年共检测到浮游植物 7门 90属, 以绿藻门(41.1%)、硅藻门(30.0%)和蓝藻门(20.0%)为主。浮游植物的种类在9月份最丰富, 有61种, 8月份最少, 仅有18种。各采样区的浮游植物丰度, 在6月份达到最大值, 为1.76×108cells·L-1, 在10月份出现最低值, 为2.74×106cells·L-1。绿藻、硅藻和蓝藻的丰度之和在全年所占比例都较高, 变化范围为96.74%—100%, 以蓝藻居多, 占51.55%—92.23%,其中, 绿藻门的优势属为十字藻属(Crucigenia)、栅藻属(Scenedesmus)、小球藻属(Chlorella); 硅藻门的优势属为直链藻属(Melosira)、小环藻属(Cyclotella); 蓝藻门的优势属为假鱼腥藻属(Pseudanabaena)。冗余分析(Redundancy analysis, RDA)表明: 全部样品分布在轴1与轴2构成的4个象限内, 轴2左侧与冬(春秋)季对应, 轴2右侧与夏季对应; 绝大多数藻类分布在冬(春秋)季对应的象限内, 少数藻类包括硅藻门的卵形藻属(Cocconeis)、蓝藻门的平裂藻属(Merismopedia)、尖头藻属(Raphidiopsis)和鞘丝藻属(Lyngbya)以及绿藻门的衣藻属(Chlamydomonas)分布在夏季所对应的象限内; 研究结果表明影响石岩水库浮游植物群落结构动态的主要驱动因子是水温(Temperature, TEMP)、总有机碳(Total Organic Carbon, TOC)、硝酸盐氮(NO3-N)和总氮(Total Nitrogen, TN)。
石岩水库; 浮游植物; 时空动态; 富营养化; 理化因子
石岩水库位于广东省深圳市宝安区, 是宝安区重要的饮用水源地。石岩水库流域集水面积44.77 km2, 总体地形东高西低, 流域内有 6 条主要入库支流, 分别是东岸的石岩河、白坑窝、深坑坜、王家庄溪和西岸的运牛坑、麻布水。随着深圳城市化进程的加快, 人口逐年增加, 各子流域内点源与非点源污染都很严重, 生活污水、工业废水、固体垃圾以及化肥、农药、畜禽排泄物和土壤流失随以上入库河流等对水库水质的保持与改善产生严重的威胁。此外,深圳属南亚热带海洋性季风气候, 常年平均气温在20 ℃以上, 为水库藻类繁殖创造了良好条件, 水库又具有典型湖泊性质的水力学特征, 流速缓慢, 使得富营养化问题成为影响石岩水库供水的主要风险。
浮游植物生长周期短, 对环境变化敏感, 其群落结构特征能够反映水库现状, 特别是能反映水库中营养水平的变化[1], 同时, 环境条件的变化也会影响浮游植物的群落结构[2]。而在不同地区不同类型的水库中, 影响浮游植物群落的关键因子有所不同[3]。一般而言, 温度和营养盐是影响浮游植物生长的主导因子[4]。亚热带地区, 虽然温度和光照对浮游植物群落的影响相对来说不如温带地区那么显著, 但流域水文的季节性变化可以引发浮游植物群落的季节性变化[5], 从而使浮游植物群落结构具有时间差异性。此外, 水库作为一个半自然半人工的水体, 具有一定的空间异质性[6], 基于此,浮游植物群落可能会产生时空异质性。因此, 对水库的污染防治应采取因地制宜的策略, 从而能更全面的掌握和改善当地水库的水质状况。
目前对石岩水库的研究仅限于从环境因子来阐明其水质污染状况, 并基于此提出防治对策, 缺乏对水库系统内浮游植物群落特征的研究。本文是在对石岩水库水质系统监测的基础上, 研究了石岩水库浮游植物群落组成、时空动态及其主要的环境影响因素, 以期为石岩水库供水水质的保障和改善以及实现其水资源的可持续利用提供科学依据。
1 材料与方法
1.1 采样点位置
根据石岩水库的地形和环境特征, 水库从上游入水口处到下游大坝依次分为三个区域, 即河流区、过渡区和湖泊区, 三个区在水动力学过程、物理、化学和生物学上存在明显差异[7], 故将此三区各设一个采样区, 分别为 S1、S2、S3, 并在每个采样区各选取3个采样点(如图1)。于2013年5月至2014年4月每月各采样两次。

图1 石岩水库采样点示意图Fig. 1 Sampling sites of Shiyan Reservoir
1.2 采样与分析方法
浮游植物定性样品用 25号浮游生物网(网孔直径为64 μm), 在水面表层呈“∞”字形缓慢捞取, 浓缩液置于100 mL塑料水样瓶中, 鲁哥液固定, 实验室供镜检分类鉴定[8]。定量样品用1 L有机玻璃采水器分别于各采样点表层0.5 m采集1 L水样, 鲁哥液固定, 实验室静置沉降, 锥形量筒沉淀浓缩。定量分析时, 从浓缩样中吸取0.1 mL 置于10×10的生物计数框中, 光镜下计数并换算成丰度[9]。
理化数据: 通过使用事先校正好的 YSI-650型多功能水质检测仪现场测定获取水温(TEMP, Temperature)、电导率(Conductivity, Con)、溶氧(Dissolved Oxygen, DO)、pH等指标, 基本水化指标包括总氮(Total nitrogen, TN)、总磷(Total phosphorus, TP)、硝酸盐氮( NO3-N)、氨氮(NH4-N)和可溶性正磷酸盐(PO4-P)的浓度, 根据GB 3838-2002标准方法在实验室内完成测定[10]。
1.3 数据处理与分析
数据 CANOCO4.5用于排序分析和绘图, 排序结果用物种-环境因子关系的双序图表示。在主轴1和主轴 2构成的平面图中, 箭头表示环境因子在平面上的相对位置, 向量长短代表相应环境因子与研究对象的相关程度大小, 箭头所处象限代表环境因子与排序轴间相关性的正负[11]。对库区内主要浮游植物种类的密度在主轴上的排序, 则可反映其与环境因子之间的对应关系。
为探究不同环境因子对石岩水库水体中浮游植物的影响, 对浮游植物与环境参数进行排序分析。用于排序分析的浮游植物要求该种类在各区出现的频度≥5, 在至少一个采样区的相对丰度>l %, 满足这两点要求的浮游植物种类才能进入排序分析矩阵。经过筛选后的浮游植物(共38种)代码见表2。分析前, 将浮游植物丰度值和环境因子(除pH外)采用lg (x+1)进行处理。首先对浮游植物数量进行除趋势对应分析(Detrended correspondence analysis, DCA),以确定其属于线型分布或单峰型分布[12]。利用变量预选法(forward selection)对环境因子进行逐步筛选,相关显著性用蒙特-卡罗(Monte Carlo)置换法进行检验。
冗余分析是一种多元线性直接梯度分析方法,它基于统计学的角度评定一个或一组变量与另一组多变量数据之间的相互关系[13], 能有效进行多个环境指标的统计检验, 并能确定对群落结构变化具有最大解释能力的最小变量组, 从而更好反映群落与环境之间的关系[14]。
2 结果
2.1 浮游植物群落组成及优势种
连续12个月, 24次采样共检测到浮游植物7门90属, 主要由蓝藻门、绿藻门和硅藻门的藻类组成。其中, 绿藻门 37属, 占总属数的 41.1%, 优势属为十字藻属(Crucigenia)、栅藻属(Scenedesmus)、小球藻属(Chlorella); 硅藻门27属, 占30.0%, 优势属为直链藻属(Melosira)、小环藻属(Cyclotella); 蓝藻18属, 占 20.0%, 优势属为假鱼腥藻属(Pseudanabaena);裸藻门3属, 占3.3%; 甲藻门、隐藻门各2属, 各占2.2%; 金藻门1属, 占1.2%(图2)。总体而言, 石岩水库在浮游植物种类数组成上属于绿藻-硅藻型。
2.2 浮游植物群落组成的时间动态
浮游植物在种类组成和数量上随时间变化而呈现差异(图3), 5、7、8月仅能检测到绿藻、硅藻和蓝藻三大门类, 2、9月, 能检测到七大门类。24次采样中全年均有检测到的属类有: 绿藻门中的角星鼓藻属(Staurastrum)、鼓藻属(Cosmarium)、十字藻属(Crucigenia), 硅藻门中的直链藻属(Melosira)、菱形藻属(Nitzschia)、针杆藻属(Synedra)、舟形藻属(Navicula), 蓝藻门的平裂藻属(Merismopedia)、假鱼腥藻属(Pseudanabaena)、尖头藻属(Raphidiopsis)。

图2 石岩水库浮游植物种类组成Fig. 2 Phytoplankton composition of Shiyan Reservoir
浮游植物的总种类数量在 9月最多, 达 61种,其次为6月(48种), 以7月(28种)和8月(19种)最少。绿藻种类数量最多出现在5月, 为24种, 而硅藻和蓝藻种类数量最多则出现在9月, 分别为18种、16种; 绿藻和硅藻种类数量最少均出现在 8月, 分别为4种、10种, 蓝藻种类数量在8月(5种)也较少, 仅比其数量最少的3月(4种)多1种。甲藻、隐藻、裸藻和金藻在全年内出现频率较低。
2.3 浮游植物丰度时空分布特点
石岩水库各采样区浮游植物丰度之和在 6月份达到最大值为1.76×108cells·L-1, 最低值出现在10月份, 为 2.74×107cells·L-1, 表明石岩水库浮游植物丰度具有季节差异性, 且变动较大(图 4)。从各门类丰度所占比例来看, 绿藻门、蓝藻门和硅藻门的丰度之和在每月所占比例都较高, 变化范围为 96.74%—100%, 其它门类所占比例较低。根据浮游植物丰度评价方法[15], 石岩水库水质为中富营养-富营养水平。
石岩水库S1、S2、S3三区的浮游植物年平均丰度分别2.53×107cells·L-1、2.36×107cells·L-1、2.41× 107cells·L-1, 都以蓝藻占绝对优势, 其次为硅藻。各采样区最小浮游植物丰度均出现在10月。尽管3个采样区的浮游植物丰度在个别月份随时间变化呈现一定的差异, 但总体趋势大致相同, 表明石岩水库浮游植物群落丰度的空间分布差异不明显。
由表1可知, 石岩水库浮游植物群落不仅总体密度有季节差异, 而且各个门类的丰度也随着季节变动, 但大部分的浮游植物门类与其种类数量的时间动态不具有一致性。蓝藻门在全年内(1月除外, 在一月份为硅藻门占优势, 所占比例为50.26%)占优势,其丰度所占比例范围为51.55%—92.23%, 且在6月达到最高, 原因可能是与蓝藻最适温度及对高温的耐受性要强于其它藻类[16]有关。硅藻的种类数在全年的变化差异不大, 然而其丰度比例随时间变化明显,除5月外, 呈现“先升高后下降”的趋势, 在一月份达到最大, 超过藻类总数量的一半。绿藻的丰度所占比例在全年内都较低, 在8月份最低, 仅占1.53%,在9月相对较高, 达到16.76%, 前后差异变化显著,但与其种类数量变化一致。其他 4门藻中, 仅隐藻的数量在温度较低的冬季有一定的增加。

图3 石岩水库浮游植物的种类组成变化Fig. 3 Numbers and composition of species of phytoplankton in Shiyan Reservoir

图4 石岩水库各采样区浮游植物丰度(106cells·L-1)Fig. 4 Cell densities of phytoplankton in 3 sampling sites of Shiyan Reservoir(106cells·L-1)
表1 石岩水库浮游植物各门类的丰度所占比例%Tab. 1 Proportions of cell densities of each phytoplankton in Shiyan Reservoir
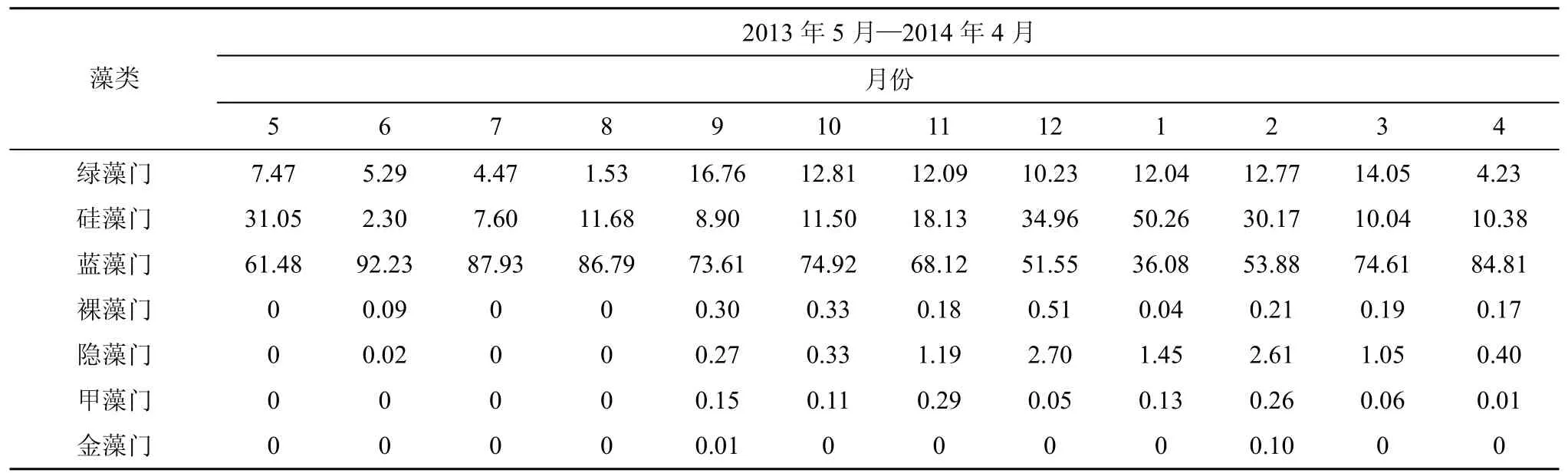
表1 石岩水库浮游植物各门类的丰度所占比例%Tab. 1 Proportions of cell densities of each phytoplankton in Shiyan Reservoir
藻类2013年5月—2014年4月月份5 6 7 8 9 10 11 12 1 2 3 4绿藻门 7.47 5.29 4.47 1.53 16.76 12.81 12.09 10.23 12.04 12.77 14.05 4.23硅藻门 31.05 2.30 7.60 11.68 8.90 11.50 18.13 34.96 50.26 30.17 10.04 10.38蓝藻门 61.48 92.23 87.93 86.79 73.61 74.92 68.12 51.55 36.08 53.88 74.61 84.81裸藻门 0 0.09 0 0 0.30 0.33 0.18 0.51 0.04 0.21 0.19 0.17隐藻门 0 0.02 0 0 0.27 0.33 1.19 2.70 1.45 2.61 1.05 0.40甲藻门 0 0 0 0 0.15 0.11 0.29 0.05 0.13 0.26 0.06 0.01金藻门 0 0 0 0 0.01 0 0 0 0 0.10 0 0
2.4 浮游植物群落与水体理化因子的关系
除趋势对应分析(DCA)结果表明, 三个采样区所有轴中最长梯度均小于 3, 适合选用基于线性的RDA(Redundancy analysis)。
石岩水库浮游植物群落与环境因子的 RDA分析结果见表3、图5和图6。由表3可知, S1区和S3区的总典型特征值高于S2区, 而第1排序轴的典型特征值则低于S2区; 3个采样区浮游植物种类与环境因子的前两轴相关系数都较高, 达到了 0.880以上; 在S3区, 轴2中的浮游植物种类与环境因子的相关性达0.975; 就浮游植物而言, 3个采样区轴1和轴2之间的相关性分别为-0.0818、0.0100、0.0269, 表明这两个排序轴几近相互垂直; 就环境因子而言, 3个采样区前两个排序轴间的相关性均为0, 表明这两个排序轴相互垂直, 以上均说明排序轴与环境因子间的线性拟合程度能较好地反映物种与环境因子间的关系, 说明排序结果是可靠的。结合轴1和轴2的贡献率分析, 3个采样区前2个排序轴的物种总贡献率分别为34.4%、34.7%、32.8%, 物种-环境总贡献率分别为54.6%、78.3%、49.2%(蒙特-卡罗检验(P-value)均小于0 .005), 表明排序轴结果在统计学上是显著的。

表2 RDA分析中浮游植物种类代码Tab. 2 Codes of phytoplankton species for RDA

表3 浮游植物与环境因子的排序分析Tab. 3 Redundancy analysis results of phytoplankton and environmental factors
从图5可以看出, 3个采样区的样品在环境因子上的分布均与季节近乎相同, 分布在轴1与轴2构成的4个象限, 轴2左侧均主要是10、11、12、1、2及3月, 轴2右侧则均主要是5、6、7和8月。因此, 3个采样区的浮游植物样品可近似看作分布在轴2的左右两侧, 分别对应着冬(春秋)季和夏季两个组群, 表明冬(春秋)季和夏季有较为明显的分界。尽管3个采样区环境因子的RDA排序略有变化, 但在这两个组群上的变化将近一致。
由图6所示的浮游植物与环境因子间的对应关系可知, 3个采样区均有水温(TEMP)和总有机碳(TOC)与轴 1呈正相关, 硝酸盐氮(NO3-N)和总氮(TN)与轴1呈负相关, 同时均有总氮(TN)与轴2呈正相关。除此之外, 在S1采样区, 氨氮(NH4-N)、总磷(TP)与轴 2呈正相关, 相关系数分别为 0.1816、0.3653, 而在S3采样区, 氨氮(NH4-N)、总磷(TP)与轴2呈负相关, 相关系数分别为-0.5723和-0.3281。

图5 石岩水库浮游植物样品的双轴等级排列Fig. 5 Ordination biplot of cases in Shiyan Reservoir
根据图6反映的石岩水库3个采样区浮游植物种类和环境因子之间的关系, 3个采样区表现出较为相似的结果。从浮游植物种类组成的双轴空间分布上看, 3个采样区隐藻门和裸藻门的藻类都分布在轴2的左侧, 而硅藻门、蓝藻门和绿藻门则有少部份分布在轴 2的右侧, 均有硅藻门的卵形藻属(Cocconeis)、蓝藻门的平裂藻属(Merismopedia)、尖头藻属(Raphidiopsis)和鞘丝藻属(Lyngbya)以及绿藻门的衣藻属(Chlamydomonas)分布在轴2右侧。轴2左侧主要与N、P营养盐的浓度表现出正相关, N、P营养盐的浓度是影响硅藻、蓝藻、绿藻、裸藻和隐藻门藻类丰度的主要环境变量。轴 2右侧与水温(TEMP)和总有机碳(TOC)表现出正相关, 表明卵形藻属、平裂藻属、尖头藻属、鞘丝藻属及衣藻属主要受TEMP和TOC的影响, 其中蓝藻门的尖头藻属和鞘丝藻属与TOC呈显著的正相关, 表明此种属适宜生长在有机物含量较高的水体。总而言之, 在冬(春秋)季, TN和NO3-N与第一主轴有较高的相关性,为主要贡献变量, 而在夏季, TEMP和TOC与第一主轴呈正相关, 为主要贡献变量。
在S1采样区, 轴1与TEMP呈最大显著正相关(r = 0.7139, p = 0.002), 与NO3-N呈最大负相关(r = -0.8110, p = 0.002), 轴2与pH呈最大显著正相关(r = 0.5257, p = 0.002)。轴1代表了水温和硝酸盐含量的变化状况, 轴2则反映了pH值的变化。沿第一轴, 浮游植物变化由喜好高硝酸盐含量的直链藻属(Melosira)到喜好高温的鞘丝藻属(Lyngbya)。蓝藻门、绿藻门的绝大多数藻属与 TN、TP、NO3-N和NH4-N有较好地相关关系, 并且不同类别的藻属对N、P营养盐的偏好呈现差异, 而硅藻门的卵形藻属(Cocconeis)、绿藻门的卵囊藻属(Oocystis)、衣藻属(Chlamydomonas)及四星藻属(Tetrastrum)等与pH呈显著的正相关。在S2采样区, 轴1与TEMP呈最大显著正相关(r = 0.7847, p = 0.002), 与NO3-N呈最大负相关(r = -0.6803, p = 0.002)。各门藻类大多与TN有较好地相关关系。在S3采样区, 轴1与TEMP呈最大显著正相关(r = 0.6233, p = 0.002), 与PO4-P呈最大负相关(r = -0.6497, p = 0.002), 轴2与透明度(SD)呈最大显著正相关(r = 0.6811, p = 0.002), 与深度(DEP)呈最大负相关(r = -0.5800, p = 0.002)。沿第一轴, 浮游植物变化由喜好高磷酸盐浓度的圆筛藻属(Coscinodiscus)到喜好高温的角星鼓藻属(Staurastrum)。
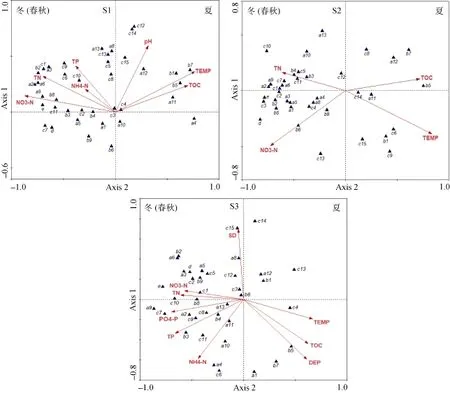
图6 浮游植物与环境因子RDA排序图Fig. 6 RDA biplot of phytoplankton species and environmental variables
3 讨论
3.1 浮游植物群落结构特征
调查期间, 共观察到浮游植物7门90属, 浮游植物的丰度范围在1.76×108cells·L-1—2.74×107cells·L-1之间。研究显示, 石岩水库浮游植物群落结构具有明显的季节差异。在种类组成上, 绿藻和硅藻在全年内所占比例较大。浮游植物的总种类数量在8月最少, 其次为7月, 而9月最多, 造成这种急剧性变动的原因可能与降水有关, 因水库所处地域为季风性区, 夏季降雨量较多, 导致水库水体动力学变化较大, 进而改变了适宜藻类生长的环境条件, 使得藻种类数降低, 而进入 9月份后, 降雨量大幅减少,库区水流流速减缓, 为各种藻类生长提供了有利条件, 致使浮游植物种类数骤然增多。在数量上, 除一月以硅藻占优势外, 其他月份则都以蓝藻占绝对优势, 其丰度都超过50%。蓝藻丰度高, 则意味着水体富营养化的程度也高[17]。石岩水库所在地区为亚热带, 常年气温较高, 适合蓝藻生长, 且在低温季节过后, 蓝藻的复苏温度和比生长速率都高于绿藻和硅藻[18], 因此, 从2月后, 蓝藻迅速生长, 继续保持其绝对优势。其中, 假鱼腥藻属为蓝藻中的优势藻属。有研究报道, 假鱼腥藻属可能会产生神经毒性氨基酸(P-N-甲氨基-L-丙氨酸), 诱导神经元损伤[19],故其大量存在会影响水体质量, 给当地居民生活带来危害, 为保证供水安全, 应加强对石岩水库水质的监测和治理。此外, 在研究过程中发现, 硅藻和隐藻的丰度所占比例在温度偏低的枯水期时有所升高,硅藻丰度在这一时期变化范围为30.17%—50.26%,隐藻变化范围为1.45%—2.70%, 相对于其他月份都较高, 原因可能是, 枯水期水温较低, 光照不充分,对水温和光照有着很好适应能力的硅藻因而能够获得优势地位[20]。隐藻在约10℃水温条件下易大量生长, 这与丹江口水库的研究结果一致[21]。
石岩水库浮游植物群落结构在空间分布上没有较大的差异, 三个采样区浮游植物的年平均丰度均在24×106cells·L-1左右, 都以蓝藻为优势, 其次为硅藻, 各采样区最大浮游植物丰度均出现在 6月, 这可能与 6月份水体中氨氮含量的升高有关, 一般认为氨氮是浮游植物较容易吸收且优先利用的氮源[22]。各采样区最小浮游植物丰度均出现在10月。尽管3个采样区的浮游植物丰度在个别月份随时间变化呈现一定的差异, 但总体趋势大致相同, 这可能与石岩水库的形态特征和入库河流有关。石岩水库各入库支流较小, 水流缓慢, 对水库的悬浮物、水体扰动等水动力特征影响较小, 且营养盐在各采样区中的传输主要为自由扩散以及水库放水引起的和吞吐流造成的水体平流输送。此外, 石岩水库其整个库区的深度梯度在全年内变化不大, 从而使内源营养盐的释放作用在纵向空间上的差异也较小。综上所述, 水库自身特有的形态结构、水动力学特征,以及所处的地理环境造成了浮游植物群落在种类和数量组成上有各自相应的特点。
3.2 影响浮游植物群落结构动态的因素分析
本研究结果表明, 影响石岩水库浮游植物群落结构动态的因素主要有是水温、总有机碳、硝酸盐氮和总氮。在冬(春秋)季, 总氮和硝酸盐氮为主要贡献变量; 在夏季, 水温和总有机碳为主要贡献变量。温度对浮游植物具有明显的影响。Temponeras等对Doirani湖的研究发现, 水温与总藻类生物量呈显著的相关关系[23]。王丽萍等对洋河水库富营养化的发展趋势研究中, 认为水温是水库水华暴发的主要驱动因子之一[24]。不同的浮游植物都有自身生长的最适温度, 而对于大多数浮游植物, 其最适生长温度在18—25℃之间[25]。温度主要是通过影响浮游植物光合作用和呼吸作用过程中的酶活性, 进而影响其代谢和繁殖[26]并限定其分布区域[27]。在本研究中,样品的RDA排序显示有部分藻分布在轴2的右侧,与水温呈显著相关, 表明夏季水温是影响藻类生长和分布的重要因素之一。TOC可用来表征水体中有机物的丰富程度。向水体中输入的TOC值越大, 有机物越多, 微生物分解产生的N、P营养盐越多, 浮游植物的种群数量则越多。张瑜斌等在对赤潮多发区深圳湾叶绿素a的时空分布调查分析中发现叶绿素a(浮游植物种群数量)与TOC等多种环境因子呈正相关[28]。本研究中, 3个采样区都有TOC与第一轴呈显著正相关, 表明石岩水库浮游植物群落结构的变化也与TOC量的多少有一定的关联。在S3采样区, 可观察到绿藻门中的四星藻属(Tetrastrum)与透明度有较高的相关关系, 表明四星藻属适宜生长在透明度较高的水体环境中。透明度对浮游植物的生长会产生间接的影响, 水体中的悬浮颗粒对光照有较强的散射作用, 能降低光照透射深度, 影响浮游植物的生长繁殖[29]。在其他环境条件一定时, 透明度越高, 浮游植物的光合作用则越强, 初级生产力越高[30]。水体深度增加, 喜好在水中或水底生存的浮游植物所接受的光照减少, 光合作用减弱, 生长繁殖受到阻抑。因此, 透明度和水深对浮游植物的分布和生长也有潜在的影响。淡水水体中的氮、磷营养盐长期以来被视为是影响浮游植物生长的限制因素, 其中过量磷的输入还是引起水体富营养化的主要原因[31], 而在石岩水库中, 仅有S1区, TP的浓度对藻类的生长有影响, 而在另两个采样区, 与藻类的生长分布无显著相关关系, 表明总磷并非是影响石岩水库浮游植物群落结构的关键因素。
水库是一种受人工调控程度较高的水体, 因此在不同地区、不同类型的水库中, 影响浮游植物种群分布的关键因子有所差异。有研究表明水温、电导率是浮游植物群落结构的主要影响因子[32]。也有研究阐明了在富营养化的水库中, 深度、pH对浮游植物的影响较大[33]。除以上一些主要的环境因素外,水库的运行管理(调水和供水)也会对生境造成短期的外在干扰, 进而改变了水库的水位、水力停留时间等水文条件及相关的理化因子, 最后间接导致浮游植物群落的更替或演替[34]。同时人类在水库周边的活动及浮游动物的下行效应[35]等在一定程度上也能影响浮游植物的群落结构。
4 结论
(1) 根据浮游植物丰度评价, 石岩水库水质偏中富营养-富营养水平, 浮游植物种类以绿藻、硅藻和蓝藻3大门类为主, 占总种类数的91.1%。浮游植物种类随季节变化明显, 在秋季较多, 夏季较少,而在空间分布上没有较大的差异。
(2) 石岩水库在浮游植物群落组成上属于绿藻-硅藻型, 群落结构有季节差异, 在夏季, 蓝藻在数量上占绝对优势, 在秋冬季, 蓝藻丰度有所下降,硅藻和隐藻则呈现升高趋势。温度和降水量可能是影响其数量和组成随季节变化的主要因素。
(3) 影响石岩水库浮游植物群落结构动态的主要驱动因子是水温、总有机碳、硝酸盐氮和总氮, 与环境因素变化关系较紧密的有硅藻门的卵形藻属(Cocconeis)、蓝藻门的平裂藻属(Merismopedia)、尖头藻属(Raphidiopsis)和鞘丝藻属(Lyngbya)以及绿藻门的衣藻属(Chlamydomonas)。
[1] SALMASO N, MORABITO G, BUZZI F, et al. Phytoplankton as an indicator of the water quality of the deep lakes south of Alps[J]. Hydrobiologia, 2006, 563:167-187.
[2] CROSSETTI L O, BICUDO C E D. Phytoplankton as a monitoring tool in a tropical urban shallow reservoir (Garcas Pond): the assemblage index application[J]. Hydrobiologia, 2008, 610: 161-173.
[3] 李秋华, 韩博平. 基于CCA的典型调水水库浮游植物群落动态特征分析[J]. 生态学报, 2007, 27 (6): 2355-2364.
[4] CET’INIC I, VILIČIC D, BURIC Z, et al. Phytoplankton seasonality in a highly stratified karstic estuary (Keka, Adriatic sea)[J]. Hydrobiologia, 2006, 555: 31-40.
[5] NOGUEIRA M G. Phytoplankton composition dominance and abundance as indicators of environmental compartmentalization in Jurumirim Reservoir (Paranapanema River), Ŝao Paulo, Brazil[J]. Hydrobiologia, 2000, 431:115-128.
[6] FIGUEREDO, CLEBER C, GIANI A. Seasonal variation in the diversity and species richness of phytoplankton in a tropical eutrophic reservoir[J]. Hydrobiologia, 2001, 445(1-3): 165-174.
[7] 韩博平. 中国水库生态学研究的回顾和展望[J]. 湖泊科学, 2010, 22(2): 151-160.
[8] 胡鸿钧, 魏印心. 中国淡水藻类-系统, 鉴定及生态[M].北京:科学出版社, 2006.
[9] 章宗涉, 黄祥飞. 淡水浮游植物研究方法[M]. 北京: 科学出版社, 1991.
[10] 国家环保总局. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境科学出版社, 2002.
[11] BRAAKTER C J F, SMILAUER P. CANOCO Reference Manual and user’s Guide to canoco for windows (version 4.5)[M]. New York: Centre for Biometry Wageningen, 2002.
[12] LEPš J, ŠMILAUER P. Multivariate analysis of ecological data using Canoco[M]. Cambridge: Cambridge University Press, 2003, 1-269.
[13] BORCARD D, LEGENDRE P, DRAPEAU P. Partialling out the spatial component of ecological variation[J]. Ecology, 1992, 73(3): 1045-1055.
[14] NOBES K, UTHICKE S, HENDERSON R. Is light the limiting factor for the distribution of benthic symbiont bearing foraminifera on the Great Barrier Reef[J]. Journal of Experimental Marine Biology and Ecology, 2008, 363(1-2): 48-57.
[15] 况琪军, 马沛明, 胡征宇, 等. 湖泊富营养化的藻类生物学评价与治理研究进展[J]. 安全与环境学报, 2005, 4(2):87-91.
[16] NALEWAJKO C, MURPHY T P. Effects of temperature, and availability of nitrogen and phosphorus on the abundance of Anabaena and Microcystis in Lake Biwa, Japan: an experimental approach[J]. Limnology, 2001, 2:45-48.
[17] 王朝晖, 林秋奇, 胡韧, 等. 广东省水库的蓝藻污染状况与水质评价[J]. 热带亚热带植物学报, 2004, 12(2):117-123.
[18] BYTTERWICK C, HEANEY S & TALLING J F. Diversity in the influence of temperature on the growth rates of fresh water algae, and its ecological relevance[J]. Fresh Water Biology, 2005, 50(2): 291-300.
[19] LOBNER D, PIANA P M T, SALONS A K, et al. p-N-methylamino-L-alanine enhances neurotoxicity through multiple mechanisms[J]. Neurobiology of Disease, 2007, 25: 360-368.
[20] 邓建明, 蔡永久, 陈宇炜, 等. 洪湖浮游植物群落结构及其与环境因子的关系[J]. 湖泊科学, 2010, 22(1): 70-78.
[21] 潭香, 夏小玲, 程晓莉, 等. 丹江口水库浮游植物群落时空动态及其多样性指数[J]. 环境科学, 2011, 32(10):2875-2882.
[22] NAQINEZHADA A, HAMZEH B, ATTARB F. Vegetation-Environment relationships in the Alder Wood Communities of Caspian Lowlands[J]. N. Iran (toward an ecological classification) Flora, 2008, 203: 567-577.
[23] TEMPONERAS M, KRISTIANSEN J, MOUSTAKA G M. Seasonal variation in phytoplankton composition and physical chemical features of the shallow Lake Doirani Macedonia, Greece. Hydrobiologia, 2000, 424 (1-3):109-122.
[24] 王丽平, 郑丙辉. 洋河水库富营养化发展趋势及其关键影响因素[J]. 生态学报, 2013, 33(3): 1011-1017.
[25] 杨东方, 陈生涛, 胡均, 等. 光照、水温和营养盐对浮游植物生长重要影响大小的顺序[J]. 海洋环境科学, 2007, 26(3): 201-207.
[26] DUPUIS A P, HANN B J. Warm spring and summer water temperatures in small eutrophic lakes of the Canadian prairies: potential implications for phytoplankton and zooplankton[J]. Journal of Plankton Research, 2009, 31(5):489-502.
[27] LANCELOT C, BILLEN G, SOURNIA A. Phaeocystis blooms and nutrient enrichment in the continental coastal zones of the North Sea[J]. Ambio, 1987, 16: 38-46.
[28] 张瑜斌, 章洁香, 张才学, 等. 赤潮多发区深圳湾叶绿素a的时空分布及其影响因素[J]. 生态环境学报, 2009, 18(5): 1638-1643.
[29] 李一平, 逢勇, 徐秋霞. 动水条件下太湖水体透明度及其影响因子模拟[J]. 河海大学学报, 2009, 37(6):625-630.
[30] 张晓晶, 李畅游, 贾克力, 等. 乌梁素海水体透明度分布及影响因子相关分析[J]. 湖泊科学, 2009, 21(6):879-884.
[31] HUDOSON J J, TAYLON W D. Phosphate concentration in lake[J]. Nature, 2000, 406(6): 54-56.
[32] FLORES L N, BARONE R. Phytoplankton dynamics in two reservoir with different trophic state (Lake Rosamarina and Lake Arancio, Sicily, Italy)[J]. Hydrobiologia, 1998, 369/ 370: 163-178.
[33] FLORES L N. Phytoplankton assemblages in twenty-one Sicilian reservoirs: relationship between species composition and environmental factors[J]. Hydrobiologia, 2000, 424:1-11.
[34] HOYER A B, MORENO O, VIDAL J, et al. The influence of external perturbations on the functional composition of phytoplankton in a Mediterranean reservoir[J]. Hydrobiologia, 2009, 636: 49-64.
[35] 刘晶, 秦玉洁, 邱焱伦, 等. 生物操纵理论与技术在富营养化湖泊治理中的应用[J]. 生态科学, 2005, 24(2):188-192.
Temporal and spatial pattern of phytoplankton community and its affected factors of Shiyan Reservoir
SHENG Xiao1, XU Haisheng2, DENG Peiyan1*, MAO Jianzhong3, LIU Wei4
1. School of Chemistry and Environment, South China Normal University, Guangzhou 510631, China
2. ShenZhen Tiegang-Shiyan Reservoir Administrative Department, Shenzhen 518034, China
3. Hydrology and Water Resources of Yunnan Bureau, Kunming 650106, China
4. Scientific Institute of Pearl River Water Resources Protection, Guangzhou 510611, China
Phytoplankton and related factors were investigated to explore the relationship between water quality andphytoplankton of the Shiyan Reservoir in 2013-2014, which was located in Guangdong Province. Temporal and spatial patterns of phytoplankton community and cell abundance were analyzed, and their associated influencing factors were also studied using redundancy analysis (RDA). Results showed that 90 genera of algae were identified, and the community was dominated by Chlorophyta (41.1%) Bacillariophyta(30.0%), and Cyanophyta (20.0%) across all the sampling year. Phytoplankton species had the most abundance in September (61), the least in August, only 18. The phytoplankton had an abundance between 2.74×108cells·L-1(in October) to 1.76×108cells·L-1(in June); Chlorophyta, Bacillariophyta and Cyanophyta accounted for the range of 96.74%-100% of the total phytoplankton abundance in the whole year, dominated by Cyanophyta, accounting for 51.55%-92.23%. The advantage of genus was Crucigenia, Scenedesmus, Chlorella, Melosira, Cyclotella and Pseudanabaena. Redundancy analysis showed that case ordination by RDA divided all samples into the four districts forming by axis 1 and axis 2, the left of axis 2 corresponding to the seasons spring, autumn and winter, while the right to summer. Most samples were located in the districts of the left of axis 2, the least including Cocconeis, Merismopedia, Raphidiopsis, Lyngbya and Chlamydomonas were in the districts of the right of axis 2. TEMP, TOC, NO3-N and TN were the main environment factors influencing the composition and dynamics of the phytoplankton community.
Shiyan Reservoir; phytoplankton; temporal and spatial patterns; eutrophication; environment factors
10.14108/j.cnki.1008-8873.2016.01.003
A
1008-8873(2016)01-017-10
2015-03-15;
2015-10-12
公益性行业科研专项(No. 201301047), 广东省水利科技创新项目成果(No: 2014-16)
盛萧(1990—), 女, 湖北黄冈人, 硕士, 主要研究方向为环境生态学
*通信作者:邓培雁(1974—), 女, 贵州毕节人, 博士, 教授, 研究方向污染生态学, E-mail: dpy213@126.com
盛萧, 徐海升, 邓培雁, 等. 深圳石岩水库浮游植物群落时空动态特征及其影响因素分析[J]. 生态科学, 2016, 35(1): 17-26.
SHENG Xiao, XU Haisheng, DENG Peiyan, et al. Temporal and spatial pattern of phytoplankton community and its affected factors of Shiyan Reservoir[J]. Ecological Science, 2016, 35(1): 17-26.

