大亚湾微表层浮游植物对无机氮磷的响应
杨雪, 王朝晖, 马长江, 熊毅俊, 梁建新
暨南大学水生生物研究中心, 水体富营养化与赤潮防治广东普通高校重点实验室, 广州 510632
大亚湾微表层浮游植物对无机氮磷的响应
杨雪, 王朝晖*, 马长江, 熊毅俊, 梁建新
暨南大学水生生物研究中心, 水体富营养化与赤潮防治广东普通高校重点实验室, 广州 510632
为了了解微表层浮游植物对氮(N)、磷(P)营养盐的响应, 于2013年6月、7月和8月采集了大亚湾海域微表层海水,设置两组N、P浓度梯度(N1: 35 μmol·L-1, N2: 70 μmol·L-1, P1: 2.2 μmol·L-1, P2: 4.4 μmol·L-1), Si为35 μmol·L-1, 进行N、P添加的正交实验, 观察微表层浮游植物的生长潜力, 并在实验开始前、实验中期(培养2—4 d)以及实验结束时(培养7—10 d)测定培养液中无机氮(DIN)、无机磷(DIP)和硅酸盐(DSi)含量. 实验结果显, 3个月份的微表层水样均以高N高P的N2P2实验组生长最好, 而低N低P(N1P1)、低N高P(N1P2)、高N低P(N2P1)组的生长状态相近; 而添加单一营养盐的4个实验组(N1、N2、P1、P2)不能促进微表层浮游植物的生长。同时添加N、P后, 浮游植物能快速生长, 在培养的2—4 d内达到生物量的最高峰. 与此同时, 营养盐含量也在生长较好的同时添加N、P组迅速下降, 特别是在N2P2组中尤为明显, 说明浮游植物的快速生长需要消耗大量的营养盐. 研究结果表明, 自然环境中N、P营养盐的输入能够促使浮游植物生物量迅速增加, 而单独添加单一营养盐并不能促使浮游植物的生长。
浮游植物; 微表层; 生长; 氮; 磷; 大亚湾; 营养盐
1 前言
海洋微表层是海洋与大气之间相互作用的重要界面[1-2], 具有独特的物理、化学和生物性质[3]。海洋微表层对营养盐、有机化合物、重金属以及微生物、浮游生物等均具有明显富集作用[4-6]。海洋浮游植物是海洋生态系统中最重要的初级生产者, 其光合作用的生产力占海洋生物所有生产力的 95%左右[7], 浮游植物种类组成、群落结构以及丰度变动直接或间接影响海洋生态系统。海洋微表层位于水体表面, 直接与阳光接触, 水温较高, 太阳辐射和紫外辐射在微表层的强度要远远高于水柱, 而且环境因子变动剧烈[8-9]。因此, 生活在微表层的生物群落具有独特的生理生态特征与生态位, 以适应微表层特殊、多变的环境。
氮(N)、磷(P)、硅(Si)是海洋中浮游植物生长不可或缺的生长要素, 为浮游植物生长提供营养需要,是海洋食物链和初级生产力的重要基础[10-12]。大亚湾位于中国南海的西北部, 是一个半封闭的港湾,其特殊的地理环境造成湾内营养盐的富集[13]。自1990年以来, 由于海水养殖以及人类活动使得海域中的营养盐增多进而导致该海域富营养化加剧[14],核电站排出的冷却水也导致了湾内环境的变化, 进而改变了该海域的浮游植物群落结构[15]。
为了了解微表层浮游植物对营养盐的响应, 本研究于2013年6—8月采集了大亚湾海域微表层水样, 根据大亚湾海域的氮(N)、磷(P)、硅(Si)含量, 进行营养盐添加实验, 监测了实验过程中浮游植物的生长潜力以及营养盐的利用情况, 以揭示微表层浮游植物群落对富营养化的响应。
2 材料与方法
2.1 样品采集
2013年6月、7月、8月份, 在大亚湾大鹏澳海域(图 1)采集了微表层水样。微表层样品的采集采用筛网法, 将孔径为1.0 mm的不锈钢网筛镶在40 cm× 50 cm的铝框中, 将筛网取样器水平没入海下, 然后轻轻提起, 将筛网垂直竖起, 附在网格上的水膜逐渐脱离网格, 微表层水样流入样品瓶中。重复此过程直至收集到所需的水样体积, 取样量除以取样次数和筛板表面积可得微表层厚度为200±10 μm。采集的样品冰浴避光保存, 在6 h内回到实验室进行实验。

图1 N、P添加后, 微表层水样叶绿素a含量的变化Fig. 1 Variation of chlorophyll a contents in surface microlayer samples after N and P addition
2.2 营养盐的测定
在实验进行前, 测定了水样中的无机氮(DIN,硝氮、氨氮和亚硝氮之和)、无机磷(DIP)和硅酸盐(DSi)含量。各营养盐指标的测定参照海洋调查规范GB/T12763.4-2007, 其中 DIP采用抗坏血酸还原磷钼蓝法, 亚硝氮采用重氮-偶氮法, 硝氮采用锌镉还原法, 铵氮采用次溴酸钠氧化法, 硅酸盐采用硅钼蓝法。
2.3 实验设置
根据大亚湾海水中N、P、Si的含量, 分别设置两组 N、P浓度梯度, 进行正交实验, Si浓度均为35 μmol·L-1, 一共设置9个实验组, 各实验组添加的营养盐浓度见表1。
实验在1000 mL的三角瓶中进行, 加入600 mL的微表层水样, 除 N、P、Si外, 其余营养元素按照 f/2培养基, 实验条件为温度: 25℃, 光照强度:100 μmol·m-2·s-1, 光暗比为L∶D=12 h∶12 h, 各实验组均设3个重复。
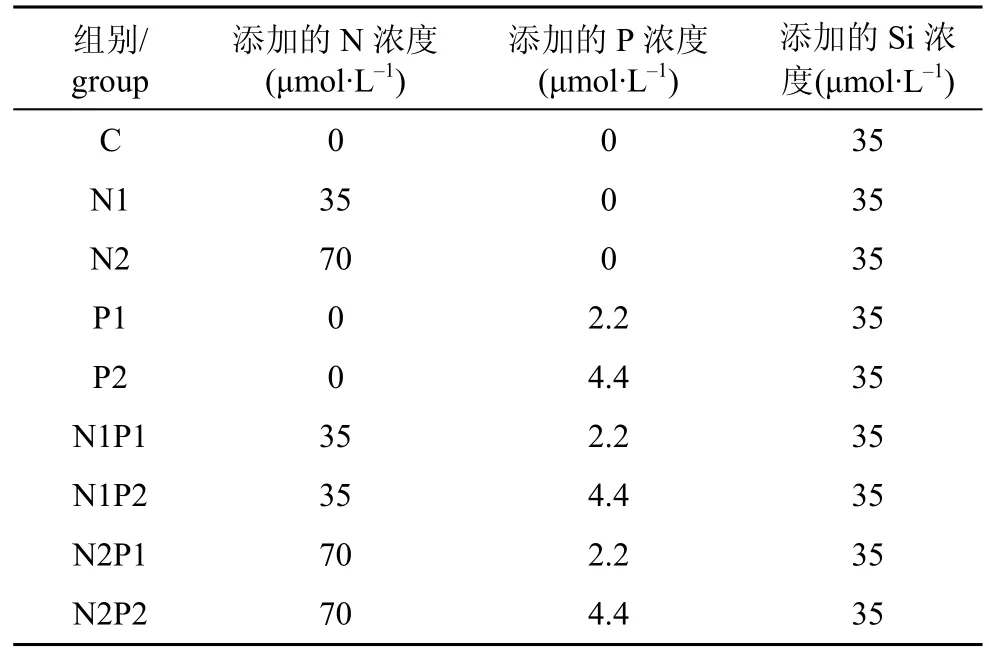
表1 各实验组中添加的营养盐浓度含量Tab. 1 Nutrient concentrations added in each test group
实验共进行 8—10 d, 每天用叶绿素荧光仪(美国Turner Designs公司Trilogy实验室荧光仪)测定荧光值, 根据叶绿素a与叶绿素荧光值关系: y=0.000188 (x-14.54), 其中y为叶绿素荧光值, x为叶绿素a含量(mg·L-1), R2=0.9919, 得到对应的叶绿素a含量。
在实验开始前(0 d)、实验中期(2—4 d)以及实验结束时(7—10 d), 测定了培养液中中无机氮(DIN,硝氮、氨氮和亚硝氮之和)、无机磷(DIP)和硅酸盐(DSi)含量, 营养盐测定方法同2.2。
3 结果与分析
3.1 微表层水样中营养盐含量
6月、7月和8月大亚湾微表层水样中DIN、DIP和DSi含量见表2。表中可以看出三个月DIN浓度在8.21—14.28 μmol·L-1之间, 其中6月和7月的DIN浓度接近, 8月份的DIN浓度较低; 三个月的DIP浓度均很低, 介于0—0.14 μmol·L-1, 其中6月份的DIP浓度低未检出程度(<0.02 μmol·L-1); DSi含量较丰富,其中6月份DSi浓度较高, 8月份的DSi浓度较低。
3.2 微表层浮游植物的生长情况
图2显示了添加营养盐后, 叶绿素a含量的变化趋势。添加营养盐后, 叶绿素a含量迅速上升, 在第2—3 天达到峰值, 随后叶绿素a含量下降; 而7月份和8月份样品的生长曲线出现了双峰。在没有添加N、P营养盐的C组, 叶绿素a含量一直处于较低水平。
6月份样品在第2天达到叶绿素a含量的最大值, 其中高N高P的N2P2生长状况最好, 最大叶绿素a含量达到0.25 mg·L-1, 低N低P(N1P1)、低N高P(N1P2)、高N低P(N2P1)组的生长状态相近, 而添加单一营养盐的4个实验组(N1、N2、P1、P2)并不能促进微表层浮游植物的生长, 生长趋势与未添加N、P的对照组相近(图1a)。在7月份的样品中, 同时添加N、P的4个实验组中叶绿素a含量在第1天就迅速上升, 然后又下降; 但第3天 N2P2又出现上升趋势, 在第 4天达到最大值后, 随后下降(图1b)。在8月份的样品中, 四个同时添加N、P的实验组, 叶绿素a含量在第1天快速上升, 在第2d达到最大值, 随后下降,在第 3天或第 4天达到低谷,随后有不同程度的回升。而未添加 N、P的对照组以及添加单一营养盐的 N1、N2、P1、P2组, 叶绿素a的含量在第2—3天达到最高值之后就一直处于下降趋势(图1c)。
最大叶绿素a含量可以更清楚显示各实验组的生长状况(图2), 三个月份均是同时添加N、P的四个实验组生长较好, 而单独添加N或者P的四个实验组与没有添加N、P的C组生长相近(p>0.05)。在N、P同时添加的四个实验组中, 以N2P2组生长最好, 3个月份 N2P2组的最大叶绿素 a含量分别为0.25、0.20、0.44 mg·L-1。8月份样品中, 4个N、P同时添加实验组的生长明显优于其余两个月样品,最大叶绿素a含量可以到达其余两个月份相应实验组的1.76—4.5倍。
3.3 培养液中DIN的变化
培养液中DIN含量在第2d或者是第4d就迅速下降(图3), 其中生长情况较好的NP同时添加组对DIN的消耗量较大, 如N1P1中N消耗率达80.5%—92.3%, N1P2组达88.8%—90.2%, N2P1达92.1%—95.9%, N2P2达90%—96.7%; 而单独添加N的N1、N2组的DIN剩余含量较多。

表2 大亚湾微表层水样营养盐含量(μmol·L-1)Tab. 2 Nutrient concentrations in water samples from microsurface layer

图2 各实验组叶绿素a含量最大值Fig. 2 The maximum chlorophyll a content in each test group
3.4 DIP的变化
图4为各实验组中DIP浓度的变化, 大亚湾微表层水样中的DIP含量均很低, 为0—0.14 μmol·L-1。在添加了P的各实验组, DIP消耗较快, 特别是在生长较快的N、P同时添加实验组(N1P1、N1P2、N2P1、N2P2), DIP在第2—4 d就消耗了60%以上, 而在实验结束时的第6—10 d, DIP含量为0—0.43 μmol·L-1, DIP消耗了90%以上。而在生长较慢的P1、P2组中, DIP的消耗量较少。

图3 培养液中DIN浓度的变化Fig. 3 Variations of DIN concentration in cultures
3.5 DSi的变化
所有实验组都添加了35 μmol·L-1的DSi, 6月份度可以到达70 μmol·L-1; 而8月份样品中DSi初始浓度较低, 仅为7.95 μmol·L-1, 添加DSi后, 实验组的 DSi含量仅为 42.95 μmol·L-1。从各实验组 DSi浓度的变化来看(图5), 同样是在生长较旺盛的实验组DSi消耗量较大; 而在未添加N、P以及N、P单独添加组, DSi消耗较少, 特别是生长较差的6月份样品, DSi基本上未消耗。
3.6 N:P值
由图6中各月份N:P值的变化可以看出, N:P远远高于Redfield比值(16:1), 6月份DIP浓度为未检出, 在未添加 P的实验组, N:P值无法计算(图 6a);而在7月份样品中, 由于DIP初始浓度很低, 导致加N的两个实验组(N1、N2)的N:P值超过了1000(图6b); 8月份样品中DIP浓度较高, 但是在C组以及N1和N2组的N:P还是远远超出Redfield比值。虽然如此, 在单独添加P的P1和P2组的N:P值均小于10.0, 在1.81—6.49之间; 而N、P同时添加的4个实验组, 不但N、P浓度较高, 而且N:P值较为合适,在9.52—33.42之间。从各实验组的生长情况来看(图1、图2), 也是N、P同时添加的实验组生长较好。
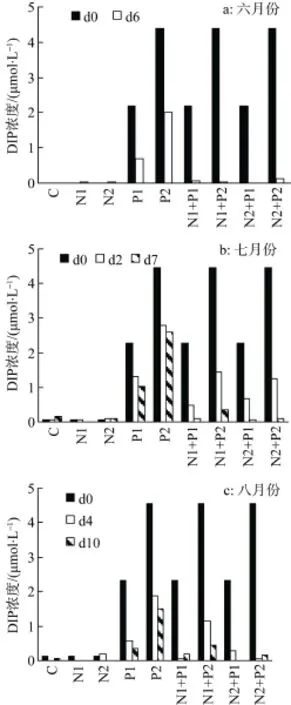
图4 培养液中DIP的变化Fig. 4 Variations of DIP concentration in cultures
4 讨论
营养盐是海洋生态系统的物质基础, 浮游植物群落组成及数量变动和水体中的营养盐和含量有着密切的关系[16-18]。长期以来, 大亚湾海域是我国沿海内湾中水质较好的海湾[14], 且被认为是低营养盐水平、高初级生产力的海域[17]。N、P是关键营养元素, 大约以16:1(Redfield比值)的比例被浮游植物吸收[18]。在本实验中, N2P2组不但N、P含量最高, 而且N:P比值符合Redfield比值, 该实验组能在短时间内迅速达到叶绿素a最大值,成为所有实验组中叶绿素a含量最高的一组。有研究表明, N:P比值改变会使浮游植物群落结构发生改变, N:P比值偏离Redfield比值越远, 硅藻的数量和种类就会减少[19]。在本实验中, 随着 P的大量消耗, 实验组中的 N:P逐渐增大, 浮游植物生长受到抑制, 叶绿素 a含量也逐渐降低(图 1)。由于自然水体中含有多种浮游植物种类, 在培养过程中发生浮游植物优势种群的演替, 与实验室单种培养的单峰型生长曲线不同, 7月份和 8月份样品的生长曲线出现了双峰型(图1b, 1c)。
图5 培养液中DSi的变化Fig. 5 Variations of DSi concentration in cultures

图6 培养液中N:P的变化Fig. 6 Variations of N:P ratio in the cultures
大亚湾为 P限制性海域, 浮游植物的生长受到严重的P限制[14]。本调查中也得出大亚湾微表层DIP的含量也非常低, 6月份样品甚至低于检出限(<0.02 μmol·L-1), N:P远远高于Reidfield比值。但是单独添加P的实验组的生长与未添加N、P以及单独添加 N的实验组相似, 叶绿素 a的含量并未得到显著增加, 这种可能由于单独添加P后, 导致N:P值较低, 浮游植物生长受到 N的限制。此外,微表层中有机 P含量较高[10], 浮游植物可以利用可溶性有机P进行生长。在大亚湾Si含量十分丰富, Si不成为硅藻生长的限制因子[13]。在本实验中,单独添加 Si时, 浮游植物的生物量并未到增加,说明Si并非大亚湾海域浮游植物生长的限制性因子。在同时添加N、P后, 生物量迅速增加, 而且在生长旺盛的实验组, 硅酸盐消耗量较大, 而生长较差的实验组则硅酸盐消耗量较低。结果说明,大亚湾微表层海域浮游植物主要以硅藻为主, 而且硅酸盐并不缺乏, 在同时进行的浮游植物调查也证实了这一点[20]。本研究结果表明, 自然环境中N、P营养盐的输入能够促使浮游植物生物量迅速增加, 而单独添加单一营养盐并不能促使浮游植物的生长。
[1] LISS P S, DUCE R A. The Sea Surface and Global Change[M]. Cambridge., Cambridge University Press, 1997.
[2] WURL O, HOLMES M. The gelatinous nature of the seasurface microlayer[J]. Marine Chemistry, 2008, 110:89-97.
[3] REINTHALER T, SINTES E, HERNDL G J. Dissolved organic matter and bacterial production and respiration in the sea-surface microlayer of the open Atlantic and the western Mediterranean Sea[J]. Limnology and oceanography, 2008, 53: 122-136.
[4] ZHOU Xianliang, MOPPERB KENNETH. Photochemical production of low-molecular-weight carbonyl compounds in seawater and surface microlayer and their air sea exchange[J]. Marine chemistry, 1997, 56: 201-203.
[5] WANG Zhaohui, YANG Yufeng, SONG Shuhua, et al. Seasonal changes in nutrients and their accumulation in the surface microlayer in Daya Bay, South China Sea[J]. Acta scientae circumstantiae, 2011, 31: 307-315.
[6] YANG Guipeng, LEVASSEUR M, MICHAUD S, et al. Distribution of dimethylsulfide and dimethylsulfoniopropionate and its relation with phytoneuston in the surface microlayer of the western North Atlantic during summer[J]. Biogeochemistry, 2009, 94: 243-254.
[7] CUNLIFFE M, SALTER M, MANN P J, et al. Dissolved organic carbon and bacterial populations in the gelatinous surface microlayer of a Norwegian fjord mesocosm[J]. Fems microbiol letters, 2009, 299:248-254.
[8] KUZNETSOVA M, LEE C, ALLER J, et al. Enrichment of amino acids in the sea surface microlayer at coastal andopen ocean sites in the North Atlantic Ocean[J]. Limnology and oceanography, 2004, 49(5): 1605-1619.
[9] HEUMEN E.V, VUORINEN J, KOEPERMIK K, et al. Existence, Character, and Origin of Surface-Related Bands in the High Temperature Iron Pnictide Superconductor BaFe2-xCoxAs2[J].. Physical revies letters, 2011, 106: 2-14.
[10] WANG Zhaohui, ZHAO Jiangang, ZHANG Yujuan, et al. Phytoplankton community structure and environmental parameters in aquaculture areas of Daya Bay, South China Sea[J]. Journal of environmental science, 2009, 21:1268-1275.
[11] 王朝晖, 杨宇峰, 宋淑华, 等, 大亚湾海域营养盐的季节变化及微表层对营养盐的富集作用[J]. 环境科学学报, 2011. 31(2): 307-315.
[12] 陈菊芳, 齐雨藻, 徐宁, 等. 大亚湾澳头水域浮游植物群落结构及周年数量动态[J]. 水生生物学报, 2006. 30(3):311-317.
[13] WANG Zhaohui, SONG Shuhua, QI Yuzao. A comparative study of phytoneuston and the phytoplankton community structure in Daya Bay, Sou China Sea[J]. Journal of sea research, 2014, 85: 474-482.
[14] 郑爱榕, 沈海维, 刘景欣, 等. 大亚湾海域低营养盐维持高生产力的机制探讨[J]. 海洋科学, 2001, 25(11):48-52.
[15] 孙翠慈, 王友绍, 孙松, 等. 大亚湾浮游植物群落特征[J].生态学报, 2006, 26(12): 3948-3958
[16] 王朝晖, 齐雨藻, 李锦蓉, 等. 大亚湾养殖区营养盐状况分析与评价[J]. 海洋环境科学, 2004, 23(2):25-28.
[17] 宋淑华, 王朝晖, 付永虎, 等. 大亚湾大鹏澳海域微表层浮游植物群落研究[J]. 海洋环境科学, 2009, 28(2):181-18515.
[18] QU Keming, CHEN Bijuan, YUAN Youxian,et al. A prellminary study on influence of N and P on population constituent of planktonic diatoms in seawater[J]. Chinese journal of applied ecology, 2000,11 (3): 445-448.
[19] Egge J K. Are diatoms poor competitors at low phosphate concentration?[J]. Journal of marine systems, 1998, 16:191-198.
[20] 熊毅俊. 大亚湾海域微表层和次表层浮游植物群落结构的比较研究[D]. 广州: 暨南大学, 2014: 10-54.
Responses of the Daya Bay microlayer phytoplankton to inorganic nitrogen and phosphorus
YANG Xue, WANG Zhaohui*, MA Changjiang, XIONG Yijun, LIANG Jianxin
Research Center of Hydrobiology, Key Laboratory of Eutrophication and Red Tide Prevention of Guangdong Higher Education Institutes, Jinan University, Guangzhou 510632, China
Water samples from the sea surface microlayer (SML) were collected from Daya Bay, the South China Sea in June, July and August 2013, respectively. The growth of phytoplankton was studied after adding two levels of nitrogen (N) and phosphorus (P) concentrations (N1: 35 μmol·L-1, N2: 70 μmol·L-1, P1: 2.2 μmol·L-1, P2: 4.4 μmol·L-1). Dissolved inorganic nitrogen (DIN), phosphorus (DIP) and silica (DSi) in cultures were measured on day 0, day 2—4, and day 7—10. The purpose of this study is to understand the response of phytoplankton in the SML to the addition of nutrients. Results showed that the growth was the best in cultures with high N and P concentrations (N2P2), and was comparable in cultures of N2P1, N1P2 and N1P1. However the growth could not be accelerated after addition of N or P alone. The biomass of phytoplankton increased rapidly after addition of both N and P, and reached the peak values on day 2—4. Meanwhile, nutrient concentrations decreased greatly in cultures in which both N and P were added, especially in the culture N2P2, indicating that the rapid growth of phytoplankton needed to consume large amounts of nutrients. The results from this study suggested that nutrient loading into natural marine system could accelerate the growth of phytoplankton, however addition of just one nutrient element might not promote the growth.
phytoplankton, surface microlayer, growth, nitrogen, phosphorus, Daya Bay, nutrients
10.14108/j.cnki.1008-8873.2016.01.005
X55
A
1008-8873(2016)01-034-07
2014-09-28;
2015-06-20
国家自然科学基金项目(41276154, 41476132)
杨雪(1989—), 女, 河南新郑人,硕士, 海洋生态学, perfectyxn@126.com
*通信作者:王朝晖, 女, 博士,教授, 研究方向: 海洋生态学与赤潮, twzh@jnu.edu.cn
杨雪, 王朝晖, 马长江, 等. 大亚湾微表层浮游植物对无机氮磷的响应[J]. 生态科学, 2016, 35(1): 34-40.
YANG Xue, WANG Zhaohui, MA Changjiang, et al. Responses of the Daya Bay microlayer phytoplankton to inorganic nitrogen and phosphorus[J]. Ecological Science, 2016, 35(1): 34-40.

