纤维蛋白原D二聚体超敏C反应蛋白与血管性痴呆的关系
常华军 全亚萍 陈顺中
南京中医药大学泰州附属医院神经内科 泰州 225300
纤维蛋白原D二聚体超敏C反应蛋白与血管性痴呆的关系
常华军全亚萍陈顺中
南京中医药大学泰州附属医院神经内科泰州225300
【摘要】目的探讨血纤维蛋白原、D二聚体、超敏C反应蛋白与血管性痴呆的关系。方法测定32例血管性痴呆患者及32例正常对照组的血纤维蛋白原、D二聚体、超敏C反应蛋白水平。采用临床痴呆量表对血管性痴呆患者进行评分。结果血管性痴呆患者血纤维蛋白原水平(3.76±0.73)g/L,D二聚体水平(1.06±0.28)mg/L,超敏C反应蛋白水平(13.25±3.11)mg/L。正常对照组血纤维蛋白原水平(2.32±0.38)g/L,D-二聚体水平(0.28±0.11)mg/L,超敏C反应蛋白水平(3.92±0.81)mg/L。血管性痴呆患者血纤维蛋白原、D二聚体、超敏C反应蛋白水平均高于正常对照组,差异有统计学意义(P<0.05)。相关性分析显示血纤维蛋白原、D二聚体水平与痴呆的严重程度呈正相关。结论血纤维蛋白原、D二聚体、超敏C反应蛋白的升高可能是血管性痴呆的危险因素。
【关键词】痴呆;血管性;纤维蛋白原;D二聚体;C反应蛋白
我国血管性痴呆的发病率较高,患病率仅次于Alzheimer病。大量研究显示,凝血功能异常和炎症反应都与脑血管病的发生有关,因此凝血功能异常和炎症反应与血管性痴呆的发生可能有关。研究[1-3]显示,高水平的纤维蛋白原、D二聚体、超敏C反应蛋白与脑血管病的发生相关。本研究旨在探讨纤维蛋白原、D二聚体、超敏C反应蛋白与血管性痴呆的关系。现分析如下。
1资料与方法
1.1研究对象选取2007-06—2013-12于我院神经内科住院的血管性痴呆患者(血管性痴呆组)32例,男18例,女14例;年龄45~82岁,平均(63.86±10.28)岁;其中饮酒6例,低教育水平10例。均符合美国国立神经病学与中风研究所(NINDS)和神经科学国际研究协会(AIREN)联合制定的NINDS- AIREN诊断标准。采用MMSE表筛选,评分标准:文盲≤17分,小学程度≤20分,中学(包括中专)程度≤22分,大学(包括大专)程度≤23分[4]。采用Hachinski缺血指数区分阿尔茨海默病(AD)和血管性痴呆(VD)以排除疑似病例,<4分为AD,>7分为VD。排除标准:(1)脑肿瘤、寄生虫病、颅内血肿,或近1 a内有脑外伤史、严重精神疾病、癫痫、酒精或药物滥用史;(2)中重度抑郁症、焦虑症;(3)非血管性痴呆,如路易体痴呆、帕金森病痴呆、中枢神经系统感染、伴皮质下梗死和白质脑病的常染色体显性遗传脑动脉病等;(4)严重的心脏疾病、肺功能不全、肝肾功能异常、血液系统或内分泌疾病;(5)缺乏理解,依从性差的患者。选择同时期的健康体检人员32例为正常对照 (normal control,NC) 组,男17例,女15例;年龄42~85岁,平均(62.32±9.82)岁;饮酒7例,低教育水平9例。2组一般资料比较,差异无统计学意义(P<0.05),具有可比性。
1.2血纤维蛋白原(FIB)测定所有患者于入院后3 d内清晨空腹采集肘静脉血2 mL,枸橼酸钠0.2 mL抗凝,1 h内离心,离心半径为10 cm,3 000 r/min,10 min。采用全自动血凝分析仪(日本希森美康CA-1500),采用Clauss法定量测定血浆纤维蛋白原浓度(试剂盒由美国德灵公司提供)。
1.3血D-二聚体测定所有患者于入院后3 d内清晨空腹采集肘静脉血2 mL,枸橼酸钠0.2 mL抗凝,1 h内离心,离心半径为10 cm,3 000 r/min,10 min。采用速率散射比浊法测定D-二聚体。仪器为全自动血凝分析仪(日本希森美康CA-1500)。
1.4血超敏C反应蛋白测定(hs-CRP)所有患者于入院后3 d内清晨空腹采集肘静脉血2 mL,置乙二胺四乙酸(EDTA)抗凝管,1 h内离心,离心半径10 cm,3 000 r/min,10 min。采用速率散射比浊法测定hs-CRP 水平。采用美国贝克曼库尔特公司试剂盒。
1.5神经心理学评估采用MMSE作为筛选工具,采用临床痴呆量表(clinical dementia rating,CDR)对血管性痴呆患者评分,以1、2、3分表示,将血管性痴呆患者分为轻度、中度、重度3级。患者于入院3 d内进行评定。评估人员均经过专业培训。

2结果
2.12组血纤维蛋白原水平、D-二聚体水平、超敏C反应蛋白水平比较2组各项比较差异均有统计学意义(P<0.05)。见表1。

表1 2组血纤维蛋白原、D-二聚体、hs-CRP比较
2.2血纤维蛋白原水平、D-二聚体水平、超敏C反应蛋白水平与CDR评分的相关性分析血纤维蛋白原水平与CDR评分呈正相关(r=0.312,P<0.05)。血D-二聚体水平与CDR评分呈正相关,(r=0.562,P<0.05)。血超敏C反应蛋白水平与CDR评分无相关(r=0.261,P>0.05)。
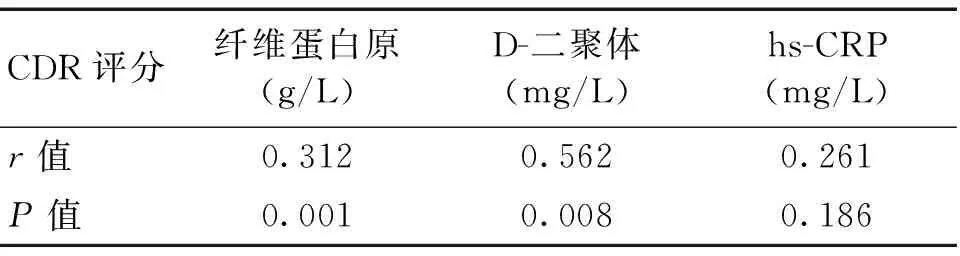
表2 血纤维蛋白原水平、D-二聚体水平、超敏C反应
3讨论
研究[5-7]显示,脑血管的常规危险因素如高血压、糖尿病、高胆固醇血症与血管性痴呆的发生是相关的,但纤维蛋白原、D二聚体、超敏C反应蛋白与血管性痴呆的关系尚不完全明确。
纤维蛋白原是一种重要的血浆糖蛋白,由肝脏合成,属于急性时相蛋白。纤维蛋白原升高提示机体纤溶活性降低、血液黏稠度高,易于血小板聚集和血栓形成。本研究显示血管性痴呆患者纤维蛋白原升高,纤维蛋白原水平与血管性痴呆的严重程度呈正相关。这与国外的研究相一致[8]。纤维蛋白原是血液黏稠度和血小板聚集的重要决定因素之一,并且影响血管内皮功能[9]。高纤维蛋白原血症可能会导致血流速度降低,因此增加血栓形成。这些凝血特性可以解释纤维蛋白原水平与血管性痴呆的相关性。高水平的纤维蛋白原与脑血管病的发生相关,可以解释纤维蛋白原水平与血管性痴呆的相关性。
D-二聚体是纤维蛋白单体通过活化因子XIII交联合作用后再经血浆纤溶降解产生的,包含γ链相连二个D片段的终末产物之一。D-二聚体在体内起着调节纤溶-凝血间平衡的重要作用。D-二聚体是反映体内血浆高凝状态及纤溶系统激活的分子标志物。本研究显示血管性痴呆患者血D-二聚体水平较健康对照组偏高,血D-二聚体水平与血管性痴呆严重程度呈正相关,这与国外的研究相一致[10-11]。D-二聚体水平升高是凝血功能增强的的标志,可能是因为凝血特性在动脉血栓形成的发病中起着重要作用。D-二聚体在血管性痴呆发病中的作用可能是由于脑部微血栓形成或者是微循环的损害导致认知功能的下降[12]。D-二聚体可能也参与了动脉粥样硬化的形成的发病机制中,导致血流量的减少从而促进了血管性痴呆的发生。
超敏C反应蛋白是急性期反应蛋白,是炎症的非特异性标志物。国外关于超敏C反应蛋白与血管性痴呆的关系尚存在争论。有研究显示,超敏C反应蛋白与血管性痴呆的发病相关[13-14],另有研究显示,全身的轻度炎症反应和超敏C反应蛋白水平的升高与血管性痴呆的发病相关[15-17],血管性痴呆的发生中存在着炎症反应机制[18]。也有研究显示,超敏C反应蛋白与血管性痴呆的发病无关[19]。在血管性痴呆的病理生理过程中普遍存在着炎症相关的脑血流灌注的下降和神经元变性。动脉粥样硬化被认为是一种炎症反应过程。动脉粥样硬化与血管性痴呆的发生相关。超敏C反应蛋白与血管性痴呆的相关性可能是通过动脉粥样硬化的过程实现的,但也有研究显示在排除动脉粥样硬化的影响后,超敏C反应蛋白与血管性痴呆的发生仍然相关[20]。超敏C反应蛋白可能也参与血管性痴呆的病理生理过程,尚需进一步研究。
本研究显示,超敏C反应蛋白与血管性痴呆的发病相关,但与痴呆的严重程度无相关性,纤维蛋白原、D-二聚体与血管性痴呆的严重程度呈正相关,纤维蛋白原、D-二聚体与血管性痴呆的相关性更强,进一步证明了血管性痴呆认知水平的下降是继发于血栓形成前状态以及进行性脑内微梗死形成所致的假说。凝血功能的激活包括血栓形成和纤维蛋白溶解的激活。本研究显示血管性痴呆患者形成过程中与凝血功能异常和炎症相关,但与凝血功能异常相关性更强,可能是血栓形成前的状态及脑缺血损害导致血管性痴呆的加重。
本研究显示纤维蛋白原、D-二聚体、超敏C反应蛋白水平的升高与血管性痴呆的发生存在相关性。纤维蛋白原、D-二聚体、超敏C反应蛋白可能是血管性痴呆的危险因素,因此通过降低纤维蛋白原、D-二聚体、超敏C反应蛋白水平可能会降低血管性痴呆的发生风险。由于本研究样本量尚少,尚需扩大样本量进一步研究纤维蛋白原、D-二聚体、超敏C反应蛋白与血管性痴呆的关系。
4参考文献
[1]Wannamethee SG,Whincup PH,Lennon L,et al.Fibrin D-dimer,tissue-type plasminogen activator,von Willebrand factor,and risk of incident stroke in older men[J].Stroke,2012,43(5):1 206-1 211.
[2]李娜,任长虹,孙菲,等.脑梗死急性期患者血浆纤维蛋白原和D-二聚体及抗凝血酶Ⅲ水平的变化[J].中国脑血管病杂志,2013,10(5):268-272.
[3]常华军,全亚萍,陈顺中.急性脑梗死血清超敏C反应蛋白与改良TOAST分型及OCSP分型的关系[J].中国现代神经疾病杂志,2014,14(10): 897-901.
[4]高素荣,袁锦楣.痴呆诊疗学[M].北京:科学技术出版社,1998:259-260.
[5]Ninomiya T,Ohara T,Hirakawa Y,et al.Midlife and late-life blood pressure and dementia in Japanese elderly:the Hisayama study[J].Hypertension,2011,58(1):22-28.
[6]Sierra C.Cerebral small vessel disease,cognitive impairment and vascular dementia[J].Panminerva Med,2012,54(3):179-188.
[7]Wiesmann M,Kiliaan AJ,Claassen JA.Vascular aspects of cognitive impairment and dementia[J].J Cereb Blood Flow Metab,2013,33(11):1 696-1 706.
[8]van Oijen M,Witteman JC,Hofman A,et al.Fibrinogen is associated with an increased risk of Alzheimer diseaseand vascular dementia[J].Stroke,2005,36(12):2 637-2 641.
[9]Arbustini E,Narula N,D'Armini AM.Fibrinogen: a circulating factor in search of its genetic architecture[J].Circulation,2013,128(12):1 276-1 280.
[10]Quinn TJ,Gallacher J,Deary IJ,et al.Association between circulating hemostatic measures and dementia or cognitive impairment: systematic review and meta-analyzes[J].J Thromb Haemost,2011,9(8):1 475-1 482.
[11]Carcaillon L,Gaussem P,Ducimetière P,et al.Elevated plasma fibrin D-dimer as a risk factor for vascular dementia: the Three-City cohort study[J].J Thromb Haemost,2009,7(12):1 972-1 978.
[12]Schneider JA,Wilson RS,Bienias JL,et al.Cerebral infarctions and the likelihood of dementia from Alzheimer disease pathology[J].Neurology,2004,62(7): 1 148-1 155.
[13]Koyama A,O'Brien J,Weuve J,et al.The role of peripheral inflammatory markers in dementia and Alzheimer's disease: a meta-analysis Cerebral infarctions and the likelihood of dementia from Alzheimer disease pathology[J].J Gerontol A Biol Sci Med Sci,2013,68(4):433-440.
[14]Eriksson UK,Pedersen NL,Reynolds CA,et al.Associations of gene sequence variation and serum levels of C-reactive protein and interleukin-6 with Alzheimer's disease and dementia[J].J Alzheimers Dis,2011,23(2):361-369.
[15]Lima TA,Adler AL,Minett T,et al.Medical Research Council Cognitive Function and Ageing Study. C-reactive protein,APOE genotype and longitudinal cognitive change in an older population[J].Age Ageing,2014,43(2):289-292.
[16]Pearson TA,Mensah GA,Alexander RW,et al.Markers of inflammation and cardiovascular disease:application to clinical and public health practice: A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association[J].Circulation,2003,107(3):499-511.
[17]Xu G,Zhou Z,Zhu W,et al.Plasma C-reactive protein is related to cognitive deterioration and dementia in patients with mild cognitive impairment[J].J Neurol Sci,2009,284(1-2):77-80.
[18]McGeer PL,McGeer EG.Inflammation,autotoxicity and Alzheimer disease[J].Neurobiol Aging,2001,22(6):799-809.
[19]Gallacher J,Bayer A,Lowe G,et al.Is sticky blood bad for the brain? hemostatic and inflammatory systems and dementia in the Caerphilly prospective study[J].Arterioscler Thromb Vasc Biol,2010,30(3):599-604.
[20]Engelhart MJ,Geerlings MI,Meijer J,et al.Inflammatory proteins in plasma and the risk of dementia: the rotterdam study[J].Arch Neurol,2004,61(5):668-672.
(收稿 2015-07-15修回2016-04-02)
【中图分类号】R749.1+3
【文献标识码】A
【文章编号】1673-5110(2016)08-0073-03

