对比剂相关急性肾损伤对缺血性脑卒中患者近期预后的影响
董 伟 陶一鸣 李志莲 陈源汉 莫立仪 梁华般 李锐钊 史 伟 梁馨苓
对比剂相关急性肾损伤对缺血性脑卒中患者近期预后的影响
董 伟 陶一鸣 李志莲 陈源汉 莫立仪 梁华般 李锐钊 史 伟 梁馨苓
目的:观察缺血性卒中患者脑血管造影后对比剂相关急性肾损伤(CI-AKI)对住院死亡率及1年死亡率的影响。 方法:回顾性纳入2009-01-01~2013-12-31在广东省人民医院接受脑血管造影介入术的缺血性脑卒中患者,收集患者造影前、造影过程中及造影后相关临床资料,通过多因素回归模型分析CI-AKI对住院死亡率及1年死亡率的影响。 结果:共有1 820例接受脑血管造影的缺血性脑卒中患者纳入本研究,其中81例(4.5%)患者发生了CI-AKI。多因素Logistic回归模型显示脑血管造影后CI-AKI增加患者住院死亡风险(优势比OR=3.99; 95%CI 1.43~11.14;P=0.008),同时多因素COX回归模型显示CI-AKI也是1年死亡的独立危险因素(风险比 HR=1.96; 95%CI 1.18~3.26;P=0.009)。 结论:脑血管造影后CI-AKI是缺血性卒中患者住院死亡及1年死亡的独立危险因素,对接受脑血管造影患者采取有效措施预防CI-AKI十分必要。
急性肾损伤 对比剂 缺血性卒中 脑血管造影 死亡率
对比剂相关急性肾损伤(CI-AKI)是医院内获得性AKI的第三位病因,约占我国医院内获得性AKI的13.1%[1]。CI-AKI增加患者不良预后,包括院内死亡率及长期死亡率[2-5]。虽然脑血管造影及介入治疗在脑血管疾病诊治过程中起到越来越重要的作用,但是目前缺乏脑血管造影相关急性肾损伤对预后影响的研究。本研究拟探讨CI-AKI对接受脑血管造影的缺血性脑卒中患者住院死亡率及1年死亡率的影响。
对象和方法
病例选择 该回顾性研究连续性纳入2009-01-01~2013-12-31在广东省人民医院接受脑血管造影术的缺血性脑卒中患者。排除标准:(1)年龄<18岁;(2)缺乏术前血清肌酐(SCr)的患者;(3)缺乏术后48h内SCr的患者;(4)缺乏1年随访记录的患者;(5)终末期肾病、已接受透析或肾移植的患者;(6)造影前已发生AKI的患者;(7)造影前72h接受肾毒性药物(包括非甾体类止痛药、氨基糖苷类抗生素、糖肽类抗生素、甘露醇等);(8)造影前72h内因其他原因接受碘对比剂;(9)孕妇;(10)术前存在严重肝功能衰竭、急性心力衰竭、急性心肌梗死、脓毒血症、休克、低血压、低血容量。
CI-AKI定义 根据2011年欧洲放射学会泌尿分会的定义:当患者造影后48h内SCr绝对值升高超过44 μmol/L,或SCr升高超过基线25%,排除其他病因所致AKI时,诊断为CI-AKI[6]。本研究中SCr基线值采用造影前最近一次的SCr值。
其他相关定义 肾功能完全恢复:出院时患者存活且无需继续肾脏替代治疗,SCr降至基线值的1.5倍以内且不超过基线值44 μmol/L。高尿酸血症:男性>420 μmol/L,女性>357 μmol/L[7]。贫血:成年男性血红蛋白<130 g/L,成年未妊娠女性血红蛋白<120 g/L[8]。高胆固醇血症:总胆固醇>6.22 mmol/L。高三酰甘油:三酰甘油>2.26 mmol/L。高低密度脂蛋白血症:低密度脂蛋白>4.14 mmol/L[9]。
临床资料收集 收集入组患者的术前、术中和术后资料,包括性别、年龄、体重、身高、血压、心率、呼吸、体温、基线、估算的肾小球滤过率(eGFR)、脑卒中类型、美国国立卫生研究院卒中量表(NIHSS)评分、并发症、既往病史、手术史、伴随使用药物、血常规、尿常规、术前SCr、肝功能、血胆固醇、血三酰甘油、电解质、是否水化治疗、造影介入治疗方式、手术持续时间、对比剂的使用剂量、术后48h内SCr值、院内死亡。通过电子病历系统及电话随访获取患者1年死亡率情况。其中基线eGFR采用2009年CKD-EPI 公式进行估算[10]。
统计学方法 采用SPSS 21.0统计软件进行统计学分析。正态分布的计量资料以均数±标准差表示,两组间比较采用t检验;非正态分布的计量资料以中位数(四分位间距)表示,两组间比较采用Mann-Whitney U检验;分类资料以例数(百分比)表示,组间比较采用Pearson卡方检验或Fisher确切概率法。采用单因素和多因素Logistic回归分析CI-AKI对院内死亡的影响。采用Kaplan-Meier描述CI-AKI患者与非CI-AKI患者1年死亡率,并采用Log-rank检验比较组间死亡率。采用单因素及多因素COX回归分析CI-AKI对1年死亡率的影响。P<0.05为差异有统计意义,P<0.01为统计学差异显著。
结 果
一般情况 共有1 820例接受脑血管造影的缺血性脑卒中患者纳入本研究,平均年龄(51.80±16.75)岁,女性896例(49.2%)。基线eGFR为(63.92±24.45) ml/(min·1.73m2),中位NIHSS评分为1(1,3)。共有423例(23.2%)患者在接受造影检查同时进行了血管内治疗。96.3%的患者的对比剂采用低渗对比剂(优维显370),其余患者采用等渗对比剂(威视派克)。30.0%的患者接受水化治疗,其中eGFR<30 ml/(min·1.73m2)的患者均接受了水化治疗。
共有81例(4.5%)患者发生了CI-AKI。发生CI-AKI的患者年龄偏大、神经功能评分更差、基线eGFR更低,贫血及蛋白尿发生更高(表1)。CI-AKI中仅2例患者需要接受间歇性血液透析滤过。81名CI-AKI患者中,有57例(70.4%)患者在出院时肾功能完全恢复,仅有1例患者在出院时需长期接受维持性血液透析治疗。
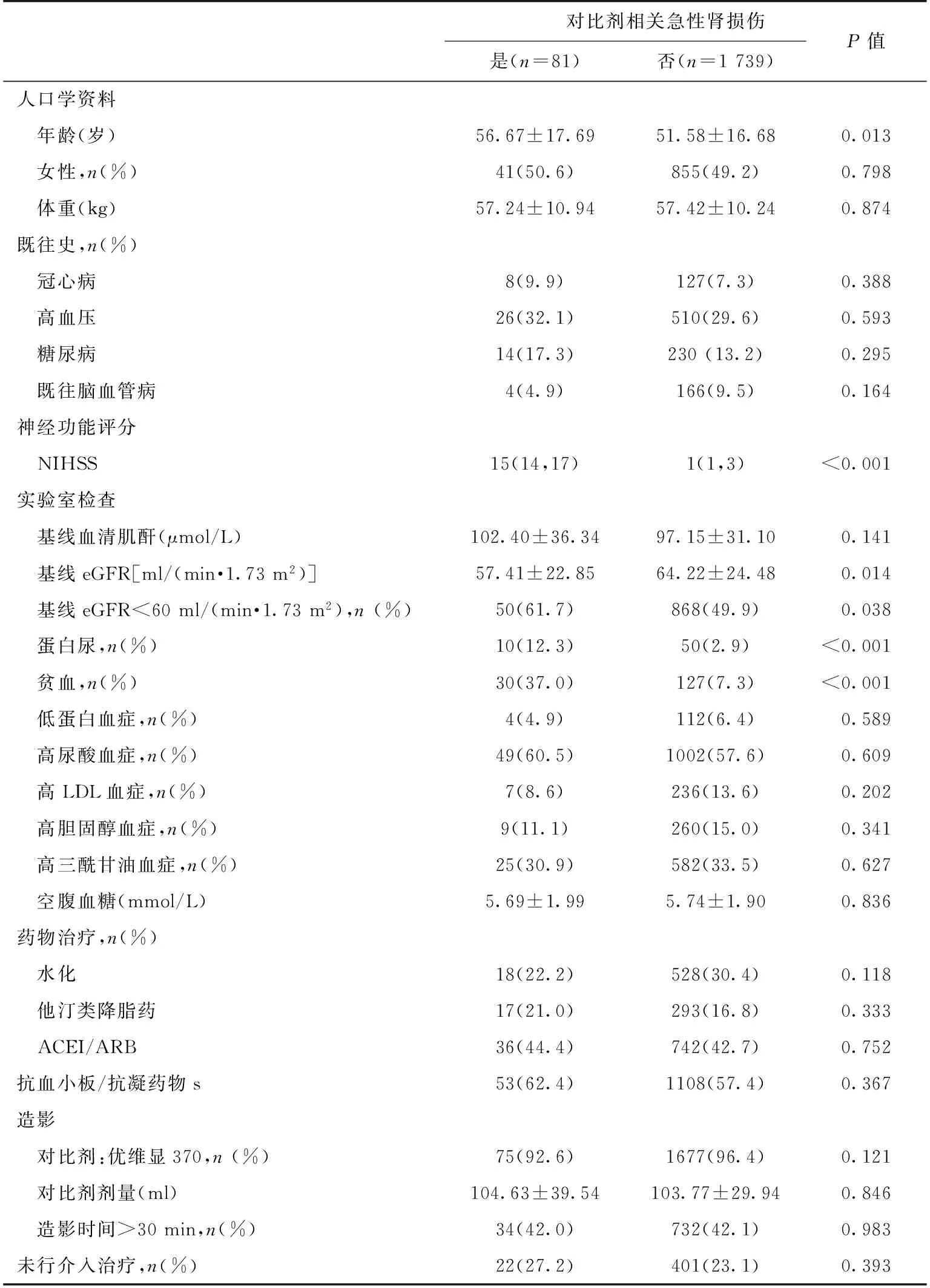
表1 接受脑血管造影的缺血性卒中患者基线资料
eGFR:估算肾小球滤过率;NIHSS:国立健康机构中风评分量表;ACEI:血管紧张素转换酶抑制剂;ARB:血管 紧张素Ⅱ受体拮抗剂
共有95例患者院内死亡,其中38例(40%)患者死于肺部感染,25例(26.3%)患者死于脑功能恶化引起的呼吸、循环衰竭,16例(16.8%)患者死于心血管事件,另外16例(16.8%)患者死于消化道出血、其他部位感染等原因,无患者直接死于CI-AKI并发症(高钾血症、容量负荷过重、代谢性酸中毒等)。
CI-AKI对住院死亡率的影响 发生CI-AKI的患者住院时间较未发生CI-AKI的患者并未明显延长(31.33±16.43dvs30.22±16.01d,P=0.540)。CI-AKI患者住院死亡率明显升高(13.6%vs4.8%,P<0.001)。Logistic回归模型显示,CI-AKI增加了院内死亡风险(表2)。
表2 对比剂相关急性肾损伤对住院死亡影响的单因素及多因素Logistic回归
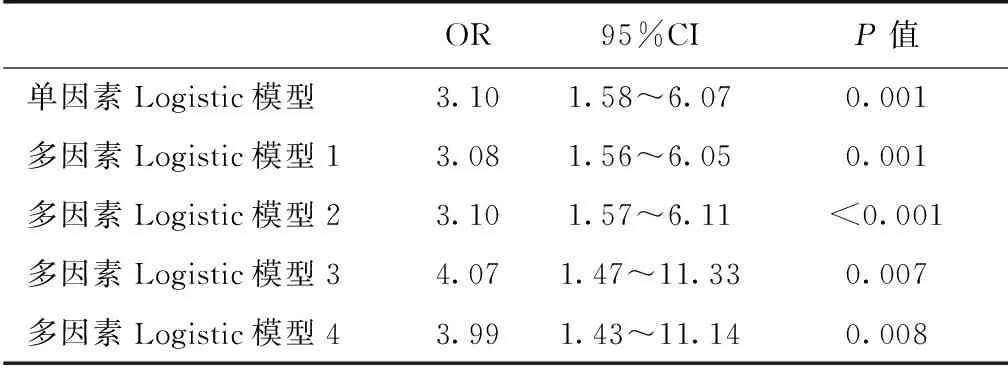
OR95%CIP值单因素Logistic模型3.101.58~6.070.001多因素Logistic模型13.081.56~6.050.001多因素Logistic模型23.101.57~6.11<0.001多因素Logistic模型34.071.47~11.330.007多因素Logistic模型43.991.43~11.140.008
多因素模型1:对性别、年龄、体重进行校正;多因素模型2:在模型1基础上,增加了对糖尿病、高血压、冠心病、既往脑血管病进行校正;多因素模型3:在模型2基础上,增加了对贫血、低蛋白血症、蛋白尿、估算肾小球滤过率、国立健康机构中风评分量表评分进行校正;多因素模型4:在模型3基础上,增加了对造影前使用血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂进行校正
CI-AKI对1年死亡率的影响 CI-AKI患者1年死亡率也明显增加(37.0%vs18.3%,图1)。单因素COX回归显示,CI-AKI患者1年死亡风险增加了1倍以上(风险比HR 2.268,95%CI 1.560~3.298,P<0.001)。即使对性别、年龄、体重、既往相关疾病、基线实验室检查、NIHSS评分、是否术前使用ACEI/ARB进行校正后,CI-AKI仍是1年死亡的独立危险因素(表3)。
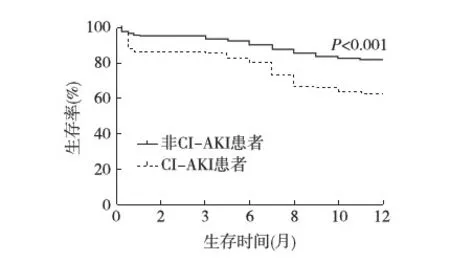
图1 CI-AKI与非CI-AKI患者1年生存率比较CI-AKI:对比剂相关急性肾损伤
表3 对比剂相关急性肾损伤对1年死亡影响的单因素及多因素COX回归
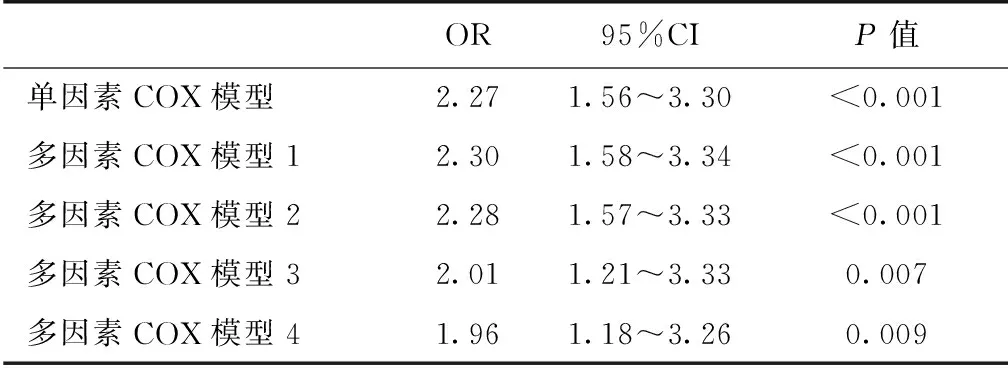
OR95%CIP值单因素COX模型2.271.56~3.30<0.001多因素COX模型12.301.58~3.34<0.001多因素COX模型22.281.57~3.33<0.001多因素COX模型32.011.21~3.330.007多因素COX模型41.961.18~3.260.009
多因素模型1:对性别、年龄、体重进行校正;多因素模型2:在模型1基础上,增加了对糖尿病、高血压、冠心病、既往脑血管病进行校正;多因素模型3:在模型2基础上,增加了对贫血、低蛋白血症、蛋白尿、估算肾小球滤过率、国立健康机构中风评分量表评分进行校正;多因素模型4:在模型3基础上,增加了对造影前使用血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂进行校正
讨 论
CI-AKI是院内获得性AKI的重要原因,约占我国院内获得性AKI的13.1%[1]。既往的相关研究发现CI-AKI增加患者近期和远期死亡率[2-5]。但上述研究主要都是集中关注冠状动脉造影后AKI的预后,缺乏脑血管患者CI-AKI的预后研究。
在本研究中缺血性卒中患者脑血管造影术后CI-AKI发生率仅为4.5%,与文献报道脑血管造影的CI-AKI发生率接近[11-15],远低于冠状动脉造影的CI-AKI发生率(7.8%~15.7%)[2,3,5,16-17]。其原因主要有以下几点:(1)脑血管疾病患者相比于心血管疾病患者其血流动力学较为稳定,尤其是在本研究中我们排除了低血容量、低血压、心源性休克等严重血流动力学不稳定患者,使得血流动力学不稳定的患者比例明显减低,避免血流动力学对肾功能影响;(2)脑血管病患者与心血管疾病患者间合并症存在差异,就本研究而言,高血压及糖尿病患者比例远低于心血管造影患者[5,16-17];(3)本研究中对比剂的使用量远低于心血管病造影相关研究中所使用的剂量[2,5,16-17]。在既往关于心血管对比剂相关AKI的研究中,水化治疗可明确预防CI-AKI,而在我们的这项回顾性研究中并未发现水化对CI-AKI发生的影响,一方面由于本研究中发生CI-AKI的比例较低,影响了统计效力,另一方面由于本研究是回顾性研究,患者接受水化存在一定选择性,往往是那些具有传统CI-AKI高危因素的患者才接受了水化。
Giacoppo等[5]在一项关于冠状动脉造影患者CI-AKI预后研究中发现,CI-AKI增加了患者住院死亡率(4.9%vs0.7%)及1年死亡率(9.8%vs2.9%)。其他的一些关于冠状动脉造影的研究也发现CI-AKI增加了患者近期及远期死亡率[2-4]。由于脑血管造影CI-AKI的发病率明显低于冠状动脉造影CI-AKI发病率,并且脑血管病患者临床特征有所不同,目前脑血管病造影CI-AKI对预后影响并不明确。本研究中,接受脑血管造影的缺血性卒中患者一旦发生CI-AKI其住院死亡风险增加约3倍,同时其1年死亡的风险增加1倍以上。同时,即使对人口学、既往疾病及基线的实验室检查指标进行校正后,CI-AKI对接受脑血管造影的缺血性卒中患者的住院死亡和1年死亡的死亡风险的影响并未发生明显变化,这说明脑血管造影CI-AKI对预后的影响并不是由于CI-AKI患者所特有的临床特征所致,而是通过AKI本身对预后产生了影响。所以,虽然脑血管造影患者CI-AKI的发生率不高,但仍然增加了患者不良预后,需要采取有效的预防措施来避免CI-AKI的发生。
本研究为回顾性研究,且排除了部分缺乏1年随访数据的患者,在患者选择上可能存在偏移;同时接近50%的1年随访资料由电话随访获得,无法取得患者1年时肾功能的情况,且部分患者死亡病因不明确。需要进一步进行前瞻性队列研究来进一步证实脑血管造影后CI-AKI对脑血管病患者预后的影响。
小结:脑血管造影后CI-AKI是缺血性卒中患者住院死亡及1年死亡的独立危险因素,对接受脑血管造影患者采取有效预防措施来避免CI-AKI是十分必要的。
1 Xu X,Nie S,Liu Z,et al.Epidemiology and Clinical Correlates of AKI in Chinese Hospitalized Adults.Clin J Am Soc Nephrol,2015,10(9):1510-1518.
2 McCullough PA,Wolyn R,Rocher LL,et al.Acute renal failure after coronary intervention: incidence,risk factors,and relationship to mortality.Am J Med,1997,103(5):368-375.
3 Weisbord SD,Chen H,Stone RA,et al.Associations of increases in serum creatinine with mortality and length of hospital stay after coronary angiography.J Am Soc Nephrol,2006,17(10):2871-2877.
4 Neyra JA,Shah S,Mooney R,et al.Contrast-induced acute kidney injury following coronary angiography: a cohort study of hospitalized patients with or without chronic kidney disease.Nephrol Dial Transplant,2013,28(6):1463-1471.
5 Giacoppo D,Madhavan MV,Baber U,et al.Impact of Contrast-Induced Acute Kidney Injury After Percutaneous Coronary Intervention on Short- and Long-Term Outcomes: Pooled Analysis From the HORIZONS-AMI and ACUITY Trials.Circ Cardiovasc Interv,2015,8(8):e002475.
6 Stacul F,van der Molen AJ,Reimer P,et al.Contrast induced nephropathy: updated ESUR Contrast Media Safety Committee guidelines.Eur Radiol,2011,21(12):2527-2541.
7 中华医学会内分泌学分会.高尿酸血症和痛风治疗中国专家共识.中华内分泌代谢杂志,2013,29(11):913-920.
8 World Health Organisation.Iron deficiency anaemia: assessment,prevention,and control.A guide for programme managers.WHO,2001.(http:∥www.who.int/nutrition/publications/micronutrients/anaemia_iron_deficiency/WHO_NHD_01.3/en/)
9 中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南.中华心血管病杂志,2007,35(5):390-419.
10 Levey AS,Stevens LA,Schmid CH,et al.A new equation to estimate glomerular filtration rate.Ann Intern Med,2009,150(9):604-612.
11 Ray B,Rickert KL,Welch BG,et al.Development of contrast-induced nephropathy in subarachnoid hemorrhage: a single center perspective.Neurocrit Care,2013,19(2):150-156.
12 Prasad V,Gandhi D,Stokum C,et al.Incidence of contrast material-induced nephropathy after neuroendovascular procedures.Radiology,2014,273(3):853-858.
13 Sharma J,Nanda A,Jung RS,et al.Risk of contrast-induced nephropathy in patients undergoing endovascular treatment of acute ischemic stroke.J Neurointerv Surg,2013,5(6):543-545.
14 Loh Y,McArthur DL,Vespa P,et al.The risk of acute radiocontrast-mediated kidney injury following endovascular therapy for acute ischemic stroke is low.AJNR Am J Neuroradiol,2010,31(9):1584-1587.
15 吴海霞,王成全,冯雪影,等.心脑血管造影和介入治疗造影剂肾病的相关危险因素研究.实用心脑肺血管病杂志,2012(3):416-417.
16 Mehran R,Aymong ED,Nikolsky E,et al.A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation.J Am Coll Cardiol.2004 Oct 6;44(7):1393-9.
17 Inohara T,Kohsaka S,Abe T,et al.Development and validation of a pre-percutaneous coronary intervention risk model of contrast-induced acute kidney injury with an integer scoring system.Am J Cardiol,2015,115(12):1636-1642.
(本文编辑 莫 非 凡 心)
The short-time mortality in ischemic stroke patients with contrast-induced acute kidney injury
DONGWei,TAOYiming,LIZhilian,CHENYuanhan,MOLiyi,LIANGHuaban,LIRuizhao,SHIWei,LIANGXinling
DivisionofNephrology,GuangdongGeneralHospital,GuangdongAcademyofMedicalscience,Guangzhou510080,China
Correspondingauthor:LIANGXinling(xinlingliang_ggh@163.com)
T Objective:The association between contrast-induced acute kidney injury (CI-AKI) and prognosis in cerebrovascular patients is still unknown. This study aimed to determine whether CI-AKI is a risk factor for in-hospital mortality and 1-year mortality in ischemic stroke patients undergoing cerebral angiography. Methodology:This retrospective observational study consisted of consecutive cerebral ischemic stroke patients undergoing cerebral angiography at Guangdong General Hospital between January 2009 and December 2013. Patient demographics, medical history, physical examination, National Institute of Health Stroke scale (NIHSS) score of neurological deficit, medication use, laboratory findings, procedural characteristics, length of stay in the hospital, requirement for renal replacement therapy (RRT), date of in-hospital death, and date of 1-year death were collected. Univariate and multivariate logistic regression analyses were used to determine whether CI-AKI was an independent risk factor for in-hospital mortality. Cox regression was performed to assess the correlation between CI-AKI and 1-year mortality. Results:A total of 1 820 ischemic stroke patients undergoing cerebral angiography were analyzed. CI-AKI was observed in 81 patients (4.5%) and was significantly associated with a higher rate of in-hospital mortality (13.6%vs4.8%,P<0.001) and 1-year mortality (37.0%vs18.3%,P<0.001). CI-AKI didn’t increase the length of stay in the hospital (31.3±16.4 daysvs30.2± 16.0 days,P=0.540). After adjusting for potential confounding risk factors, patients with CI-AKI had a 4-fold higher risk of compared with patients without CI-AKI (odds ratio [OR] 3.99; 95% confidence interval [CI] 1.43~11.14;P=0.008). CI-AKI also increased 1-year hospital mortality independently (hazard ratio [HR] 1.96, 95%CI 1.18-3.26;P=0.009). Conclusion:CI-AKI is an independent risk factor for in-hospital mortality and 1-year mortality in ischemic stroke patients undergoing cerebral angiography.
acute kidney injury contrast medium ischemic stroke cerebral angiography mortality
10.3969/cndt.j.issn.1006-298X.2016.04.003
国家临床重点专科建设项目 国家自然科学基金面上项目(81170683)
广东省人民医院肾内科 广东省医学科学院(广州,510080)
梁馨苓(E-mail:xinlingliang_ggh@163.com)
2016-05-12
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有

