视网膜神经节细胞凋亡对延迟整流钾电流的影响*
赵 瑛, 徐亚吉, 路雪婧, 段俊国△
(1成都中医药大学视觉生理重点实验室,四川 成都 610075; 2成都大学生理教研室,四川 成都 610106)
视网膜神经节细胞凋亡对延迟整流钾电流的影响*
赵 瑛1, 徐亚吉2, 路雪婧1, 段俊国1△
(1成都中医药大学视觉生理重点实验室,四川 成都 610075;2成都大学生理教研室,四川 成都 610106)
目的: 观察视网膜神经节细胞(retinal ganglion cells,RGCs)凋亡对延迟整流钾电流(delayed recti-fier K+currents,IK)的影响。方法: 将原代培养2~3 d的SD乳大鼠RGCs分为对照组、加压0.5 h组、加压1 h组、加压1.5 h组和加压2 h组,对照组为常规培养6 d;其它各组常规培养6 d后用自行设计的加压装置加压80 mmHg,时间分别为0.5 h、1 h、1.5 h和2 h,通过连续波长多功能微孔板检测仪检测各组RGCs线粒体的荧光强度;通过全细胞膜片钳技术观察各组细胞膜电容(membrane capacitance,Cm)的变化,观察对照组与加压1 h组IK、V1/2、k和Gmax的变化。结果: 对照组RGCs线粒体的荧光强度与加压0.5 h组比较差异无统计学显著性,而加压1 h、1.5 h和2 h各组RGCs线粒体的荧光强度显著低于对照组(P<0.05);对照组RGCs的细胞Cm与加压0.5 h组比较差异无统计学显著性,其余各组RGCs的细胞Cm显著低于对照组(P<0.05)。与对照组比较,加压1 h能使电流幅度显著增加,在刺激电位为-10 mV~60 mV时,加压1 h组的电流密度明显大于对照组(P<0.05)。加压1 h组的Gmax值明显高于对照组(P<0.05),V1/2显著小于对照组(P<0.01),两组间比较k值的差异无统计学显著性。结论: 视网膜神经节细胞凋亡伴有IK通道电导增加,IK增大。
延迟整流钾电流; 视网膜神经节细胞; 加压; 细胞凋亡
青光眼是不可逆致盲性眼病,病理基础是视网膜神经节细胞(retinal ganglion cells,RGCs)凋亡,视野缺损,因此探索RGCs凋亡机理对预防和治疗青光眼有重要意义。越来越多的研究表明,细胞内钾离子浓度降低是多种细胞凋亡途径的重要因素,胞内钾外流是引起老年痴呆患者海马神经元凋亡的关键[1],随着凋亡细胞内K+的丢失,细胞内促凋亡因子Bax表达增加使细胞凋亡[2]。我们前期的研究发现,青光眼大鼠的RGCs促凋亡因子Bax增加,凋亡抑制因子Bcl-2的表达减少,RGCs的凋亡增多[3]。然而尚不清楚在凋亡过程中RGCs的K+电流是如何变化的。为此,本研究探讨压力诱导RGCs凋亡时延迟整流钾电流(delayed rectifier K+currents,IK)的变化,探索RGCs凋亡的机理,为防止青光眼视神经疾病奠定基础。
材 料 和 方 法
1 实验动物及分组
SD乳鼠(出生2~3 d),雌雄不拘,由成都中医药大学实验动物中心提供。将分离培养的乳鼠RGCs分为对照组、加压0.5 h组、加压1 h组、加压1.5 h组和加压2 h组。对照组为常规培养6 d;其余各组为常规培养6 d后用自行设计的加压装置加压80 mmHg,时间分别为0.5 h、1 h、1.5 h和2 h。
2 主要试剂与仪器
多聚鸟氨酸、多聚赖氨酸、胰蛋白酶、ATP-Mg、 GTP、phosphocreatin、EGTA和Asp(Sigma);层黏连蛋白(Roche);胎牛血清、HEPES、 DMEM/F12、B-27、Thy1.1单克隆抗体、rhodamine 123和二甲基亚砜(Invitrogen);羊抗鼠IgG(北京中杉金桥生物科技有限公司);宁夏枸杞多糖(由香港大学脑与认知科学国家重点实验室馈赠)。Multiclamp 700B膜片钳系统(Axon);P-97电极拉制仪(Sutter);Ti倒置显微镜(Nikon);DMi1倒置显微成像系统(Leica);SMZ445体视显微镜(Nikon)
3 方法
3.1 RGCs的培养 用文献报道的方法[4]分离培养RGCs。取出生2~3 d内的SD乳鼠,75%乙醇消毒,断颈处死,无菌条件下取眼球,置入含青霉素的PBS液中。在体视显微镜下沿角膜剪开,去除晶状体和玻璃体,钝性分离视网膜。将视网膜放入终浓度0.125%的胰蛋白酶中,吸管轻轻吹打,消化10 min,加入胎牛血清终止消化,用200目无菌钢筛网过滤,滤液离心2次,1 000 r/min,每次10 min,弃上清液。向沉淀中加入DMEM/F12培养液(含90% DMEM/F12、10%胎牛血清、1×105U/L青霉素、100 mg/L链霉素),吸管吹打使之分散均匀制成单细胞悬液。将视网膜细胞悬液加入经羊抗鼠IgG和小鼠抗大鼠Thy-1.1单克隆抗体包被的培养皿中,在37 ℃、5% CO2培养箱中孵育30 min,使视网膜RGCs与Thy-1.1单克隆抗体充分结合。去除悬液,用无血清DMEM/F12培养液反复漂洗,清除培养皿表面未黏附细胞。用0.125%胰蛋白酶消化黏附的细胞5 min,小牛血清终止消化。收集细胞,1 000 r/min离心5 min,去上清,加入含胎牛血清的DMEM/F12培养液,用吸管反复吹打,使细胞分散均匀,制成细胞悬液,计数,将细胞悬液按每孔1×106个接种于经多聚鸟氨酸、层黏连蛋白包被的24孔板中,置于培养箱中培养。
3.2 线粒体膜电位的检测 用0.125%胰蛋白酶消化黏附的细胞5 min,小牛血清终止消化,收集细胞,1 000 r/min离心5 min,加入PBS液使细胞悬浮,将悬液加入酶标板中,静置30 min贴壁,加入已配置好的1 μmol/L rhodamine 123,每孔20 μL,使终浓度至0.5 μmol/L,37 ℃孵育20 min,用PBS洗涤2次,用连续波长多功能微孔板检测各组RGCs线粒体膜荧光强度,激发光波长为488 nm,发射光波长为532 nm,重复3次实验。
3.3 全细胞膜片钳记录 在室温条件(20~25 ℃)下记录各组RGCs的膜电容(membrane capacitance,Cm)以及对照组与加压1 h组的IK。采样频率为10 kHz,低通滤波频率2 kHz,保持电位钳制在-50 mV,以10 mV的阶跃,从-50 mV去极化至+60 mv,钳制时间为200 ms。电极液(mmol/L):KOH 110、KCl 20、Asp 110、MgCl21、HEPES 10、EGTA 5、ATP-Mg 5、GTP 0.1、phosphocreatin 5,用KOH调节pH值至7.2;细胞浴液(mmol/L):NaCl 136、KCl 5.4、CaCl21.0、MgCl21.0、NaH2PO40.33、HEPES 5、glucose 10、CoCl23,用NaOH调节pH值至7.35。
4 统计学处理
采用Clampfit 10.0和Origin 7.5软件进行数据处理并作图,采用SPSS 17.0软件进行统计学分析,实验数据以均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间进行比较采用单因素方差分析(one-way ANOVA),各组均数间两两比较采用LSD法,以P<0.05为差异有统计学意义。
结 果
1 加压对RGCs线粒体膜电位的影响
线粒体膜电位与rhodamine 123荧光强度成正比,因此可通过rhodamine 123荧光强度间接观察线粒体膜电位的变化。对照组与加压0.5 h组比较差异无统计学显著性,加压1 h组、加压1.5 h组和加压2 h组显著低于对照组(P<0.05),见图1。

Figure 1.Time courses of pressure-induced decreses in rhodamine 123 fluorescence in the mitochondria of RGCs. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图1 加压时间延长引起RGCs线粒体膜电位减小
2 加压对细胞Cm的影响
为了观察加压诱导凋亡细胞体积的变化,我们在电生理实验中观察了加压不同时间的细胞Cm,对照组和加压0.5 h组细胞的Cm差异无统计学显著性,加压1 h、1.5 h和2 h组细胞的Cm均显著低于对照组(P<0.05),而加压1.5 h和2 h组细胞的Cm差异无统计学显著性,见图2。
3 凋亡的RGCsIK的改变
加压80 mmHg 1 h能使RGCs发生凋亡,因此,本研究采用全细胞电压钳制脉冲刺激模式记录对照组和加压1 h组RGCs 的IK。选择胞体光泽好、细胞膜光滑、立体感强的细胞进行实验。与对照组比较,加压1 h能使电流幅度显著增加。各阶跃电压下的电流大小以电流密度(电流/膜电容)表示,做电流-电压(I-V)曲线,与对照组比较,在刺激电位为-10 mV~60 mV时,加压组的电流密度明显大于对照组,差异有统计学显著性(P<0.05),见图3。
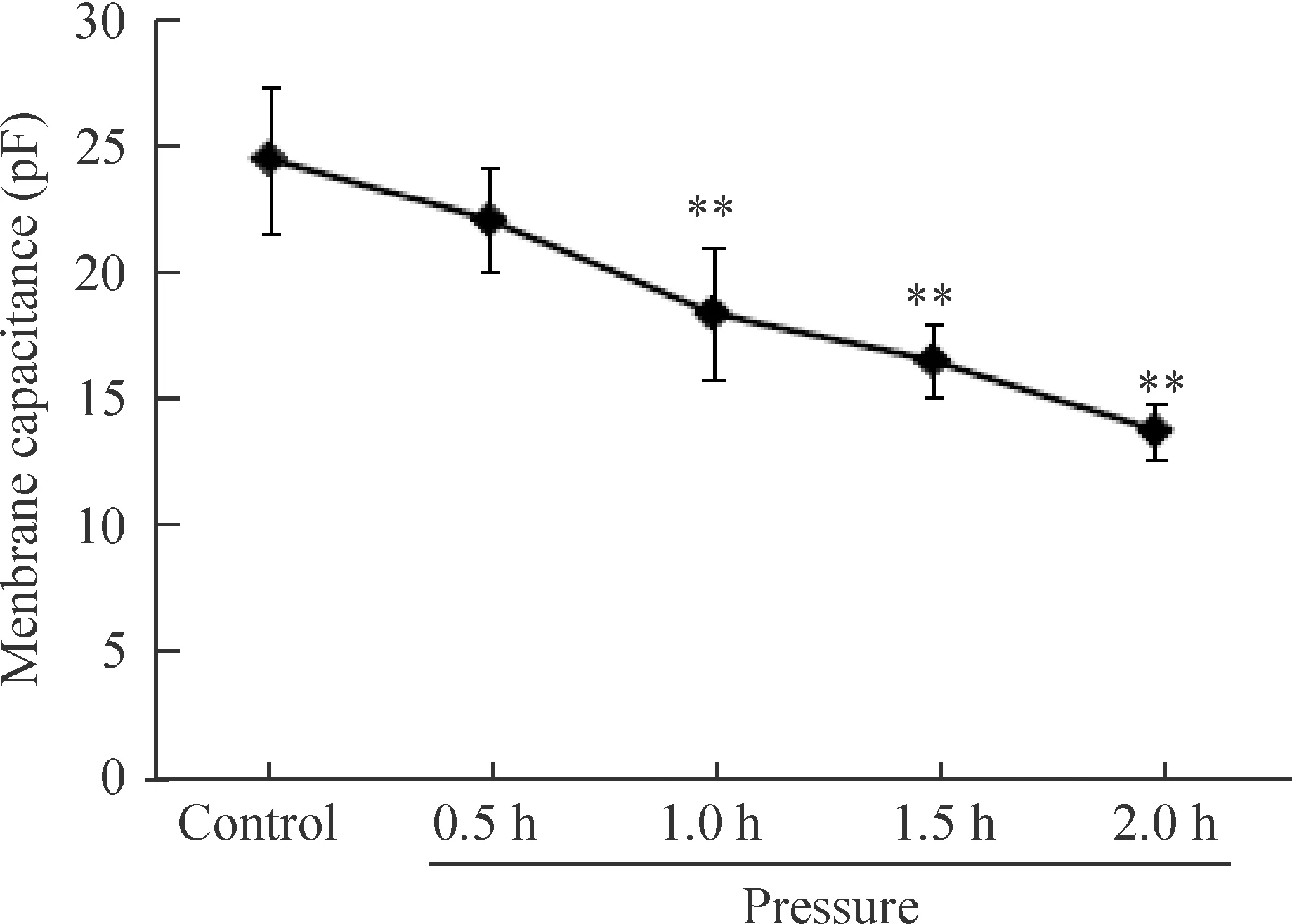
Figure 2.Time courses of pressure-induced decreses in the membrane capacitance. Mean±SD.n=8.**P<0.01vscontrol group.
图2 加压时间延长引起细胞膜电容减小
4 凋亡的RGCsIK的动力学改变
从IK电流-电压曲线中获得数据并转化为电导值,以标准化电导值对膜电位作图,用Boltzmann方程G=Gmax/{1+exp[(V1/2-Vm)/k]}拟合,得到最大电导值(Gmax)、IK电流激活曲线、IK半数激活电压(V1/2)和斜率k值。加压1 h组的Gmax与对照组的Gmax比较差异有统计学显著性(P<0.05),加压1 h组的V1/2与对照组比较差异有统计学显著性(P<0.01);两组比较k值间的差异无统计学显著性,见图4、表1。
讨 论
青光眼是全世界第二位致盲性眼病,据流行病学调查显示,目前,我国40岁以上人群中,青光眼患者达到2 210万人,且青光眼患者数量呈逐年上升的趋势[5],青光眼的主要病理变化是视网膜神经节细胞的凋亡及视神经的永久性损害,视野缺损,因此,探索青光眼视网膜神经节细胞凋亡的机制尤为重要。
细胞凋亡是细胞死亡的主要形式之一,诱导凋亡的方法根据研究者们研究的对象和目的而采取不同的方法,国内外研究己证实外来机械压力可导致淋巴细胞凋亡[6],神经节细胞的损伤或凋亡[7-8]。本实验室早已建立了成熟的加压诱导RGCs细胞凋亡的方法,发现加压80 mmHg 1 h能诱发RGCs凋亡[9],采用加压的方法诱导RGCs凋亡模拟了眼球在高压状态下引起RGCs凋亡及损伤的情况。
线粒体在细胞凋亡过程中发挥积极主动的调控作用,而且处于多种凋亡调控通路和信号的中心地位[10]。正常的线粒体膜电位是生存所必须的,当细胞受到凋亡诱导因素作用后,线粒体膜受到破坏使其膜电位降低,导致线粒体内促凋亡蛋白分子释放,使细胞凋亡。Rhodamine 123是一种可透过细胞膜的阳离子荧光染料,是一种线粒体跨膜电位的指示剂,rhodamine 123荧光与线粒体膜电位呈线性关系。我们的研究显示随着加压时间大于1 h,rhodamine 123荧光强度降低,该研究结果与凋亡的大脑纹状体神经细胞内rhodamine 123颗粒荧光强度降低[11],缺氧诱导的大鼠皮层神经细胞线粒体膜电位降低一致[12]。荧光强度的降低可能与加压引起RGCs线粒体膜完整性破坏有关,从线粒体中释放出活性氧(reactive oxygen species,ROS)、caspase-3、caspase-9等促凋亡蛋白[13-14]可能引起压力诱导的RGCs凋亡。我们的研究还发现,加压80 mmHg 1 h、1.5 h、2 h会引起RGCs的Cm变小,而加压1.5 h 与加压2 h无明显的差异,细胞Cm间接反映了细胞体积的大小,这与细胞凋亡时细胞体积变小的基本形态学特性一致。我们的这些研究结果也再次证明了加压 80 mmHg 1 h可引起RGCs凋亡。
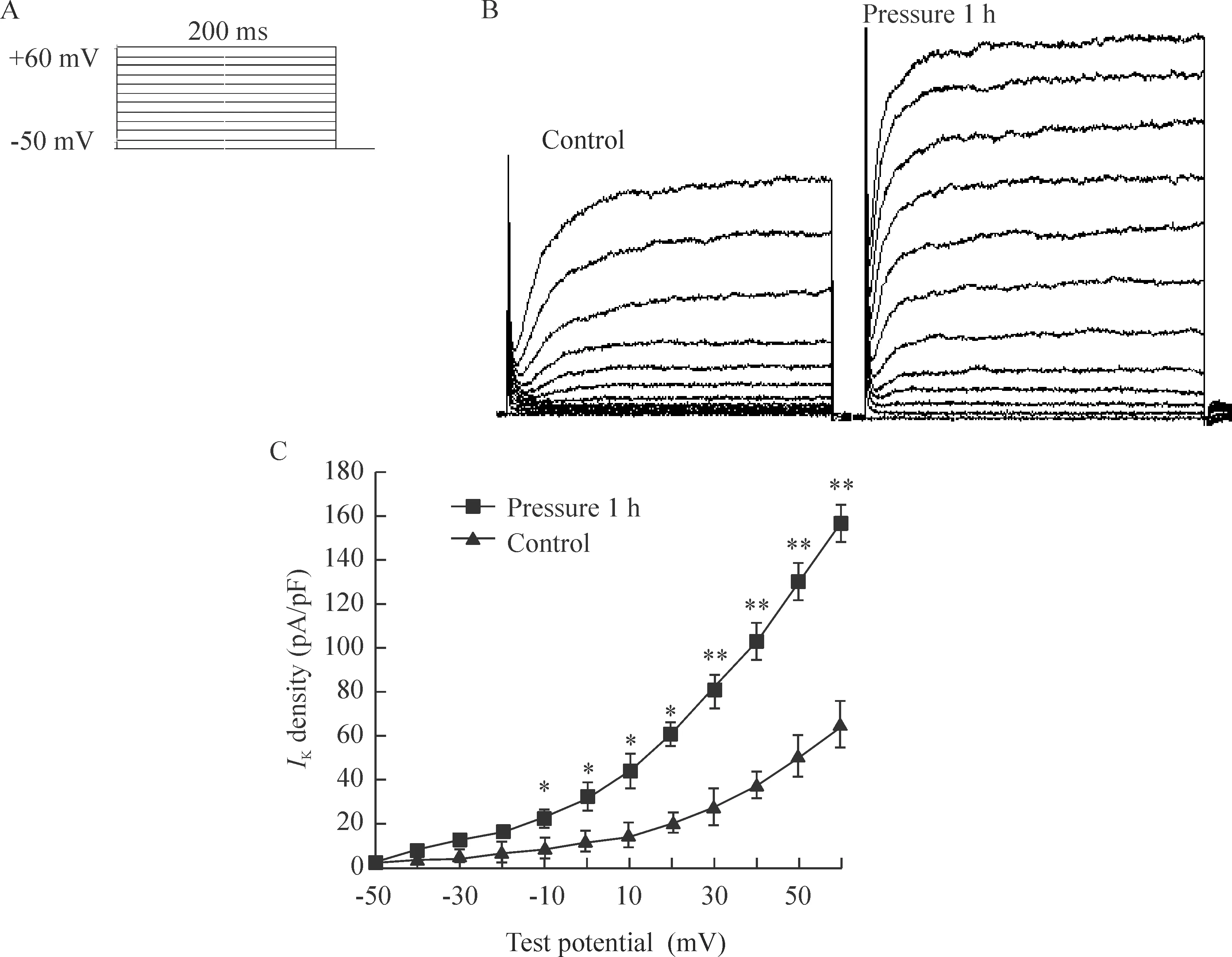
Figure 3.The delayed rectifier K+currents in control group and pressure 1 h group. A: voltage clamp protocol, voltage step from -50 to 60 mV; B: current traces ofIKin control group and pressure 1 h group; C: current (I)-voltage (V) relationship of the 2 groups. Mean±SD.n=9.*P<0.05,**P<0.01vscontrol group.
图3 加压1 h组与对照组IK的变化

Figure 4.The conductance-voltage curves for control and pressure 1 h groups. Mean±SD.n=9.
图4 加压1 h组和对照组的电导-电压曲线

表1 两组IK的动力学特征
*P<0.01,**P<0.05vscontrol group.
大量的研究发现,多种细胞凋亡伴有细胞内钾离子的外流增加,本研究发现加压引起细胞IK增大,V1/2左移变小,Gmax增加,这一研究结果与文献报道的神经细胞凋亡时外向钾电流增加[15]一致,说明RGCs凋亡也伴有外向钾电流增加,增加的原因可能是细胞膜上的K+通道数开放增多,电导增大,但并不能说明通道开放的速度增快。此外,外向钾电流的增加,细胞内容物减少,促进了细胞体积变小,这也可能是细胞凋亡时体积变小的原因。然而,RGCs凋亡时外向钾电流增加是否是RGCs凋亡的必要条件,钾通道在RGCs凋亡过程中的作用是什么?哪种类型的钾通道参与RGCs凋亡我们还要做进一步的研究。
致谢: 感谢苏国辉院士为本研究提供宁夏枸杞多糖。
[1] 金宏伟. 电压依赖性钾通道在老年痴呆相关的神经细胞凋亡中的作用研究 [D].北京:中国协和医科大学,1999.
[2] 杨巧云.钾离子调节转录因子活性参与神经元凋亡机制的探讨[D].上海:中国科学院上海生命科学研究院神经科学研究所,2006.
[3] 赵 瑛,刘立夏,黄 燕,等.枸杞多糖对高眼压大鼠视网膜神经节细胞的影响[J]. 中医眼耳鼻喉杂志, 2012, 2(1):24-26.
[4] 张 虹,钟 杰,李贵刚,等.压力对大鼠纯化视网膜神经节细胞存活及轴突生长的影响[J]. 中华眼科杂志, 2009, 44(2):164-167.
[5] Jonas JB, George R, Asokan R, et al. Prevalence and causes of vision loss in Central and South Asia: 1990-2010 [J]. Br J Ophthalmol, 2014, 98(5):592-598.
[6] Takano KJ, Takano T, Yamanouchi Y, et al. Pressure-induced apoptosis in human lymphoblasts[J]. Exp Cell Res, 1997, 235(1):155-160.
[7] Chen C, Wang L, Rong X, et al. Effects of fluoxetine on protein expression of potassium ion channels in the brain of chronic mild stress rats[J]. Acta Pharm Sin B, 2015, 5(1):55-61.
[8] Pannaccione A, Boscia F, Scorziello A, et al. Up-regulation and increased activity of KV3.4 channels and their accessory subunit MinK-related peptide 2 induced by amyloid peptide are involved in apoptotic neuronal death[J]. Mol Pharmacol, 2007, 72(3):665-673.
[9] 曾洁萍. DSX及其成分对体外培养鼠视网膜神经节细胞影响的实验研究[D]. 成都:成都中医药大学,2003.
[10]Susin SA, Zamzami N, Kroemer G.Mitochondria as regulators of apoptosis: doubt no more[J]. Biochim Biophys Acta, 1998, 1366(1-2):151-165.
[11]Tang K, Zhang JT. Clausenamide improves long-term potentiation impairment and attenuates apoptosis after tran-sient middle cerebral artery occlusion in rats[J]. Neurol Res, 2003, 25(7):713-717.
[12] 魏楚蓉,刘路宽,田立兵,等.硫化氢对缺氧诱导的大鼠皮层神经元损伤的保护作用[J].中国病理生理杂志,2014,30(2):203-207.
[13]应 俊,潘若望,王茂峰,等.藻蓝蛋白诱导喉癌HEP-2细胞凋亡的实验研究[J].中国病理生理杂志,2015,31(7):1189-1196.
[14]刘 俊,张雪林,任永生,等.BARF1表达下调通过活化caspase依赖的线粒体通路诱导EBV阳性胃癌细胞凋亡[J].中国病理生理杂志,2015,31 (11):1970-1978.
[15]Norris CA, He K, Springer MG, et al. Regulation of neuronal proapoptotic potassium currents by the hepatitis C virus nonstructural protein 5A[J]. J Neurosci, 2012, 32(26):8865-8870.
(责任编辑: 卢 萍, 罗 森)
Effects of retinal ganglion cell apoptosis on delayed rectifier K+currents
ZHAO Ying1, XU Ya-ji2, LU Xue-jing1, DUAN Jun-guo1
(1KeyLaboratoryforVisionPhysiology,ChengduUniversityofTraditionalChineseMedicine,Chengdu610075,China;2DepartmentofPhysiology,ChengduUniversity,Chengdu610106,China.E-mail:duanjgs@126.com)
AIM: To investigate the effects of rat retinal ganglion cell (RGC) apoptosis on delayed rectifier K+currents (IK). METHODS: The retinas of 2~3 d newborn Sprague-Dawley rats were dissociated into cell suspension by trypsin digestion. The RGCs were cultured and divided into control group, pressure 0.5 h group, pressure 1 h group, pressure 1.5 h group and pressure 2 h group. The cells were cultured regularly for 6 d in control group, and the cells in other groups were cultured regularly for 6 d and gave pressure of 80 mmHg for 0.5 h, 1 h, 1.5 h and 2 h, respectively. The rhodamine 123 fluorescence from labeled RGC mitochondrion was detected by continuous wavelength multifunctional microplate detection instrument. The membrane capacitance (Cm) in different groups andIKin the pressure 1 h group were recorded from the RGCs by whole-cell patch-clamp technique. RESULTS: No difference of rhodamine 123 fluorescence in the RGC mitochondria between control group and pressure 0.5 h group was observed. Rhodamine 123 fluorescence in the other 3 groups was significantly lower than that in control group (P<0.05). No difference of theCmbetween control group and pressure 0.5 h group was found, and theCmin the other 3 groups was significantly lower than that in control group (P<0.05). The amplitudes ofIKwere higher than that in control group. At the test potential from -10 mV to 60 mV, the current density in pressure 1 h group was significantly higher than that in control group (P<0.05). The maximal conduction (Gmax) in pressure 1 h group was significantly higher than that in control group. The voltage forIKchannel half-activation (V1/2) in pressure 1 h group declined comparison with control group (P<0.01), and thekvalue had no significant difference between the 2 groups. CONCLUSION: Retinal ganglion cell apoptosis accompanies with delayed rectifier K+current enhancement.
Delayed rectifier K+currents; Retinal ganglion cells; Pressure; Apoptosis
1000- 4718(2016)08- 1403- 05
2016- 02- 26
2016- 06- 15
国家科技部重大新药创制资助项目(No. 2009ZX09103-369);四川省教育厅重点项目(No. 200ZD013)
R774.6;R339.14
A
10.3969/j.issn.1000- 4718.2016.08.010
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 028-87715032; E-mail: duanjgs@126.com

