MnO2/碳布复合材料的制备及其电化学行为
黄子龙,赵 昕,李英芝,任坚理,张清华
(东华大学 a. 纤维材料改性国家重点实验室; b. 材料科学与工程学院, 上海 201620)
MnO2/碳布复合材料的制备及其电化学行为
黄子龙a, b,赵昕a, b,李英芝a, b,任坚理a, b,张清华a, b
(东华大学 a. 纤维材料改性国家重点实验室; b. 材料科学与工程学院, 上海 201620)
摘要:利用低温水热法在碳布(CC)表面一步法生长MnO2纳米颗粒,通过控制水热反应时间,制备了一系列MnO2/碳布复合材料.通过场发射扫描电子显微镜、X射线衍射、拉曼光谱、X射线光电子能谱分析了不同复合材料的形貌与结构,同时利用恒流充放电、循环伏安、交流阻抗方法对所制备的复合材料进行了电化学性能的测试.结果表明,碳布表面的性质和反应时间对MnO2生长形貌和厚度具有一定的影响,从而造成复合材料电化学性能的改变.电化学性能测试显示,经0.50 h反应所得的MnO2/碳布复合材料在0.2 mA/cm2充放电电流下,面积比电容达到76.9 mF/cm2,经过1 700 次循环测试后其面积比电容仍保留原来的89%.以碳布为基材大大缩短了离子传输和电荷转移路径,从而使得复合材料呈现良好的电化学性能.
关键词:碳布; MnO2; 水热法; 复合材料; 电化学性能; 超级电容器
为了满足现代社会的需求和日益突出的能源问题,开发一种低成本、环保、能源转换高效的储能器件,成为电化学领域的研究热点.这类储能器件的性能与电极材料的性质紧密相关,新型结构材料的制备和设计是能量转换和存储的核心问题,例如可循环充电锂电池、超级电容器等,因此,电极材料的进一步突破是储能器件研究的关键[1].
超级电容器电极材料的储能机理包括双电层机制和可逆的氧化还原反应的储存机制,因此,电极材料既要符合传统电容器高比表面积的特点,又需要其能够发生可逆氧化还原反应,从而实现高能量密度和高功率密度兼备的优异性能.目前用于超级电容器的电极材料主要有:碳材料(石墨烯、碳纳米管、碳纤维、活性炭等)、过渡金属氧化物(如RuO2、NiO、Co3O4、MnO2)和导电聚合物(如聚苯胺、聚噻吩和聚吡咯等)[2-3].碳材料具有比表面积高、热稳定性好、孔径分布可控、耐腐蚀、价廉易得等特点,其是超级电容器的理想电极材料[4].而MnO2价廉低毒,且具有高的赝电容以及环境友好等特点,将其制备成纳米结构,不仅具有比表面积高、阳离子和电子传输路径短的特点,而且可以减缓弯曲压力的冲击,使得MnO2可以应用于柔性储能材料的电极,近年来逐步受到广大研究者的青睐.目前,制备纳米MnO2的主要方法有液相共沉淀法[5-6]、低温固相法[6]、热分解法[7]、水热合成法[8]和溶胶-凝胶法(sol-gel法)[9]、电化学沉积法[10]等,其中,水热法具有反应简单、反应条件温和、MnO2形貌可控等优点.本文采用水热合成法一步制得碳布支撑MnO2复合材料,并对材料的形貌表征和电化学测试作了系统的研究.
1试验
1.1碳布表面处理
碳布用等离子体表面处理仪进行前处理,控制仪器的电压为15 V,调节功率为1000 W左右,在室温下于N2氛围内处理2 min,然后将其在浓硫酸中浸泡1 h,再用去离子水和无水乙醇反复清洗至中性,最后置于70℃烘箱中干燥备用.
1.2MnO2/碳布复合材料的制备
将等离子体处理后的碳布裁剪为4 cm×2 cm的矩形样条,用铂丝固定使其直立放置于水热釜聚四氟乙烯内胆中.配置70 mL 5 mmol/L的高锰酸钾溶液,将其倒入聚四氟乙烯内胆中,并使碳布充分浸渍在溶液中.利用5 mol/L的H2SO4溶液调节反应液的pH值约为1,然后将其置于140℃下进行反应,控制反应时间分别为0.10,0.25,0.50,1.00和2.00 h.反应结束后,冷却到室温取出反应物,得到表面呈现深棕色的MnO2/碳布复合材料,用去离子水和无水乙醇清洗数遍,放在70℃烘箱干燥24 h.
1.3结构与形貌表征
采用日本HITACHI S-4800型场发射扫描电子显微镜观察样品的微观形貌,利用Rigaku D-max-2500型X- 射线衍射仪(Cu Kα入射光波长λ=0.154 06 nm)、Via-Reflex Micro-Raman型拉曼(Raman)光谱仪和5000C ESCA System型X射线光电子能谱(XPS)测试仪表征样品的结构与表面物质成分.
1.4电化学性能测试
釆用三电极体系测试复合材料的电化学性能.将自支撑(free-standing)的MnO2/碳布复合材料裁剪成1.0 cm×0.5 cm 大小直接作为工作电极,无需使用黏结剂和导电填料,以1 cm×1 cm 大小的铂片为对电极,饱和甘汞电极为参比电极,选用0.5 mol/L的Na2SO4溶液作为电解液,于室温下进行测试.使用AutoLab PGSTAT 302N电化学工作站测定电极的循环伏安(CV)曲线、恒流充放电曲线和交流阻抗(EIS)谱图,使用蓝电电池测试系统对电极的循环稳定性进行测试.交流阻抗在频率范围为10-1~105Hz和扰动电压为5 mV的条件下测试.利用充放电曲线按式(1)计算电极材料的面积比电容C.
(1)
其中:Δu为扫描电压窗口(V);i为充放电电流(A);t为放电时间(s);S为测试体系中复合材料的面积(cm2).
2结果与讨论
将碳布浸泡在高锰酸钾溶液中,在高压反应釜中碳与高锰酸钾发生氧化还原反应,其反应机理[11]为
在该反应中,碳布不仅充当基底,同时也是反应的还原剂,其双重作用使反应所得MnO2与碳布表面具有较强的结合力,不易脱落,从而使MnO2/碳布复合材料在作为电极使用时具有较高的电化学稳定性能.
2.1形貌结构表征
利用不同反应时间所制备的MnO2/碳布复合材料的表面形貌如图1所示.从图1可以看出,随着水热反应时间的改变,复合材料的表面呈现不同的形貌特征.由图1(a)可见,碳布经过等离子体表面处理后呈现一条条径向分布的沟槽,这不仅增加了碳布的比表面积,有利于提高MnO2的附着量,而且有助于增加MnO2在碳布表面附着时的结合力,提高复合材料中两种组分的相互作用.由图1(b)~1(f)可见,随着反应时间的延长,碳布表面生长的MnO2层变厚,反应时间为0.10 h(图1(b))和0.25 h(图1(c))时,MnO2呈现蓬松的花球状,直到反应时间为0.50 h(图1(d))时,所生成的MnO2几乎完全覆盖于碳布的整根纤维上,且分布比较均匀.随着反应时间的进一步延长,所制备的MnO2逐渐由球状结构变为棒状结构(图1(e)和1(f)),并且杂乱无规地生长于碳布的表面.

(a) 0 h

(b) 0.10 h

(c) 0.25 h

(d) 0.50 h

(e) 1.00 h

(f) 2.00 h
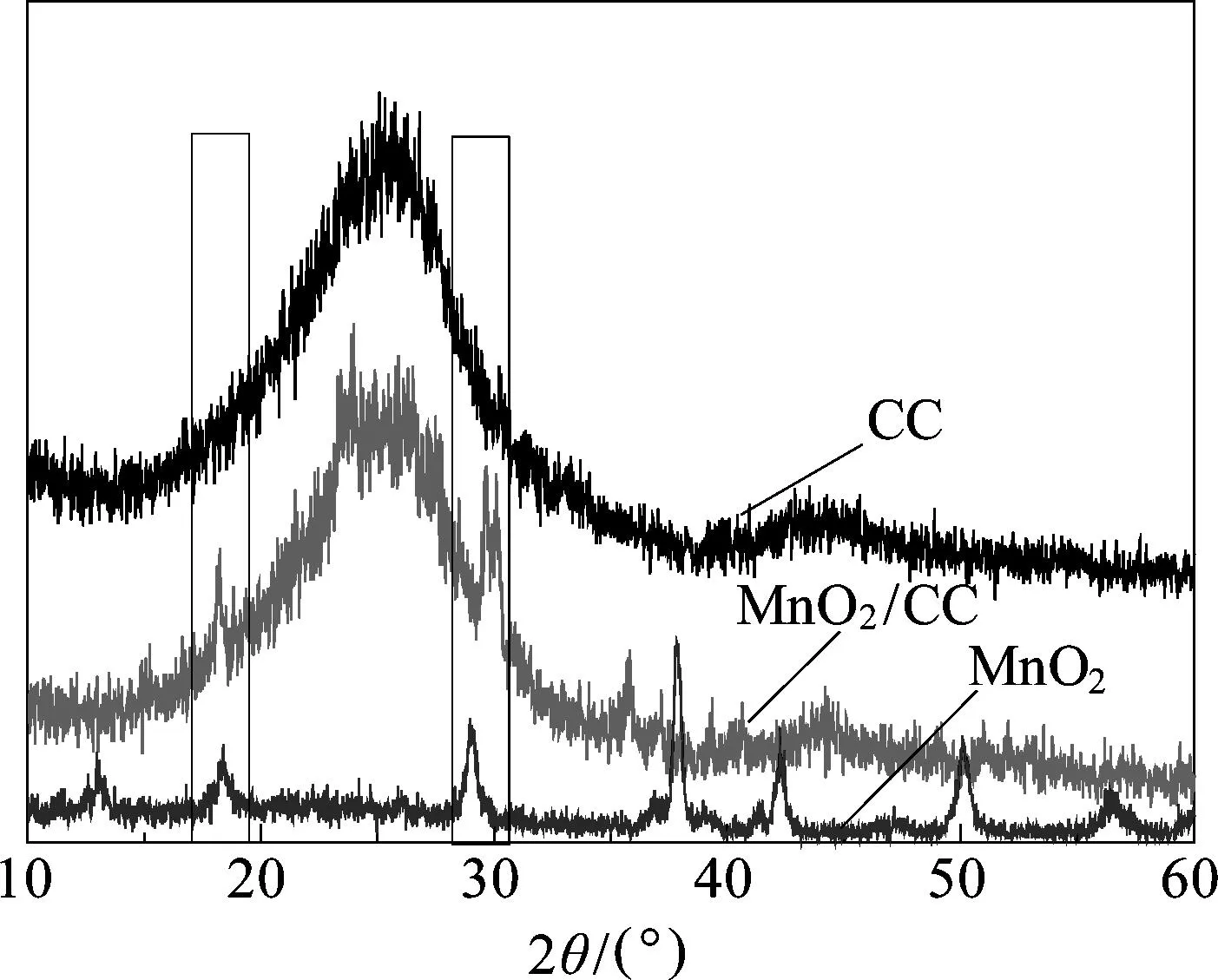
当反应时间为1.00 h,所制备的MnO2/碳布复合材料(MnO2/CC)、MnO2(在相同的条件下用硫酸锰作为还原剂制备得到)和纯碳布(CC)的XRD与Raman图如图2所示.由图2(a)可见,碳布在2θ为25.3°和44.4°处呈现碳材料典型的吸收峰, 而MnO2/碳布复合材料在2θ为18.3°,29.7°,37.2°处出现了新的吸收峰,并且与MnO2的特征吸收峰吻合.由于碳布在44.4°处的特征吸收峰较强,将MnO2的后续几个吸收峰覆盖,故无法判别.根据文献[12]的报道,这些特征峰分别对应于α- MnO2的(200),(130),(211)晶面,因此,可以推断在本实验中碳布表面的负载物质有α-MnO2.为进一步分析MnO2/碳布复合材料的结构,由图2(b)可以看出,碳布的Raman曲线在1580和1328 cm-1出现了两个特征峰,分别对应于碳材料的G峰和D峰,其中G峰是由于sp2杂化的C—C键所呈现出的两维六方晶格型,而D峰是由于石墨化缺陷及晶格无序所致,其中D峰强度略大于G峰强度,说明在碳布基体的结构中存在一定的杂质与缺陷.而对于MnO2/碳布复合材料而言,其Raman曲线中仍然存在碳布的特征峰,此外,在565和640 cm-1处又出现了两个新的特征峰,分别对应于MnO2晶格中MnO6八面体基本结构单元的Mn—O伸缩振动和对称伸缩振动[13],从而进一步证实了复合材料中MnO2的存在.
(a) XRD谱图

(b) Raman谱图

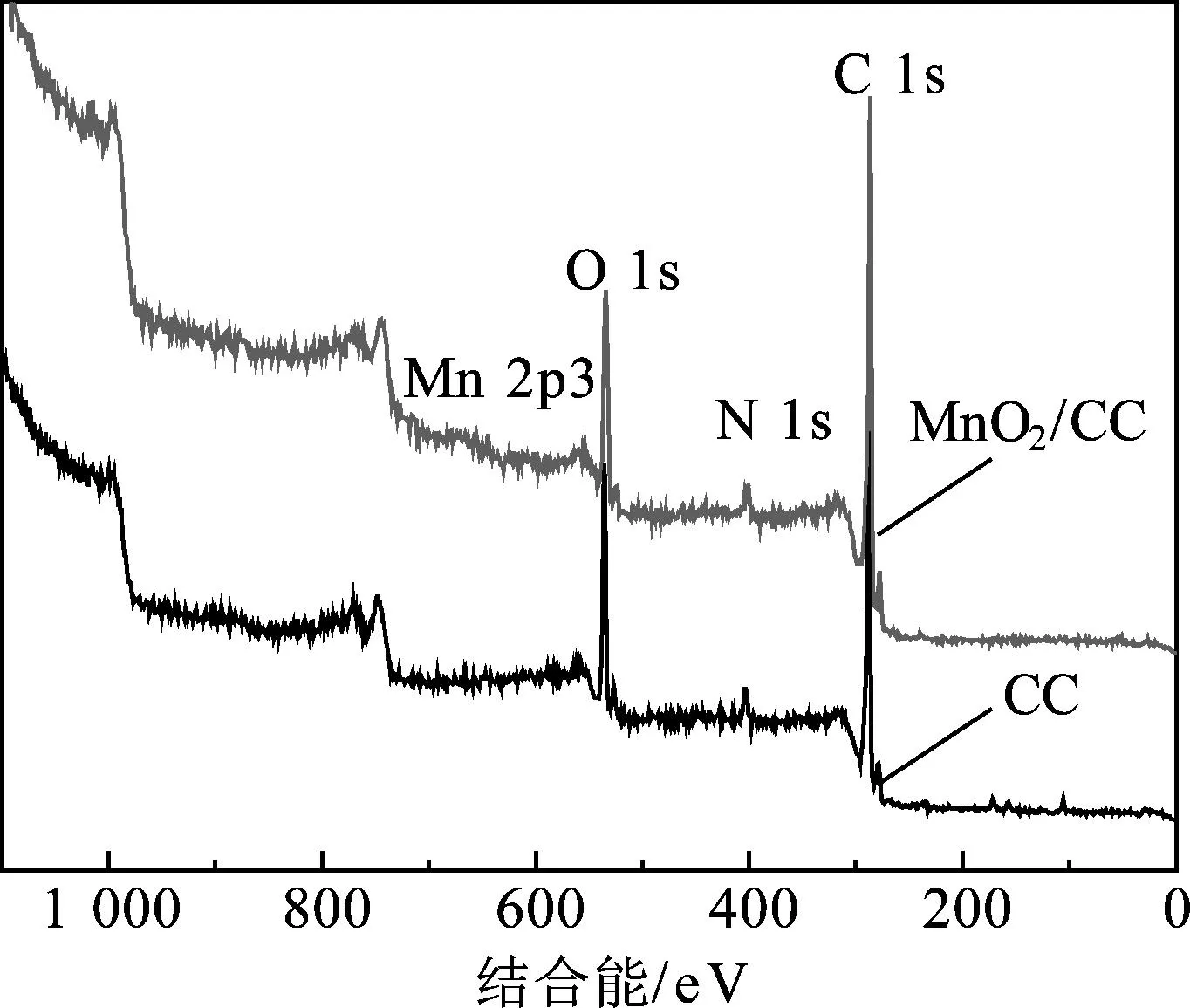
(a) 全谱扫描
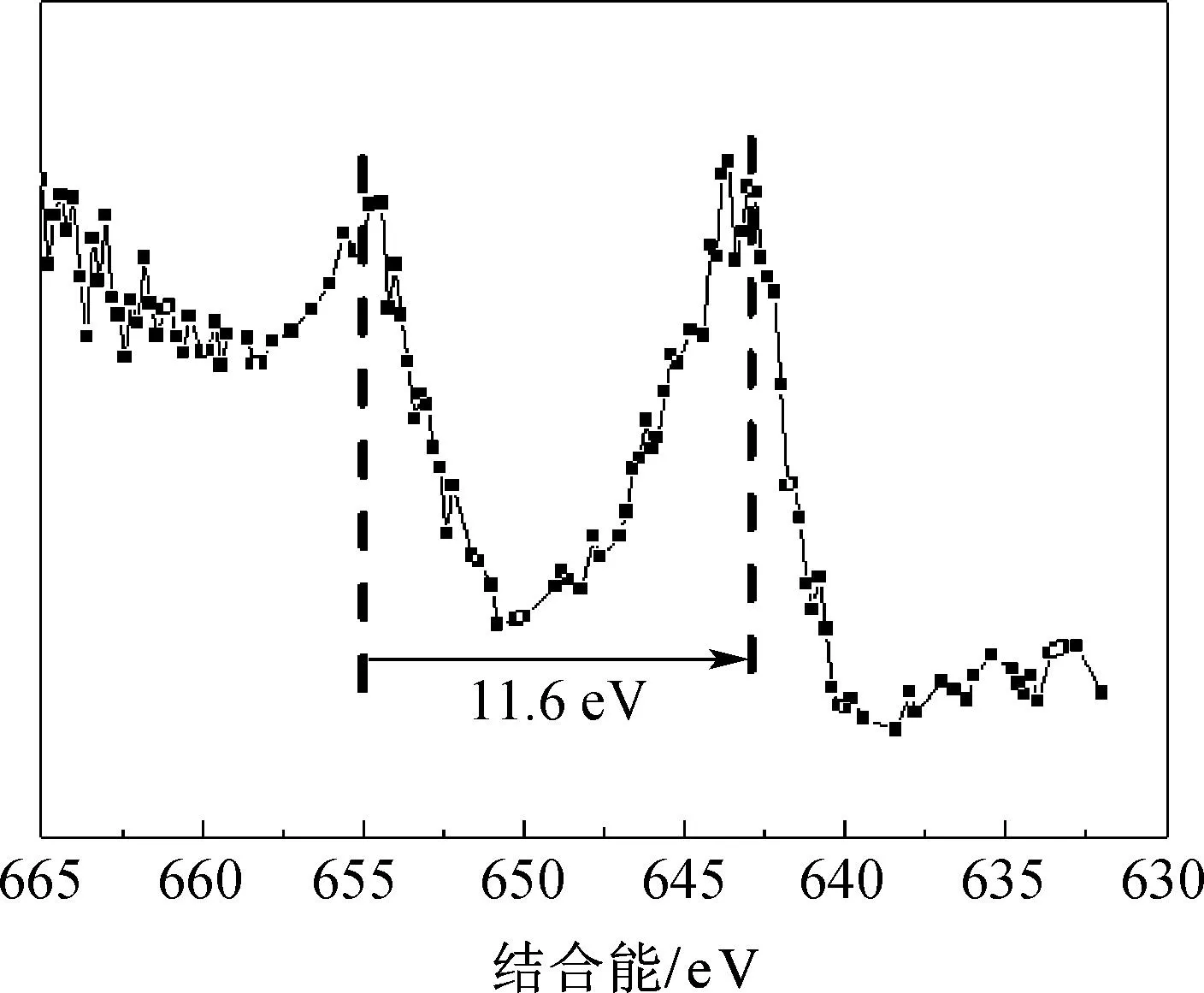
(b) Mn 2p
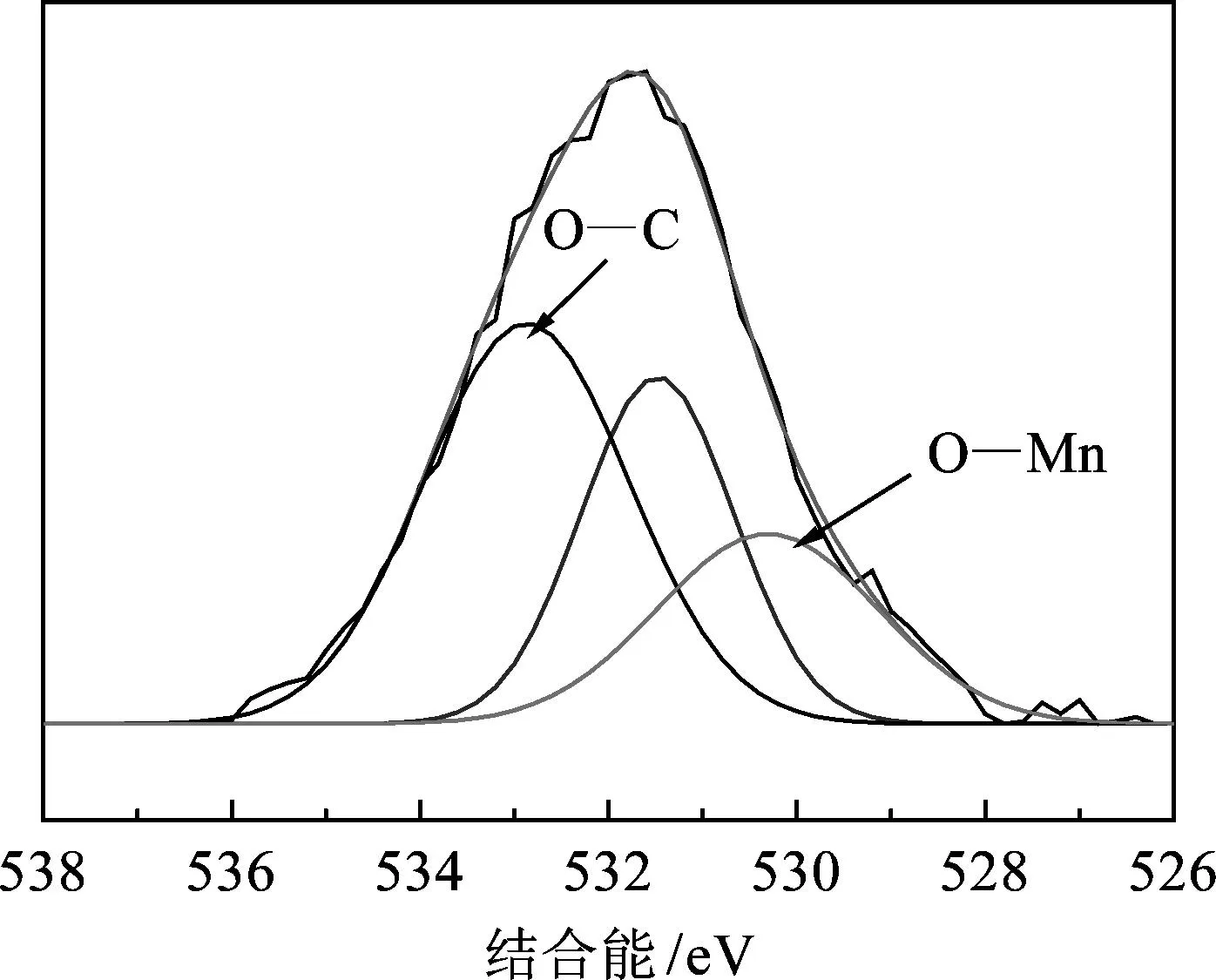
(c) O 1s
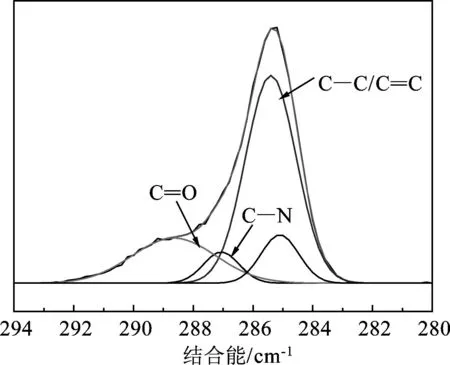
(d) C 1s
2.2电化学性能测试
据文献[17]报道可知,MnO2的储能机理有两种:一种是MnO2表面吸附电解液阳离子C+(H+,Li+,Na+和K+等)而发生氧化还原反应,其反应机理如下所示.
另一种是电解液阳离子在MnO2晶格内的嵌入与脱嵌,其反应机理如下所示.
这两种储能机理都表现了MnO2在低价态和高价态之间的转变.为了进一步研究MnO2/碳布复合材料作为电极材料的性能,将不同反应时间所得MnO2/碳布复合材料直接作为工作电极,在电压范围-0.2~0.8 V条件下进行循环伏安测试,扫描速度分别为5和50 mV/s,测试结果如图4所示.
由图4(a)可知,在低扫描速度下循环伏安曲线接近扁平状矩形,表明材料具有较好的对称可逆电化学反应,在工作电压范围内没有明显的氧化还原峰.由图4(b)可知,当扫描速度增大到50 mV/s时,随着反应时间的延长,当反应时间超过1.00 h后循环伏安曲线出现明显的电化学极化和浓差极化现象,结合前文的SEM分析,在反应时间超过1.00 h后MnO2膜沉积的厚度已经很大,导致材料表面的导电性下降,同时在电解液中的浸润也比较困难,从而影响了电化学反应过程中电荷的传递与离子的扩散,因此表现出较严重的极化现象.当MnO2/碳布复合材料在电流密度为0.2 mA/cm2和电压范围为0~0.8 V条件下测试所得到的充放电曲线如图5所示.由图5可见,随着反应时间的延长,碳布表面的MnO2膜厚度逐渐增加,其三角形充放电曲线对称性越来越差,同时表现出来的电压降也越来越显著.根据上文分析可知,较厚的MnO2在碳布上沉积,使得MnO2/碳布复合材料表面导电性下降,从而影响了复合材料中活性物质的电化学性能.通过式(1)可计算出反应时间为0,0.10,0.25,0.50,1.00, 2.00h时复合材料的面积比电容分别为6.7,20.0,46.0,76.9,103.7和143.7 mF/cm2,显示了复合材料具有良好的电容性能.随着反应时间的延长,复合材料的面积比电容值一直增大,但其增加量逐渐减小.这是由于碳布表面的MnO2量随着反应时间的增加不断增加,较厚的MnO2在碳布表面的沉积导致复合材料的导电性逐渐下降,而且MnO2与碳布的结合力逐渐减弱,使得活性物质MnO2的利用率逐渐减小,从而影响了复合材料电化学性能的进一步提高.

(a) 5 mV/s
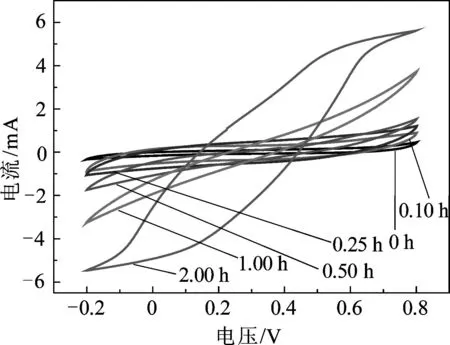
(b) 50 mV/s
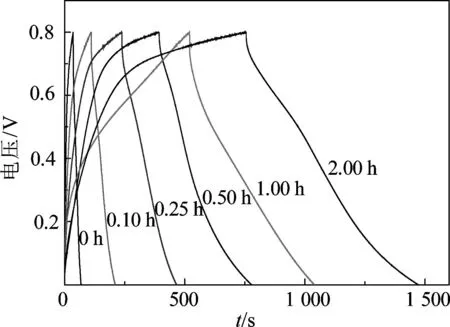
图5 MnO2/碳布复合材料复合电流密度为 0.2 mA/cm2下的恒电流充放电曲线Fig.5 The charge-dischrage curves of the MnO2/CC composites at a scan rate of 0.2 mA/cm2
为了进一步研究电极材料的电化学反应动力学特征,在开路电压下以5 mV的电压扰动在10-1~105Hz的频率范围测试得到MnO2/碳布复合材料的交流阻抗谱图,结果如图6所示.典型交流阻抗谱图的Nyquist曲线主要由两部分组成:一部分是高频区的半圆区域,半圆与z’轴的交点值代表三电极体系的内阻,包括溶液电阻、活性物质自身电阻以及体系的接触电阻,半圆半径反映了电解液/活性物质界面上的电荷转移电阻;另一部分是中频至低频区的近似直线部分,其中频区(45°斜率)对应的是电解液扩散引起的Warburg阻抗[18].从图6看出,随着反应时间的延长,复合材料的Nyquist曲线在高频区的圆弧越来越大,表明材料的电荷转移电阻逐渐增大,这与材料表面MnO2沉积量的增加有关,较厚的MnO2覆盖在碳布表面,使复合材料的导电性下降,从而影响了电化学反应中的传质与扩散过程.

图6 不同反应时间所得MnO2/碳布 复合材料的交流阻抗谱Fig.6 The EIS curves of MnO2/CC composites with different reaction time
循环稳定性是电极材料的另一个重要参数,用相同的电极组装体系在蓝电电池测试系统下用0.2 mA/cm2的电流密度,在电压窗口0~0.8 V范围内进行充放电测试.选用反应时间为0.50 h的MnO2/碳布复合材料样品,循环1700次,其结果如图7所示.由图7可知,材料在前300次面积比电容有所下降,之后趋于稳定,至最后到1700次面积比电容仅下降到原来的89%,表现出优异的循环稳定性.这个结果说明在反应时间为0.50 h所得到的复合材料中,MnO2与碳布间具有较好的结合力,通过合适的反应时间,花球状MnO2可以均匀生长在柔性碳布基体上,并且由于碳布表面的凹槽结构,使两者之间具有较强的相互作用力,从而使所制备的复合材料具有较好的结构稳定性.

图7 MnO2/碳布复合材料在电流密度0.2 mA/cm2时充放电1700次后的循环曲线Fig.7 The cycling curves of MnO2/CC composite ata scan rate of 0.2 mA/cm2 after 1700 cycles
3结语
本文以经过等离子体表面处理的碳布为基体,通过水热合成法一步制备了MnO2/碳布复合材料,并对其形貌、结构和电化学性能做了一系列测试分析.通过控制水热反应时间得到了具有不同结构的复合材料.在反应时间较短时(0.50 h),碳布表面易形成球状花瓣形MnO2,随着反应时间的增加,MnO2在自身表面继续生长易形成棒状,这种结构对材料的循环可逆反应不利;当反应时间达到1.00 h以后,材料的交流阻抗谱图显示出较大的电荷转移电阻,而且低频区材料的电容性能很差,反应时间为0.50 h时,制备的MnO2/碳布复合材料的面积比电容达到76.9 mF/cm2,而且循环1700次后面积比电容仍保留89%.
参考文献
[1] ZHANG L L, ZHAO X S. Carbon-based materials as supercapacitor electrodes[J]. Chemical Society Reviews, 2009, 38(9): 2520-2531.
[2] WANG G, ZHANG L, ZHANG J. A review of electrode materials for electrochemical supercapacitors[J]. Chemical Society Reviews, 2012, 41(2): 797-828.
[3] ZHANG Y, FENG H, WU X, et al. Progress of electrochemical capacitor electrode materials: A review[J]. International Journal of Hydrogen Energy, 2009, 34(11): 4889-4899.
[4] MCCREERY R L. Advanced carbon electrode materials for molecular electrochemistry[J]. Chem Rev, 2008, 108(7): 2646-2687.
[5] CHENG F, ZHAO J, SONG W, et al. Facile controlled synthesis of MnO2nanostructures of novel shapes and their application in batteries[J]. Inorganic Chemistry, 2006, 45(5): 2038-2044.
[6] LI B, RONG G, XIE Y, et al. Low-temperature synthesis of α-MnO2hollow urchins and their application in rechargeable Li+batteries[J]. Inorganic Chemistry, 2006, 45(16): 6404-6410.
[7] XU C, LI B, DU H, et al. Electrochemical properties of nanosized hydrous manganese dioxide synthesized by a self-reacting microemulsion method[J]. Journal of Power Sources, 2008, 180(1): 664-670.
[8] MA R, BANDO Y, ZHANG L, et al. Layered MnO2nanobelts: Hydrothermal synthesis and electrochemical measurements[J]. Advanced Materials, 2004, 16(11): 918-922.
[9] WANG X, WANG X, HUANG W, et al. Sol-gel template synthesis of highly ordered MnO2nanowire arrays[J]. Journal of Power Sources, 2005, 140(1): 211-215.
[10] DUPONT M F, DONNE S W. Nucleation and growth of electrodeposited manganese dioxide for electrochemical capacitors[J]. Electrochimica Acta, 2014, 120: 219-225.
[11] CHI H Z, TIAN S, HU X, et al. Direct growth of MnO2on carbon fiber cloth for electrochemical capacitor[J]. Journal of Alloys and Compounds, 2014, 587: 354-360.
[12] KO W Y, CHEN L J, CHEN Y H, et al. Solvothermal synthesis of shape-controlled manganese oxide materials and their electrochemical capacitive performances[J]. Journal of Materials Research, 2014, 29(1): 107-114.
[13] SUMBOJA A, FOO C Y, WANG X, et al. Large areal mass, flexible and free-standing reduced graphene oxide/manganese dioxide paper for asymmetric supercapacitor device[J]. Advanced Materials, 2013, 25(20): 2809-2815.
[14] XU S D, ZHU Y B, ZHUANG Q C, et al. Hydrothermal synthesis of manganese oxides/carbon nanotubes composites as anode materials for lithium ion batteries[J]. Materials Research Bulletin, 2013, 48(9): 3479-3484.
[15] JIANG X, WANG Y, YANG L, et al. Dealloying to porous hybrid manganese oxides microspheres for high performance anodes in lithium ion batteries[J]. Journal of Power Sources, 2015,274:862-868.
[16] COMPTON O C, DIKIN D A, PUTZ K W, et al. Electrically conductive “alkylated” graphene paper via chemical reduction of amine-functionalized graphene oxide paper[J]. Advanced Materials, 2010, 22(8): 892-896.
[17] WEI W, CUI X, CHEN W, et al. Manganese oxide-based materials as electrochemical supercapacitor electrodes[J]. Chemical Society Reviews, 2011, 40(3): 1697-1721.
[18] QU Q, ZHANG P, WANG B, et al. Electrochemical performance of MnO2nanorods in neutral aqueous electrolytes as a cathode for asymmetric supercapacitors[J]. The Journal of Physical Chemistry C, 2009, 113(31): 14020-14027.
Preparation of MnO2/Carbon Cloth Composites and Their Electrochemical Properties
HUANGZi-longa, b,ZHAOXina, b,LIYing-zhia, b,RENJian-lia, b,ZHANGQing-huaa, b
(a. State Key Laboratory for Modification of Chemical Fibers and Polymer Materials;b. College of Materials Science and Engineering, Donghua University, Shanghai 201620, China)
Abstract:Nano-structured manganese dioxide (MnO2) was grown directly on the treated carbon cloth through a simple low temperature hydrothermal method. Several MnO2/carbon cloth composites were fabricated by changing the reaction time. The morphologies and structures of the composites MnO2/carbon cloth were studied by field emission scanning electron microscopy (FESEM), X-ray diffraction (XRD), Raman, and X-ray photoelectron spectroscopy (XPS). And the electrochemical properties of the composites were investigated by galvanostatic charge-discharge, cyclic voltammograms (CV), and electrochemical impedance spectroscopy (EIS). The results show that the surface properties of carbon cloth and the reaction time have great effects on the morphologies and thickness of the obtained MnO2 layers. With the reaction time of 0.50 h, the fabricated MnO2/carbon cloth composites demonstrated a high specific capacitance of 76.9 mF/cm2at a current density of 0.2 mA/cm2, and the specific capacitance still remained about 89% of its initial value after continuous 1700 charge/discharge cycles. The good electrochemical performance of the composites is attributed to the short ion diffusion path and good electron transport environment offered by the substrate of carbon cloth.Key words: carbon cloth; MnO2; hydrothermal method; composite; electrochemical properties; supercapacitor
文章编号:1671-0444(2016)02-0167-06
收稿日期:2014-12-23
基金项目:中央高校基本科研业务费专项资金资助项目(2232014D3-09);教育部博士点基金资助项目(20130075120018)
作者简介:黄子龙(1989—),男,江西上饶人,硕士研究生,研究方向为超级电容器电极材料.E-mail: hfalsjt@163.com 张清华(联系人),男,教授,E-mail:qhzhang@dhu.edu.cn
中图分类号:O 631; TB 34
文献标志码:A

