响应曲面优化丹参多糖提取工艺及抗氧化活性分析
祁小妮 马晓红 李振亮 党金宁


摘要:【目的】優化丹参多糖提取的柔化工艺参数,并分析其抗氧化活性,为丹参多糖产品的研发提供参考依据。【方法】以液料比(A)、浸提温度(B)、浸提时间(C)为自变量,以丹参多糖提取率(Y)为响应值,采用3因素3水平的响应曲面分析法优化丹参多糖提取工艺,同时测定丹参多糖对羟基自由基的清除能力。【结果】建立的丹参多糖提取二次多项回归方程为:Y=1.94-0.041A-0.056B+0.022C-0.046AB+0.13AC-0.03BC-0.24A2-0.75B2-0.44C2,其中浸提温度与浸提时间的交互作用对丹参多糖提取率影响显著(P<0.05)。丹参多糖提取的最佳柔化工艺条件为:液料比25∶1(mL/g)、浸提温度75 ℃、浸提时间90 min,在此条件下多糖提取率为1.94%,与预测值1.97%接近。丹参多糖对羟基自由基有明显的清除能力,且随多糖质量浓度的增加而逐渐增强;丹参多糖质量浓度为4.5 mg/mL的清除率最高,为42%。【结论】采用响应曲面法优化的提取柔化工艺参数准确可靠,可用于丹参多糖提取;丹参多糖具有一定的体外抗氧化能力,可作为食品及医药行业的天然抗氧化剂资源进行开发利用。
关键词: 丹参;多糖;响应曲面;抗氧化活性
中图分类号: R284.2 文献标志码:A 文章编号:2095-1191(2016)11-1926-06
Abstract:【Objective】Diffusion process parameters in Salvia miltiorrhiza Bunge polysaccharide extraction was optimized and antioxidant activity was analyzed, in order to provide reference basis for development and research of S. miltiorrhiza polysaccharide products. 【Method】With liquid to material ratio(A), extraction temperature(B) and extraction time(C) as independent variable, extraction rate of S. miltiorrhiza polysaccharide(Y) as response value, extraction process of S. miltiorrhiza polysaccharide was optimized using response surface methodology with three factors and three levels. Meanwhile, scavenging effects of S. miltiorrhiza polysaccharide on hydroxyl radical were measured. 【Result】The quadratic multinomial regression equation of S. miltiorrhiza polysaccharide extraction was presented as follows: Y=1.94-0.041A-
0.056B+0.022C-0.046AB+0.13AC-0.03BC-0.24A2-0.75B2-0.44C2. The interaction of extraction temperature and extraction time had significant influence on S. miltiorrhiza polysaccharide extraction(P<0.05). The optimal diffusion process condition was as follows: liquid to material ratio 25∶1(mL/g), extraction temperature 75 ℃, extraction time 90 min. Under such condition, polysaccharide extraction rate reached 1.94%, which was close to the expected value 1.97%. S. miltiorrhiza polysaccharide had obvious scavenging effects on hydroxyl radical, and the scavenging effects strengthened as mass concentration of polysaccharide increased. The scavenging effects reached maximum(42%) when mass concentration of polysaccharide was 4.5 mg/mL. 【Conclusion】The diffusion process parameters optimized by response surface methodology are reasonable and reliable, which can be used in extraction process of S. miltiorrhiza polysaccharide. S. miltiorrhiza polysaccharide enjoys certain in vitro antioxidant activity and can be developed as natural antioxidant in food and pharmaceuticals indusrties.
Key words: Salvia miltiorrhiza Bunge; polysaccharide; response surface methodology; antioxidant activity
0 引言
【研究意义】丹参(Salvia miltiorrhiza Bunge)又称赤参、紫丹参、红根,为唇形科鼠尾草属植物,具有缓解疼痛、祛除瘀堵、活络经脉等功效(刘伟等,2015),对于治疗心脏病、高血脂、高血压等常见临床病症具有显著作用(石亚飞等,2014)。丹参含有黄酮苷类、酚酸类、多糖类等物质(张金涛和于敏佳,2011;董顺福等,2013;姚慧娟等,2015),已有研究表明丹参多糖具有一定的抗氧化活性(刘振亮等,2013)。因此,研究丹参多糖提取工艺,对其药用开发与利用具有重要意义。【前人研究进展】目前,已有不少学者对丹参多糖提取工艺进行研究。巩健(2015)采用响应面优化复合酶法提取白花丹参多糖工艺,得到最佳工艺条件为:复合酶添加量8.0 mg/mL、液料比45∶1(mL/g)、酶解温度52 ℃、酶解时间70 min,在此条件下多糖提取率为13.36%;张海容等(2015)在单因素试验的基础上,采用响应面法优化超声波提取丹参多糖工艺,结果表明,在超声功率90 W、超声温度50 ℃、液固比55∶1的条件下提取30 min、提取2次,丹参多糖提取率为8.23%;杨瑞花和张玥莉(2016)采用3因素3水平响应面法优化纤维素酶提取丹参多糖工艺,结果表明,在加酶量0.5%、酶解温度65 ℃、提取时间120 min的最优条件下,丹参多糖提取率为2.59 mg/g。有关丹参多糖抗氧化活性的研究也有一些报道,如刘振亮等(2013)研究发现白花丹参多糖的抗氧化能力随多糖质量浓度的增加而增强,1 mg/mL白花丹参多糖对亚油酸过氧化抑制率为23.05%;巩健(2015)、王燕华等(2015)的研究结果表明,丹参多糖可有效清除1,1-二苯基-2-三硝基苯肼自由基。【本研究切入点】在已有的提取丹参多糖研究中,大多采用超声波法或酶法以提高多糖提取效率,但超声波产生的超强辐射作用对原始多糖结构会产生不可逆转的改变,使大分子多糖降解成小分子单糖,不仅改变了原始多糖的生物学多级构象,还影响多糖的生物活性(高擎等,2012);而在酶解过程中,多糖易水解生成新的还原糖。故本研究采用柔化的多糖提取工艺参数(液料比、浸提时间、浸提温度),最大限度地保持丹参多糖的原始活性,有效合理地评价丹参多糖的生物体外抗氧化活性。【拟解决的关键问题】采用响应曲面分析法优化丹参多糖提取的柔性工艺参数,并分析丹参多糖的体外抗氧化活性,为丹参多糖产品的研发提供参考依据。
1 材料与方法
1. 1 试验材料
丹参购自甘南中药材大药房。无水乙醇、三氯甲烷、苯酚、正丁醇、乙醚、浓硫酸、30%过氧化氢、硫酸亚铁、水杨酸、葡萄糖均为分析纯,购自国药集团化学试剂有限公司。主要仪器设备:SHB-Ⅲ循环水真空泵(河南巩义予华仪器有限责任公司);GZX-DH-600电热恒温干燥箱(上海跃进医疗器械有限公司);PHS-3C精密pH计(上海雷磁仪器厂);FA2004电子天平(上海精密科学仪器公司);HHS数显恒温水浴锅(上海精密科学仪器公司);UV1900双光束紫外可见分光光度计(浙江福立分析仪器有限公司);RE-52A旋转蒸发仪(上海雅荣生化仪器设备有限公司);CT14D高速离心机(上海天美生化仪器设备工程有限公司)。
1. 2 試验方法
1. 2. 1 丹参多糖提取工艺流程 丹参粉碎→称量(5 g左右)→浸泡1 h(去离子水)→浸提(不同温度下)→真空抽滤→浓缩提取液(40 mL)→醇沉淀(24 h)→离心、过滤→加入去离子水溶解沉淀→加1/4体积的Sevage试剂脱蛋白(Sevage试剂为氯仿∶正丁醇=4∶1,搅拌30 min离心取上清液,反复操作3次直至蛋白脱尽)→干燥→称重(吴从平等,2007;江磊等,2013)。
1. 2. 2 丹参多糖含量测定 多糖含量采用苯酚—硫酸法(刘振亮等,2013)测定。以蒸馏水为试剂空白,在最大吸收波长490 nm处测不同浓度所对应的吸光值,以葡萄糖为标准品,配制相应准确浓度,绘制标准曲线,并计算丹参多糖含量(祁小妮等,2015)。多糖提取率计算公式为:
多糖提取率=M×V×(F/m)×100
式中,M为根据标准曲线计算出供试品的多糖质量浓度(μg/mL);V为供试液体积(mL);F为稀释倍数;m为丹参样品质量(g)。
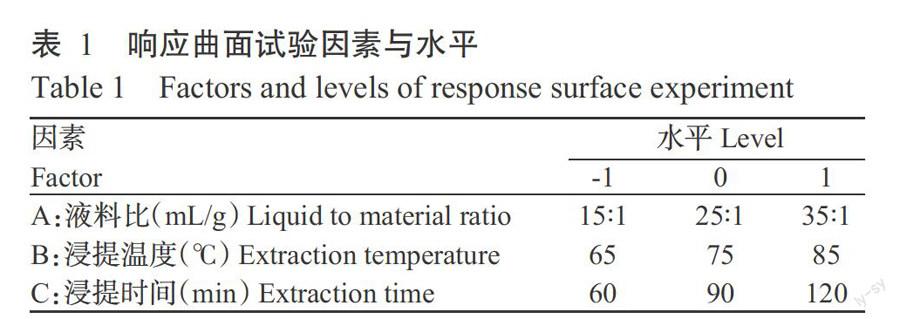
1. 2. 3 响应曲面试验设计 在单因素试验基础上(李渊,2015;张海容等,2015),根据实际条件适当调整考察因素。根据Box-Behnken试验设计原理,选择液料比、浸提温度、浸提时间为自变量,以丹参多糖提取率为响应值,采用3因素3水平的响应曲面分析法确定丹参多糖提取的最佳柔性工艺参数。因素及水平编码见表1。
1. 2. 4 多糖抗氧化活性分析 参考Fenton反应体系模型(何传波等,2013;祁小妮等,2015),配制9 mmol/L水杨酸—乙醇溶液、9 mmol/L硫酸亚铁溶液和8.8 mmol/L过氧化氢溶液,分别取上述3种标准溶液按等体积比例混合,再加入抗氧化活性物质,多糖与水杨酸同时竞争体系中产生的羟基自由基,根据生成有色物质含量的变化,进行定量分析。以蒸馏水为试剂空白,在最大吸收波长处(490 nm)测各浓度的吸光值。以羟基自由基清除率为衡量抗氧化活性指标,以维生素C为阳性对照,丹参多糖对羟基自由基的清除率计算公式为:
清除率=[1-(A1-A2)/A3]×100
式中,A1为加多糖的吸光值;A2为不加显色剂的多糖吸光值;A3为蒸馏水吸光值。
1. 3 统计分析
利用Design-Expert 8.0对响应面试验结果进行统计分析。
2 结果与分析
2. 1 葡萄糖标准曲线
葡萄糖标准曲线的回归方程为:y=0.006x+0.047(R2=0.9995),说明葡萄糖标准液质量浓度在0.01~0.05 μg/mL范围内与其吸光值呈良好的线性关系。
2. 2 响应曲面优化丹参多糖提取工艺
2. 2. 1 响应曲面试验结果 根据Box-Behnken试验设计原理进行响应曲面试验,结果如表2所示。表2中试验1~12为析因试验点,13~15为中心试验点。利用Design-Expert 8.0对表2数据进行二次多项数学拟合回归分析,得到丹参多糖提取率对提取因素的二次多项回归方程为:
Y=1.94-0.041A-0.056B+0.022C-0.046AB+0.13AC-
0.03BC-0.24A2-0.75B2-0.44C2
对试验结果(表2)进行方差(ANOVA)检验,该模型系数的显著性检验结果如表3所示。由表3可看出,模型P<0.0001,说明试验模型具有极显著性;模型的失拟项检验不显著(P>0.05),说明模型选择较合适,试验相对误差较小;校正决定系数R2Adj=0.9820,说明该模型能够对响应值98.20%的变化规律作出解释。浸提时间与浸提温度的交互作用(BC)及浸提时间的二次项(C2)对丹参多糖提取率影响显著(P<0.05,下同),而料液比、浸提温度的二次项(A2、B2)对丹参多糖提取率影响极显著(P<0.01)。
2. 2. 2 响应曲面分析结果 采用固定单因素法,绘制另外两个因素的交互作用对丹参多糖提取率影响的三维立体曲面图。从图1~图3可看出,响应曲面二次函数抛物面曲面图开口朝下,说明该复合函数的二阶导数不为零,模型包括的因素水平均为最优化组合。椭圆形的等高线图反映因素交互作用显著,反之,则不显著。由图1可看出,当浸提温度为65 ℃时,浸提时间与液料比的交互作用对丹参多糖提取率的影响明显,曲线呈上升趋势,且变化幅度较大。由图2可看出,当浸提时间为60 min时,浸提温度对丹参多糖提取率的影响较大,其曲线呈先升高后降低趋势;料液比的影响曲线变化较平缓,表明其对多糖提取率影响较小。由图3可看出,浸提时间与浸提温度的交互作用对丹参多糖提取率影响显著。
2. 2. 3 模型验证试验结果 根据回归模型分析得到丹参多糖最佳提取工艺条件为:液料比25.3∶1、浸提温度74.6 ℃、浸提时间89.5 min,在此条件下丹参多糖提取率预测值为1.97%。为了检验响应曲面法对丹参多糖提取工艺优化的可靠性,进行验证试验,结合实际操作条件,将柔性工艺参数调整优化为:液料比25∶1、浸提温度75 ℃、浸提时间90 min,进行3次平行试验,丹参多糖提取率最高为1.94%,与回归模型预测值间具有良好的吻合性。说明该模型可以很好地预测丹参多糖提取条件与提取率之间的关系。
2. 3 丹参多糖抗氧化活性分析结果
丹参多糖对羟基自由基的清除效果如图4所示。由图4可知,丹参多糖和维生素C对羟基自由基均具有明显的清除能力,且清除率呈浓度依赖型变化;当丹参多糖质量浓度为4.5 mg/mL时,清除率达最大值(42%)。由于平台效应影响(何传波等,2013),随着多糖质量浓度的增加,丹参多糖对羟基自由基的清除率趋于稳定,但丹参多糖清除羟基自由基的能力弱于维生素C。
3 討论
丹参是药食两用中药材,药学研究发现丹参多糖具有抗氧化、调节免疫系统等作用(张湘东等,2012;王燕华等,2015)。不少学者选择高效、省时的强化技术对其进行提取研究,如孟国良(2009)利用微波在水料比10∶1、50目粉碎、萃取3次、每次高火萃取5 min的条件下萃取白花丹参多糖;王燕华等(2015)利用超声波在超声功率212 W、超声时间18 min、颗粒大小55目的条件下提取得到丹参多糖提取率4.73%。虽然微波法和超声波法提取多糖省时、提取率较高,但超声波和微波的机械作用及超声空化作用易破坏植物多糖的原始活性,从而影响对多糖抗氧化活性的准确评估。巩健(2015)研究白花丹参多糖酶法提取条件及其抗氧化活性,在最佳工艺条件下得到多糖提取率13.36%,抗氧化试验结果表明白花丹参多糖浓度为10 mg/mL时,对羟基自由基的清除率达88.57%。虽然采用酶法可提高丹参多糖的提取率,但破坏了一部分原始多糖的活性。
本研究采用响应曲面法对丹参多糖提取的柔化工艺参数液料比、浸提温度和浸提时间进行优化,在最佳柔化工艺条件下得到丹参多糖提取率为1.94%,提取的多糖对羟基自由基的最大清除率为42%,相当于单位浓度多糖的抑制率为9.4%,较巩健(2015)采用酶法提取的单位浓度多糖对羟基自由基的抑制率(8.857%)高。本研究的柔化工艺与其他提取工艺相比,可有效保存丹参多糖的原始生物活性,提高准确评估多糖生物活性的可信度;但其提取率略低,可能与柔化试验参数设计有关,故下一步的研究重点是在保存多糖原始活性的基础上提高多糖提取率,找出更优的参数水平。此外,本研究采用响应曲面优化法对3个因素的各水平进行分析,发现浸提温度与浸提时间的交互作用对丹参多糖提取率影响显著,反映了因素间的交互作用,并以较少试验次数和较短时间对所选试验参数进行全面研究,克服了正交试验只能对一个孤立的试验点进行分析及不能给出直观图形的缺陷。
4 结论
采用响应曲面法优化的提取柔化工艺参数准确可靠,可用于丹参多糖提取;丹参多糖具有一定的体外抗氧化能力,可作为食品及医药行业的天然抗氧化剂资源进行开发利用。
参考文献:
董顺福,李亚新,韩丽琴. 2013. 丹参等三种中药总黄酮含量分析及其抗氧化机制研究[J]. 时珍国医国药,24(5):1107-1109.
Dong S F,Li Y X,Han L Q. 2013. Total flavonoids content and antioxidant mechanism of Salvia miltiorrhiza and other two kinds of traditional Chinese medicines[J]. Lishizhen Medicine and Materia Medica Research,24(5):1107-1109.
高擎,游丽君,赵谋明. 2012. 超声辅助提取松茸抗氧化多糖工艺的研究[J]. 食品工业科技,33(7):298-302.
Gao Q,You L J,Zhao M M. 2012. Study on optimization of ultrasonic assisted extraction of polysaccharides with anti-oxi-
dant activities from Tricholoma matsutake[J]. Science and Technology of Food Industry,33(7):298-302.
巩健. 2015. 白花丹参多糖酶法提取条件的响应面优化及其抗氧化活性研究[J]. 粮油食品科技,23(4):93-97.
Gong J. 2015. Study on optimization of extraction condition of polysaccharides from Salvia miltiorrhiza f. alba by response surface methodology and antioxidant activities[J]. Science and Technology of Cereals,Oils and Foods,23(4):93-97.
何传波,魏好程,熊何健,汤凤霞,吴国宏. 2013. 酶与微波处理对海带多糖提取及抗氧化活性的影响[J]. 食品科学,34(18): 51-55.
He C B,Wei H C,Xiong H J,Tang F X,Wu G H. 2013. Extraction and antioxidant activities of polysaccharides from Laminaria japonica as affected by enzymatic hydrolysis and microwave[J]. Food Science,34(18):51-55.
江磊,梅丽娟,刘增根,李洁琼,王启兰,邵赟,陶燕铎. 2013. 响应面法优化枸杞叶粗多糖提取纯化工艺及其降血糖活性[J]. 食品科学,34(4):42-46.
Jiang L,Mei L J,Liu Z G,Li J Q,Wang Q L,Shao Y,Tao Y D. 2013. Extraction and hypoglycemic effect of crude polysaccharides from Chinese wolfberry(Lycium chinense) leaves[J]. Food Science,34(4):42-46.
李渊. 2015. 丹参多糖提取工艺研究[J]. 四川职业技术学院学报,25(6):168-171.
Li Y. 2015. Study on extraction process of polysaccharide from Salvia miltiorrhiza[J]. Journal of Sichuan Vocational and Technical College,25(6):168-171.
劉伟,魏莹莹,刘大会,周洁,王晓,李奉胜,祝福有. 2015. 白花丹参抗连作品系植物学及物候期特性研究[J]. 中药材,38(1):5-7.
Liu W,Wei Y Y,Liu D H,Zhou J,Wang X,Li F S,Zhu F Y. 2015. Biological and phenological properties of Salvia miltio-
rrhiza f. alba for anti-continuous cropping[J]. Journal of Chinese Medicinal Materials,38(1):5-7.
刘振亮,张昌军,刘克,孙立彦. 2013. 白花丹参多糖含量测定及其抗氧化性研究[J]. 山东农业大学学报(自然科学版), 44(3):357-360.
Liu Z L,Zhang C J,Liu K,Sun L Y. 2013. The study on determination and antioxidation of polysaccharides from Salvia miltiorrhiza f. alba[J]. Journal of Shandong Agricultural University(Natural Science Edition),44(3):357-360.
孟国良. 2009. 白花丹参多糖的微波提取工艺研究[J]. 中国现代中药,11(2):39-40.
Meng G L. 2009. Studies on microwave-assisted extraction technology of soluble polysaccharides from Salvia miltiorrhiza Bge. f. alba[J]. Modern Chinese Medicine,11(2):39-40.
祁小妮,隋英,李振亮,党金宁,刘瑞林. 2015. 响应曲面优化菟丝子多糖提取工艺及抗氧化活性研究[J]. 中国酿造,34(8):35-38.
Qi X N,Sui Y,Li Z L,Dang J N,Liu R L. 2015. Optimization of polysaccharide extraction technology from Cuscuta chinensis by response surface methodology and its antioxidant activity[J]. China Brewing,34(8):35-38.
石亚飞,闫荟,孙世光,王瑞,孙晓迪,李阳,王苏会. 2014. 两种丹参类中药注射剂治疗冠心病心绞痛的系统评价及其药物经济学分析[J]. 中国循证医学杂志,14(3):287-291.
Shi Y F,Yan H,Sun S G,Wang R,Sun X D,Li Y,Wang S H. 2014. Two kinds of radix Salviae miltiorrhizae injection for angina pectoris:A systematic review and pharmacoeconomics analysis[J]. Chinese Journal of Evidence-Based Medicine,14(3):287-291.
王燕华,武福华,郭昭涵,彭明星,宋万华,夏敏,梁子安,张乃群. 2015. 响应面试验优化丹参中多糖的超声波提取工艺及其抗氧化活性[J]. 食品科学,36(18):7-12.
Wang Y H,Wu F H,Guo Z H,Peng M X,Song W H,Xia M,Liang Z A,Zhang N Q. 2015. Optimization of ultrasonic-assisted extraction and antioxidant activities of polysaccharides from the roots of Salvia miltiorrhiza Bge.[J]. Food Science,36(18):7-12.
吴从平,梁宏昌,王身相. 2007. 紫花丹参多糖的提取工艺研究[J]. 泰山医学院报,28(4):251-252.
Wu C P,Liang H C,Wang S X. 2007. Studies on extraction technology of soluble polysaccharides from Salvia miltiorrhiza Bge[J]. Journal of Taishan Medical College,28(4):251-252.
杨瑞花,张玥莉. 2016. 响应面法优化纤维素酶提取丹参多糖工艺[J]. 中国药师,19(1):43-46.
Yang R H,Zhang Y L. 2016. Optimization of cellulase extraction process for Salvia polysaccharide by response surface analysis[J]. China Pharmacist,19(1):43-46.
姚慧娟,姚慧敏,李莉霞,李方,卜书红. 2015. 丹参多酚酸盐对2型糖尿病患者胰岛β细胞功能和血清抗氧化酶活性水平的影响[J]. 中国医药导报,12(10):135-138.
Yao H J,Yao H M,Li L X,Li F,Bu S H. 2015. Effect of Salvianolate on pancreatic β-cells function antioxidant enzymes activity in type 2 diabetes mellitus patients[J]. China Medical Herald,12(10):135-138.
张海容,魏增云,秦怡,陈金娥. 2015. 响应面优化-超声辅助提取丹参多糖工艺[J]. 计算机与应用化学,32(5):596-600.
Zhang H R,Wei Z Y,Qin Y,Chen J E. 2015. Optimization of ultrasound-assisted extraction of polysaccharides from Salvia miltiorrhiza bunge roots using response surface analysis[J]. Computers and Applied Chemistry,32(5):596-600.
张金涛,于敏佳. 2011. 丹参的化学成分及其临床应用探讨[J]. 黑龙江科技信息,(18):44.
Zhang J T,Yu M J. 2011. Chemical composition of Salvia miltio-
rrhiza and its clinical application[J]. Heilongjiang Science and Technology Information,(18):44.
张湘东,许定舟,李金华,汪涛,葛发欢,杨丽. 2012. 丹参多糖的免疫调节活性研究[J]. 中药材,35(6):949-952.
Zhang X D,Xu D Z,Li J H,Wang T,Ge F H,Yang L. 2012. Study on the immunocompetence of polysaccharide extrac-
ted from root of Salvia miltiorrhiza[J]. Journal of Chinese Medicinal Materials,35(6):949-952.
(責任编辑 罗 丽)

