铁皮石斛查尔酮合酶基因克隆与表达分析
孟衡玲 张薇 卢丙越 苏一兰 薛春丽


摘要:【目的】克隆铁皮石斛中查尔酮合酶(CHS)基因,分析其基本生物学信息及组织表达特异性,为进一步研究CHS基因在铁皮石斛中的表达调控机理及其在铁皮石斛中的功能打下理论基础。【方法】采用铁皮石斛转录组序列与NCBI同源序列进行比对,根据保守区段设计引物克隆铁皮石斛CHS基因的cDNA全长,采用实时荧光定量PCR定量表达分析不同生长年限、不同组织部位中CHS基因的表达水平。【结果】铁皮石斛CHS基因cDNA编码区1188 bp,编码395个氨基酸,GenBank登录号KT783451,分子量为43.2 kD,理论等电点6.05。铁皮石斛GHS氨基酸序列与同属植物金钗石斛(Dendrobium nobile)的CHS氨基酸序列同源性最高,达99%,与非同科植物欧洲大叶杨(Populus trichocarpa)、巨桉(Eucalyptus grandis)和紫玉兰(Magnolia liliiflora)等植物的同源性在83%左右。该基因编码的蛋白质属非分泌蛋白,定位于细胞质基质中,为非跨膜结构的亲水性不稳定蛋白。CHS基因在1年生铁皮石斛叶片中的表达量最高,随着植株年龄的增长,叶片中CHS基因的表达量降低,茎中的表达量升高。【结论】铁皮石斛CHS基因早期主要参与激素运输和器官形态建成,后期主要参与类黄酮物质合成。
关键词: 铁皮石斛;查尔酮合成酶;基因克隆;實时荧光定量PCR
中图分类号: S567.239;Q785 文献标志码:A 文章编号:2095-1191(2016)12-2015-05
Abstract:【Objective】The present study cloned chalcone synthase(CHS) gene and analyzed its basic biological information and tissue-specific expression in Dendrobium officinale, in order to lay a theoretical basis for further research on the function and expression regulation mechanism of CHS gene in D. officinale. 【Method】Comparing conserved sequence with NCBI homologous sequence, real-time fluorescence quantitative PCR was adopted to analyze CHS gene expression in different tissues at different growth years based on cDNA full length of design-primer-cloned CHS gene in conserved domain. 【Result】The coding region of CHS gene in D. officinale was 1188 bp encoding 395 amino acids, molecular weight was 43.2 kD, theoretical isoelectric point 6.05, GenBank accession number KT783451. In terms of amino acid sequence,CHS in D. officinale showed the highest homology(99%) with that in Dendrobium nobile, its same generic plant. The homology between CHS sequence in D. officinale and its non-family plants Populus trichocarpa, Eucalyptus grandis and Magnolia liliiflora was around 83%. The encoded protein of CHS gene belonged to non-secreted protein which was located in cytoplasmic matrix. It was hydrophilic unstable protein with non-transmembrane structure. The expression level of CHS gene was the highest in one-year leaves of D. officinale. As growth year increased, the expression level of CHS gene decreased in leaves, but increased in stems. 【Conclusion】CHS gene in D. officinale is mainly involved in auxin transport and organ morphogenesis at early stage and participats in flavonoid biosynthesis at late stage.
Key words: Dendrobium officinale; chalcone synthase; gene cloning; real-time fluorescence quantitative PCR
0 引言
【研究意义】黄酮二糖碳苷类化合物是自然界中抗氧化作用最强的天然化合物之一,具有抑制活性氧和清除自由基的作用,在铁皮石斛(Dendrobium officinale)的茎、叶和花中均有分布且含量丰富(周桂芬和吕圭源,2012)。查尔酮合成酶(Chalcone synthase,CHS)是植物次生代谢途径中黄酮类物质合成的第一个关键酶,参与类黄酮合成(康亚兰等,2014;田爱梅等,2014)。因此,克隆铁皮石斛CHS基因并进行实时荧光定量PCR(qRT-PCR)分析,对研究CHS基因在铁皮石斛中的表达和黄酮类物质的合成机理具有重要意义。【前人研究进展】CHS基因是一个较大的基因家族,在植物不同类群中CHS基因较保守,科之间存在70%~90%的氨基酸同源性(Lanz et al.,1991)。目前,已从玉米(Franken et al.,1991)、兰花(Liew et al.,1998)、拟南芥(Saslowsky et al.,2000)和高粱(Lo et al.,2002)等600多种植物中克隆获得CHS基因。研究表明,CHS基因不仅参与类黄酮的合成,还参与防辐射、抗病等生理活动,在植物体中的表达具有器官特异性,可能与器官形态建成、功能分化有一定联系(蒋明和曹家树,2007;刘涛等,2013;Yan et al.,2015;巫建华等,2016)。【本研究切入点】目前,关于铁皮石斛CHS基因表达和功能的研究鲜见报道,限制了对铁皮石斛黄酮合成及CHS基因功能的深入研究。【拟解决的关键问题】克隆铁皮石斛CHS基因,分析其基本生物学信息及组织表达特异性,为研究CHS基因在铁皮石斛中的表达调控机理及其在铁皮石斛中的功能打下理论基础。
1 材料与方法
1. 1 试验材料
铁皮石斛由云南红河州巨峰石斛种植有限公司提供,以其叶片为材料提取总RNA并进行CHS基因克隆。以1~3年生铁皮石斛的根、茎、叶为材料分析不同生长年限、不同组织部位中CHS基因的表达水平。大肠杆菌DH5α由云南省高校农作物优质高效栽培与安全控制重点实验室自备,pMD 18-T载体购自宝生物工程(大连)有限公司,总RNA提取试剂盒、DNA消化试剂盒、反转录酶SuperScript III First- Strand Synthesis SuperMix及qRT-PCR反应试剂PowerUpTM SYBR Green Master Mix购自Life Technologies公司。
1. 2 铁皮石斛CHS基因克隆
用试剂盒提取铁皮石斛总RNA,进行DNA消化,然后进行反转录,获得铁皮石斛cDNA模板。根据GenBank中CHS基因的保守区域,设计扩增特异性引物F1(5'-ATGGCGCCGCCGGCAATGGAAGAGA-3')和R1(5'-TCACACCGCACCAGCAATCGGAACG-3'),以cDNA为模板进行PCR扩增,扩增程序为:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min。将扩增获得目的片段克隆到pMD18-T载体上,送至华大基因研究中心进行测序。
1. 3 铁皮石斛CHS基因的生物信息学分析
采用Computer pI/Mw Tool在线软件进行蛋白分子量、理论等电点、不稳定系数预测;ExPASy ProtParam tool预测蛋白质氨基酸组成,TMHMM的Transmembrane Prediction server预测跨膜结构域,NCBI结构分析软件进行CHS基因结构域分析。
1. 4 铁皮石斛CHS基因的qRT-PCR分析
根据已获得的铁皮石斛CHS基因序列,设计qRT-PCR扩增引物CHS Forward(5'-GGTTCTCGTCGTTTG TTCAG-3')和CHS Reverse(5'-TCGTTCAGTAGTCAAGTCAGG-3'),目的片段148 bp。根据金钗石斛内参基因GAPDH(GQ250049.1)序列设计内参引物GAPDH Forward(5'-GTGCCAAGAAGGTTATCATCTCTG-3')和GAPDH Reverse(5'-CTCATGCTCATTAACACCAACAAC-3'),目的片段74 bp。使用ABI7500荧光定量PCR仪进行qRT-PCR分析,每个样本重复3次,扩增程序为:95 ℃预变性2 min;95 ℃ 10 s,60 ℃ 34 s,72 ℃ 30 s,进行45个循环,循环结束后从60 ℃升高到98 ℃获取熔解曲线。
2 结果与分析
2. 1 铁皮石斛CHS基因全长克隆
2. 1. 1 铁皮石斛总RNA提取及CHS基因全长扩增 经SMA4000超微量分光光度計(Merinton)检测,提取的铁皮石斛总RNA纯度高,OD260/280在1.8~2.0。以铁皮石斛cDNA为模板,F1/R1为引物,经PCR扩增获得一条约1200 bp的特异性条带(图1),将扩增片段纯化回收,克隆到pMD18-T载体上,筛选阳性质粒进行基因测序。结果表明,铁皮石斛CHS基因cDNA编码区共1188 bp,编码395个氨基酸,GenBank登录号为KT783451。CHS基因CDS序列中A+T含量为56.58%,G/C含量为43.42%,A和T的含量明显高于G和C的含量。
2. 1. 2 铁皮石斛CHS基因同源性分析 采用MEGA 5.0软件UPGMA法构建基于CHS氨基酸序列的系统发育进化树(图2),NCBI BLASTp分析结果显示,铁皮石斛CHS氨基酸序列与同属植物金钗石斛(Dendrobium nobile)CHS氨基酸序列一致性最高,其同源性达99%,与欧洲大叶杨(Populus trichocarpa)、巨桉(Eucalyptus grandis)和紫玉兰(Magnolia liliiflora)等植物的CHS氨基酸序列同源性在83%左右,说明铁皮石斛CHS基因的保守性较高。
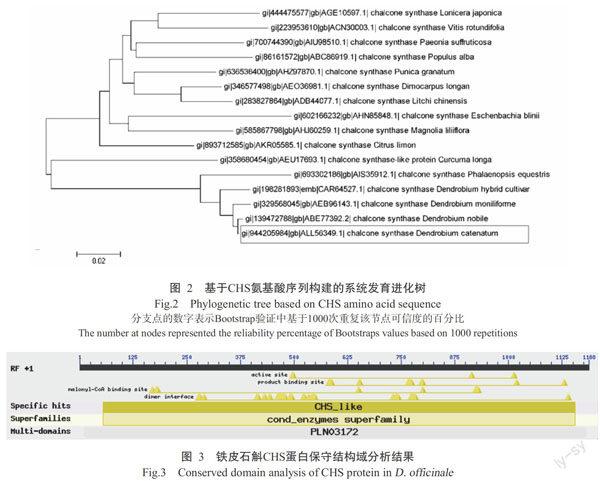
2. 1. 3 铁皮石斛CHS基因的生物信息学分析 对CHS基因编码蛋白进行分子量和等电点预测分析,发现该基因蛋白分子量为43.2 kDa,理论等电点为6.05,不稳定系数为45.59。CHS蛋白氨基酸中,亮氨酸所占比例最高,为10.9%。TMHMM的Transmembrane Prediction server预测结果表明,CHS蛋白为非跨膜结构亲水性不稳定蛋白,无信号肽,定位于细胞质基质中。NCBI结构分析发现,该蛋白序列具有多个活性位点,5个结构功能域,包括有N-末端结构域、C-末端结构域和聚酮合酶结构域(图3)。
2. 2 铁皮石斛CHS基因的定量表达分析结果
将1年生根的表达量设为对照(2-△△Ct定义为1),从图4可看出,铁皮石斛中CHS基因的表达水平在不同生长年限、不同组织部位间差异明显。方差分析结果表明,CHS基因在1年生叶中的表达量最高,与1年生和3年生茎中的表达量无显著差异(P>0.05),2年生和3年生叶中的表达量最低,仅为1年生叶中表达的10%左右。CHS基因在不同生长年限根中的表达量差异较小,其中2年生根的表达量显著高于1年生和3年生根(P<0.05)。不同生长年限、不同组织部位中铁皮石斛CHS基因表达量排序为:1年生叶>1年生茎>3年生茎>2年生根>1年生根>3年生根>2年生茎>3年生叶>2年生叶。
3 讨论
CHS超基因家族属于生物聚酮合酶(Polyketide synthases,PKS)中结构最简单的类型,即III型聚酮合酶类(Zhan,2009;Abe and Morita,2010)。III型聚酮合酶类可催化多种聚酮化合物的生物合成,这些聚酮化合物具有抗菌、消炎、提高人体免疫力和抗癌等药理功效(Jez et al.,2001),在植物器官着色(田鹏等,2015)、病虫害防护和紫外辐射抵御(Abe and Morita,2010)等方面起着非常重要的作用。CHS是超基因家族中的核心酶,也是目前研究最透彻的酶,大量研究主要集中于CHS对花色素合成的调节(李冬梅等,2012;张云婷等,2013;康亚兰等,2014;田爱梅等,2014;王旭等,2014),但在植物生长发育与代谢途径方面的研究较少。因此,对III型聚酮合成酶,特别是对其整个超基因家族的深入研究可为寻找新型药物、提升植物本身营养构成和促进作物的遗传改良等提供新的途径(包颖等,2015)。
本研究克隆了铁皮石斛CHS基因cDNA全长,并对CHS基因在不同生长年限、不同组织部位进行实时定量表达分析。铁皮石斛CHS基因编码区序列高度保守,氨基酸序列与同属金钗石斛、细茎石斛的同源性高达99%。定量表达分析结果表明,CHS基因在1年生组织中的相对表达水平较高,但在2年生和3年生铁皮石斛叶片中的表达量很低,说明铁皮石斛CHS基因的表达与植物组织器官及生长发育时期或生长年限有关(Xu et al.,2007),CHS基因早期在叶中的表达量最高,主要是参与生长激素运输和器官形态建成,与Knogge等(1986)的研究觀点一致。随着植株的成熟,3年生茎中的表达量最高,此时CHS基因主要参与次生代谢物黄酮类化合物的合成。本研究结果为进一步探究铁皮石斛中CHS基因的功能及表达调控打下了理论基础。
4 结论
铁皮石斛CHS基因保守性较高,在幼苗生长阶段整体表达量较高,说明CHS基因早期主要参与植物激素运输和器官形态建成;随着植株的成熟,3年生铁皮石斛根及叶中的CHS基因表达量降低,茎中的表达量升高,说明CHS基因后期主要参与黄酮类物质合成。
参考文献:
包颖,郭昌锋,陈少华,刘梅. 2015. 植物查尔酮合成酶超基因家族的分子进化[J]. 植物学报,50(1):55-71.
Bao Y,Guo C F,Chen S H,Liu M. 2015. Molecular evolution of chalcone synthase gene superfamily in plants[J]. Chinese Bulletin of Botany,50(1):55-71.
蒋明,曹家树. 2007. 查尔酮合成酶基因[J]. 细胞生物学杂志,29(4):525-529.
Jiang M,Cao J S. 2007. Chalcone synthase gene[J]. Chinese Journal of Cell Biology,29(4):525-529.
康亚兰,裴瑾,刘薇,罗静,刘维,陈翠平. 2014. 红花查尔酮合成酶基因的克隆、生物信息学分析及表达[J]. 中草药,45(16):2385-2389.
Kang Y L,Pei J,Liu W,Luo J,Liu W,Chen C P. 2014. Cloning,bioinformatic analysis,and expression of chalcone synthase gene in Carthamus tinctorius[J]. Chinese Traditional and Herbal Drugs,45(16):2385-2389.
李冬梅,朱根发,操君喜,吕复兵,刘海林,孙映波. 2012. 兜兰查尔酮合成酶基因的克隆与表达分析[J]. 热带作物学报,33(4):655-662.
Li D M,Zhu G F,Cao J X,Lü F B,Liu H L,Sun Y B. 2012. Molecular cloning and expression analysis of a chalcone synthase gene from Paphiopedilum orchid[J]. Chinese Journal of Tropical Crops,33(4):655-662.
刘涛,牟兰,梁艳丽,王建军,杨生超. 2013. 灯盏花查尔酮合成酶基因表达与灯盏乙素含量关系的研究[J]. 中国中药杂志,38(14):2241-2244.
Liu T,Mu L,Liang Y L,Wang J J,Yang S C. 2013. Relationship between expression of chalcone synthase gene(CHS)and scutellarin content in Erigeron breviscapus[J]. China Journal of Chinese Material Medica,38(14):2241-2244.
田爱梅,许忠民,张恩慧. 2014. 白芨查尔酮合成酶基因的克隆与分析[J]. 西北农业学报,23(7):91-95.
Tian A M,Xu Z M,Zhang E H. 2014. Isolation and molecular characterization of BsCHS gene from Bletilla striata[J]. Acta Agriculturae Boreali-occidentalis Sinica,23(7):91-95.
田鹏,苏艳丽,康保珊,魏闻东. 2015. 两个红梨品种花色苷合成相关基因及转录因子MYB10表达模式分析[J]. 江苏农业学报,31(1):166-171.
Tian P,Su Y L,Kang B S,Wei W D. 2015. Analyses of expression patterns of transcription factor MYB10 and anthocyanin synthesis genes in two red shin pear varieties[J]. Jiangsu Journal of Agricultural Sciences,31(1):166-171.
王旭,韩春乐,周亚楠,王春国,宋文芹,陈成彬. 2014. 黄秋葵查尔酮合成酶基因AeCHS的克隆与表达分析[J]. 植物遗传资源学报,15(3):561-567.
Wang X,Han C L,Zhou Y N,Wang C G,Song W Q,Chen C B. 2014. Cloning and expression analysis of chalcone synthase gene(AeCHS)in Abelmoschus esculentus L.[J]. Journal of Plant Genetic Resources,15(3):561-567.
巫建华,贾思振,冯英娜,王全智. 2016. 茉莉酸合成关键酶基因FaOPR3调控草莓果实成熟[J]. 江苏农业学报,32(5):1148-1154.
Wu J H,Jia S Z,Feng Y N,Wang Q Z. 2016. Regulation of strawberry fruit ripening by jasmonic acid synthesis gene FaOPR3[J]. Jiangsu Journal of Agricultural Sciences,32(5):1148-1154.
张云婷,于定群,程怡,汤浩茹,王清明,张勇. 2013. 月季查尔酮合成酶基因片段的克隆及其表達分析[J]. 生物技术通报,(7):66-70.
Zhang Y T,Yu D Q,Cheng Y,Tang H R,Wang Q M,Zhang Y. 2013. Cloning and expression analysis of chalcone synthase gene from rosa hybrid[J]. Biotechnology Bulletin,(7):66-70.
周桂芬,吕圭源. 2012. 铁皮石斛不同部位黄酮碳苷类成分及清除DPPH自由基能力比较研究[J]. 中国中药杂志,37(11):1536-1540.
Zhou G F,Lü G Y. 2012. Comparative studies on scavenging DPPH free radicals activity of flavone C-glycosides from different parts of Dendrobium officinale[J]. China journal of Chinese material medica,37(11):1536-1540.
Abe I, Morita H. 2010. Structure and function of the chalcone synthase superfamily of plant type III polyketide synthases[J]. Natural Product Reports,27(6):809-838.
Franken P,Niesbach-Kl sgen U,Weydemann U,Maréchal-Drouard L,Saedler H,Wienand U. 1991. The duplicated chalcone synthase genes C2 and Whp(white pollen)of Zea mays are independently regulated;evidence for translational control of Whp expression by the anthocyanin intensifying gene in[J]. EMBO Journal,10(9):2605-2612.
Jez J M,Ferrer J L,Bowman M E,Austin M B,Schr der J,Dixon R A,Noel J P. 2001. Structure and mechanism of chalcone synthase-like polyketide synthases[J]. Journal of Industrial Microbiology & Biotechnology,27(6):393-398.
Knogge W,Schmelzer E,Weissenb ck G. 1986. The role of chalcone synthase in the regulation of flavonoid biosynthesis in developing oat primary leaves[J]. Archives of Biochemistry and Biophysics,250(2):364-372.
Lanz T,Tropf S,Marner F J,Schr der J,Schr der G. 1991. The role of cysteines in polyketide synthase. Site directeted mutagenesis of resveratrol and chalcone synthases,two key enzymes in different plant-specific pathways[J]. Journal Biology Chemistry,266(15):9971-9976.
Liew C F,Goh C J,Loh C S. 1998. Cloning and characterization of full-length cDNA clones encoding chalcone synthase from the orchid Bromheadia finlaysoniana[J]. Plant Physiology and Biochemistry,36(9):647-655.
Lo C,Coolbaugh R C,Nicholson R L. 2002. Molecular characterization and in silico expression analysis of a chalcone synthase gene family in Sorghum bicolor[J]. Physiological and Molecular Plant Pathology,61(3):179-188.
Saslowsky D E,Dana C D,Winkel-Shirley B. 2000. An allelic series for the chalcone synthase locus in Arabidopsis[J]. Gene,225(2):127-138.
Xu F,Cheng S Y,Cheng S H,Wang Y,Du H W. 2007. Time course of expression of chalcone synthase gene in Ginkgo biloba[J]. Journal of Plant Physiology and Molecular Biology,33(4):309-317.
Yan L,Wang X,Liu H,Tian Y,Lian J,Yang R,Hao S,Wang X,Yang S,Li Q,Qi S,Kui L,Okpekum M,Ma X,Zhang J,Ding Z,Zhang G,Wang W,Dong Y,Sheng J. 2015. The genome of dendrobium officinale iIlluminates the biology of the important traditional Chinese orchid herb[J]. Molecular Plant,8(6):922-934.
Zhan J. 2009. Biosynthesis of bacterial aromatic polyketides[J]. Current Topics in Medicinal Chemistry,9(17):1958-1610.
(责任编辑 王 晖)

