干旱胁迫下香蕉幼苗蛋白质组学分析
孙洁 庞昇泽 禤维言 冯斗

摘要:【目的】研究干旱胁迫下香蕉蛋白表达情况,为探索香蕉的抗旱分子机制提供理论依据。【方法】以桂蕉1号组培苗叶片为材料,对其进行干旱胁迫处理,运用iTRAQ结合液相色谱—质谱联用(LC-MS-MS)技术对其差异蛋白进行检测,并通过生物信息学分析对香蕉叶片蛋白质组进行鉴定。【结果】从干旱胁迫处理的组培苗叶片中共鉴定出1655种蛋白,其中获得定量信息的蛋白有1023种,差异表达蛋白78种,包括上调蛋白32种和下调蛋白46种。GO生物进程分析结果表明,78种差异表达蛋白参与了细胞过程、代谢过程、响应刺激胁迫过程及单有机体过程等多个生物进程。GO分子功能分析结果表明,上调蛋白主要具有催化活性功能、结合功能、抗氧化活性和功能调节;下调蛋白主要具有催化活性功能和结合功能。GO富集分析结果显示,上调蛋白主要参与过氧化氢反应、活性氧反应等;下调蛋白主要参与淀粉代谢、二糖代谢、蔗糖代谢、寡糖代谢、细胞碳水化合物生物合成等多个碳素代谢进程,且其主要是质外体、胞外区、类囊体等部位的组分,参与1,6-二磷酸果糖1-磷酸酶反应、蔗糖磷酸酶反应及碳水化合物磷酸酶反应等。在氮素代谢过程中,参与甘氨酸代谢的丝氨酸羟甲基转移酶(SHMT)在线粒体中的含量明显下降,而参与活性氧代谢的过氧化氢酶(CAT)含量明显上升。【结论】干旱胁迫下香蕉的表达蛋白种类及数量发生明显变化,且其抗旱机制是多种蛋白质共同作用的结果,主要通过調节物质和能量代谢及应激活动来发挥作用。
关键词: 香蕉;干旱胁迫;差异表达蛋白;iTRAQ;液相色谱—质谱联用(LC-MS-MS)技术
中图分类号: S668.1 文献标志码:A 文章编号:2095-1191(2016)12-2020-07
Abstract:【Objective】The present experiment was conducted to study protein expression of banana under drought stress,in order to provide theoretical basis for molecular mechanism of drought resistance in banana. 【Method】Tissue-cultured seedlings of Guijiao 1 were treated by drought stress. Then differentially expressed proteins in leaf of banana were detected using iTRAQ and liquid chromatography-mass spectrometry(LC-MS-MS) technology, and identified based on bioinformatics analysis. 【Result】A total of 1655 proteins were identified from leaves of tissue-cultured seedlings treated by drought stress, 1023 of which were quantified, but only 78 differentially expressed proteins were found, including 32 up-regulated proteins and 46 down-regulated proteins. The gene ontology(GO) annotation and analysis of biological processes showed that, 78 differentially expressed proteins were mainly involved in multiple biological processes, such as cellular process, metabolic process, response to stimulus and single-organism process. GO annotation and analysis of molecular function indicated that, the up-regulated proteins mainly had catalytic activity, binding function, antioxidant activity and molecular function regulation, while the down-regulated proteins mainly had catalytic activity and binding function. GO enrichment analysis showed that, the up-regulated proteins were mainly involved in reactions with hydrogen peroxide and reactions with reactive oxygen, the down-regulated proteins were mainly involved in many carbon metabolism processes,including starch metabolism, disaccharide metabolism, sucrose metabolism, oligosaccharide metabolism and cellular carbohydrate biosynthesis, and which were constituents of apoplast and extracellular region, thylakoid and so on, and mainly involved in reactions catalyzed by fructose-1,6-diphosphate 1-phosphatase, sucrose phospholylase, carbohydrate phospholylase. In several nitrogen metabolism process, content of serine hydroxymethyl transferase(SHMT) involved in glycine metabolism declined obviously in mitochondria, however, varieties of catalase(CAT) involved in reactive oxygen metabolism rose obviously. 【Conclusion】Under drought stress, kinds and amounts of expressed proteins in banana leaf change obviously, mechanism of drought resistance is result of interactions between various proteins, and primarily plays an role by regulating substance metabolism, energy metabolism and stress response.
Key words: banana; drought stress; differentially expressed protein; iTRAQ; liquid chromatography-mass spectrometry(LC-MS-MS) technology
0 引言
【研究意义】干旱是影响植物生长发育最主要的逆境因子,每年由于干旱胁迫给农业造成的损失相当于其他所有环境因子胁迫造成损失的总和(孙存华等,2005)。干旱胁迫下,植物生长发育受到不同程度的影响,植物基因表达发生改變,如与抗性相关的基因被诱导表达上调,但还有部分基因的转录或翻译过程受到抑制甚至关闭,导致其编码的蛋白无法正常合成(申永锋等,2007)。因此,干旱胁迫下差异蛋白质组学研究对阐明胁迫伤害机制及植物响应机制具有重要意义。【前人研究进展】Salekdeh等(2002)利用双向电泳技术检测干旱胁迫下水稻叶片蛋白,结果发现42种差异蛋白,其中多个参与抗氧化反应、光合作用、能量代谢和细胞骨架等过程。张洁等(2007)在冬小麦抗旱性研究中发现66.2 kD的D-应答蛋白,将该蛋白作为抗旱性鉴定指标。Xu和Huang(2010)对两种匍匐翦股颖进行干旱处理,对其叶片蛋白进行双向电泳,共鉴定出46种蛋白质,并发现一些参与基础碳氮循环的蛋白质丰度均有所下降,而抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)和谷胱甘肽转移酶(GST)等抗氧化酶蛋白丰度上升,表明一些参与细胞膜合成、细胞壁松动、抗氧化防御及维持细胞膨压的蛋白在多年生草响应水分胁迫中发挥重要作用。Aranjuelo等(2011)从植物生理学和蛋白质组学水平研究了苜宿叶片对干旱胁迫的响应,结果发现干旱胁迫导致叶片中Rubisco结合蛋白含量下降,蛋白酶表达上升,Rubisco蛋白被降解,致使Rubisco衍生的氮素用于脯氨酸等渗透调节物质合成,并向主根输送,以提高植株抗旱性,其次,干旱胁迫诱导Rubisco的降解,利用Rubisco衍生的氮素弥补根瘤固氮酶固氮量的不足,可能是苜宿适应干旱胁迫的另一种途径。目前,已有大量研究证实干旱对香蕉的品质和产量有较大影响,但有关香蕉抗旱性的研究主要集中在光合作用(黄鹤丽等,2009a)、膜系统(黄鹤丽等,2009b)、渗透调节、植株形态(王蕊等,2010)、酶活性(刘晚苟和吴华伟,2011)、激素调节(何娟等,2013)等方面。此外,对香蕉抗旱基因ASR(王园,2010)、MaASR1(张丽丽,2012;苗红霞等,2014)和MaMYB(邢文婷,2014)等也进行了深入研究。【本研究切入点】目前,鲜见有关香蕉在干旱胁迫下差异蛋白质组学的文献报道。【拟解决的关键问题】采用iTRAQ结合液相色谱—质谱联用(LC-MS-MS)技术对干旱胁迫下香蕉蛋白表达情况进行研究,从蛋白质水平上对香蕉的抗旱分子机理进行探讨,以期为香蕉抗旱育种提供理论依据。
1 材料与方法
1. 1 试验材料
供试材料为桂蕉1号组培苗,由广西农业科学院提供。iTRAQ Kit购自AB SCIEX公司;测序级胰蛋白酶购自Promega公司;乙醇、丙烯腈、乙腈购自Fisher Chemical公司;三氟乙酸购自Sigma-Aldrich公司;2D-Quant Kit定量试剂盒购自GE Healthcare公司。主要仪器设备:Q Exactive质谱仪(Thermo ScientificTM公司)。
1. 2 试验方法
1. 2. 1 干旱胁迫处理 取长势健壮均一的6叶1心期杯栽香蕉组培幼苗,移栽至大桶中进行盆栽培养,土壤选用当地具有代表性的红壤,在土壤相对水含量80%~70%的条件下培养40 d后,设置80%~70%(T1,对照)、70%~65%(T2)、65%~60%(T3)、60%~55%(T4)、55%~50%(T5)5个土壤水分处理,每处理4个重复,干旱胁迫处理10 d,采集组培幼苗倒2叶,将处理组T2、T3、T4和T5的叶片混合后取样用于后续试验(Yang et al.,2012)。
1. 2. 2 蛋白质提取 取混合的香蕉组培苗叶片0.5 g,液氮下研磨成粉,加入4倍体积裂解液(8 mol/L尿素,1% TritonX-100,65 mmol/L DTT,0.1%蛋白酶抑制剂),冰上超声处理3次;于4 ℃ 20000×g离心10 min,取上清液;加入适量预冷的15%TCA丙酮溶液,-20 ℃沉淀2 h;于4 ℃ 20000×g离心10 min,弃上清液;预冷丙酮洗涤,3次重复;复溶于含0.1 mol/L TEAB的缓冲液中。最后,使用2D-Quant Kit定量试剂盒进行蛋白质定量。
1. 2. 3 iTRAQ定量 每处理取100 μg蛋白质,胰蛋白酶消化后,肽段用Strata X C18 SPE柱脱盐,分别用分子质量为117和118的基团标记对照组,分子质量为119和121的基团标记处理组。
1. 2. 4 数据库检索 通过Q Exactive质谱仪获得MS-MS质谱信息,利用Mascot Search Engine在Uniprot_ Musa acuminata数据库中进行信息搜索。
2 结果与分析
2. 1 差异表达蛋白鉴定结果
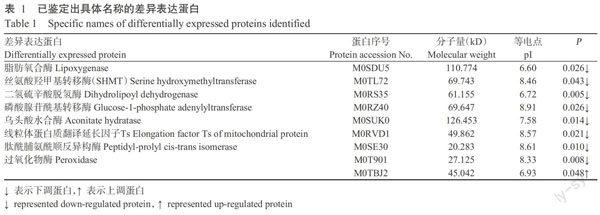
利用Uniprot_Musa acuminata数据库共鉴定出1655种蛋白,其中获得定量信息的蛋白1023种。蛋白相对定量比值高于1.30或低于0.77,当t检验值P小于0.05时,共获得78种差异表达蛋白(上调蛋白32种,下调蛋白46种),其中,已鉴定出具体名称的差异表达蛋白8种(表1)。利用Uniprot_Musa acuminata数据库对已鉴定出的8种差异表达蛋白进行分析,结果发现位于香蕉叶片细胞线粒体上的丝氨酸羟甲基转移酶(SHMT)含量明显下降,由于其主要参与N5,N10-亚甲基四氢叶酸+丝氨酸+H2O→四氢叶酸+L-丝氨酸反应过程,会直接导致L-丝氨酸含量下降,而L-丝氨酸是生命活动必需物质,因此干旱胁迫下香蕉幼苗生命活动受到明显抑制。此外,线粒体SHMT具有离子结合、一碳基团转移、辅因子结合等分子功能,主要参与非生物胁迫的响应刺激、细胞代谢、有机物质代谢等生物进程,由此证实香蕉幼苗抗旱机制具有多样性。
2. 2 GO生物进程分析结果
运用DAVID数据库对筛选获得的32种上调蛋白和46种下调蛋白进行GO生物进程分类,其中22个上调蛋白和32个下调蛋白能找到对应的分类号。分析结果如表2所示,已注释生物进程的上调蛋白主要参与响应刺激胁迫过程(GO:0050896)、细胞过程(GO:0009987)、代谢过程(GO:0008152)及单有机体过程(GO:0044699),还涉及发育过程(GO:0032502)、多细胞有机体过程(GO:003250)、细胞定位(GO:0051179)、多有机体过程(GO:0051704)、细胞组分组织发生(GO:0071840)及生物学调节(GO:0065007)等生物学进程,其中响应刺激胁迫过程和细胞过程类别所占差异表达蛋白的比例较大,分别占上调差异表达蛋白总数的24.14%和17.24%;已注释生物进程的下调蛋白主要参与细胞过程(GO:0009987)、代谢过程(GO:0008152)、单有机体过程(GO:0044699)及响应刺激胁迫过程(GO:0050896),还涉及生物学调节(GO:0065007)、多有机体过程(GO:0051704)及细胞组分组织发生(GO:0071840)等生物学进程,其中细胞过程类别和代谢过程类别所占差异表达蛋白的比例较大,分别占下调蛋白总数的25.23%和22.43%。
综合分析发现,参与细胞过程和代谢过程类别的总差异表达蛋白数量较多,分别为37和33种;参与光合电子传递链的差异表达蛋白共3种,占细胞过程类别差异表达蛋白总数的8.11%;参与光合作用的差异表达蛋白共10种,占代谢过程类别差异表达蛋白总数的30.30%,表明在干旱胁迫下香蕉幼苗的光合作用受影响较大。此外,参与淀粉代谢、二糖代谢、蔗糖代谢、寡糖代谢、细胞碳水化合物生物合成、葡聚糖代谢和多糖代谢的差异表达蛋白均为3个,分别占代谢过程类别差异表达蛋白总数的8.11%,表明干旱胁迫对香蕉体内的能量和物质转化有较大影响,且影响范围较大。此外,研究还发现,共有14种上调蛋白和16种下调蛋白参与了香蕉的响应刺激胁迫过程且发生变化,表明受到干旱胁迫时,香蕉体内的蛋白质应激性机制反应明显。
2. 3 GO分子功能分析结果
运用DAVID数据库对筛选获得的32种上调蛋白和46种下调蛋白进行GO分子功能分类,其中28种上调蛋白和46种下调蛋白能找到对应的分类号。分析结果如表3所示,已注释分子功能的上调蛋白主要具有催化活性功能(GO:0003824)、结合功能(GO:0005488)、抗氧化活性(GO:0016209)和功能调节(GO:0098772),少数蛋白具有结构分子活性(GO:0005198)与转运活性(GO:0005215),其中催化活性功能和结合功能所占比例较大,均占上调差异表达蛋白总数的38.46%;已注释分子功能的下调蛋白主要具有催化活性功能(GO:0003824)和结合功能(GO:0005488),少数蛋白具有电子载体活性(GO:0009055),其中催化活性功能和结合功能所占比例较大,分别占下调差异表达蛋白总数的50.82%和40.98%。因此,具有催化活性功能和结合功能的差异表达蛋白分别占差异表达蛋白总数的47.13%和40.23%。其中具有辅因子结合功能的差异表达蛋白有9种,占结合功能类别差异表达蛋白总数的22.50%。表明干旱胁迫对香蕉幼苗叶片中酶活性有较大影响,进而影响其正常的生理代谢活动。
2. 4 GO富集分析
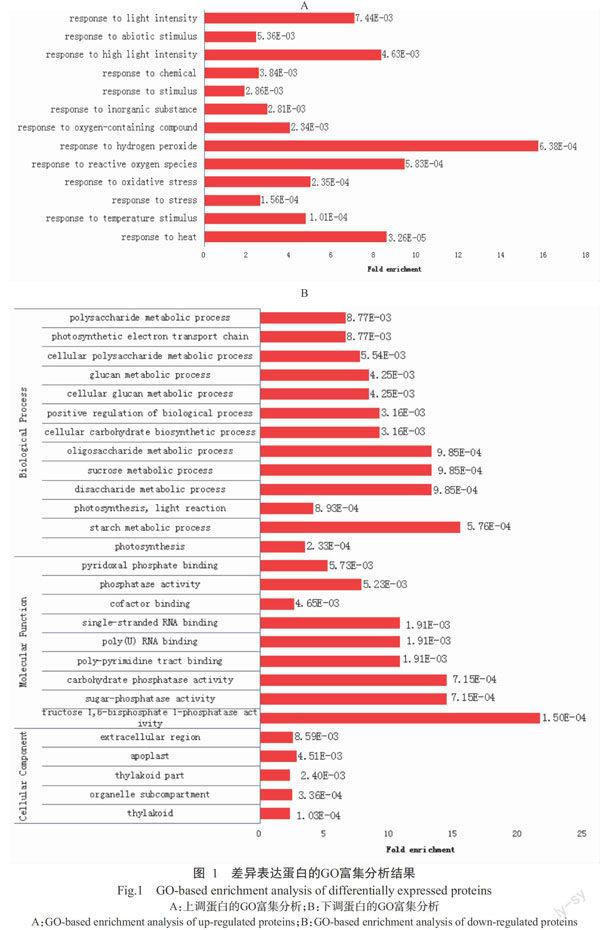
运用DAVID数据库对筛选获得的32种上调蛋白和46种下调蛋白进行GO富集分析。其中,对上调蛋白进行生物进程GO富集分析结果如图1-A所示,其主要参与过氧化氢反应(GO:0042542)和活性氧反应(GO:0000302)等,表明干旱促使香蕉幼苗叶片中H2O2等活性氧有害物质含量上升,进而引起香蕉幼苗体内CAT含量上升,从而形成新的响应机制。对下调蛋白进行生物进程、细胞组分、分子功能的GO富集分析,结果如图1-B所示。其中,生物进程的富集分析结果显示,下调蛋白主要参与淀粉代谢(GO:0005982)、二糖代谢(GO:0005984)、蔗糖代谢(GO:0005985)、寡糖代谢(GO:0009311)、细胞碳水化合物生物合成(GO:0034637)等过程。细胞组分的富集分析结果显示,下调蛋白主要位于质外体(GO:0048046)、胞外区(GO:0005576)及类囊体(GO:0009579)等部位。分子功能的富集分析结果显示,下调蛋白主要参与1,6-二磷酸果糖1-磷酸酶反应(GO:0042132)、蔗糖磷酸酶反应(GO:0050308)及碳水化合物磷酸酶反应(GO:0019203)等。综上所述,干旱胁迫下,香蕉幼苗叶片中参与物质代谢和能量循环的蛋白质表达量明显下降。
3 讨论
iTRAQ技术是美国应用生物系统公司于2004年推出的一项新的同位素标记技术(Ross et al.,2004),为低丰度蛋白定性和定量研究提供了有效的方法。大量研究证实,运用iTRAQ结合LC-MS-MS技术可同时分离和鉴定成百上千的蛋白质,最大程度地得到蛋白质组的“全组信息”(王林纤等,2010),并能发现一些低丰度的差异表达蛋白。本研究共鉴定出1655种蛋白,其中已获得定量信息的蛋白1023种,差异表达蛋白78种,高于利用双向电泳技术在香蕉叶片中检测出的差异表达蛋白数量(祁君凤,2010)。
GO注释是一个重要的生物信息学分析方法,用于统一表示基因和基因产物在所有物种中的属性,其原理就是通过计算机程序建立基因产物与用于定义它们的本体论词条间的联系(黄子夏等,2012)。1998年,基因本体论项目(Gene Ontology Project)被创立(Harris et al.,2004),该项目对基因功能进行了一致性描述,开发了可控制的词汇表,且无物种特异性。秦志英(2013)运用iTRAQ技术分离和鉴定了BNS不育系在不育条件和可育条件下花药不同发育时期的蛋白质,从细胞组分、分子功能和生物进程3个方面进行GO注释和分析,结果显示83种差异表达蛋白中有56种具有生物学途径GO注释。本研究中,主要从生物进程和分子功能两个方面进行分析注释。生物进程的GO分类结果显示,差异表达蛋白参与了香蕉幼苗叶片中的响应刺激过程、细胞过程、代谢过程、单有机体过程、生物学调节、多有机体过程和细胞组分组织发生过程等生物进程。由此推断,在干旱脅迫下,香蕉幼苗叶片中的应激机制启动,通过生长环境与体内代谢活动的相互作用,经过多重生物进程的改变,将干旱胁迫带来的损失降到最低。此外,王忠(2000)和张仁和等(2011)研究表明,抗旱玉米品种具有较高的电子传递效率,其是抗旱的光合特征之一,干旱胁迫能降低植物的光合速率及叶绿体对光能的吸收能力和转化效率,也能降低光合电子传递速率和磷酸化活力,从而影响光合碳同化。本研究也发现,参与光合电子传递链和光合作用的差异表达蛋白分别有3种和10种,分别占细胞过程类别差异表达蛋白总数的8.11%和代谢过程类别差异表达蛋白总数的30.30%,表明在干旱胁迫下,香蕉幼苗的光合作用受影响较大。
本研究在已鉴定的蛋白中发现了线粒体SHMT,其含量在干旱胁迫下明显降低,直接影响丝氨酸转化过程,导致香蕉无法正常生长发育。Bauwe和Kolukisaoglu(2003)研究发现,SHMT在高等植物的一碳代谢和光呼吸中发挥重要作用,主要功能是在蛋白质和嘌呤的生物合成中提供甘氨酸,并为C1库提供N5,N10-亚甲基四氢叶酸。若植物缺少SHMT会导致严重的生长迟缓(马莉和陈丽梅,2008),可见SHMT在植物中具有重要的生理功能。目前,GenBank数据库中已收录了35种以上的SHMT序列,其在香蕉体内的作用机理需进一步探究。此外,本研究还发现,干旱胁迫可引起香蕉幼苗叶片中H2O2等活性氧有害物质含量上升,导致CAT含量的增加,表明香蕉自身存在调控应激机制,对干旱胁迫具有一定的抵抗力。由此推测,植物的抗旱机制可在一定程度上缓解干旱胁迫带来的伤害,如高粱以CAT为主要抗氧化酶,具有较强的抗旱、伤害修复及超补能力,水分胁迫下高粱CAT活性明显增加(邵艳军,2006)。但不同植物的抗旱机制存在差异,仍需进一步探究。
4 结论
干旱胁迫下香蕉的表达蛋白种类及数量发生明显变化,且其抗旱机制是多种蛋白质共同作用的结果,主要通过调节物质和能量代谢及应激活动来发挥作用。
参考文献:
何娟,李茂富,吴凡,李绍鹏,周双云. 2013. 干旱胁迫下香蕉幼苗对外源ALA的生理响应[J]. 南方农业学报,44(5):745-750.
He J,Li M F,Wu F,Li S P,Zhou S Y. 2013. Physiological response of banana seedling to exogenous ALA under drought stress[J]. Journal of Southern Agriculture,44(5):745-750.
黄鹤丽,林电,章金强,孙恪志. 2009a. 水分胁迫对巴西香蕉幼苗叶片生理特性的影响[J]. 热带作物学报,30(4):485-488.
Huang H L,Lin D,Zhang J Q,Sun K Z. 2009a. Effect of water stress and flooding on leaf physiological characteristics in Brazil banana seedling[J]. Chinese Journal of Tropical Crops,30(4):485-488.
黄鹤丽,林电,章金强,孙恪志. 2009b. 水分胁迫对巴西香蕉幼苗水分状况、质膜透性和根系活力的影响[J]. 基因组学与应用生物学,28(4):740-744.
Huang H L,Lin D,Zhang J Q,Sun K Z. 2009b. Effect of water stress and flooding on water state,membrane permeability and root activity in Brazil banana seedling[J]. Genomics and Applied Biology,28(4):740-744.
黄子夏,柯才焕,陈军. 2012. 大规模GO注释的生物信息学流程[J]. 厦门大学学报(自然科学版),51(1):139-142.
Huang Z X,Ke C H,Chen J. 2012. Bioinformatics procedure of large-scale GO annotation[J]. Journal of Xiamen University (Natural Science),51(1):139-142.
刘晚苟,吴华伟. 2011. 水分胁迫对香蕉幼苗保护酶活性的影响[J]. 热带农业科学,31(12):46-48.
Liu W G,Wu H W. 2011. Effects of water stress on activities of protective enzymes in banana seedlings[J]. Chinese Journal of Tropical Crops,31(12):46-48.
马莉,陈丽梅. 2008. 植物丝氨酸羟甲基转移酶基因研究进展[J]. 生物技术通报,(2):15-19.
Ma L,Chen L M. 2008. The research advances on serine hydro-
xymethyl transferase gene in plants[J]. Biotechnology Bulletin,(2):15-19.
苗红霞,王园,徐碧玉,刘菊华,贾彩红,张建斌,王卓,孙佩光,金志强. 2014. 香蕉MaASR1基因的抗干旱作用[J]. 植物学报,49(5):548-559.
Miao H X,Wang Y,Xu B Y,Liu J H,Jia C H,Zhang J B,Wang Z,Sun P G,Jin Z Q. 2014. The role of banana MaASR1 in drought stress tolerance[J]. Chinese Bulletin of Botany,49(5):548-559.
祁君鳳. 2010. 低温胁迫香蕉叶片SSH文库的构建及其差异蛋白的初步研究[D]. 海口:海南大学.
Qi J F. 2010. Banana leaves of low temperature stress SSH library construction and differential protein study[D]. Haikou:Hainan University.
秦志英. 2013. 基于iTRAQ技术的小麦BNS雄性不育差异表达蛋白分离鉴定与分析[D]. 新乡:河南科技学院.
Qin Z Y. 2013. Separation,identification and analysis of diffe-
rential expressed proteins of wheat BNS male sterility line based on iTRAQ method[D]. Xinxiang:Henan Institute of Science and Technology.
邵艳军,山仑,李广敏. 2006. 干旱胁迫与复水条件下高粱、玉米苗期渗透调节及抗氧化比较研究[J]. 中国生态农业学报,14(1):68-70.
Shao Y J,Shan L,Li G M. 2006. Comparison of osmotic regulation and antioxidation between sorghum and maize seedlings under soil drought stress and water recovering conditions[J]. Chinese Journal of Eco-Agriculture,14(1):68-70.
申永锋,赵锦,刘孟军. 2007. 双向电泳技术及其在植物抗性研究中的应用[J]. 河北林果研究,22(4): 351-354.
Shen Y F,Zhao J,Liu M J. 2007. Two-dimensional electrophoresis and application on plant resistance research[J]. Hebei Journal of Forestry and Orchard Research,22(4):351-354.
孙存华,李扬,贺鸿雁,孙东旭,杜伟,郑曦. 2005. 藜对干旱胁迫的生理生化反应[J]. 生态学报,25(10):2556-2561.
Sun C H,Li Y,He H Y,Sun D X,Du W,Zheng X. 2005. Physio-
logical and biochemical responses of Chenopodium album to drought stresses[J]. Acta Ecologica Sinica,25(10):2556-2561.
王林纤,戴勇,涂植光. 2010. iTRAQ标记技术与差异蛋白质组学的生物标志物研究[J]. 生命的化学,30(1):135-140.
Wang L X,Dai Y,Tu Z G. 2010. iTRAQ labeling and biomarker discovery in comparative proteomic studies[J]. Chemistry of Life,30(1):135-140.
王蕊,李新国,李绍鹏,王令霞,黄绵佳. 2010. 干旱胁迫下2种香蕉幼苗叶片和根的主要渗透调节物质的变化[J]. 基因组学与应用生物学,29(3):518-522.
Wang R,Li X G,Li S P,Wang L X,Huang M J. 2010. Changes of drought stress on main osmotic adjustment substance in leaves and roots of two banana plantlets[J]. Genomics and Applied Biology,29(3):518-522.
王园. 2010. 香蕉ASR基因抗逆功能的研究[D]. 海口:海南大学.
Wang Y. 2010. Study of function of MaASR1 tolerance to drought and salt resistance[D]. Haikou:Hainan University.
王忠. 2000. 植物生理学[M]. 北京:中国农业出版社.
Wang Z. 2000. Plant Physiology[M]. Beijing:China Agriculture Press.
邢文婷. 2014. 香蕉MaMYB基因克隆及抗旱功能研究[D]. 海口:海南大学.
Xing W T. 2014. Cloning and function analysis of MaMYB drought resistant[D]. Haikou:Hainan University.
张洁,谢惠民,吕树作,王宏礼. 2007. 水分胁迫条件下冬小麦幼苗应答蛋白的表达及其与品种抗旱性的关系[J]. 麦类作物学报,27(2):303-308.
Zhang J,Xie H M,Lü S Z,Wang H L. 2007. Relationship between drought resistance and response protein of winter wheat during seedling stage under water stress[J]. Journal of Triticeae Crops,27(2):303-308.
張丽丽. 2012. 香蕉转录因子基因-MaASR1提高拟南芥抗旱能力的调控机理研究[D]. 海口:海南大学.
Zhang L L. 2012. The regulation mechanism of banana transcription factor gene-MaASRl for improving the drought resistance of Arabidopsis[D]. Haikou:Hainan University.
张仁和,邓友军,马国胜,张兴华,路海东,史俊通,薛吉全.2011. 干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J]. 生态学报,31(5):1303-1311.
Zhang R H,Deng Y J,Ma G S,Zhang X H,Lu H D,Shi J T,Xue J Q. 2011. Effects of drought stress on photosynthetic sraits and protective enzyme activity in maize seedling[J].Acta Ecologica Sinica,31(5):1303-1311.
Aranjuelo I,Molero G,Erice G,Avice J C,Nogues S. 2011. Plant physiology and proteomics reveals the leaf response to drought in alfalfa(Medicago sativa L.)[J]. Journal of Experimental Botany,62(1):111-123.
Bauwe H,Kolukisaoglu U. 2003. Genetic manipulation of glycine decarboxylation[J]. Journal of Experimental Botany,54(387):1523-1535.
Harris M A,Clark J,Ireland A. 2004. The gene ontology(GO) database and informatics resources[J]. Nucleic Acids Research,32(S1):258-261.
Ross P L,Huang Y N,Marchese J N. 2004. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents[J]. Mol Cell Proteomic,3(12):1154-1169.
Salekdeh G H,Siopongco J,Wade L J,Ghareyazie B,Bennett J.2002. Proteomic analysis of rice leaves during drought stress and recovery[J]. Proteomics,2(9):1131-1145.
Xu C,Huang B. 2010. Differential proteomic responses to water stress induced by PEG in two creeping bentgrass cultivars differing in stress tolerance[J]. Journal of Plant Physiology,167(17):1477-1485.
Yang Q S,Wu J H,Li C Y,Sheng O,Hu C H,Kuang R B,Huang Y H,Peng X X,McCardle J A,Chen W,Yang Y,Rose J K,Zhang A,Yi G J. 2012. Quantitative proteomic analysis reveals that antioxidation mechanisms contribute to cold tolerance in plantain(Musa paradisiaca L.;ABB Group) seedings[J]. The American Society for Biochemistry and Molecular Biology,11(12):1853-1869.
(責任编辑 陈 燕)

