巴西橡胶树HbEBP1生物学特性、原核表达及氨肽酶活性分析
程汉 朱建顺 安泽伟 方家林 胡彦师 黄华孙


摘 要 从巴西橡胶树中筛选到了HbEBP1基因,该基因序列长度为1 462 bp,其中5′端非编码区长度为141 bp,3′端非编码区长度为133 bp,其cDNA序列具有完整的阅读框,编码395个氨基酸,推导的HbEBP1分子量为43.596 ku,等电点位为6.45。生物信息学分析结果表明巴西橡胶树HbEBP1具有3个保守结构域:增值相关蛋白2G4(PA2G4-like)、氨肽酶M24(APP_MetAP)、甲硫氨酸氨肽酶(MAP)结构域。对原核表达的HbEBP1蛋白进行氨肽酶活性测定,发现体外表达的HbEBP1蛋白没有Map活性。这些结果表明,橡胶树HbEBP1基因并不存在氨肽酶活性。
关键词 橡胶树;HbEBP1;氨肽酶;原核表达
中图分类号 S794.1,Q78 文献标识码 A
The Characterization,Prokaryotic Expression and MetAP
Activity Analysis of Hevea brasiliensis HbEBP1
CHENG Han,ZHU Jianshun,AN Zewei,FANG Jialin,HU Yanshi,HUANG Huasun*
Rubber Research Institute,Chinese Academy of Tropical Agricultural Science,Danzhou,Hainan 571737,China
Abstract An EBP1 gene was identified from rubber tree in this study. The full length of the cDNA sequence of HbEBP1 gene was 1 462 bp in length,with a 141 bp 5′ UTR and a 133 bp 3′ UTR. An intact ORF was found in the HbEBP1 cDNA sequence, which encoding a 395 AA poly-peptide. The deduced HbEBP1 protein had a molecular weight of 43.596 ku,pI 6.45. Bioinformatics analysis revealed this protein had three conserved domains:a PA2G4-like domain,a APP-MetAP domain and a MAP domain. HbEBP1 was expressed in E.coli, and the purified protein was used to test the MAP activity. The results showed that HbEBP1 protein had no MAP activity in vitro. These results demonstrated that HbEBP1 may not function as a MAP enzyme.
Key words Rubber tree;HbEBP1;Aminopeptidase;Prokaryotic expression
doi 10.3969/j.issn.1000-2561.2016.02.017
EBP1是近年发现的一种新型蛋白质,是表皮生长因子受体ErbB-3结合蛋白,被认为是重要的转录因子和转录共调节因子。研究发现,EBP1参与多个信号传导途径,与细胞周期、蛋白质的转录、翻译相关,影响细胞的增殖和分化,但其确切的作用机制尚不明确[1-5]。EBP1是增殖相关蛋白2G4(PA2G4s)家族的一员。在真核生物中,P2G4蛋白高度保守,参与细胞的生长和分化[6-7]。人体EBP1蛋白由PA2G4基因编码,其cDNA序列全长1 697 bp,其编码蛋白长度为394 aa,与调节鼠细胞周期的DNA结合蛋白p38-2G4高度同源[8],在对p38-2G4进行免疫荧光显微镜观察时发现,其表达具有以下特点:G1期至S期中期表达呈强阳性,S期晚期表达量减少,S/G2间期表达呈阴性,G0期表达消失[9,6]。EBP1蛋白的分子量为48 ku,是一类碱性蛋白质,在其C-端(368aa-373aa)存在着一个细胞核定位信号。整个蛋白包含5个酪蛋白激酶Ⅱ的磷酸化位点和6个蛋白激酶C(PKC)的丝氨酸/苏氨酸磷酸化位点,其第258~313 aa的肽段被推测为亲水亲脂性双螺旋区域[10]。
植物中EBP1基因的命名与克隆主要基于其与人体EBP1基因在结构和序列上的相似性。笔者在橡胶树中克隆了橡胶树HbEBP1基因,并对其进行了亚细胞定位研究,发现该基因编码的蛋白质能定位到细胞核与细胞质中[11],然而对于该基因的功能尚未进行深入研究。通过同源性比对搜索,发现HbEBP1与甲硫氨酸氨肽酶(MAP)基因也具有较高的同源性。在人类中EBP1蛋白和MAP1蛋白在结构上具有高度的相似性,但EBP1蛋白不具有氨肽酶活性[12,10]。因此,橡胶树HbEBP1到底属于EBP家族基因还是MAP尚未可知。本研究通过原核表达技术使HbEBP1蛋白在大肠杆菌中表达,经过纯化后分析了HbEBP1蛋白的氨肽酶活性,这为进一步阐明该基因的功能奠定基础。
1 材料与方法
1.1 材料
实验所用巴西橡胶树抗寒品种93-114由中国热带农业科学院橡胶研究所橡胶树国家种质资源圃提供。当年将芽接苗种植于大棚内,待其长至第二蓬叶稳定时,收集叶片样品,于液氮保存备用。所使用的菌株、质粒载体均为中国热带农业科学院橡胶研究所农业部橡胶树生物学重点开放实验室保存。
1.2 方法
1.2.1 巴西橡胶树HbEBP1基因的获得 本课题组通过低温诱导构建了巴西橡胶树品系93-114的全长cDNA文库[13],利用该文库,对测序后的EST序列进行注释,得到了1 462 bp的HbEBP1基因全长cDNA。从文库中找到对应HbEBP1基因的编号,用无菌牙签沾取少量菌液,接种到盛有20 mL含100 μg/mL氨苄西林的LB培养基中,于37 ℃、220 r/min条件下振荡培养过夜;提取质粒后送交华大基因科技有限公司进行测序分析。
1.2.2 HbEBP1基因的生物信息学分析 HbEBP1基因的ORF预测通过NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)程序进行;利用ExPASy的在线软件Compute PI/MW(http://au.expasy. org/tools/pi_tool.html)、 Protparam tool(http://us.expasy.org/tools/protparam.html)、 http://www.ch.embnet.org/和NCBI的核酸、蛋白质结构特征在线分析工具对氨基酸序列进行理化特性分析;通过NCBI的CD-Search service工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)对氨基酸功能保守区进行预测;信号肽预测采用SignalP 3.0程序(http://www.cbs.dtu.dk/services/SignalP)进行; HbEBP1蛋白的疏水性图谱使用ExPASy的ProtScale(http://www.expasy.org/cgi-bin/protscale.pl)进行绘制; 使用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM/)对蛋白质跨膜区进行预测;使用Psort程序(http://psort.nibb.ac.jp)对亚细胞进行定位分析。
1.2.3 巴西橡胶树HbEBP1基因的原核表达 (1)表达载体的构建。根据HbEBP1基因序列设计2对引物,分别引入BamHI和NotⅠ酶切位点:上游引物P1(5′-TCAAAGCTGTGGATCCATGTCGG-3′)和下游引物P2(5′-CATAAGCGGCCGCATACAAGGT-3′)。使用高保真酶从橡胶树叶片cDNA中扩增基因片段,PCR产物经1.2%琼脂糖凝胶电泳后,用iNtRON公司的MEGA-spin Agarose Gel Extraction Kit回收目的片段,具体操作按试剂盒说明书进行。
将回收的目的片段用BamHI、NotⅠ(Fermentas)进行双酶切,回收后将其连接至经过BamHI、NotⅠ双酶切并磷酸化处理过的PGEX-6P-1原核表达载体中,转入E.coli JM109感受态细胞中,挑取单克隆,经过测序确认序列正确后,提取质粒并转入工程菌BL21DE3感受态细胞中。
(2)HbEBP1融合蛋白的诱导表达。带有HbEBP1基因的工程菌经过夜活化后,按1 ∶ 100的比例将其稀释于新的培养基中,继续于37 ℃中培养1~2 h,待OD600≈0.6时,加入一定浓度的IPTG进行诱导,在各个时间点(1 h、2 h、3 h、4 h)分别取出1 mL的菌液,离心收集菌体;分别在诱导后每隔1 h取出1 mL培养物,取其中40 μL加入10 μL的5×SDS loading buffer中,于100 ℃中煮沸10 min后,以12 000 r/min离心1 min,收集上清,取20 μL进行12% SDS-PAGE电泳。
(3)重组蛋白GST-HbEBP1的分离纯化。取保存于-70 ℃的菌体,加入细胞裂解液(200 μL PBS、0.2% Triton-X 100、1 mmol/LPMSF )悬浮,使用超声波裂解仪进行裂解,直至溶液透明,以12 000 r/min离心10 min后,取上清液,用50%谷胱甘肽交联琼脂4B(Glutathione Sepharose 4B)柱进行离心管纯化,并使用谷胱甘肽洗脱液剪切GST,之后进行洗脱,收集纯化后的HbEBP1蛋白,测定其浓度后保存。
(4)HbEBP1蛋白的氨肽酶活性测定。本研究采用了2种方案对HbEBP1的甲硫氨酸氨肽酶活性进行检测。
参照Selvakumar等[14]的方法:以Met-pNA(BACHEM公司)为反应底物,反应液为500 μL,包括50 mmol/L Tris-HCl(pH7.5)、0.25 mmol/L Met-pNA、0.4 mmol/L各种不同的二价金属离子(Fe2+,Cu2+,Co2+,Ca2+,Mg2+,Mn2+)、融合蛋白125 ng,混匀后于37 ℃反应30 min,冰上静置15 min后,测OD405值。
参照Li等[15]的方法:以Met-Gly-Pro-pNA(LKT公司)为底物, 反应液为500 μL,包括10 mmol/L Hepes(pH 7.35)、150 mmol/L KCl、10%甘油、融合蛋白200 ng、0.5 U DPP-IV(Sigma)、0.4 mmol/L二价金属离子(Fe2+,Cu2+,Co2+,Ca2+,Mg2+,Mn2+),混匀后于37 ℃ 温浴5 min;加入2 mmol/L Met-Gly-Pro-pNA,混匀后,测定OD405值。
2 结果与分析
2.1 巴西橡胶树HbEBP1基因序列及其生物信息学分析
2.1.1 HbEBP1基因序列及其ORF区预测 借助NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)程序可知, HbEBP1基因序列长度为1 462 bp。从HbEBP1基因中找出一条长1 188 bp的ORF,其起始密码子位于142 bp,终止密码子位于1 327 bp,推测编码395个氨基酸。ORF两测分别是141 bp的5′UTR和133 bp的3′UTR(图1)
2.1.2 HbEBP1蛋白质特性分析 通过ExPASy在线软件Compute PI/MW、Protparam tool、http://www.ch.embnet.org/和NCBI的核酸、蛋白质结构特征在线分析工具对推测的HbEBP1氨基酸序列进行了理化特性分析。结果表明HbEBP1蛋白质的分子量为43.596 ku,理论等电点为6.45,不稳定指数估算值为35.71,属于稳定蛋白质。其氨基酸组成见表1。
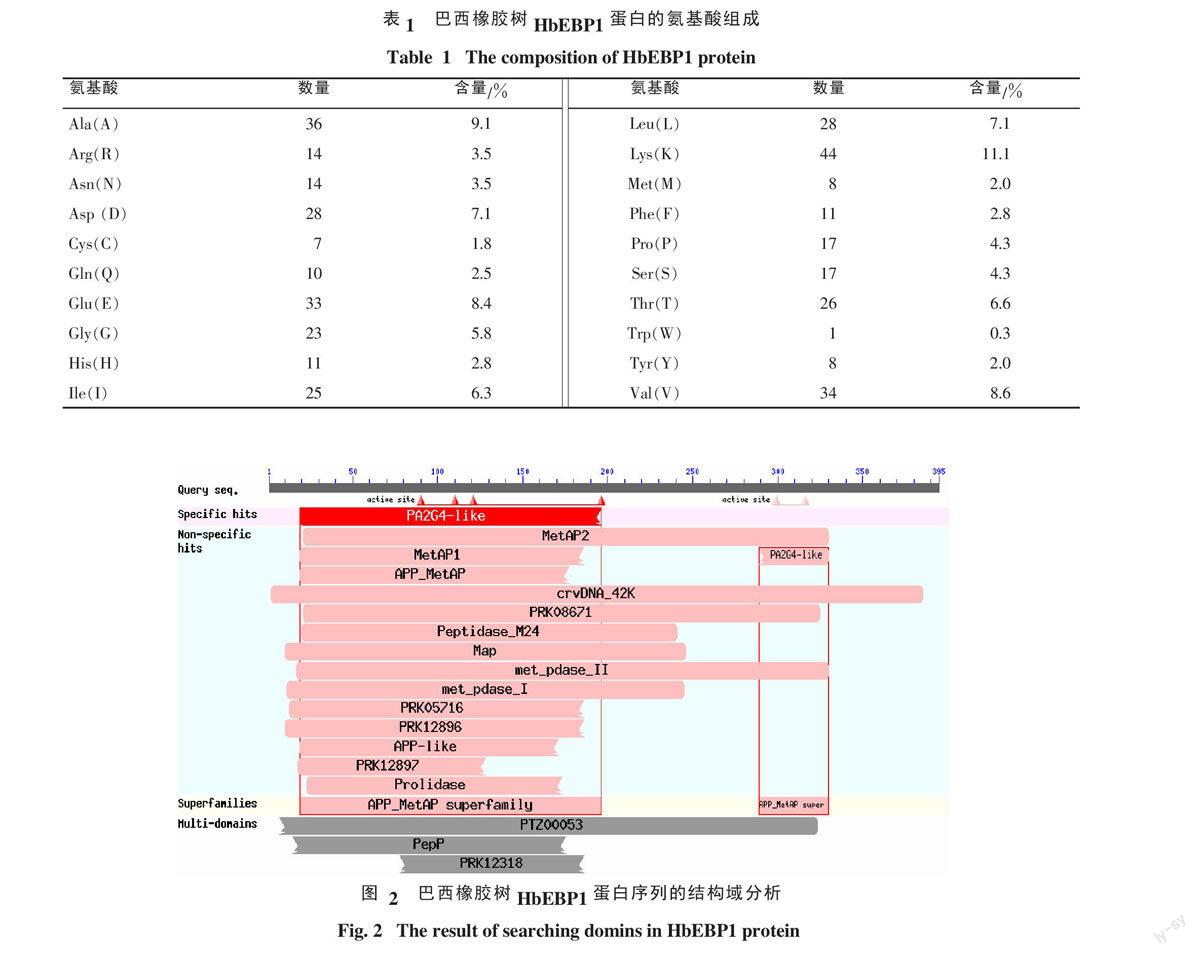
蛋白质通常由多个膜体(Motif)组成,组成这些膜体的氨基酸区段行使各自特定的功能,同时还蕴藏了各自的遗传进化信息。通过NCBI的CD-Search service工具对巴西橡胶树HbEBP1的多肽序列进行功能保守区域的分析。结果表明,HbEBP1具有增殖相关蛋白2G4(PA2G4-like)结构域、氨肽酶M24(APP_MetAP)结构域、甲硫氨酸氨肽酶(MAP)结构域,且都高度同源(图2)。其中,据报道,在蛋白质合成过程中,MAP具有切除N-端起始甲硫氨酸的功能[16],且在原核生物和真核生物中都高度保守。
2.1.3 信号肽、疏水性及跨膜区预测 采用SignalP 3.0程序对氨基酸序列进行信号肽预测。分析结果显示,巴西橡胶树HbEBP1蛋白氨基酸序列存在信号肽的概率为0,存在信号切割位点的概率也为0,且S-core mean<0.5(图3),因此,推测HbEBP1蛋白中不存在信号肽,不是分泌蛋白。
在进行蛋白质的二级结构和三级结构预测时必须分析蛋白质的亲/疏水性质,通过了解整条肽链中不同肽端的亲/疏水性,可以对一些蛋白质跨膜的肽段进行预测,不仅可以为蛋白质次级结构预测提供参考,还可以为结构域和功能域的划分提供参考。合成的新生肽链,有相当一部分被转运并定位到不同的细胞器上,或被分泌到细胞外。折叠为特定的空间构象的肽链,表面带有大量的亲水基团,虽然在细胞质中很容易被传送,但是不能通过脂质构成的细胞膜。用ExPASy的ProtScale对HbEBP1蛋白进行预测,计算疏水性图谱,通过分析氨基酸残基的得分可知,HbEBP1不含明显的疏水区(图4)。
跨膜结构域一般富含疏水性氨基酸残基,起着固定于细胞膜中的“抛锚”作用。具有跨膜结构域的蛋白属于跨膜蛋白,跨膜结构域的预测对正确认识蛋白质的结构、功能、细胞定位具有重要意义。利用TMHMM软件,对蛋白进行跨膜区预测,结果表明该蛋白没有跨膜结构,属于非跨膜蛋白。
2.1.4 亚细胞定位预测 用Psort程序分析HbEBP1蛋白的亚细胞定位,结果显示该蛋白定位于细胞质和细胞核的可能性都是30%,并在第365个氨基酸处存在核定位信号序列(NLS):KKKK。用Protfun预测HbEBP1蛋白的功能分类,结果发现该蛋白存在于信号传导、转录调节、生长调节、胁迫应答的可能性分别是0.051、0.037、0.018和0.011。植物EBP1基因在生长调节和响应胁迫应答方面的作用已经得到证实[17]。因此推测HbEBP1在橡胶树中可能具有调节生长和胁迫应答功能。
2.1.5 HbEBP1同源性分析 HbEBP1与蓖麻的增值相关蛋白RcP2G4(Ricinus communis,XP_002530
504)、沙冬青AmEBP1(Ammopiptanthus mongolicus,ABF66654)、马铃薯StEBP1(Solanum tuberosum,ABJ97690)、拟南芥AtEBP1(Arabidopsis thaliana,NP_190748)的同源性分别为100%、98%、97%、98%。图5可看出,HbEBP1在植物中是高度保守的。
2.2 HbEBP1蛋白的原核表达及氨肽酶活性分析
将HbEBP1基因克隆进工程载体PGEX-6P-1中后,转入工程菌BL21,经0.1 mmol/L的IPTG诱导,得到高效表达(图6)。结果显示GST-HbEBP1在诱导表达过程中,随时间的积累,表达量不断上升,在诱导4 h后(第7泳道),融合蛋白得到了大量积累,得到的重组蛋白分子量在69 ku左右,和预计的大小(GST为26 ku,HbEBP1预计为43.6 ku)基本相当。
2.3 重组蛋白的氨肽酶活性测定
由于HbEBP1含有MAP保守结构域,据报道,MAP在原核生物和真核生物中都高度保守,是一种双核金属蛋白水解酶,广泛存在于生物体中,其主要功能是可选择性地水解切除新生蛋白质或多肽链N端的第一个甲硫氨酸,这对于蛋白质的翻译后修饰、成熟及其在细胞中的准确定位、功能发挥和最终降解等起着关键作用。
用裂解液将诱导后的培养物沉淀悬浮,之后用超声波裂解,将上清液用谷胱甘肽琼脂糖凝胶(Glutathione Sepharose)4B过柱纯化,最后将洗脱液收集起来,测定含量后参照Selvakumar等[14]和Li等[15]的方法,在0.4 mmol/L的不同金属离子存在条件下对酶活性进行检测。结果显示,应用2种方法都未能检测到氨肽酶活性。
3 讨论与结论
Kowalinski等[10]在研究人源HsEBP1的晶体结构时,在其中也没有检测到MAP活性。Kowalinski等[10]研究发现,HsEBP1含有和甲流氨酸氨肽酶(MAP)、脯氨酰氨基酸酶、肌酸酶和氨肽酶P一样的皮塔面包结构,从结构上看,HsEBP1和人源HsMAP2非常接近,但序列确相差较大。皮塔面包酶的主要结构特点是其内表面的β-桶状结构形成一个大的腔体[10],这个腔体是MAP2的活性位点,也是与底物结合识别的相邻位点。在MAP家族中,活性中心的二价离子结合位点是水解底物所必需的。人体MAP2中2个金属离子通过单基配位体(His 331和Glu 364)和二基配位体(Asp251,Asp262和Glu459)相结合。而在EBP1中,晶体结构中不存在金属离子,只有2个金属配位残基(Asp109和His188)是保守的。MAP2中的2个带负电荷的残基(Asp262,Glu364)在EBP1中被Asn120和Asp227替换,最为显著的是MAP2中的Glu459在EBP1中变成了Lys320,正电荷Lys320的长侧链在静电上和空间位置上都阻碍了金属的配位,所以,EBP1不能将MAP的底物进行水解。
笔者将HbEBP1与HsEBP1的氨基酸序列做了比对,发现HbEBP1和HsEBP1在结构上是保守的,HsEBP1的Asp227、Lys320位点和HbEBP1完全一样,只是HsEBP1的Asn120在HbEBP1中变成了Val氨基酸,而Val是疏水性氨基酸,在空间上可能更加阻碍了HbEBP1与底物的结合。因此,推测HbEBP1蛋白与HsEBP1蛋白一样,也不具有氨肽酶活性。在本研究中,笔者使用了2种氨肽酶活性测量方法,均未能检测到氨肽酶活性,与推测结果一致。
然而,由于本研究使用的HbEBP1蛋白来源于大肠杆菌中的过量表达,而不是从橡胶树中纯化得到,因此也不能完全排除HbEBP1蛋白在原核表达体系中失去氨肽酶活性。原核表达蛋白的活性丢失往往是由于其在大肠杆菌中形成包涵体而导致错误折叠,而在本研究中,HbEBP1能够高水平表达出可溶性蛋白,且融合蛋白的GSH标签也很容易被切除,因此大大降低了目的蛋白错误折叠的可能性。另外,已有报道称,在原核细胞中能够表达具有活性的氨肽酶活性蛋白[18],因此,结合HbEBP1蛋白的生物学特征和本研究结果,笔者认为HbEBP1不具有氨肽酶活性最可能的原因是其内在属性。
本研究从巴西橡胶树cDNA文库中筛选到了巴西橡胶树HbEBP1基因。该基因序列长度为1 462 bp,具有完整的阅读框,编码395个氨基酸,推导的HbEBP1蛋白分子量为43.596 ku,等电点位6.45。分析表明巴西橡胶树HbEBP1具有3个保守结构域:增殖相关蛋白2G4(PA2G4-like)、氨肽酶M24(APP_MetAP)、甲硫氨酸氨肽酶(MAP),不存在信号肽,不是分泌蛋白,不含明显的疏水区,没有跨膜结构,属于非跨膜蛋白。对原核表达的HbEBP1蛋白进行氨肽酶活性测定,发现原核表达的巴西橡胶树HbEBP1没有MAP活性。
参考文献
[1] Nguyen L X T, Lee Y, Urbani L, et al. Regulation of ribosomal RNA synthesis in T cells: requirement for GTP and Ebp1[J]. Blood, 2015, 125(16): 2 519-2 529.
[2] Ko H R, Kim C K, Ahn J Y. Phosphorylation of the N-terminal domain of p48 Ebp1 by CDK2 is required for tumorigenic function of p48[J]. Molecular Carcinogenesis, 2014: n/a-n/a.
[3] Figeac N, Serralbo O, Marcelle C, et al. ErbB3 binding protein-1(Ebp1)controls proliferation and myogenic differentiation of muscle stem cells[J]. Developmental Biology, 2014, 386(1): 135-151.
[4] Horváth B M, Magyar Z, Zhang Y, et al. EBP1 regulates organ size through cell growth and proliferation in plants[J]. The EMBO Journal, 2006, 25(20): 4 909-4 920.
[5] Deprost D, Yao L, Sormani R, et al. The Arabidopsis TOR kinase links plant growth, yield, stress resistance and mRNA translation[J]. EMBO Reports, 2007, 8(9): 864-870.
[6] Radomski N, Jost E. Molecular cloning of a murine cDNA encoding a novel protein, p38-2G4, which varies with the cell cycle[J]. Experimental Cell Research, 1995, 220(2): 434-445.
[7] Yamada H, Mori H, Momoi H, et al. A fission yeast gene encoding a protein that preferentially associates with curved DNA[J]. Yeast(Chichester, England), 1994,10(7): 883-894.
[8] Lamartine J, Seri M, Cinti R, et al. Molecular cloning and mapping of a human cDNA(PA2G4)that encodes a protein highly homologous to the mouse cell cycle protein p38-2G4[J]. Cytogenetics and Cell Genetics, 1997, 78(1): 31-35.
[9] Xia X M, Lessor T J, Zhang Y X, et al. Analysis of the Expression Pattern of Ebp1, an ErbB-3-Binding Protein[J]. Biochemical and Biophysical Research Communications, 2001, 289(1): 240-244.
[10] Kowalinski E, Bange G, Bradatsch B, et al. The crystal structure of Ebp1 reveals a methionine aminopeptidase fold as binding platform for multiple interactions[J]. FEBS letters, 2007, 581(23): 4 450-4 454.
[11] 祝建顺, 程 汉, 肖成江, 等. 橡胶树HbEBP1蛋白亚细胞定位初步研究[J]. 热带作物学报, 2013, 34(5): 815-820.
[12] Monie T P, Perrin A J, Birtley J R, et al. Structural insights into the transcriptional and translational roles of Ebp1[J]. The EMBO Journal, 2007, 26(17): 3 936-3 944.
[13] 程 汉, 蔡海滨, 黄华孙. 巴西橡胶树低温诱导全长cDNA文库构建[J]. 热带作物学报, 2008, 29(4): 410-414.
[14] Selvakumar P, Lakshmikuttyamma A, Kanthan R, et al. High expression of methionine aminopeptidase 2 in human colorectal adenocarcinomas[J]. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research, 2004, 10(8): 2 771-2 775.
[15] Li X, Chang Y H. Evidence that the human homologue of a rat initiation factor-2 associated protein(p67) is a methionine aminopeptidase[J]. Biochemical and Biophysical Research Communications, 1996, 227(1): 152-159.
[16] Datta B. MAPs and POEP of the roads from prokaryotic to eukaryotic kingdoms[J]. Biochimie, 2000, 82(2): 95-107.
[17] Cao P, Song J, Zhou C, et al. Characterization of multiple cold induced genes from Ammopiptanthus mongolicus and functional analyses of gene AmEBP1[J]. Plant Molecular Biology, 2008, 69(5): 529-539.
[18] kanudia P, Mittal M, Kumaran S, et al. Amino-terminal extension present in the Methionine aminopeptidase type 1c of Mycobacterium tuberculosis is indispensible for its activity[EB/OL]. 2015-11-11. http://www.biomedcentral.com/1471-2091/12/35.

