广西巴马小型猪PAQR3基因克隆及表达谱分析
司景磊 黄玥萌 李龙 陈秋明 严雪瑜 吴延军 张笠


摘要:【目的】克隆广西巴马小型猪孕激素和脂联素分子受体3(PAQR3)基因,并研究该基因在广西巴马小型猪不同组织中的表达特性,为揭示PAQR3的功能及其在疾病模型中的作用打下基础。【方法】采用RT-PCR扩增广西巴马小型猪PAQR3基因,应用在线预测软件对其功能和结构进行生物信息学分析,并以qRT-PCR分析PAQR3基因在不同組织中的表达特性及高脂高糖诱导后的表达水平。【结果】广西巴马小型猪PAQR3基因编码区(CDS)序列全长936 bp,编码312个氨基酸,与人类(XM_006714106.2)、猕猴(NM_001257693.1)、牛(XM_010806259.1)、家犬(XM_014109889.1)、家鼠(XM_ 006534874.2)、羊(XM_012180242.1)、鸡( XM_001233720.3) PAQR3氨基酸序列的一致性在81%以上,其中与猕猴的亲缘关系最近,与牛的亲缘关系相对较远。PAQR3蛋白氨基酸序列包含保守的HlyIⅡ结构域,为亲水性蛋白,有7个跨膜螺旋结构;其二级结构主要是延伸链,占31.83%;该蛋白不存在信号肽,不属于分泌蛋白。qRT-PCR分析结果表明,PAQR3基因在广西巴马小型猪的不同组织中均有表达,以在肺脏中的表达量最高、脂肪中的表达量最低;经高脂高糖诱导后,PAQR3基因在广西巴马小型猪肝脏组织中的表达水平显著降低(P<0.05)。【结论】PAQR3基因在广西巴马小型猪不同组织中广泛表达,在胆固醇和甘油三脂充裕的条件下,机体可通过下调PAQR3基因的表达量来平衡胆固醇含量。
关键词: 广西巴马小型猪;PAQR3基因;克隆;表达谱分析
中图分类号: S828.89 文献标志码:A 文章编号:2095-1191(2016)08-1390-06
Abstract:【Objective】The present experiment was conducted to clone progesterone and adipoQ receptor 3(PAQR3) gene of Guangxi Bama mini-pig and investigate its expresssion in different tissues of Guangxi Bama mini-pig, in order to lay a foundation for revealing PAQR3 fuction and its role in disease models. 【Method】The PAQR3 gene of Guangxi Bama mini-pig was cloned by RT-PCR, the protein structure of porcine PAQR3 was analyzed based on bioinformatics using online prediction software. The PAQR3 gene expression pattern in different tissues and its expression level after being induced by high fat and high sugar were detected by qRT-PCR. 【Result】The results showed that, the PAQR3 gene of Guangxi Bama mini-pig was 936 bp in length, encoding 312 amino acids. The phylogenetic tree analysis showed that, and the amino acid sequence of porcine PAQR3 protein shared identity of more than 81% with human(XM_006714106.2), macaque(NM_001257693.1), cattle(XM_010806259.1), canis famliliaris(XM_014109889.1), house mouse(XM_0065348
74.2), sheep(XM_012180242.1) and chicken(XM_001233720.3). It indicated that Guangxi Bama mini-pig had the closest genetic relationship with macaque, but the most distant genetic relationship with cattle. Furthermore, PAQR3 protein contained conserved HlyIⅡ domain and was hydrophilic protein, with 7 transmembrane helices, and the extended strand accounted for 31.83% in the secondary structure. And PAQR3 protein wasnt secretory protein because it had no signal peptide. The qRT-PCR results showed that, PAQR3 gene was expressed in the different tissues of Guangxi Bama mini-pig, especially in lung at the highest level, but in fat at the lowest level. In addition, after being induced by high fat and high sugar, the expression level of PAQR3 gene was reduced significantly in liver tissues of Guangxi Bama mini-pig(P<0.05). 【Conclusion】Th PAQR3 gene can be expressed widely in different tissues of Guangxi Bama mini-pig, and under high content of cholesterol and triglyceride, body can balance cholesterol content by regulating PAQR3 gene expresssion.
Key words: Guangxi Bama mini-pig; PAQR3 gene; cloning; expression patterns analysis
0 引言
【研究意义】孕激素和脂联素分子受体3(Progesterone and adipoQ receptor 3,PAQR3)又名RKTG(Raf kinase trapping to golgi),為PAQRs家族中的一员,是具有7次跨膜结构且N端在外、C端在胞内的膜蛋白受体(Yamauchi et al.,2003;Feng et al.,2007;Luo et al.,2008)。PAQRs家族在哺乳动物中有11个成员,即PAQR1~PAQR11(Tang et al.,2005),其成员的功能各不相同,主要是由于具有非保守性的N末端和C末端结构(陈雁和谢小多,2009)。因最初发现某些成员具有与脂联素或孕酮相似的生物学功能,故被命名为孕酮及脂联素受体家族(Tang et al.,2005)。PAQR3能参与细胞的多种信号通路,特别是与癌症发生发展相关的信号通路,其在乳腺癌、胃癌、直肠癌等肿瘤组织中的表达水平降低,进而增强乳腺癌细胞对抗肿瘤药物的敏感性(李日恒等,2015;宋艳敏等,2015)。因此,研究PAQR3基因在不同组织中的表达特性对揭示其功能具有重要意义。【前人研究进展】自PAQR3被发现以来,其功能多样性正逐步被报道。Greene和Tischler(1976)研究表明,PAQR3基因过表达能抑制神经生长因子诱导的P12细胞分化;Fan等(2008)研究表明,PAQR3通过在空间上调控Raf激酶而达到抑制Ras/ Raf/MEM/ERK信号通路的目的;Wang等(2013)研究证实,PAQR3在调节机体能量代谢、肥胖及胰岛素信号通路方面发挥重要作用;宋艳敏等(2015)研究发现,结直肠癌组织中PAQR3基因表达降低与启动子发生高甲基化密切相关;而李日恒等(2015)通过结直肠癌组织甲基化特异性检测,发现结直肠癌组织中PAQR3基因甲基化与性别、年龄和肿瘤部位无关。此外,PAQR3基因过表达和敲除分别能够降低或增强PI3K活性及PIP3的产生(王笑等,2013);在机体胆固醇水平较低的条件下,PAQR3能够将Scap/SREBP2锚定于高尔基体上,从而调节机体胆固醇的合成(Xu et al.,2015)。【本研究切入点】PAQR3不仅在抑制癌细胞生成方面有积极作用,还在胆固醇和脂肪酸的合成与代谢、胰岛素抵抗信号通路等方面发挥重要作用(Wang et al.,2012;Xu et al.,2015),但目前针对猪PAQR3基因表达尚无研究报道。【拟解决的关键问题】应用RT-PCR扩增广西巴马小型猪PAQR3基因编码区(CDS)序列,应用在线预测软件对其功能和结构进行生物信息学分析,并以qRT-PCR分析PAQR3基因mRNA在不同组织中的表达特性及高脂高糖诱导后的表达水平,以期为进一步研究PAQR3的功能及其在疾病模型中的作用打下基础。
1 材料与方法
1. 1 试验材料
广西巴马小型猪样品由广西大学动物遗传育种实验室保存提供。除LA Taq DNA聚合酶、M-MLV反转录酶、SYBP■ Green I定量试剂盒、DL2000 DNA Marker、pMD19-T载体、DNA回收试剂盒、DH5α感受态细胞购自生工生物工程(上海)股份有限公司外,其他试剂均购自TaKaRa公司。
1. 2 组织总RNA提取
采用Trizol提取广西巴马小型猪肝脏组织总RNA,以核酸仪检测所提取RNA的浓度和纯度,并用1%琼脂糖凝胶电泳检测所提取RNA完整性。cDNA第一链的合成按TaKaRa试剂盒说明进行操作,反转录产物-20 ℃保存备用。
1. 3 PAQR3基因克隆及定量引物
根据GenBank上已公布的猪PAQR3基因CDS序列(登录号XM_013998797.1)设计PAQR3基因扩增引物PAQR3-F1和PAQR3-R1,同时针对PAQR3、SREBP2(固醇调节元件结合蛋白2)、HMGCS(3-羟基-3-甲基戊二酰辅酶A合酶基因)、HMGCR(HMGCoA还原酶)、LDLR(低密度脂蛋白受体)、ABCA1(三磷酸腺苷结合盒转运体A1)等基因分别设计不同的荧光定量PCR(qRT-PCR)扩增引物,包括PAQR3-F2/R2、SREBP2- F/R、HMGCS-F/R、HMGCR-F/R、LDLR-F/R、ABCA1- F/R及管家基因GAPDH(内参基因),所有引物均由深圳华大基因研究院合成(表1)。以广西巴马小型猪肝脏cDNA为模板进行目的片段扩增,PCR反应体系50.0 μL:cDNA模板1.0 μg,10 μmol/L的上、下游引物(PAQR3-F1/PAQR3-R1)各0.5 μL,LA Taq DNA聚合酶12.5 μL,加ddH2O补足至50.0 μL。扩增程序:94 ℃预变性1 min;98 ℃ 10 s,60 ℃ 35 s,72 ℃ 1 min,进行30个循环;最后72 ℃延伸10 min。
1. 4 目的片段克隆
用1.0%琼脂糖凝胶电泳检测PCR产物片段大小,并切胶回收连接至pMD19-T载体(胶回收产物4.0 μL、Ligase Buffer 5.0 μL、pMD19-T载体1.0 μL),然后转化DH5α感受态细胞,并涂布于含有氨苄青霉素的LA培养基上,37 ℃下倒置培养过夜(10 h)后挑选阳性克隆进行菌液PCR验证,将阳性菌落送至华大基因研究院进行测序鉴定。
1. 5 PAQR3基因生物信息学分析
将测序结果用Lasergene 7.0进行序列比对分析,用MEGA 6.0进行同源性比对并构建系统发育进化树。利用ExPASy数据库中的ProtParam预测PAQR3基因所编码蛋白的亲/疏水性、氨基酸组成和理化性质、跨膜结构域等生物学信息。
1. 6 PAQR3基因在不同组织中的表达水平分析
以稀释后的cDNA为模板进行qRT-PCR,反应体系:SYBP Premix Ex TaqTMⅡ 10.0 μL,cDNA模板5.0 μL,上、下游引物各0.4 μL,ddH2O 4.2 μL。扩增程序:94 ℃预变性30 s;94 ℃ 10 s,60 ℃ 10 s,72 ℃ 1 s,进行40个循环。利用2-△△Ct计算PAQR3基因的相对表达量。所有样品进行3个重复,且均设阴性对照。
1. 7 统计分析
采用SPSS 22.0统计分析PAQR3基因的表达水平,以Duncans多重和单因素方差分析比较其差异显著性。
2 结果与分析
2. 1 PAQR3基因CDS序列和氨基酸序列分析结果
以广西巴马小型猪肝脏cDNA为模板,用PAQR3-F1和PAQR3-R1引物能扩增出1条特异性条带,长度约930 bp(图1),与预期结果一致。
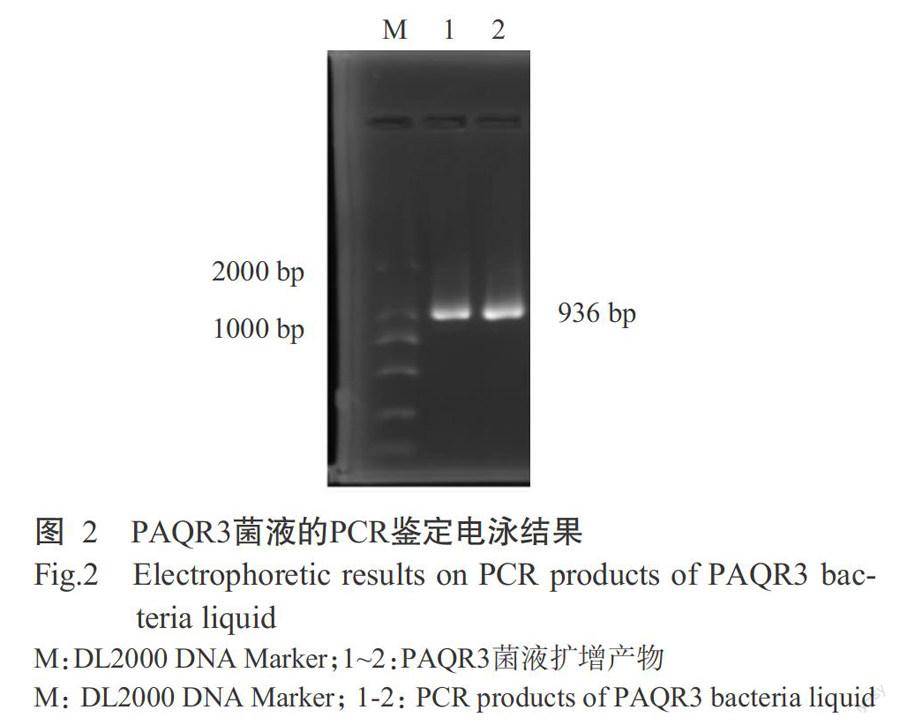
将目的片段胶回收后连接至pMD19-T载体,再转化DH5α感受态细胞,挑取单克隆进行菌液PCR鉴定,结果获得1条清晰的目的条带(图2),即表明菌液测序验证结果正确。
扩增获得的PAQR3基因CDS序列全长936 bp,编码312个氨基酸,与NCBI已公布的猪PAQR3基因序列(XM_013998797.1)的同源性为100%,与人类(XM_006714106.2)、猕猴(NM_001257693.1)、牛(XM_
010806259.1)、家犬(XM_014109889.1)、家鼠(XM_
006534874.2)、羊(XM_012180242.1)、鸡(XM_001233-
720.3)PAQR3氨基酸序列的一致性分别为93%、92%、91%、93%、89%、92%和81%,说明PAQR3基因具有高度保守性。利用MEGA 6.0构建系统发育进化树,发现广西巴马小型猪与猕猴的PAQR3基因亲缘关系最近,而与牛PAQR3基因的亲缘关系相对较远(图3)。
2. 2 PAQR3基因理化性质预测及蛋白保守域分析结果
2. 2. 1 PAQR3基因的理化性质及结构预测结果 使用ExPASy在线网站进行PAQR3基因编码蛋白亲/疏水性分析,结果显示,广西巴马小型猪PAQR3蛋白平均亲水数为0.403,属于亲水蛋白(图4)。ProtScale程序预测得到PAQR3蛋白的理论等电点(pI)为9.15,分子量为21893.6。用TMHMM程序预测PAQR3蛋白的7个跨膜螺旋区,结果(图5)发现7个跨膜螺旋的位置分别位于PAQR3蛋白序列中的第74~96、106~128、141~163、173~195、202~224、239~256和276~298位氨基酸残基处。SOPMA网站预测PAQR3蛋白二级结构,结果显示,α-螺旋占31.19%,延伸链占31.83%,β-转角占11.90%,無规则卷曲占25.08%。利用PSORTⅡ预测PAQR3蛋白的细胞器定位,发现其分布概率为:内质网47.8%,线粒体34.8%,囊泡分泌系统4.3%,细胞核13.0%。SingIP 4.1 Server在线预测信号肽发现PAQR3不存在信号肽,即该蛋白不属于分泌蛋白。
2. 2. 2 PAQR3蛋白保守域分析结果 根据NCBI网站BLAST检索结果分析PAQR3蛋白保守结构域,结果显示,广西巴马小型猪PAQR3蛋白氨基酸序列符合蛋白质结构的特点,包含保守的HlyIⅡ结构域(图6)。2. 3 PAQR3基因在不同组织中的表达水平分析结果
2. 3. 1 PAQR3基因在10种不同组织中的表达谱 以广西巴马小型猪不同组织的cDNA为模板,分别进行PAQR3基因和GAPDH基因的qRT-PCR扩增分析,结果表明,PAQR3基因在肺脏中的表达量最高,而在脂肪中的表达量最低(图7)。
2. 3. 2 高脂高糖诱导对PAQR3基因表达的影响 以高脂高糖饲料饲喂广西巴马小型猪12个月,以正常的饲料营养水平为对照。采集广西巴马小型猪肝脏并提取cDNA为模板,qRT-PCR扩增分析相关基因和内参基因的表达情况,结果(图8)表明,高脂高糖诱导后广西巴马小型猪肝脏的PAQR3基因表达量显著低于对照组(P<0.05),LDLR基因表达量极显著低于对照组(P<0.01),其他基因的表达量与对照组无显著差异(P>0.05)。
3 讨论
自PAQR3被发现至今,已不断展现其在不同方面和代谢信号通路的作用,起初关于PAQR3的研究主要集中于癌症方面,包括抑制结直肠癌、膀胱癌和肝癌的发生发展(Wu et al.,2014;Xiu et al.,2014;Yu et al.,2014)。PAQR3在调节由饮食诱导的肥胖、能量代谢、胰岛素抵抗中同样具有显著作用。如PAQR3基因敲除鼠经高脂高糖诱导16周后能有效抵抗肥胖和机体脂肪的生成,且其血液胆固醇和低密度脂蛋白水平显著低于野生组(Wang et al.,2013)。机体胆固醇、脂质代谢是人类许多疾病发生发展的基础,如与糖尿病、动脉粥样硬化等疾病密切相关(Xu et al.,2015)。机体胆固醇合成主要通过食物吸收和体内胆固醇合成,在哺乳动物中,胆固醇从头合成是机体胆固醇需求的一种重要方式(Xu et al.,2015)。本研究通过检测高脂高糖诱导广西巴马小型猪肝脏PAQR3基因表达量及调控胆固醇合成与代谢的相关基因,发现高脂高糖诱导后PAQR3基因显著下调,同时调控胆固醇合成的相关基因下调表达、调控胆固醇代谢的相关基因上调表达。
PAQR3虽属于脂联素受体家族成员,但有报道指出,同时敲除AdipoR1和AdipoR2基因能引起胰岛素抵抗和葡萄糖耐受性,提高组织甘油三酯含量和炎症氧化应激(Yamauchi et al.,2007);仅敲除AdipoR2基因也能促进鼠Ⅱ型糖尿病发生(Liu et al.,2007)。与之相反,敲除PAQR3基因能提高能量代谢和胰岛素敏感性,可区别于脂联素受体敲除的表型(Wang et al.,2013)。PAQR3发挥这些作用主要是通过锚定p110α,从而在空间上调控PI3K信号通路来调控胰岛素信号通路。本研究克隆获得广西巴马小型猪PAQR3基因CDS序列,全长936 bp,其核苷酸序列与人类、猕猴、牛、家犬、家鼠等核苷酸序列具有很高的一致性(在81%以上),且符合其家族蛋白的典型特征。PAQR3基因在广西巴马小型猪不同组织中广泛表达,以在肺脏中的表达量最高、脂肪中的表达量最低;经高脂高糖诱导后肝脏中的PAQR3基因表达量显著下调,说明在胆固醇和甘油三脂充裕的条件下,机体可通过下调PAQR3基因的表达量来平衡胆固醇含量。Xu等(2015)研究表明,PAQR3是通过将SREBPs/Scap锚定于高尔基体上而促进胆固醇合成,但本课题组的前期研究结果表明,经高脂高糖诱导广西巴马小型猪血液中胆固醇与甘油三酯的含量较对照组显著提高(宋少锐,2014),可能是在机体负反馈调节作用下,PAQR3发生锚定作用的可能性微小,同时Scap将SREBP2锚定于内质网,通过下调胆固醇合成相关基因的表达来降低胆固醇合成,但具体原理有待进一步探究。
4 结论
PAQR3基因在广西巴马小型猪不同组织中广泛表达,在胆固醇和甘油三脂充裕的条件下,机体可通过下调PAQR3基因的表达量来平衡胆固醇含量。
参考文献:
陈雁,谢小多. 2009. RKTG基因功能研究[J]. 细胞生物学杂志,31(1):9-14.
Chen Y,Xie X D. 2009. The studies of RKTG function[J]. Chinese Journal of Cell Biology,31(1):9-14.
李日恒,杨瑞红,宋艳敏,张涛,李青,吕志刚,张爱民,安宇亮. 2015. 结直肠癌组织中PAQR3、PDCD4基因甲基化水平与结直肠癌的关系[J]. 中国老年学杂志,35(13):3633-3635.
Li R H,Yang R H,Song Y M,Zhang T,Li Q,Lü Z G,Zhang A M,An Y L. 2015. Methylation and expression of PAQR3 and PDCD4 genes in tissue with colorectal cancer and its relation with colorectal cancer[J]. Chinese Journal of Geron-
tology, 35(13):3633-3635.
宋少锐. 2014. 广西巴马小型猪动脉粥样硬化模型制作的初步研究[D]. 南宁:广西大学.
Song S R. 2014. Preliminary study on preparation of atherosclerosis model using Guangxi Bama mini-pig[D]. Nanning:Guangxi University.
宋艳敏,李日恒,张涛,贾佳,马芳,赵立华. 2015. 结直肠癌中PAQR3甲基化水平及mRNA表达的研究[J]. 医学研究与教育,32(1):55-60.
Song Y M,Li R H,Zhang T,Jia J,Ma F,Zhao L H. 2015. The methylation and mRNA expression of PAQR3 in colorectal cancer[J]. Medical Research and Education,32(1):55-60.
王笑,王甄真,陳雁. 2013. PI3K/AKT信号通路在维持血糖平衡中的作用[J]. 生命科学,25(2):133-139.
Wang X,Wang Z Z,Chen Y. 2013. The functions of PI3K/AKT signaling pathway in glucose homeostasis[J]. Chinese Bulletin of Life Sciences,25(2):133-139.
Fan F,Feng L,He J,Wang X,Jiang X,Zhang Y,Wang Z,Chen Y. 2008. RKTG sequesters B-Raf to the Golgi apparatus and inhibits the proliferation and tumorigenicity of human malignant melanoma cells[J]. Carcinogenesis,29(6):1157-1163.
Feng L,Xie X,Ding Q,Luo X,He J,Fan F,Liu W,Wang Z,Chen Y. 2007. Spatial regulation of Raf kinase signaling by RKTG[J]. Proceedings of the National Academy of Sciences of the United States of America,104(36):14348-14353.
Greene L A,Tischler A S. 1976. Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor[J]. Proceedings of the National Academy of Sciences of the United States of America,73(7):2424-2428.
Liu Y,Michael M D,Kash S,Bensch W R,Monia B P,Murray S F,Otto K A,Syed S K,Bhanot S,Sloop K W,Sullivan J M,Reifel-Miller A. 2007. Deficiency of adiponectin receptor 2 reduces diet-induced insulin resistance but promotes type 2 diabetes[J]. Endocrinology,148(2):683-692.
Luo X,Feng L,Jiang X,Xiao F,Wang Z,Feng G S,Chen Y. 2008. Characterization of the topology and functional domains of RKTG[J]. The Biochemical Journal,414(3):399-406.
Tang Y T,Hu T,Arterburn M,Boyle B,Bright J M,Emtage P C,Funk W D. 2005. PAQR proteins:a novel membrane receptor family defined by an ancient 7-transmembrane pass motif[J]. Journal of Molecular Evolution,61(3):372-380.
Wang L,Wang X,Li Z,Xia T,Zhu L,Liu B,Zhang Y,Xiao F,Pan Y,Guo F,Chen Y. 2013. PAQR3 has modulatory roles in obesity,energy metabolism,and leptin signaling[J]. Endocrinology,154(12):4525-4535.
Wang X,Li X,Fan F,Jiao S,Wang L,Zhu L,Pan Y,Wu G,Ling Z Q,Fang J,Chen Y. 2012. PAQR3 plays a suppressive role in the tumorigenesis of colorectal cancers[J]. Carcinogenesis,33(11):2228-2235.
Wu H G,Zhang W J,Ding Q,Peng G,Zou Z W,Liu T,Cao R B,Fei S J,Li P C,Yang K Y,Hu J L,Dai X F,Wu G,Li P D. 2014. Identification of PAQR3 as a new candidate tumor suppressor in hepatocellular carcinoma[J]. Oncology Reports,32(6):2687-2695.
Xiu Y,Liu Z,Xia S,Jin C,Yin H,Zhao W,Wu Q. 2014. MicroRNA-137 upregulation increases bladder cancer cell proliferation and invasion by targeting PAQR3[J]. PLoS One,9(10):e109734.
Xu D,Wang Z,Zhang Y,Jiang W,Pan Y,Song B L,Chen Y. 2015. PAQR3 modulates cholesterol homeostasis by anchoring Scap/SREBP complex to the Golgi apparatus[J]. Nature Communications,6:8100.
Yamauchi T,Kamon J,Ito Y,Tsuchida A,Yokomizo T,Kita S,Sugiyama T,Miyagishi M,Hara K,Tsunoda M,Murakami K,Ohteki T,Uchida S,Takekawa S,Waki H,Tsuno N H,Shibata Y,Terauchi Y,Froguel P,Tobe K,Koyasu S,Taira K,Kitamura T,Shimizu T,Nagai R,Kadowaki T. 2003. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J]. Nature,423(6941):762-769.
Yamauchi T,Nio Y,Maki T,Kobayashi M,Takazawa T,Iwabu M,Okada-Iwabu M,Kawamoto S,Kubota N,Kubota T,Ito Y,Kamon J,Tsuchida A,Kumagai K,Kozono H,Hada Y,Ogata H,Tokuyama K,sunoda M,Ide T,Murakami K,Awazawa M,Takamoto I,Froguel P,Hara K,Tobe K,Nagai R,Ueki K,Kadowaki T. 2007. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin bin-
ding and metabolic actions[J]. Nature Medicine,13(3):332-339.
Yu L,Zhou L,Cheng Y,Sun L,Fan J,Liang J,Guo M,Liu N,Zhu L. 2014. MicroRNA-543 acts as an oncogene by targeting PAQR3 in hepatocellular carcinoma[J]. American Journal of Cancer Research,4(6):897-906.
(責任编辑 兰宗宝)

