酶解章鱼下脚料的产物分析
黄惠莉, 张爽, 张育荣, 张鹭鹰, 王开明
(1. 华侨大学 化工学院, 福建 厦门 361021;2. 华侨大学 环境与资源技术研究所, 福建 厦门 361021;3. 厦门东海洋水产品进出口有限公司, 福建 厦门 361012)
酶解章鱼下脚料的产物分析
黄惠莉1,2, 张爽1, 张育荣3, 张鹭鹰3, 王开明3
(1. 华侨大学 化工学院, 福建 厦门 361021;2. 华侨大学 环境与资源技术研究所, 福建 厦门 361021;3. 厦门东海洋水产品进出口有限公司, 福建 厦门 361012)
摘要:为了提高下脚料的综合利用率,用4种商业蛋白酶对章鱼下脚料进行水解,并初步分析检测产物中的氨基酸和抗氧化多肽.实验结果表明:动物蛋白酶水解液中的复合氨基酸获取率占总氨基酸的57.12%,达到57.12%;而4种蛋白酶水解产物中肽类物质的·OH清除力IC50均小于1.28 mg·mL-1,Fe2+螯合力IC50均小于2.82 mg·mL-1,还原力随多肽质量浓度增加而提升;这种工艺条件和方法可以同时获取两类活性物质(复合氨基酸、抗氧化性多肽),为章鱼下脚料资源的最大化利用提供实验依据.
关键词:章鱼; 下脚料; 蛋白酶水解; 复合氨基酸; 抗氧化多肽
生物活性氨基酸和多肽在人体新陈代谢的调节中发挥着十分重要的作用,可以作为改善人类健康和预防疾病的功能性食品、保健品和药品[1].游离氨基酸关系到或构建成进行生理活动的蛋白质,同时也是激素和含氮碱基的前体[2].另外,食物中的必需氨基酸很好地维持机体的健康[3].从海洋生物蛋白质中获取的天然活性多肽,与活性蛋白质相比更易被人体吸收,而与氨基酸相比又保持着多种多样的功能性特征[4].Raghavan等[5]利用风味酶水解罗非鱼蛋白质,获得血管紧张素转换酶(ACE)抑制活性肽.Anusha等[6]发现鳕鱼可以在体内自我水解,得到具有抗氧化活性的片段.许多商业蛋白酶已被用来获取海洋水产品中的氨基酸和活性肽[7],但对章鱼下脚料的水解液研究较少.本文利用4种常见商业蛋白酶(碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、动物蛋白酶A5),酶解章鱼下脚料中蛋白质,对氨基酸和粗肽液分析,判断获取率和性能,为废物的利用提供实验依据.
1材料与方法
1.1材料与试剂
1) 材料.章鱼内脏(-20℃保存,厦门市东海洋水产品进出口有限公司);碱性蛋白酶(6.668 mkat)、中性蛋白酶(6.668 mkat)、木瓜蛋白酶(33.34 mkat)、动物(复合)蛋白水解酶A5(2.500 5 mkat)(-20℃保存,广西市南宁庞博生物工程有限公司).
2) 试剂.磷酸二氢钠,磷酸氢二钠,水杨酸,过氧化氢,FeSO4,FeCl2,K3Fe(CN)6,FeCl3,Ferrozine(西陇化工股份有限公司);氢氧化钠,酒石酸钾钠,硫酸铜,三氯乙酸(上海国药集团化学试剂有限公司);牛血清白蛋白(美国Amresco公司).
1.2仪器与设备
JJ-2型组织捣碎匀浆机(江苏省常州市国华电器有限公司);pH700型pH计( 美国Eutech Instruments公司);DKZ-2型电热恒温振荡水浴锅(上海精宏实验设备有限公司);RO-NF-UF-4010型膜分离设备,HPS-10,HPS-1型超滤膜组件(上海摩速科学器材有限公司);VIS-7220型分光光度计(北京瑞利分析仪器公司).
1.3实验方法
1.3.1复合氨基酸的制备蛋白酶(广西南宁庞博生物工程有限公司)的水解最优条件,如表1所示.表1中:θ为温度;ρ为底物质量浓度;t为时间.复合氨基酸的制备过程如下:章鱼下脚料匀浆→调固液比、pH值、预热至反应温度10 min→加酶水解→灭酶(100 ℃水浴,10 min)→4 500 r·m-1,离心15 min→上清液通过氨基酸分析仪分析检测.

表1 4种蛋白酶的最优水解条件
抗氧化肽类的制备如下:章鱼下脚料匀浆→调固液比、pH值、预热至反应温度10 min→加酶水解→灭酶(100 ℃水浴,10 min)→纱布过滤→超滤膜10 ku(截留相对分子质量10 ku)过滤→超滤膜1 ku(截留相对分子质量1 ku)过滤→1~10 ku的浓缩液→冷冻干燥备用→检测抗氧化性能时用去离子水溶解即可.
1.3.2氨基酸的测定酸解液(全部氨基酸溶液GBT 5009.124-2003)及水解液(游离氨基酸溶液)委托青岛科标检测中心进行检测.
1.3.3抗氧化性能检测1) 羟基(·OH)清除能力的测定.将0.5 mL不同质量浓度的多肽溶液,0.5 mL 的FeSO4(6 mmol·L-1),及0.5 mL的H2O2(6 mmol·L-1)混匀,静置10 min.在溶液中加入0.5 mL的水杨酸(6 mmol·L-1),记为Ai;在溶液中加入去离子水,记为Aj;在溶液中加入多肽,记为Aj.将溶液静置30 min后,12 000 r·min-1离心2 min,取上清液于510 nm下测定吸光度,即
(1)
式(1)中:Y为羟基(·OH)清除率,%;Ai为多肽水溶液吸光值;Aj为多肽水溶液空白吸光值;Ao为试剂空白吸光值.

(2)

3) 还原能力的测定.将1 mL不同质量浓度的多肽溶液,1 mL的PBS(pH值为6.6),1 mL的 K3Fe(CN)6(质量分数为1%)混匀,在50℃下,反应20 min.在溶液中加入1 mL的TCA(质量分数为10%)后,3 000 r·min-1离心10 min.取1 mL的上清液,加入1 mL的去离子水和0.2 mL的FeCl3(质量分数为 0.1%),于700 nm下测定吸光度,做多肽浓度与吸光值的曲线.
4) 粗肽液验证.利用反相高效液相色谱法,对4种蛋白酶水解液中的1~10 ku的粗肽液进行初步分离纯化,判断其纯化效果.具体实验条件如下:色谱柱为Bio-C18;流动相A为0.1%的TFA,B为乙腈-TCA;流速为1.0 mL·min-1;检测波长为280 nm;柱温为室温;进样量为5 μL;多肽质量浓度为1 mg·mL-1.
2结果与分析
2.1水解产物中氨基酸分析
根据节1.3.1的实验方法,利用氨基酸分析仪,对4种商业蛋白酶水解章鱼下脚料获取的复合氨基酸上清液进行氨基酸分析,不同水解方法获得的17种氨基酸结果,如表2所示.

表2 不同蛋白酶水解产物中氨基酸质量比
由表2可知:碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、以及动物蛋白酶A5水解得到的复合游离氨基酸的质量比分别为0.227 5,0.126 9,0.071 1,0.360 5,分别占蛋白质全部水解生成复合氨基酸总量的36.05%,20.11%,11.27%,57.12%.由此可见:动物蛋白酶水解章鱼下脚料获取氨基酸的效果最好;4种蛋白酶水解得到的必需氨基酸质量分数分别占每种蛋白酶水解液中总游离复合氨基酸的53.93%,54.53%,55.56%,49.72%.
由于人和脊椎动物无法自身合成必需氨基酸,或合成速度很慢,所以必需从食物和饲料中摄取和补充,而4种蛋白酶水解生成的必需氨基酸,均符合食品与饲料所需的全部8种必需氨基酸.
根据Cui等[8]利用碱性和中性蛋白酶对不同动物下脚料进行水解研究,发现不同内脏所得氨基酸比例与种类基本相似,从而判断一种商业蛋白酶对不同蛋白质的酶切位点基本一致.本实验碱性蛋白酶水解产生的氨基酸集中在Glu,Phe,Lys,Leu上(均大于2%),与Kechaou等[9]利用碱性蛋白酶水解乌贼下脚料生成的氨基酸种类相似.碱性蛋白酶水解生成氨基酸顺序为:Leu,Lys,Glu,Phe,Tyr,Thr(大于50%),中性蛋白酶为Leu,Glu,Lys,Phe,Aps(大于50%),木瓜蛋白酶为Glu,Leu,Lys,Phe(大于50%).较多集中在疏水性氨基酸上,证实了3种蛋白酶具有内切酶的特性.而动物蛋白酶水解生成氨基酸顺序为Leu,Glu,Lys,Tyr,Phe,Thr(大于50%),疏水性与亲水性的氨基酸数量基本一致,证实了这种蛋白酶在水解过程,同时发挥了内切和外切酶的特性.另外,部分芳香族氨基酸和脂肪族氨基酸对产品的风味有突出贡献,降低了氨基酸水解液的腥味.
2.2水解产物中肽类物质的抗氧化性能检测
化合物抗氧化作用的方式和机制有很多种,对蛋白质水解产物进行体外抗氧化活性检测,包括清除自由基的能力、还原能力和金属螯合能力[10].
用4种商业蛋白质水解章鱼下脚料,水解条件,如表1所示.水解液经10 ku的膜分离装置获取滤过液,再经过1 ku的膜分离装置获取浓缩液,即相对分子质量1~10 ku的粗肽液.不同类型和质量浓度的多肽难以比较,所以选择IC50为指标进行抗氧化性能的评价.
2.2.1羟基(·OH)清除能力检测自由基是机体正常氧化反应中产生的一种有害物质.一般经过体内抗氧化酶和其他氧化剂就可以达到清除的效果[11].其中,羟基是自由基中氧化性最强的一种,Fe2+和H2O2置换生成Fe3+,OH-和·OH,再通过水杨酸与·OH反应生成可显色的二羟基苯甲酸,对比吸光度和IC50即可判断清除能力的高低.用OriginPro 8.0进行拟合分析,结果如图1所示.

图1 不同质量浓度肽类的·OH清除能力Fig.1 ·OH scavenging ability of different concentrations of peptides
碱性蛋白酶:y=101.02-68.16/[1+(x/0.85)2.8],R2=0.992 3,IC50=0.58 mg·mL-1;
中性蛋白酶:y=138.45-114.08/[1+(x/2.26)1.59],R2=0.998 8,IC50=1.04 mg·mL-1;
木瓜蛋白酶:y=102.41-73.32/[1+(x/0.86)2.15],R2=0.992 1,IC50=0.56 mg·mL-1;
动物蛋白酶A5:y=99.75-75.82/[1+(x/1.66)2.48],R2=0.999 9,IC50=1.28 mg·mL-1.
由图1可知:4种蛋白酶水解产物的拟合R2均在0.99以上,拟合度高.碱性蛋白酶和木瓜蛋白酶水解产物的最高清除能力可达95%以上,IC50分别为0.58,0.56 mg·mL-1;中性蛋白酶和动物蛋白酶水解产物的最高清除能力在95%以下,IC50分别为1.04,1.28 mg·mL-1.酶解产物清除·OH的能力由大到小的蛋白酶为:木瓜蛋白酶>碱性蛋白酶>中性蛋白酶>动物蛋白酶A5.
经研究发现:含硫氨基酸(Cys,Met)、芳香族氨基酸(Trp,Tyr,Phe)、含咪唑基氨基酸(His)能有效清除羟基,但是单个氨基酸存在时无法发挥活性,只能通过肽链或与蛋白质的结合达到清除羟基的活性作用[12].由此推断碱性蛋白酶和木瓜蛋白酶水解章鱼下脚料水解产物的肽类能暴露更有益于清除·OH的肽键和氨基酸.
2.2.2Fe2+螯合能力检测抗氧化化合物在抑制或缓解氧化时,也可以通过螯合金属的方式.1894年,Fenton[13]发现Fe2+与H2O2反应可以产生·OH,证明Fe2+能置换出羟基,进而危害人类健康.所以实验中利用Fe2+,Fe3+和Ferrozine的显色机理,控制肽类的质量浓度减少Fe2+的生成率,对比吸光度和IC50即可判断螯合能力的高低.用OriginPro 8.0进行拟合分析,结果如图2所示.

图2 不同质量浓度肽类的Fe2+螯合能力Fig.2 Fe2+ chelating ability of different concentrations of peptides
碱性蛋白酶:y=90.11-46.22/[1+(x/0.61)6.54],R2=0.999 9,IC50=0.46 mg·mL-1;
中性蛋白酶:y=80.60-79.14/[1+(x/0.99)2.42],R2=0.999 4,IC50=1.20 mg·mL-1;
木瓜蛋白酶:y=59.21-55.11/[1+(x/1.25)2.13],R2=0.999 9,IC50=2.66 mg·mL-1;
动物蛋白酶A5:y=62.81-63.38/[1+(x/1.62)2.48],R2=0.999 2,IC50=2.82 mg·mL-1.
由图2可知:4种蛋白酶水解产物的R2均在0.999以上,有的甚至达到0.999 9,拟合度高.碱性蛋白酶的IC50为0.46 mg·mL-1是4种蛋白酶水解产物中最小的,说明其水解产物中多肽能十分有效快速地螯合Fe2+;另外与·OH清除率相比,中性比木瓜蛋白酶水解产物更有效地螯合Fe2+,但中性比木瓜蛋白酶水解产物的螯合能力大20%,IC50分别为1.22 mg·mL-1和2.66 mg·mL-1;在动物蛋白酶中,随着肽类质量浓度增加,螯合率变化平缓,IC50为2.82 mg·mL-1.
对金属螯合能力起到有效作用的多肽一般含有酸性或者碱性的氨基酸侧链.Chen等[14]发现多肽的疏水性与螯合能力基本没有关系,而与含有His的多肽链有关.判断碱性蛋白酶在水解章鱼下脚料后的水解产物中肽类能暴露出更多有益于螯合Fe2+的片段.
2.2.3还原能力检测还原能力的检测是判断酶解产物中的肽类是否具有将已被氧化的物质还原的能力,还原力越强即自身抗氧化活性越好.肽类将Fe3+(铁氰化钾)还原成Fe2+(亚铁氰化钾),Fe2+与FeCl3反应生成普鲁士蓝(Fe4[Fe(CN)6]3),在700 nm下有最大吸收值,对比吸光度即可判断还原力的高低.用OriginPro 8.0进行拟合分析,得到结果如图3所示.图3中:D表示吸光度.

图3 不同质量浓度多肽的吸光度Fig.3 Absorbance of differentconcentrations of peptides
碱性蛋白酶:y=1 499.78-1 499.62/[1+(x/
150.7)1.84],R2=0.992 1;
中性蛋白酶:y=0.99-0.84/[1+(x/2.11)1.83],R2=0.988 3;
木瓜蛋白酶:y=158.71-158.82/[1+(x/
11 275.79)0.6],R2=0.992 1;
动物蛋白酶A5:y=8.08-8.02/[1+(x/41.49)0.86],R2=0.994 1.
由图3可知:4种蛋白酶水解产物中粗酶液在还原能力检测上R2接近0.99,拟合度较好;碱性蛋白酶水解产物中肽类随着质量浓度的增加,还原能力大大增大,而其他3种蛋白酶水解产物中的肽类随着质量浓度的增加呈直线上升水平.试验是通过吸光度判断肽类的还原能力,而IC50的原理是计算清除率50%的蛋白质质量浓度,所以这里不用IC50、仅对比吸光度判断肽类的还原能力.对比其他文献,发现这4种蛋白酶水解章鱼下脚料的时间较短,但还原力较高[15-16],可以作为很好的还原剂加以利用.
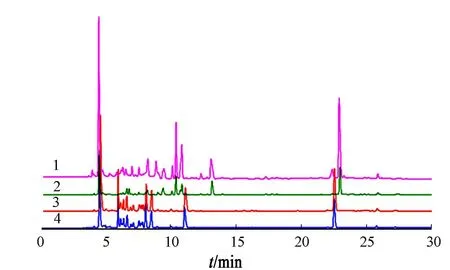
图4 4种粗肽液的反相高效液相色谱Fig.4 RP-HPLC of four crude peptide liquids
2.3多肽的验证
对粗肽液进行反相高效液相色谱分析,判断多肽的可纯化程度结果,如图4所示.图4中:1为碱性蛋白酶;2为动物蛋白酶;3为中性蛋白酶;4为木瓜蛋白酶.
由图4可知:Bio-C18柱可以有效地分离多肽混合液.4种蛋白质水解液在相同质量浓度下进行分离纯化的,所以对比发现碱性蛋白酶水解液中多肽的种类和质量浓度较多,而动物蛋白酶的较少.由此推断动物蛋白酶可以将章鱼下脚料中的蛋白质大部分水解成氨基酸,而碱性蛋白酶、中性蛋白酶和木瓜蛋白酶可以获取具有抗氧化活性较高的多肽,其中,碱性蛋白酶的抗氧化效果最好.另外,通过反相高效液相色谱和Bio-C18柱的结合,可以一次性有效得分离纯化水解液中的小分子肽,相对于其他献中需要结合凝胶色谱、离子交换色谱等方法,更加简便快捷.
3结束语
通过4种常见商业蛋白酶对章鱼下脚料中蛋白质的初步水解实验发现,动物蛋白酶A5水解后获取的复合氨基酸质量分数最多,有着蛋白酶用量少、酶解时间较短的优点,可以作为工厂大规模加工获取复合氨基酸的参考及选择.另外,4种蛋白酶水解章鱼下脚料后获取的粗肽液均有不同程度的抗氧化能力,可以作为提取天然抗氧化的基础,但还需进一步纯化分析才能获取活性更好的化合物.
参考文献:
[1]COLIN B.Marine nutraceuticals and functional foods[M].America:CRC Press Inc,2007:8-13.
[2]WU Guoyao.Amino acids: Metabolism, functions and nutrition[J].Amino Acids,2009,37(1):1-17.
[3]YIN Huaixia,PU Jianing,WAN Yuting,et al.Rheological and functional properties of catfish skin protein hydrolysates[J].Journal of Food Science,2010,75(1):11-17.
[4]NEKLYUDOV A D,IVANKIN A N,BERDUTINA A V.Properties and uses of protein hydrolysates (review) [J].Applied Biochemistry and Microbiology,2000,36(5):452-459.
[5]RAGHAVAN S,KRISTINSSON H G.ACE-inhibitory activity of tilapia protein hydrolysates[J].Food Chemistry,2009,117(4):582-588.
[6]ANUSHA G P,EUNICE C Y.Autolysis-assisted production of fish protein hydrolysates with antioxidant properties from pacific hake (merluccius productus)[J].Food Chemistry,2008,107(2):768-776.
[7]SHANIDI F,ZHONG Y.Bioactive peptides[J].Journal of Aoac International,2008,91(4):914-931.
[8]CUI Jian,CHONG B,RUTHERFURD S M,et al.Gross and true ileal digestible amino acid contents of several animal body proteins and their hydrolysates[J].Meat Science,2013,94(3):349-354.
[9]KECHAOU E S,DUMAY J,CLAIRE D M,et al.Enzymatic hydrolysis of cuttlefish (sepia officinalis) and sardine (sardina pilchardus) viscera using commercial proteases: Effects on lipid distribution and amino acid composition[J].Journal of Bioscience and Bioengineering,2009,107(2):158-164.
[10]陈洁,胡晓赟.蛋白水解物的抗氧化性研究与展望[J].中国食品学报,2011,11(9):111-119.
[11]张昊,任发政.天然抗氧化肽的研究进展[J].食品科学,2008,29(4):443-447.
[12]CHAN K M.Endogenous skeletal muscle antioxidants[J].Food Science Nutritrion,1994,34(4):403-426.
[13]FENTON H J H.LXXIII-Oxidation of tartaric acid in presence of iron[J].Journal of Chemical Society,1894,65:899-910.
[14]CHEN H M,MURAMOTO K,YAMAUCHI F,et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,1998,46(1):49-53.
[15]厉望,靳挺,武玉学.带鱼蛋白酶解条件优化及酶解物抗氧化性能[J].食品科学,2013,34(9):234-239.
[16]余杰,杨振国,钟炼,等.酶法制备牡蛎抗氧化肽研究[J].中国海洋药物杂志,2012,31(3):31-36.
(责任编辑: 陈志贤英文审校: 刘源岗)
Product Analysis of Protein Hydrolysate From Octopus Leftovers
HUANG Huili1,2, ZHANG Shuang1, ZHANG Yurong3,ZHANG Luying3, WANG Kaiming3
(1. College of Chemical Engineering, Huaqiao University, Xiamen 361021, China;2. Environment and Resource Institute, Huaqiao University, Xiamen 361021, China;3. Xiamen East China Sea Aquatic Products Import and Export Company Limited, Xiamen 361012, China)
Abstract:In order to improve the comprehensive utilization of leftovers, four kinds of proteases were used to hydrolyze the octopus leftovers, and the amino acids and antioxidant peptides from the hydrolysate were preliminarily analyzed. The results show that the compound amino acid content from the animal protease hydrolysate could reach up to 57.12%. The ·OH scavenging ability IC50 of four kinds of hydrolysates were all less than 1.28 mg·mL-1, and the Fe2+chelating ability IC50 were all less than 2.82 mg·mL-1. The reduction increased with the peptide concentration increasing. It indicates that the process conditions and method can obtain two kinds of active substances (amino acid and antioxidant peptide), which provides experimental basis for the maximum utilization of the octopus leftovers.
Keywords:octopus; leftovers; enzymatic hydrolysis; compound amino acid; antioxidant peptide
中图分类号:TS 254.9
文献标志码:A
基金项目:福建省厦门市农业科技重点项目(2013N0022)
通信作者:黄惠莉(1962-),女,教授,主要从事海洋资源开发与利用的研究.E-mail:hlhuang@hqu.edu.cn
收稿日期:2015-05-03
doi:10.11830/ISSN.1000-5013.2016.03.0330
文章编号:1000-5013(2016)03-0330-06
——以S公司的端材、铜屑管理为例

