海金沙草对鸡胚血管新生的抑制作用
袁俏冰,何晓东,何伟,亓翠玲,王丽京
(广东药科大学 血管生物学研究所,广东 广州 510006)
海金沙草对鸡胚血管新生的抑制作用
袁俏冰,何晓东,何伟,亓翠玲,王丽京
(广东药科大学 血管生物学研究所,广东 广州 510006)
摘要:目的 研究从海金沙草中分离的各类成分对鸡胚血管新生的抑制作用,筛选出抑制效果最佳的有效成分。方法 系统提取海金沙草的各类组分,利用鸡胚绒毛尿囊膜(CAM)和鸡胚卵黄囊膜(YSM)模型,观察海金沙各类组分对鸡胚血管新生的作用。结果 海金沙正丁醇组及正丁醇黄酮组处理过的CAM和YSM血管新生密度和迁移面积明显低于其他组分和对照组,差异有统计学意义。结论 海金沙正丁醇组及正丁醇黄酮组对鸡胚血管新生有明显抑制作用。
关键词:海金沙提取物;龄前鸡胚绒毛尿囊膜; 鸡胚卵黄囊膜; 血管新生
海金沙草(Lygodiumjaponicum)系海金沙科(Lygodiaceae)海金沙属(Lygodium)多年生蕨类植物海金沙的地上部分,又称迷离网、鸡胶莽、洗碗藤、金砂蕨等[1],主产于广东、广西、江苏、陕西及甘肃等地。全草或者干燥成熟孢子入药,有清热解毒、利湿利胆消肿的功效。海金沙的主要化学成分包括黄酮类、酚酸类及萜类和脂肪酸类等,研究表明这些成分具有很好的抗菌、抗病毒活性,临床广泛用于治疗尿路感染、尿路结石、湿热肿满、泌尿系统感染等症[2-3]。但到目前为止未见国内外有关其抗血管生成作用的报道。鸡胚绒毛尿囊膜(chicken chorioallantoicmembrane,CAM) 和鸡胚卵黄囊膜(yolk sac membrane,YSM )测定法是研究血管新生的经典的体内测定法[4]。目前这两种模型的应用已成熟,并广泛用于血管新生和抗肿瘤血管形成的研究中[5-7]。本课题采用经典的CAM和YSM模型,观察海金沙系统分离的各类组分对血管新生的抑制作用,筛选出效果最佳的组分,为进一步扩展该药的临床应用提供实验依据。
1材料
1.1主要材料与仪器
海金沙全草(采自广西南宁,经广东药学院何伟教授鉴定,是海金沙科海金沙属海金沙的地上部分);二甲基亚砜(DMSO,上海生工生物有限公司);沙利度胺(常州制药厂有限公司);0 d种蛋购于华南增城种鸡厂;0.22 μm微孔滤膜(密理博公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);CKX41体式荧光显微镜及照相系统(奥林巴斯);BSC-250恒温恒湿培养箱(上海博讯实业有限公司医疗设备厂);Airtech 超净工作台(苏净集团安泰公司)。
1.2海金沙各组分的分离提取
根据海金沙中各有效成分的性质不同,采用系统分离方法进行分离提取[8]。称取海金沙草120 g,70%(φ)乙醇回流提取2次,每次1.5 h,合并提取液,减压(-0.1 mPa,45 ℃)回收乙醇,滤液以水定容至1 000 mL作为样品溶液。
取400 mL样品溶液,减压(-0.1 mPa,35 ℃)浓缩至100 mL,以石油醚(60~90 ℃)提取(1 00 mL×3次),合并减压回收石油醚(-0.1 mPa,45 ℃)至10 mL(含48 g生药),作为石油醚提取物样品溶液。
石油醚提取后的水层挥至无石油醚味,以乙酸乙酯提取(100 mL×3次)提取,合并减压回收乙酸乙酯(-0.1 mPa,35 ℃)至20 mL,作为乙酸乙酯提取物样品溶液。
乙酸乙酯提取后的水层挥至无乙酸乙酯味,以水饱和正丁醇提取(100 mL×3次),合并减压回收正丁醇(-0.1 mPa,45 ℃)至20 mL,作为正丁醇提取物样品溶液。
取正丁醇提取物过聚酰胺层析柱,以70%乙醇4 BV/h洗脱,收集洗脱液,至无色,减压浓缩,作为正丁醇黄酮提取物样品溶液。
余下水层水浴浓缩并定容至50 mL,作为水层样品溶液。
各提取物给药时先用DMSO溶解,再用生理盐水分别配成生药浓度为高剂量9.6 mg/mL、中剂量4.8 mg/mL、低剂量2.4 mg/mL,过0.22 μm微孔滤膜除菌,4 ℃保存备用。
2方法2.1鸡胚CAM模型
2.1.1种蛋处理将0 d 鸡胚表面清洁,1∶1 000 新洁尔灭液擦拭,拭干后将鸡胚气室向上,长轴与蛋托呈45度放入37.8 ℃普通培养箱中孵化,相对湿度60%,每天转蛋3 次。
2.1.2开窗孵育第8天,在照蛋器下标记气室,确定开窗位置,用75%酒精消毒后,用慢速牙科钻在气室标记处钻1个1 cm×1 cm大小的小孔,形成直径约为1 cm 的缺口,用眼科镊轻轻揭掉蛋膜暴露鸡胚绒毛尿囊膜。
2.1.3实验分组及加药开窗后将鸡胚随机分为石油醚组、乙酸乙酯组、正丁醇组、正丁醇黄酮组、水层和阳性对照组(沙利度胺)、阴性对照组(DMSO)各8只,浓度为9.6 mg/mL,加药50 μL/只。将药物从开口处小心加到尿囊膜上,医用胶布封口,放入37.8 ℃、50%~60%湿度的恒温箱中孵育48 h。
2.1.4判断标准鸡胚剪开后立即观察以加药点为中心辐射区的血管生长情况,观察有无血管向心生长情况,若有则表示没有抑制作用,评为“-”。若无向心生长,出现加药口及附近四级微血管变细变少,评为“+”。若出现加药口及附近3、4级血管明显变少,苍白,血管长势扭曲,则评为“++”。若加药口及附近1级或2级大血管出现比较明显变细变少,或出现无血管区域,则评为“+++”。根据评级情况来说明抑制血管新生能力的强弱。
2.2鸡胚YSM模型
2.2.1种蛋处理将种蛋表面清洁,处理孵育条件方法同上。
2.2.2实验分组及加药取孵化2.5 d 的鸡胚,将鸡胚内容物倾倒入无菌平皿中,将红色和黑色记号笔标记的2个同样大小的硅胶环放置到鸡胚卵黄囊血管网较少的两侧位置,盖好平皿盖(不需封闭),放入37~38 ℃孵育箱中继续孵育。3~4 h后,挑选硅胶环未见移位,卵黄囊膜完整,血管网及胚盘发育良好的鸡胚,黑色标记的胶圈加入30 μL的正丁醇组9.6 mg/mL、正丁醇黄酮组9.6 mg/mL,红色标记的硅胶环加入等量DMSO对照,继续孵育。
2.3不同浓度的海金沙正丁醇黄酮对鸡胚YSM血管生成的影响
种蛋处理方法同“2.2”。 黑色标记的胶圈加入30 μL的各剂量正丁醇黄酮药液(分别是高剂量9.6 mg/mL、中剂量4.8 mg/mL、低剂量2.4 mg/mL),红色标记的硅胶环加入等量DMSO对照,继续孵育。
2.4统计学处理
加药后0 h、12 h、24 h分别在体式显微镜下拍照,采集药物组和空白对照组硅胶圈内的血管面积,采用Image-Pro Plus 6.0 图像分析系统分析整个硅胶圈内的血管,以血管面积和血管密度的变化作为分析指标,计算两组加药12 h和24 h后胶圈内血管面积增长率,增长率= (加药24 h后胶圈内血管面积-加药0 h后胶圈内血管面积)/加药0 h后胶圈内血管面积。
3结果
3.1海金沙系统提取的各组分对CAM血管生成的影响
图1A结果显示,阴性对照组,CAM血管丰富,纹理清晰。阳性对照组,CAM上的血管新生明显受到了抑制。加入海金沙各组分后,CAM血管新生均受到了不同程度的抑制,血管稀疏,其中正丁醇黄酮组尤为明显。
用(Image-Pro Plus,IPP)软件统计分析表明阳性药物显著抑制了血管新生,海金沙草各组分中,乙酸乙酯、正丁醇和正丁醇黄酮组的血管密度明显较阴性对照组低,且正丁醇和正丁醇黄酮对CAM血管的抑制作用较乙酸乙酯明显。石油醚组对CAM血管形成没有明显的抑制作用(图1B)。
3.2海金沙正丁醇及正丁醇黄酮组对YSM血管生成的影响
12 h和24 h,正丁醇黄酮组和正丁醇组血管的迁移面积均小于阴性对照组(图2A)。表示正丁醇黄酮组和正丁醇组的提取物能够抑制YSM血管的生成,差异有统计学意义(P<0.01)(图2B)。
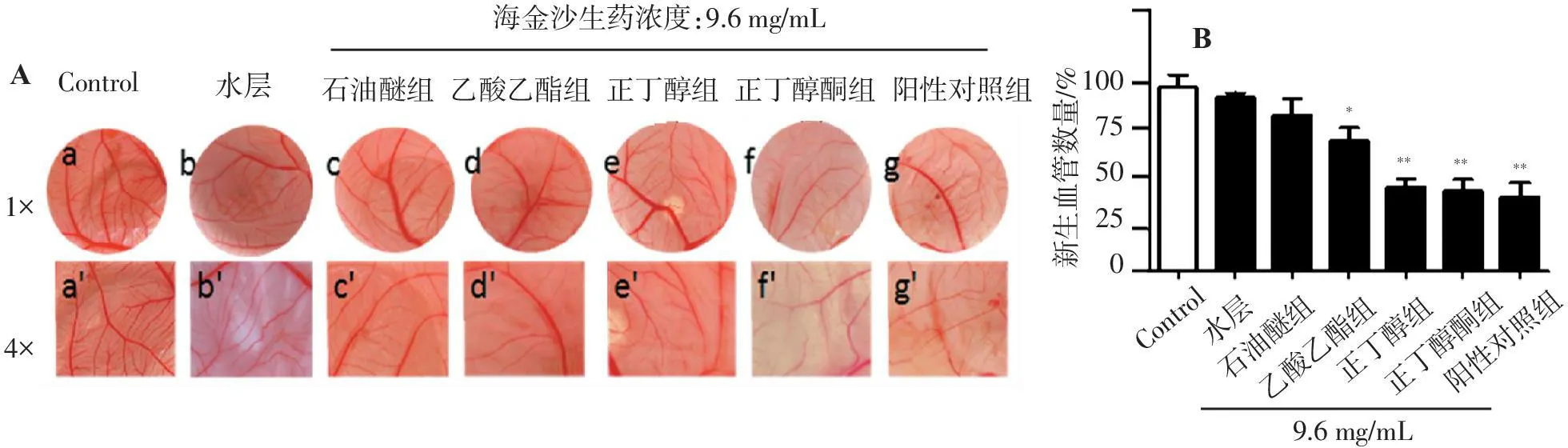
Control水层石油醚组乙酸乙酯组正丁醇组正丁醇酮组阳性对照组海金沙生药浓度:9.6mg/mL1?4?AB1007550250新生血管数量/%9.6mg/mLControl水层石油醚组乙酸乙酯组正丁醇组正丁醇酮组阳性对照组*******
A.海金沙各组分对鸡胚绒毛尿囊膜血管生成的影响; B.不同组别的鸡胚绒毛尿囊膜血管数量情况。与阴性对照组比较:*P<0.05,**P<0.01。
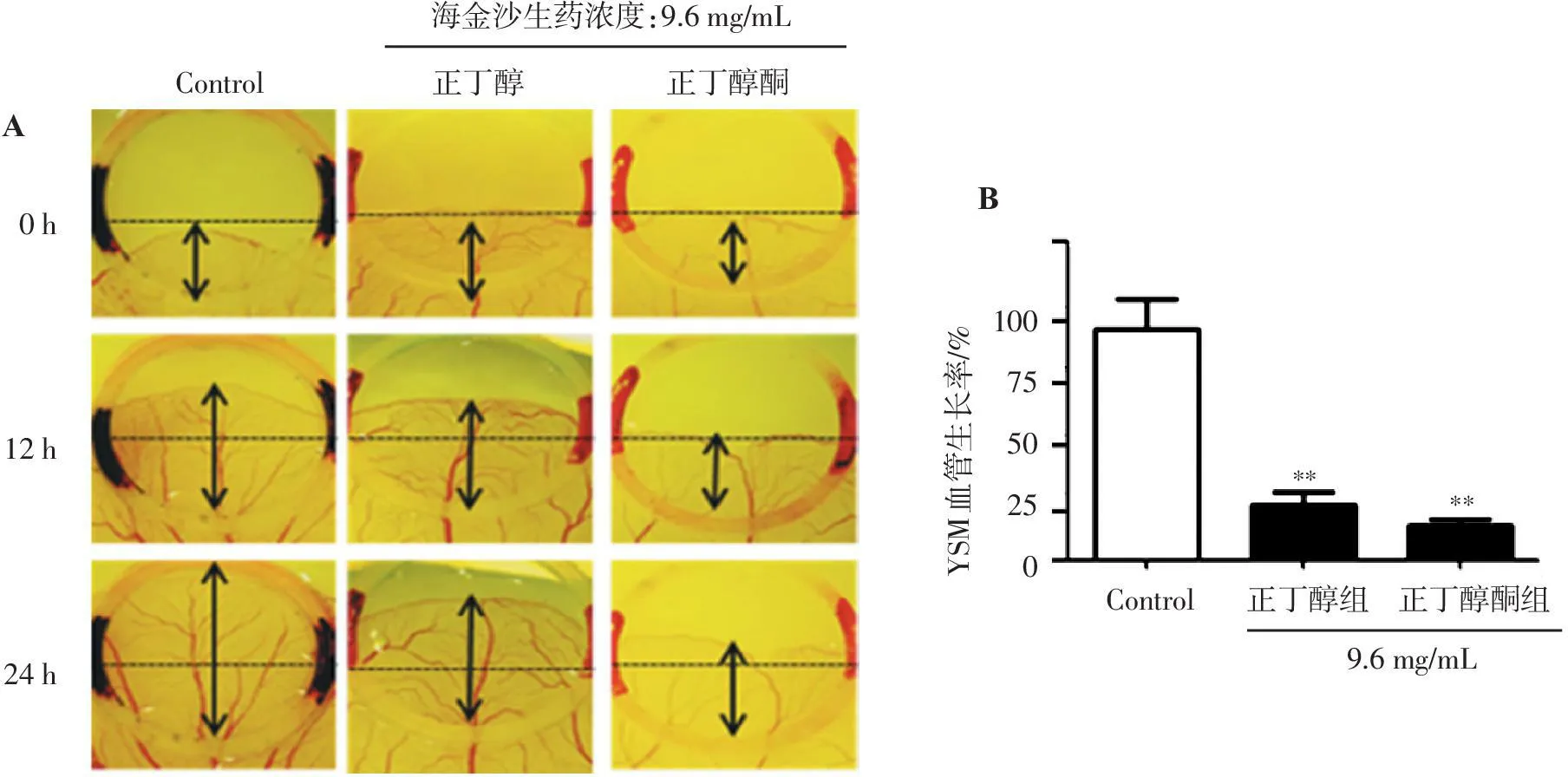
图1 海金沙系统提取的各组分对鸡胚绒毛尿囊膜血管生成的影响
A.海金沙正丁醇及正丁醇黄酮组对鸡胚YSM的影响; B.对YSM新生血管迁移面积的统计。与阴性对照组比较:**P<0.01。
图2海金沙正丁醇及正丁醇黄酮组对YSM血管生成的影响
Figure 2Effect of the n-butanol and n-butanol flavone groups on the angiogenesis of YSM
3.3海金沙正丁醇黄酮组不同浓度对YSM血管生成的影响
结果显示,海金沙正丁醇黄酮组高、中浓度鸡胚血管迁移的面积均明显小于对照组(图3A),应用统计软件IPP结果显示正丁醇黄酮组高、中浓度能够抑制YSM血管的生成,差异有统计学意义(图3B)。
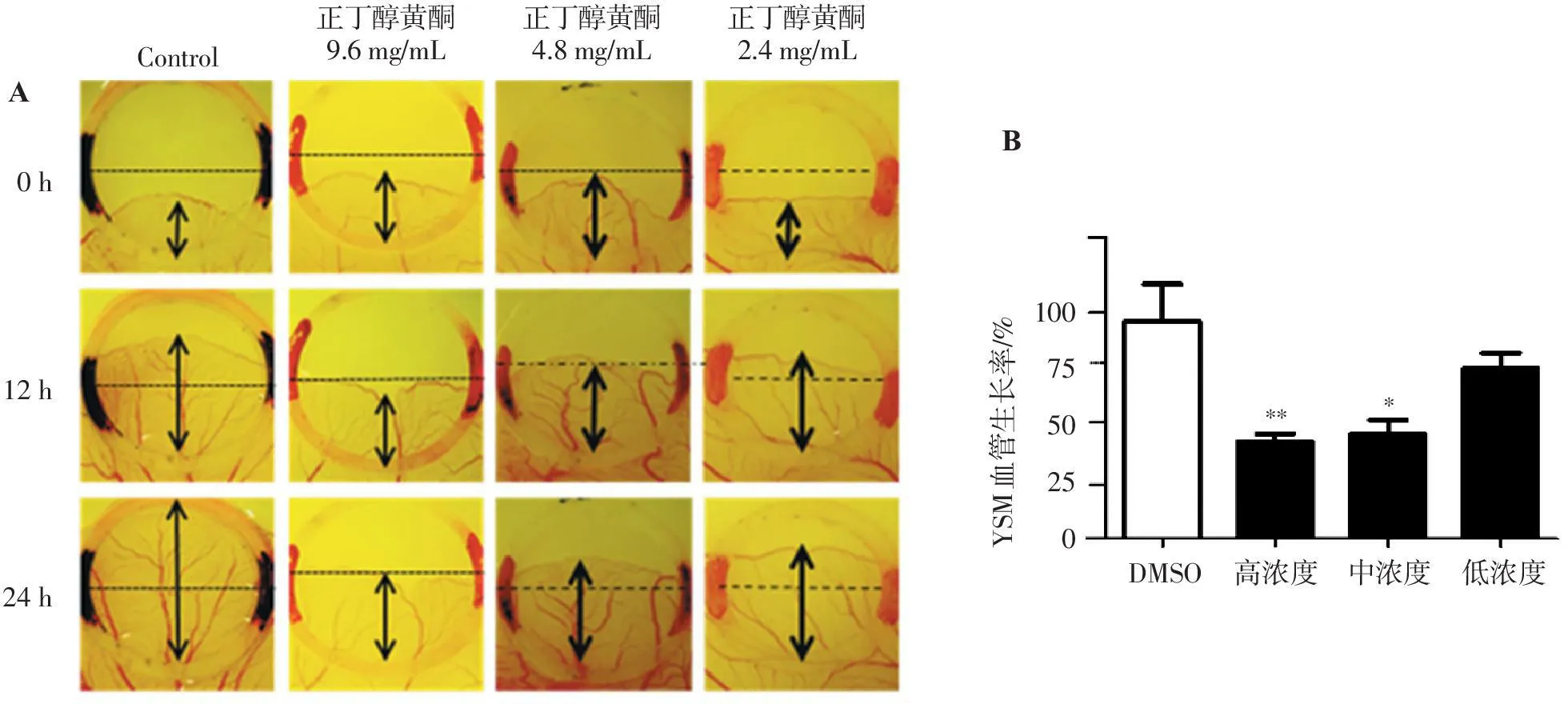
0h12h14hAControl正丁醇黄酮9.6mg/mL正丁醇黄酮4.8mg/mL正丁醇黄酮2.4mg/mLYSM血管生长率/%1007550250DMSO高浓度中浓度低浓度B***
A.海金沙正丁醇黄酮组各剂量对YSM血管的迁移; B.海金沙正丁醇黄酮各剂量对鸡胚YSM血管迁移面积的统计。
与DMSO比较:*P<0.05,**P<0.01。
图3海金沙正丁醇黄酮组不同浓度对YSM血管生成的影响
Figure 3Effect of n-butanol flavone at different concentrations on the angiogenesis of YSM
4讨论
血管新生是肿瘤生长的必要条件,肿瘤血管新生对肿瘤的发生、浸润、转移、复发和预后都有着举足轻重的作用,直径超过1~2 mm的实体瘤的生长需要新生血管的介入和支持[9]。如果没有血管新生,原发肿瘤体积不会超过1~2 mm3(大约105~106个肿瘤细胞)[10]。研究表明,对肿瘤组织中已经存在的血管或正在生成血管的肿瘤进行干预,阻断诱导血管生成的通路,能够有效地抑制肿瘤增殖和生长,使其处于休眠状态[11]。自1971年folkman首次提出肿瘤的生长和转移具有血管依赖性之后,如何抑制血管生成、破坏肿瘤血管已经成为肿瘤防治研究的热点和突破口[12]。近10多年来,以肿瘤血管生成抑制作为靶点,开发肿瘤血管生成抑制剂,成为肿瘤防治研究中的热点之一[13]。全世界都在寻找新的靶向抑制肿瘤血管新生且不良反应少的血管新生抑制剂。
本研究根据海金沙中各类成分性质的差异,采用系统分离提取法。考虑到正丁醇的溶解能力比较广,能溶解极性和非极性物质,同时海金沙正丁醇层的化学成分中黄酮类物质含量较大[14],故把正丁醇层黄酮分离出来另设一组,为后面更深入研究海金沙总黄酮打下基础。
研究表明,在一定浓度和给药剂量下,乙酸乙酯、正丁醇和正丁醇黄酮组均能够抑制CAM新生血管的生长,其中正丁醇和正丁醇黄酮组效果更为明显,能够显著抑制YSM血管的迁移。通过对海金沙正丁醇黄酮组的高、中、低浓度进行鸡胚YSM实验[15],结果表明海金沙正丁醇黄酮高、中浓度能够显著抑制YSM血管的迁移。
本研究采用经典的鸡胚CAM和YSM模型发现海金沙中的黄酮类成分对鸡胚血管新生具有抑制作用。下一步将利用高效液相色谱、气相色谱等方法将正丁醇黄酮组中的化学成分进一步分离,在此基础上,将利用鸡胚肿瘤模型及肿瘤动物模型,研究各分离成分对肿瘤血管的作用,为临床治疗肿瘤提供有效的新途径。
参考文献:
[1] 国家中医药管理局中华本草编委会.中华本草:第一卷[M].上海:上海科技出版社,1999:443.
[2] 楼英.海金沙治疗带状疱症5例分析[J].浙江临床医学,2002,4(4):265.
[3] 江苏新医学院.中药大辞典.上册[M].上海:上海人民出版社,1978:1259.
[4] 陈丽娟.海金沙正丁醇层化学成分研究[D].沈阳:沈阳药科大学,2009.
[5] 王会萍,李卫东,王丽京.血管形成的测定方法[J]. 广东药学院学报,2009,25(4):331-334.
[6] QI Cuiling,ZHOU Qin,WANG Lijing,et al. Glipizide,an antidiabetic drug,suppresses tumor growth and metastasis by inhibiting angiogenesis[J]. Oncotarget,2014,5(20):9966-9979.
[7] HE Y Q,LI Y,WANG J,et al. Dimethyl phenyl piperazine iodide (DMPP) induces glioma regression by inhibiting angiogenesis[J]. Exp Cell Res,2013,320(2):354-364.
[8] 王德江,覃瑶.右归饮新方系统分离及成分的初步分析[J].重庆中草药研究,2014,12(2):1-16.
[9] 郑敏.数字图像分析技术在鸡胚卵黄囊膜血管形成模型中的应用[J].解剖学研究,2009,31(1):47-50.
[10] SO J,WANG F Q,NAVARI J,et al. LPA-induced epithelial ovarian cancer(EOC) in vitro invasion and migration are mediated by VEGF receptor-2(VEGF-R2) [J]. Gynecol Oncol,2005,97(3):870-878.
[11] KERBEL R S. Tumor angiogenesis past present and the near future[J]. Carcinogenesis,2000,21(3):505-515.
[12] SHI W,TESCHENDFF C,MUZYCZKA N,et al. Adeno-associated virus-mediated gene transfer of endostatin inhibits angiofenesis and tumor growthinvivo[J]. Cancer Gene Ther,2002,9(6):513-521.
[13] 徐霞飞,陆茵.中药抗肿瘤血管生成研究进展[J].现代中药研究与实践, 2007,21(1):61- 64.
[14] HARRIS A L. Angio genesis as anew target for cancer control[J].EJC Supplements,2003,1(2):1-12.
[15] ZHOU Qin,QI Cuiling,WANG Lijing,et al.A novel four-step system for screening angiogenesis inhibitors[J]. Mol Med Rep,2013,8(6):1734-1740.
(责任编辑:幸建华)
Inhibition ofLygodiumextracts on the angiogenesis of chick embryo
YUAN Qiaobing,He Xiaodong,HE Wei,QI Cuiling,WANG Lijing
(InstituteofVascularBiologyResearch,GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
Abstract:Objective To investigate the inhibitory effect of various extracts isolated from Lygodium′ on the angiogenesis of chick embryo,and screen the best extract. Methods The chicken chorioallantoic membrane (CAM) and yolk sac membrane (YSM) were treated with different Lygodium′ extracts. The angiogenesis of chick embryo was observed. Results The n-butanol and n-butanol flavone groups obviously suppressed the angiogenesis of CAM and YSM. Conclusion The n-butanol and n-butanol flavone groups of Lygodium′ exhibit a significant inhibitory effect on the angiogenesis of chick embryo.
Key words:Lygodium′ extract; chicken chorioallantoic membrane; yolk sac membrane; angiogenesis
DOI:10.16809/j.cnki.1006-8783.2015120401
中图分类号:R282.74
文献标志码:A
文章编号:1006-8783(2016)02-0248-05
作者简介:袁俏冰(1987—),女,在职研究生,主要从事中药药效学研究,Email:yuanqiaobing123456@163.com;通信作者:王丽京,女,教授,主要从事肿瘤分子病理学研究,Email:wanglijing62@163.com。
基金项目:国家自然科学基金项目(31271455); 广东省医学科研基金项目(B2014207)
收稿日期:2015-12-04
网络出版时间:2016-03-29 10:19网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160329.1019.003.html

