MicroRNAs表达与药物代谢酶CYP2C19活性相关性研究
唐千捷,钟诗龙,林浩铭,李夏寅,何国东,韩雅玲,王来友
(1.广东药科大学 药科学院,广东 广州 510006; 2.广东省人民医院广东省医学科学院 医学研究部,广东 广州 510080; 3.孙逸仙纪念医院 肝胆外科,广东 广州 510120; 4.沈阳军区总医院 心血管内科,辽宁 沈阳 110000)
MicroRNAs表达与药物代谢酶CYP2C19活性相关性研究
唐千捷1,钟诗龙2,林浩铭3,李夏寅2,何国东2,韩雅玲4,王来友1
(1.广东药科大学 药科学院,广东 广州 510006; 2.广东省人民医院广东省医学科学院 医学研究部,广东 广州 510080; 3.孙逸仙纪念医院 肝胆外科,广东 广州 510120; 4.沈阳军区总医院 心血管内科,辽宁 沈阳 110000)
摘要:目的 探讨肝组织MicroRNAs (miRNA)与CYP2C19代谢酶活性的相关性。方法 通过基于LC/MS/MS的“Cocktail”探针药物法检测人肝S9中CYP2C19等4种代谢酶活性;运用生物信息学预测软件选择5个作用于CYP2C19 mRNA的miRNA以及1个作用于CYP3A4 mRNA的miRNA作为阴性对照,并用qRT-PCR方法检测其在肝组织中的表达水平,分析miRNA表达量与酶活性的关系。结果 在6个miRNAs中,miR-130a(r=-0.476 2,P<0.05)和miR-142(r=-0.400 8,P<0.05)在肝脏中的表达水平与CYP2C19酶活性显著负相关。结论 miRNA的表达水平可能是影响人群中CYP2C19酶活性变化差异的重要因素之一。
关键词:miRNA; CYP2C19; “Cocktail”探针药物法; LC/MS/MS
细胞色素P4502C19(CYP2C19)是肝脏中P450多功能氧化酶系统的重要成员。CYP2C19参与了10%~15%临床药物的代谢过程[1-2],包括质子泵抑制剂奥美拉唑,抗抑郁药如氟西汀、丙咪嗪,抗癫痫药物如安定、丙戊酸,以及抗血小板药物氯吡格雷和抗疟药利福平等[3]。对人体而言,CYP2C19蛋白由CYP2C19基因编码[4]。大量的研究表明,遗传变异、内源性因素和环境因素影响了CYP2C19的表达和作用功能:在427例人群研究中发现,CYP2C19基因遗传变异引起的CYP2C19 mRNA表达及其蛋白活性变化存在800倍的差异[5]。到目前为止,已发现CYP2C19*1~CYP2C19*35突变等位基因,致使CYP2C19酶的功能降低甚至缺失[6-7]。CYP2C19基因遗传变异不仅调控CYP2C19酶活性,而且也影响它的抑制和诱导,为临床精准用药带来了很大困难。
然而,当前的基因多态性等遗传变异研究还不能充分解释CYP2C19酶活性的多态性变化,表观遗传学MicroRNA(miRNA)转录后调控提供了研究者们新的关注视角。近年来研究发现,miRNA能够直接或间接地影响编码CYP450酶相关基因的表达,从而调控酶活性[9]。Pan等[10]研究证明miR-27b能直接作用于CYP3A4 mRNA 3′-UTR来调节CYP3A4代谢酶的活性。目前关于miRNA对CYP2C19活性影响的研究尚少,仅有Yu等[12]报道的miR-29b能够调控CYP2C19 mRNA在肝细胞株和肝组织的表达。
除了已报道的miRNA外,还可能存在其他miRNA能够对CYP2C19酶活性产生影响。本研究通过运用课题组已研究过的“Cocktail”探针药物法检测获得肝S9中CYP2C19活性,从生物信息学角度,在人体肝脏水平探讨miRNA是否可以影响CYP2C19酶活性变化。
1仪器与试药
1.1仪器
LC-20高效液相色谱仪(日本岛津公司);API 4000 Qtrap三重串联四极杆质谱仪、电喷雾电离源ESI(美国AB Sciex公司);Analyst 1.4.2 数据处理系统(美国AB Sciex公司);C18XB分析柱(3 μm,150×2.1 mm,大连依利特);Beckman GS-6R离心机、Beckman-Coulter AllegraTM64R冷冻高速离心机(美国Beckman 公司);BP110S型电子分析天平(德国Sartorius公司);Mili Q-plus 超纯水净化系统(美国Billerica公司);NanoDrop2000分光光度计(美国Thermo公司);MJ Research PTC-200 PCR仪(美国MJ Research公司);Bio-Rad CFX Connect荧光定量PCR仪(美国Bio-Rad公司)。
1.2主要试剂
标准品试剂:奥美拉唑、5-羟基奥美拉唑、氯唑沙宗、6-羟基氯唑沙宗、甲苯磺丁脲、4-羟基甲苯磺丁脲、α-羟基咪达唑仑、格列齐特标准品(均为99%)购自美国Sigma公司;咪达唑仑标准品(98%)购自江苏恩华药业;甲醇、乙腈为色谱纯,购自德国默克公司;水为超纯水;乙酸乙酯及其他化学试剂为国产分析纯。
miRNA提取定量试剂:GENMED组织清洗液及匀浆液购自美国Genmed公司;Trizol Reagent购自美国Life公司;RNase Free Water和RNAlater储存液购自德国Qiagen公司;逆转录PrimeScriptRTKit购自日本Takara公司;iTaq Universl SYBR Green supermix购自美国Bio-Rad公司;Bulge-LoopTMmiRNA引物购自广州锐博公司。
2方法
2.1肝组织样本收集
收集2012年9月至2015年5月中山大学孙逸仙纪念医院25例肝脏标本(其中包括13例肝癌标本),男性为18例,所有肝组织患者年龄范围为32~70岁,并考察性别、年龄、苯巴比妥用药、肝癌和乙肝疾病对结果的影响。样本搜集严格遵循医学伦理原则,获医院伦理委员会批准,均获得患者家属知情同意。在外科手术中取患者的部分肝组织,放入预装1.5 mL RNAlater储存液的离心管中,并于-80 ℃冰箱长期保存。另外剩余肝组织剪碎后用GENMED清理液A清洗3~4次,装入冻存管中置于液氮罐中备用。
2.2制备肝S9方法
从液氮罐中取出冻存的肝组织,迅速称质量,移入研钵中,倒入液氮研磨成粉末,移至预冷的玻璃匀浆器中,按1∶4(W∶V)加入GENMED匀浆液B,在冰上抽提匀浆,将液体转移至离心管中,9 000 g、4 ℃离心20 min,取上清液,在冰上分装至预冷的冻存管中,置液氮罐中保存。运用Braford法对肝S9蛋白含量进行检测。
2.3酶活性检测孵育体系及样品前处理(“Cocktail”探针药物法)
取人肝S9组分适量(1 mg/mL),0.4 mol/L MgCl22 μL,1.65 mol/L KCl 2 μL,250 mg/mL 6-磷酸葡萄糖单钠盐(G-6-PNa)1.2 μL,100 mg/mL NADP 6 μL,100 U/mL 6-磷酸葡萄糖脱氢酶(G-6-PDH)2 μL,磷酸盐缓冲液(pH=7.4)100 μL,混合探针底物适量(氯唑沙宗/奥美拉唑/甲苯磺丁脲/咪达唑仑终质量浓度均为50 ng/mL),去离子水补足至200 μL。
孵育一定时间后加入1 000 μL乙酸乙酯终止反应,再加入200 ng/mL格列齐特内标工作液10 μL,漩涡震荡3 min,静置10 min,在4 ℃下12 000 r/min离心10 min,吸取上层有机相至另一离心管中,在真空干燥器中挥干。残渣用50%甲醇(V∶V)100μL复溶,涡旋1min,在4 ℃下12 000r/min离心5min,取上清加入96孔板,进样3μL。本实验对专属性、准确度、精密度、回收率、稳定性和基质效应进行了考察。
2.4色谱和质谱条件
色谱条件:正离子和负离子流动相均为乙腈∶水(含0.1%甲酸)(80∶20,V∶V),流速为0.25 mL/min,柱温为20 ℃。分析时间均为5 min。质谱条件:离子源为电喷雾电离源(ESI+或ESI-);电喷雾电压正离子模式为5 500 V,负离子模式为4 500 V;加热毛细管温度为450 ℃;鞘气(N2)压力为15 psi,辅助气(N2)压力为1 psi,碰撞气(N2)压力为1.0 mTorr;扫描峰宽为0.7 Th;扫描时间为200 ms,扫描方式为多反应检测扫描(MRM)。
2.5miRNA的预测和选择
运用TargetScan、miRanda、miRBase和RNA22计算机软件库预测到了具有潜在的靶向作用于CYP2C19的miRNA,并选择hsa-miR-130a-3p、hsa-miR-142-5p、hsa-miR-206、hsa-371b-5p、hsa-miR-491-3p这5个miRNA作进一步研究,同时选择了靶向作用于CYP3A4 mRNA的miR-27b作为阴性对照。
2.6组织miRNA提取及定量方法
从RNAlater中取出1/3绿豆大小肝组织并经液氮研磨后,用Trizol-氯仿法(5∶1)萃取上清,并加入等体积异丙醇,离心后用75%(φ)乙醇漂洗2次,晾干EP管,并用25 μL RNase free Water溶解即得。取2 μL RNA样品进行NanoDrop2000检测,记录浓度与A260/280。采用stem-loop qRT-PCR方法检测miRNA表达水平,以sh RNA U6为内参基因标准化不同组织样品量差异。逆转录体系按照Takara RR037试剂盒说明书,使用RNA 模版1 μg,于MJ Research PCR(PTC-200)仪上完成,程序为42 ℃ 60 min,79 ℃ 10 min,4 ℃保存。荧光定量PCR体系为10 μL,其中iTaq Universl SYBR Green supermix 5 μL,Forward/Reverse Prime(5 μmol/L)各1 μL,cDNA1 μL,RNase Free Water 2 μL。Bio-Rad PCR仪反应程序为95 ℃ 5 min,95 ℃ 10 s、60 ℃ 30 s 40个循环,以及溶解曲线。miRNA相对表达量=2-△Ct,△Ct=Ct目的基因-CtU6。
2.7统计分析
应用SPSS 21.0软件进行统计分析,Shapiro-Wilk normality test分析样本数据是否符合正态性分布,用多重线性回归分析临床基线资料与miR-130a、miR-142和CYP2C19活性的影响关系,运用Sperman correlation分析变量之间是否具有相关性,P<0.05为差异有统计学意义。
3结果
3.125例肝组织样本临床基线资料
表1显示了25例肝组织病例临床基线资料。多重线性回归分析结果说明,病例性别与年龄的变化与肝组织miR-130a、miR-142的表达水平没有相关性(P>0.05)。服用巴比妥类药物对实验结果没有显著影响(P>0.05)。另外,肝癌和乙肝疾病对实验结果也无直接影响(P>0.05)。
3.2液质联用检测酶活性结果
针对CYP2C19酶活性检测,以反应时间为横坐标,以探针底物奥美拉唑的代谢产物5-羟基奥美拉唑浓度为纵坐标,绘制反应曲线,见图1。奥美拉唑反应速度由快减慢,5-羟基奥美拉唑生成量在0~120 min呈线性平稳上升,之后反应速率趋于稳定。25例肝组织样品间CYP2C19酶活性从0.46~16.2(nmol·min-1·mg-1)变化差异较大,其频率分布直方图见图2。
表125例肝组织患者临床基线资料以及其对miR-130a、miR-142表达和CYP2C19活性的影响
Table 1Relationship between general characteristics and miR-130a and miR-142 expression and CYP2C19 activity in 25 liver tissues
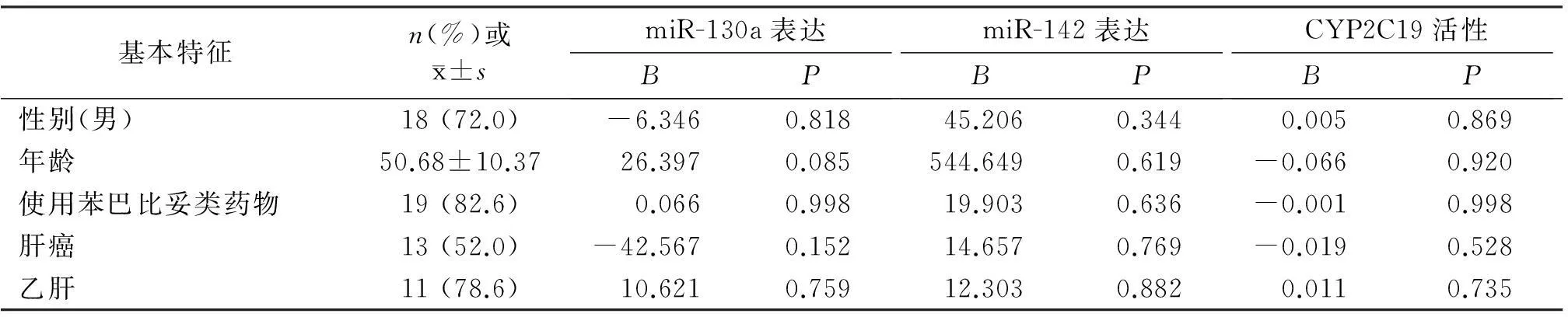
基本特征n(%)或x±smiR-130a表达BPmiR-142表达BPCYP2C19活性BP性别(男)18(72.0)-6.3460.81845.2060.3440.0050.869年龄50.68±10.3726.3970.085544.6490.619-0.0660.920使用苯巴比妥类药物19(82.6)0.0660.99819.9030.636-0.0010.998肝癌13(52.0)-42.5670.15214.6570.769-0.0190.528乙肝11(78.6)10.6210.75912.3030.8820.0110.735

98765432102004006008000t/minBA76543210100150500ρ/(ng?mL-1)ρ/(ng?mL-1)
A. 0~720 min; B. 0~120 min。
图15-羟基奥美拉唑的反应曲线
Figure 1Response curve of 5-hydroxyomeprazole (n=5)
3.3miRNA表达与CYP2C19活性关系
所选的6个miRNAs都处于可检测水平,但是miR-371、miR-206和miR-491的表达水平均低于其他miRNAs(见图3)。在这6个miRNAs中,miR-130a和miR-142的表达水平与CYP2C19酶活性呈显著负相关关系(miR-130a:r=-0.476 2,P<0.05,95%CI=-0.739 0~-0.087 45;miR-142:r=-0.400 8,P<0.05,95%CI=-0.693 6~0.005 761)。但是,miR-491、miR-206和miR-371的表达与CYP2C19酶活性关系相对稳定,差异均无统计学意义(P>0.05)。阴性对照miR-27b在肝脏中表达量与CYP2C19酶活性关系相对稳定,差异无统计学意义(P>0.05)。见图4。
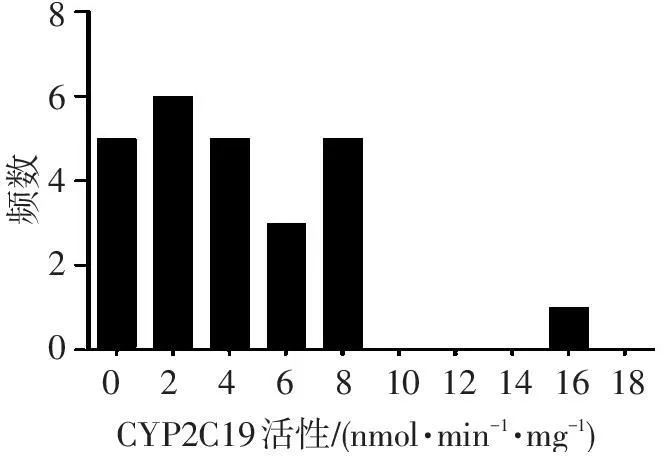
86420频数101214161802468CYP2C19活性/(nmol?min-1?mg-1)
图2CYP2C19酶活性频数分布图(n=25)
Figure 2Frequency distribution of CYP2C19 enzyme activity
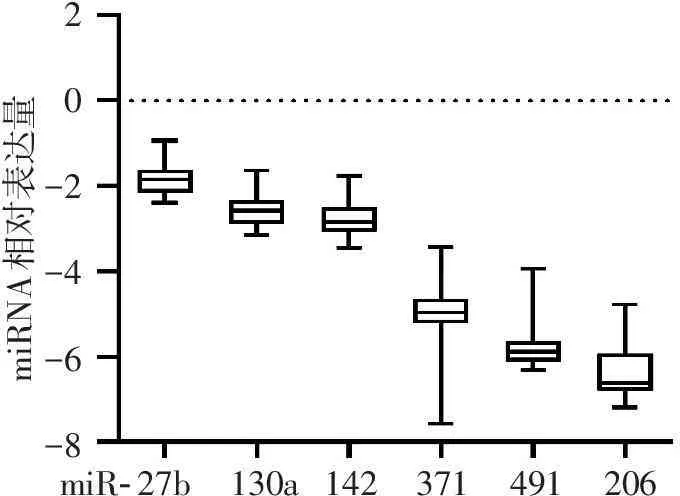
20-2-4-6-8miRNA相对表达量miR-27b130a142371491206
图3所选相关miRNAs在肝组织中的表达水平(n=25)
Figure 3Expression of selected relative miRNAs in human liver tissues
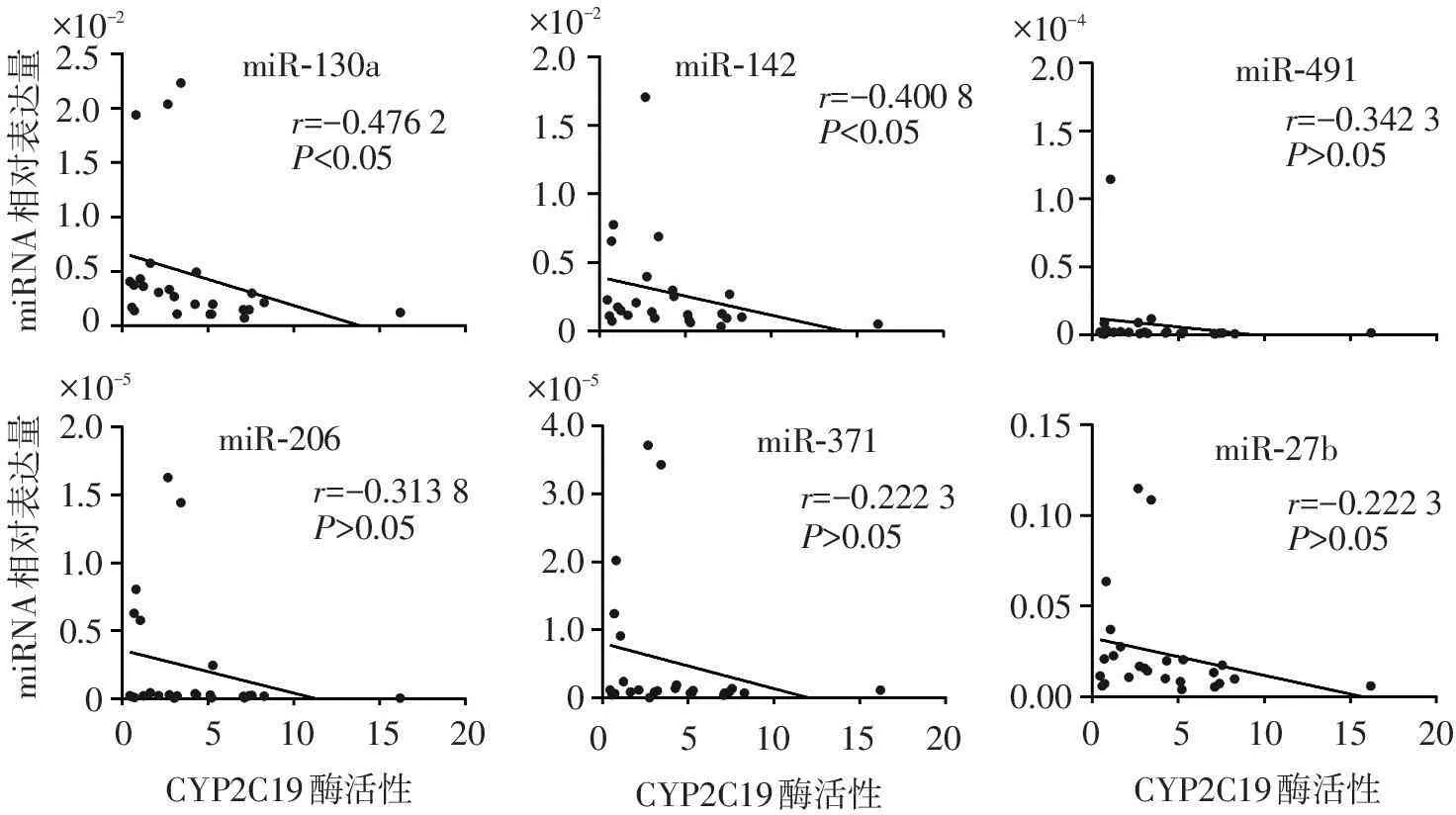
miRNA相对表达量2.01.51.00.50?10-42.01.51.00.50?10-5miRNA相对表达量4.03.02.01.00?10-50.150.100.050.00miR-142miR-491miR-27bmiR-371miR-206miR-130ar=-0.3138P>0.05r=-0.4762P<0.05r=-0.4008P<0.05r=-0.2223P>0.05r=-0.3423P>0.05r=-0.2223P>0.052.52.01.51.00.50?10-22.01.51.00.50?10-2CYP2C19酶活性05101520CYP2C19酶活性05101520CYP2C19酶活性05101520
图4miRNA与CYP2C19酶活性的相关性分析结果
Figure 4Correlation between miRNA expression and CYP2C19 enzyme activity (n=25)
4讨论
细胞色素P450是人体内最重要药物代谢酶系,目前关于miRNA与P450酶作用的相关分析尚不充分。本研究运用生物信息学方法预测并选择检测靶向作用于CYP2C19基因的miRNA,是首次在中国人群中进行miRNA与肝药酶CYP2C19活性的相关研究。
对25例肝组织样本的临床基线资料统计分析,说明了本研究纳入的病例患者年龄、性别、苯巴比妥用药、肝癌和乙肝疾病因素对实验结果均无影响。肝组织体外代谢奥美拉唑的产物5-羟基奥美拉唑反应曲线显示,在0~120 min孵育时间内,60 min时反应速率最快,因此体外孵育的最佳反应时间为60 min。所有肝组织CYP2C19酶活性变化存在35倍差异,频数分布较分散,反映了肝组织病例间CYP2C19代谢酶活性个体差异较大。
实验发现,miR-130a和miR-142与CYP2C19酶活性呈显著负相关关系,提示了miRNA可能是影响CYP2C19酶活性差异的重要因素之一。TargetScan数据库预测显示,miR-130a和miR-142能分别与CYP2C19 mRNA 3′-UTR(ENST00000371321.3)2371-2377和2555-2561位点的种子序列结合,可能通过引起mRNA切割或翻译抑制,从而在转录后水平干扰CYP2C19靶基因的蛋白质,对CYP2C19酶活性起到负调节作用。而且,有研究称miR-130b可能抑制CYP2C19蛋白的表达,而miR-130a与miR-130b属于同家族miRNA,具有高度的同源性,可能对它们的靶基因和蛋白具有共同的抑制作用[13]。
另外,miR-371、miR-206和miR-491与CYP2C19酶活性无显著相关性,可能是由于它们在肝脏的表达水平均远低于其他miRNA,对CYP2C19酶活性产生的抑制作用较弱,因此与其活性的相关性低。而作为阴性对照的靶向作用于CYP3A4 mRNA的miR-27b的表达与CYP2C19酶活性无显著相关性,说明实验结果有效可靠。但本研究仍然存在一定的局限性,今后的实验应该收集纳入更多的样本,并进一步验证miRNA对CYP2C19基因和蛋白表达的作用机制。
综上所述,在人体肝组织中的miR-130a、miR-142与CYP2C19代谢酶活性具有负相关作用,miRNA的表达水平可能是影响人群中CYP2C19酶活性变化差异的重要因素之一。
明确CYP2C19代谢酶的遗传缺失因素,将有利于临床上个体化用药,减少药物不良反应,预测患者对药物的反应性,从而提供最安全有效的精准药物治疗。
参考文献:
[1] ROMKES M,FALETTO M B,BLAISDELL J A,et al. Cloning and expression of complementary DNAs for multiple members of the human cytochrome P450IIC subfamily[J]. Biochemistry,1991,30(13):3247-3255.
[2] GRAY I C,NOBILE C,MURESU R,et al. A 2,4-megabase physical map spanning theCYP2Cgene cluster on chromosome 10q24[J]. Genomics,1995,28(2):328-332.
[3] GOLDSTEIN J A. Clinical relevance of genetic polymor-phisms in the humanCYP2Csubfamily[J]. Brit J Clin Pharmaco,2001,52(4):349-355.
[4] GOLDSTEIN J A,FALETTO M B,ROMKES S M,et al. Evidence that CYP2C19 is the major (S)-mephenytoin 4’-hydroxylase in humans[J]. Biochemistry,1994,33(7):1743-1752.[5] YANG L,PRICE E T,.CHANG C W,et al. Gene expression variability in human hepatic drug metabolizing enzymes and transporters[J]. PLoS One,2013,8(4):e60368.
[6] LIU Y,LIU N,LI W,et al. Relationship ofCYP2C19*2 andCYP2C19*3 gene polymorphism with clopidogrel response variability and recurrent cardiovascular events in Chinese patients undergoing percutaneous coronary intervention[J]. Pharmacology,2013,91(3/4):165-172.
[7] CHAUDHRY A S,PRASAD B,SHIRASAKA Y,et al. TheCYP2C19 intron 2 branch point SNP is the ancestral polymorphism contributing to the poor metabolizer phenotype in livers withCYP2C19*35 andCYP2C19*2 alleles[J]. Drug Metab Dispos,2015,43(8):1226-1235.[8] BARTEL D P. MicroRNAs genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281-297.
[9] YU A M,PAN Y Z. Noncoding microRNAs: small RNAs play a big role in regulation of ADME[J]. Acta Pharmaceutica Sinica B,2012,2(2):93-101.
[10] PAN Y Z,GAO W,YU A M. MicroRNAs regulateCYP3A4 expression via direct and indirect targeting[J]. Drug Metab Dispos,2009,37(10):2112-2117.
[11] CICCACCI C S,RUFIRNI,POLITI C,et al. Could MicroRNA polymorphisms influence warfarin dosing? A pharmacogenetics study on mir133 genes[J]. Thromb Res,2015,136(2):367-370.
[12] YU D,GREEN B,TOLLESON W H,et al. MicroRNA hsa-miR-29a-3p modulates CYP2C19 in human liver cells[J]. Biochem Pharmacol,2015,98(1):215-223.
[13] RIEGGER J K,KLEIN K,WINTER S,et al. Expression variability of absorption,distribution,metabolism,excretion-related microRNAs in human liver:influence of nongenetic factors and association with gene expression[J]. Drug Metab Dispos,2013,41(10):1752-1762.
(责任编辑:幸建华)
Relationship between microRNAs expression and drug metabolism enzyme CYP2C19 activity
TANG Qianjie1,ZHONG Shilong2,LIN Haoming3,LI Xiayin2,HE Guodong2,HAN Yaling4,WANG Laiyou1(1.SchoolofPharmacy,GuangdongPharmaceuticalUniversity;GuangdongMetabolicDiseasesResearchCenterofIntegratedChineseandWesternMedicine,Guangzhou510006,China; 2.MedicalResearchCenterofGuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Guangzhou510080,China; 3.DepartmentofHepatobiliarySurgery,SunYat-senMemorialHospitalofSunYat-senUniversity,Guangzhou510120,China; 4.CardiovascularMedicineofGeneralHospitalofShenyangMilitaryRegion,Shenyang110000,China)
Abstract:Objective To investigate the correlation between miRNAs expression and cytochrome CYP2C19 enzyme activity in liver tissues. Methods The activities of four metabolic enzymes in liver S9 fraction including CYP2C19 were determined by cocktail drug probe approach based on LC/MS/MS. Five potential miRNAs targeting CYP2C19 mRNA and one negative miRNA targeting CYP3A4 mRNA were chosen by bioinformatics software. The levels of these miRNAs in liver were determined by qRT-PCR. The relevance between miRNAs expression and metabolic enzyme activities was analyzed. Results Among the six miRNAs,miR-130a (r=-0.476 2,P<0.05) and miR-142 (r=-0.400 8,P<0.05) levels were negatively associated with the activity of CYP2C19. Conclusion miRNAs could be one of key factors that influence CYP2C19 activity in populations.
Key words:miRNA; CYP2C19; “cocktail” approach; LC/MC/MC
DOI:10.16809/j.cnki.1006-8783.2015112602
中图分类号:Q554
文献标志码:A
文章编号:1006-8783(2016)02-0243-07
作者简介:唐千捷(1991—),女,2013级硕士研究生;通信作者:王来友,男,博士,副教授,硕士研究生导师,主要从事药物代谢动力学与代谢性疾病药物研究,Email: wanglaiyou@gdpu.edu.cn。
基金项目:“十二五”国家科技支撑计划项目(2011BAI11B07);国家自然科学基金项目(81373486);广东省科技计划项目(2013B021800157);广州市科技计划项目(201510010236);广东省教育厅特色创新项目(自然科学类)(2105KTSCX073)
收稿日期:2015-11-26
网络出版时间:2016-03-29 10:16网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160329.1016.002.html

