狼疮性肾炎、胰岛素抵抗
许一新 杜 宏
·临床集锦·
狼疮性肾炎、胰岛素抵抗
许一新 杜 宏
男性 29岁,2007年诊断系统性红斑狼疮、狼疮性肾炎,2013年行自体外周血干细胞移植治疗。发现血糖升高半年,口服降糖药物治疗效果不佳后予胰岛素治疗,血糖仍未能控制。经我院检查诊为B型胰岛素抵抗,予免疫抑制治疗后胰岛素抵抗改善,逐渐停用胰岛素及降糖药物,血糖恢复正常。
B型胰岛素抵抗 特殊类型糖尿病 狼疮性肾炎
病史摘要
现病史 29岁男性,因“发现血糖升高半年余”于2015-10-21日入院。患者于2007年诊断“系统性红斑狼疮(累及肾脏、血液系统),狼疮性肾炎Ⅳ+Ⅴ型”,给予“泼尼松+雷公藤多苷+他克莫司(FK506)”诱导治疗后缓解并采用此方案维持治疗, 2年后逐渐停用雷公藤多苷和他克莫司,泼尼松单用维持。2012年患者定期随访时发现尿蛋白升高,行甲泼尼龙0.5g×3d冲击治疗,后续以30 mg/d,尿检无缓解。患者于2013年11月行“自体外周血干细胞移植治疗”,治疗后尿蛋白恢复正常,后长期服用泼尼松10 mg/d,环孢素A 150 mg/d。2015年5月发现血糖升高;空腹血糖8.4 mmol/L,餐后2h血糖13.4 mmol/L,糖化血红蛋白8.5%,外院予阿卡波糖、格列吡嗪控释片等治疗,血糖控制不佳,逐渐升高,空腹血糖波动于15~20 mmol/L,餐后2h血糖波动于18~30 mmol/L。2015年10月外院住院治疗,尿常规示尿糖++++,尿酮++,尿蛋白+,胰岛相关抗体阴性,甲状腺功能和抗体正常,给予胰岛素泵治疗,最大剂量为三餐前25 IU、22 IU、24 IU,基础量24 IU,全天血糖波动在15~30 mmol/L。为进一步诊治入院。病程中体重无明显改变。
既往史 青光眼病史3年,控制良好。 个人史、婚育史无特殊。
家族史 无糖尿病、狼疮家族史。患者系独子,父母体健,否认家族中同样疾病患者,否认家族性遗传病史。
体格检查 体温 36.4℃,心率77次/min,血压118/64 mmhg,身高 173 cm,体重55.6 kg,体质量指数(BMI) 18.58 kg/m2。神志清楚,体型偏瘦。颈部、肩背部及腋下皮肤可见黑棘皮样改变(图1),全身毛发正常。心肺、腹部无异常。双下肢无水肿。
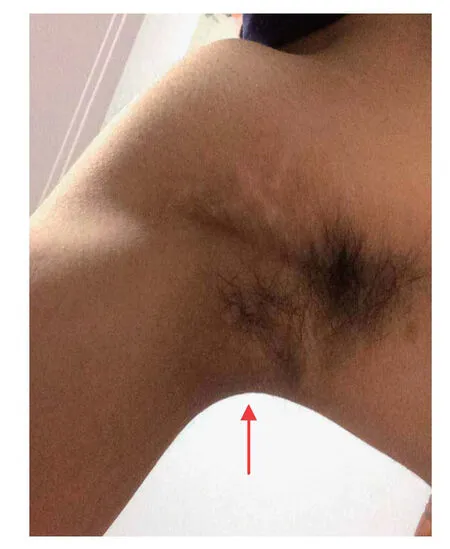
图1 腋下黑棘皮症
辅助检查
尿常规 尿酮++,葡萄糖+++,蛋白-。
血液 血红蛋白129 g/L,白细胞计数4.7×109/L,红细胞计数4.67×1012/L,血小板90×109/L,C反应蛋白(CRP)107.3 mg/L。血清白蛋白38.8 g/L,谷丙转氨酶16 U/L,谷草转氨酶14 U/L,血清肌酐57 μmol/L, 空腹血糖11.1 mmol/L,总胆固醇 4.28 mmol/L,三酰甘油0.75 mmol/L。电解质正常。糖化血红蛋白14.7%。
空腹皮质醇 100 ng/ml;空腹促肾上腺皮质激素(ACTH):44.8 pg/ml。
胰岛相关抗体 IAA++,GAD-,ICA-。
甲状腺功能及抗体 T3 1.28 nmol/L:T4 90.45 nmol/L;FT3 3.37 pmol/L;FT4 9.9 pmol/L;TSH 3.20 mIU/L;TrAb 0.30 IU/L,TPO 165.20 IU/mL,TgAb 2102.0 IU/Ml。
免疫学 免疫球蛋白:IgG 14.9 g/L, IgA 3.13g/L, IgM 1.21 g/L, IgE 973.0 IU/mL,C3 0.839 g/L, C4 0.199 g/L,ASO 41.9 IU/ml,RF<20 IU/ml。抗核抗体谱中A-Ro52 阳性,其余均阴性。
诊断分析 青年男性,体型消瘦,曾诊断“系统性红斑狼疮(累及肾脏、血液系统)狼疮性肾炎Ⅳ+Ⅴ型”,长期使用免疫抑制剂,此次因发现血糖升高半年入院,外院使用口服降糖药联合胰岛素治疗,血糖控制不佳,无糖尿病家族史,2型糖尿病可能性不大。患者出现明显黑棘皮症,有胰岛素抵抗表现,虽血糖升高明显,但无酮症现象,胰岛素抗体(胰岛素治疗前)阴性,提示1型糖尿病可能也较小。结合患者患有狼疮性肾炎,长期使用激素,不能排除类固醇糖尿病。
初步诊断:(1)特殊类型糖尿病,类固醇糖尿病?(2)系统性红斑狼疮,狼疮性肾炎Ⅳ+Ⅴ型;(3)青光眼。
诊疗经过 患者入院后继续服用泼尼松10 mg/d,环孢素A 75 mg/d。针对糖尿病,给予胰岛素泵治疗,起始基础量24 IU,三餐前各10 IU,并加用二甲双胍0.5g 2次/d控制血糖,血糖控制不佳,空腹血糖11~16 mmol/L,餐后2h血糖20~26 mmol/L。调整二甲双胍为0.5g 3次/d,加用西格列汀 0.1g 1次/d,胰岛素泵量逐渐增加至三餐前30 IU、26 IU、30 IU,基础量46 IU,血糖情况无改善。1周后停胰岛素泵,改为甘精胰岛素 46 IU 1/晚,诺和锐胰岛素三餐前30 IU、26 IU、30 IU,继续原剂量使用二甲双胍和西格列汀,逐渐加用利拉鲁肽1.2 mg 1次/d,瑞格列奈2 mg 3次/d,吡格列酮30 mg 1次/d,继续观察10d,血糖亦无明显改善。进一步实验室检查结果显示:脂联素191.8 μg/ml,瘦素极低。馒头餐试验(表1)可见患者空腹和餐后2h血糖均升高,且餐后升高更为显著,空腹和餐后的胰岛素水平一直为检测的最大值,C肽水平也升高(图2)。动态血糖监测(图3A)发现患者全天血糖水平升高(均>11.1 mmol/L),餐后2h血糖升高更为明显,患者3d的血糖曲线重合度良好。
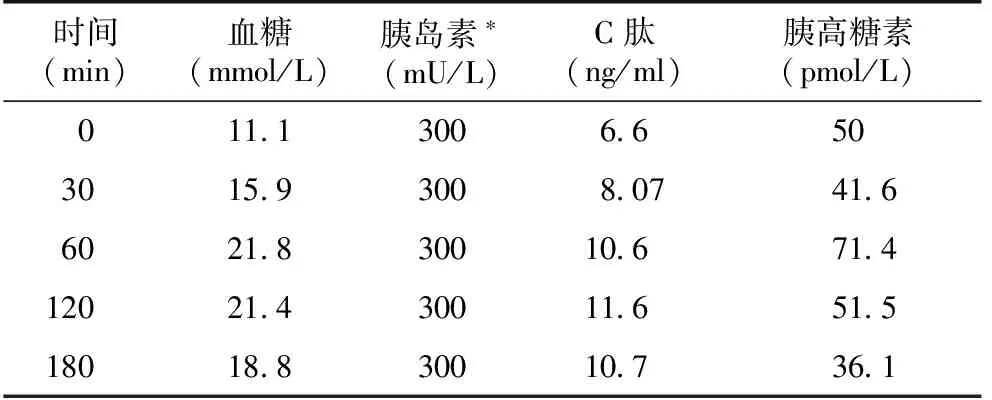
表1 馒头餐实验
*我院实验室血清胰岛素检测最大值为300 mU/L
总结患者病史特点如下:(1)青年男性,体型偏瘦,无糖尿病家族史;(2)患系统性红斑狼疮多年;(3)胰岛素强化治疗效果差,提示存在明显的胰岛素抵抗;(4)伴黑棘皮症;(5)血浆胰岛素水平和脂联素水平明显升高。根据上述特点,考虑诊断为B型胰岛素抵抗(TBIR)。遂于2015-12-02开始使用免疫抑制剂冲击治疗:当日开始使用环磷酰胺600 mg静脉滴注,次日开始使用20 mg/d;2周后再次循环前次环磷酰胺和治疗,其余降糖治疗维持不变。血糖逐渐出现好转趋势,空腹血糖下降至6~12 mmol/L,餐后2h血糖下降至15~22 mmol/L,缓慢减少基础胰岛素剂量。12月24日患者出院,出院时方案为甘精胰岛素 10 IU 1/晚,诺和锐胰岛素三餐前30 IU、26 IU、30 IU,二甲双胍0.5g 3次/d,西格列汀 0.1g 1次/d,利拉鲁肽1.2 mg 1次/d,瑞格列奈2 mg 3次/d,吡格列酮30 mg 1次/d,20 mg 1次/d,环孢素A 75 mg 1次/d。
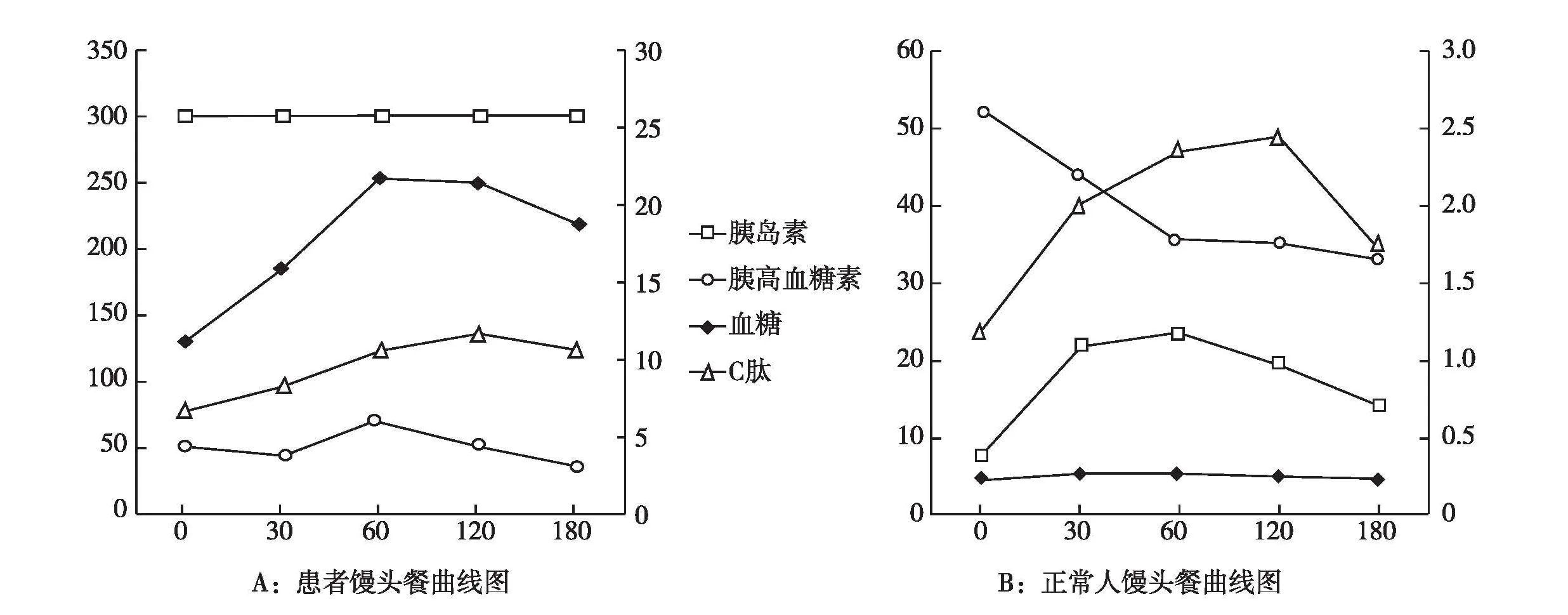
图2 馒头餐试验曲线图A:患者曲线; B:正常人曲线;正常人馒头餐试验血糖在正常范围内且平稳,无明显峰值,胰岛素峰值在0.5~1h,C肽峰值较胰岛素稍延后,胰高糖素与胰岛素相反,而图A该患者血糖逐渐升高,胰岛素一直处于最大值,胰高糖素节律紊乱

图3 治疗前后动态血糖对比
最后诊断 (1)特殊类型糖尿病:B型胰岛素抵抗;(2)系统性红斑狼疮,狼疮性肾炎Ⅳ+Ⅴ型;(3)青光眼。
后续治疗及随访 患者出院后甲泼尼龙1周减至12 mg,以后每周减4 mg至8 mg/d维持,环孢素A 75 mg/d。监测血糖逐渐下降,2016-01-02开始夜间3点出现低血糖,最低至2 mmol/L,停甘精胰岛素,血糖仍低。2016-01-11停用二甲双胍、西格列汀、瑞格列奈、利拉鲁肽,诺和锐用量为早12U、中16U、晚12U。空腹血糖有所升高,但仍在3.5~4.0 mmol/L,胰岛素逐渐减量,1月16日后停胰岛素。 2016-01-19再次入院复查,血糖基本恢复正常(表2),空腹血清胰岛素大幅降低。再次动态血糖监测(图3B)显示患者血糖明显改善。
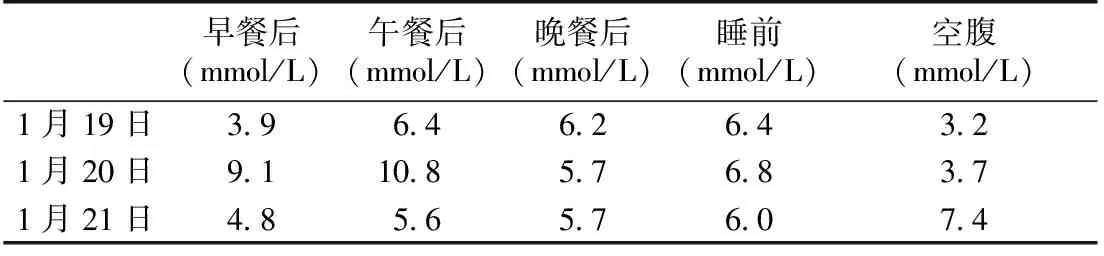
表2 入院复查监测血糖表
讨 论
患者系统性红斑狼疮、狼疮性肾炎病史9年,发现血糖升高半年。口服降糖药物及胰岛素治疗效果不佳,极度胰岛素抵抗,高胰岛素血症明显。最终诊断为特殊类型糖尿病TBIR。予环磷酰胺冲击并维持治疗后病情改善(图4),逐渐停口服降糖药物和胰岛素,血糖逐渐恢复正常。
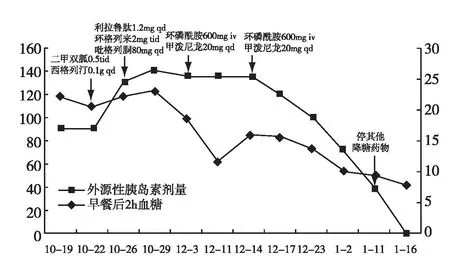
图4 治疗流程
特殊类型糖尿病共有8类:(1)基因缺陷所致胰岛β细胞功能异常;(2)基因缺陷所致胰岛素作用降低;(3)胰腺外分泌疾病;(4)内分泌疾病;(5)药物及化学制剂所致糖尿病;(6)感染;(7)非常见型免疫介导的糖尿病;(8)其他遗传综合征有时伴发糖尿病。TBIR属于上述第7类。
本例患者首次入院时虽CRP升高,不排除在院外发生病毒或其他特殊感染的可能性,但入院后反复监测无感染的征象,且血胰岛素水平极度升高,未发现其他内分泌疾病,胰腺外分泌功能正常,未发现其他遗传缺陷,因此可排除第1~4类及第6和第8类。药物及化学制剂所致的糖尿病大部分是通过破坏胰岛B细胞,降低胰岛功能所致,而本例患者的胰岛功能未被破坏,而是在胰岛素的作用通路上发生障碍,因此也不符合第5类。最终诊断为TBIR。
TBIR是一类非常罕见的疾病,以产生特异性胰岛素受体抗体为特征,表现为严重的胰岛素抵抗及高胰岛素血症,常发生在合并系统性红斑狼疮、干燥综合征、系统性硬化、自身免疫性血小板减少性紫癜等自身免疫疾病的患者[1-3]。部分细菌或病毒感染如幽门螺杆菌或HIV病毒感染也可导致TBIR,此外一些恶性肿瘤如霍奇金淋巴瘤、多发性骨髓瘤[4]也可引起该病。TBIR的发病率非常低,目前全球有文献报道的仅50余例,国内报道不足5例。该病的生理机制是机体某种特异的自身免疫状态下产生了针对胰岛素受体的抑制性抗体,主要为IgG,抗体结合在胰岛素受体上,从而阻止了胰岛素与胰岛素受体的结合,其次抗体和胰岛素受体结合可通过内化作用使受体的自噬增加,减少胰岛素受体的数目,再次,抗体和胰岛素受体结合可抑制细胞内的信号传导。体内葡萄糖的代谢必须有胰岛素的参与,而TBIR患者由于以上几个方面的作用,抑制了胰岛素作用的发挥,从而使机体无法利用葡萄糖,体内葡萄糖逐渐蓄积造成了体内的高血糖。而患者的B细胞未受破坏,功能大致正常,极高浓度的血糖刺激又刺激胰岛B细胞分泌胰岛素,引起血胰岛素浓度的升高,然而升高的胰岛素仍然被阻拦在糖代谢之外,高血糖的状况仍旧得不到缓解,形成了体内高血糖与极高胰岛素同时并存的状态。最新的研究发现,抗体的抗原结合片段的数目不同,其对胰岛素受体的作用也不同,当抗体含有1个抗原结合片段时,抗体对受体是抑制作用,而当含有2个抗原结合片段时则为刺激作用[5]。同时Arioglu等[5]统计了45例TBIR的患者,其中28例患有系统性红斑狼疮,系统性红斑狼疮为TBIR最常见的并发症。本例患者基础疾病为系统性红斑狼疮,可能存在免疫功能亢进,产生可以与胰岛素受体相结合的特异性抗体,该抗体与胰岛素受体结合并不能诱导底物水平的磷酸化发挥降糖作用,反而因此抑制了胰岛素与受体的结合,从而使胰岛素难以发挥生物学作用,导致了血糖的升高。
TBIR主要有以下表现:(1)难治性糖尿病。发生糖尿病后治疗效果不佳,针对常规1型糖尿病和2型糖尿病的各种口服药物和胰岛素及GLP-1受体激动剂均无明显疗效;(2)体内胰岛素水平极高。该病患者体内的胰岛素水平往往是正常人的10倍以上,文献报道中可高达1 000~2 000 mIU /L,本例患者我院监测空腹及餐后血清胰岛素均为300 mIU/L(为我院实验室检测的最大值),推测其真实胰岛素水平更高;而极高浓度的血清胰岛素可表现为明显的黑棘皮,这也是TBIR的一个特点,Arioglu等[5]曾报道了24例TBIR,这也是首次对TBIR进行的较大规模的报道,发现其中87.5%的患者有黑棘皮;(3)输注大剂量胰岛素仍不能达到理想的降糖效果。文献报道的差异较大,每日胰岛素使用剂量从100U最高至29 000U[5],本例患者最大日剂量为142 U/L,血糖仍无明显改善,也提示了患者体内存在极度的胰岛素抵抗;(4)雄激素增多。女性患者可出现多毛等雄激素增多的表现,在男性患者中该表现不明显;(5)部分患者可出现低血糖反应。机制不明,有研究者认为可能的机制为:与受体结合使受体13亚单位发生磷酸化[4-5];胰岛素受体的增殖[4];在抗体滴度较高时,抗体与受体结合发挥拮抗效应,而在滴度较低时,可能为激动效应[4];(6)确诊的“金标准”是体内可检出胰岛素受体抗体。本例患者符合TBIR表现中的1、2、3、5项,因此可诊断TBIR。对于诊断的“金标准”:胰岛素受体抗体,虽然本例患者缺乏胰岛素受体抗体的检测结果,但实验性免疫抑制治疗取得了良好的结果,进一步验证了之前的诊断。
TBIR作为一种罕见的自身免疫疾病,目前尚无特定的治疗方法,总体原则是在治疗原发病的基础上行免疫抑制治疗。文献报道,多使用大剂量激素联合环磷酰胺联合治疗[6]。Eriksson等[7]对严重病例治疗经验表明可使用血浆置换短期内去除使抗体,续以硫唑嘌呤和环孢素A等免疫抑制剂长期维持。最近发现利妥昔单抗可以联合环磷酰胺、激素一起使用,以达到缓解[3,8]。另有报道IGF-1可缓解高血糖状态[9-11]。本例患者使用环磷酰胺600 mg 每2周一次,冲击2次,冲击间隙及冲击后使用20 mg/d治疗,从开始冲击治疗至完全缓解共2月余。协和医院近期报道3例患者,其中仅1例在免疫抑制治疗后病情即刻缓解,其余2例经针对原发病治疗和免疫抑制治疗后也得到了缓解[12]。Malek等[3]观察了7例TBIR患者发现,经利妥昔单抗、环磷酰胺和糖皮质激素冲击的联合治疗后,这些患者的病情均得到了缓解,平均治疗期为8个月,而这远远长于单独使用免疫球蛋白治疗,尽管如此,免疫球蛋白仍非TBIR的首选治疗。仅常规治疗均无效时,免疫球蛋白可作为挽救性治疗手段[9]。
本病的预后差异性较大,主要与原发病的种类及严重程度有关, Arioglu等[5]曾报道18例患者,1/3可自行缓解,1/3经免疫调节治疗等积极治疗后缓解,1/3经积极治疗也未缓解,作者还认为本病的预后也和患者发病时的表现相关,如果患者表现为高血糖和低血糖交替出现,往往提示预后较差,甚至可导致死亡。
小结:本例患者系统性红斑狼疮、狼疮性肾炎患者,在病中出现难治性高血糖,胰岛素治疗不敏感,血胰岛素浓度极度升高,诊断为TBIR,予免疫抑制治疗后病情迅速改善。虽然TBIR较罕见,但临床表现较为特异,但诊断并不困难。当患者有自身免疫疾病病史,临床表现为难治性高血糖,有胰岛素抵抗的体征,体内可测到高浓度的胰岛素,或从顽固性高血糖转变为低血糖时,应考虑该病可能。
1 Flier JS,Kahn CR,Roth J,et al.Antibodies that impair insulin receptor binding in an unusual diabetic syndrome with severe insulin resistance.Science,1975,190(4209):63-65.
2 Kahn CR,Flier JS,Bar RS, et al.The syndromes of insulin resistance and acanthosis nigricans.Insulin-receptor disorders in man.N Engl J Med,1976,294(14):739-745.
3 Malek R,Chong AY,Lupsa BC,et al.Treatment of type B insulin resistance:a novel approach to reduce insulin receptor autoantibodies.J Clin Endocrinolo Metab,2010,95(8):3641-3647.
4 Lupsa BC,Chong AY,Cochran EK,et al.Autoimmune forms of hypoglycemia.Medicine(Baltimore),2009,88(3):141-153.
5 Arioglu E,Andewelt A,Diabo C,et al.Clinical course of the syndrome of autoantibodies to the insulin receptor(type B insulin resistance):a 28-year perspective.Medicine (Baltimore),2002,81(2):87-100.
6 Zhang S,Wang G,Wang J.Type B insulin resistance syndrome induced by systemic lupus erythematosus and successfully treated with intravenous immunoglobulin:case report and systematic review.Clin Rheumatol,2013,32(2):181-188.
7 Eriksson JW,Bremell T,Eliasson B,et al.Successful treatment with plasmapheresis,cyclophosphamide,and cyclosporin A in type B syndrome ofinsulin resistance.Case report.Diabetes Care,1998,21(8):1217-1220.
8 Takei M,Ishii H,Kawai Y,et al.Efficacy of oral glucocorticoid and cyclosporine in a case of rituximab-refractory type B insulin resistance syndrome.J Diabetes Investig,2015,6(6):734-738.
9 Yamamoto T,Sato T,Mori T,et al.Clinical efficacy of insulin-like growth factor-1 in a patient with autoantibodies to insulin receptors:a case report.Diabetes Res Clin Pract,2000,49(1):65-69.
10 Hirano T,Adachi M.Insulin-like growth factor 1 therapy for type B insulin resistance.Ann Intern Med,1997,127(3):245-246.
11 Manikas ED,Isaac I,Semple RK,et al.Successful treatment of type B insulin resistance with rituximab.J Clin Endocrinol Metab,2015,100(5):1719-1722.
12 杨国庆, 窦京涛,吕朝晖,等.B型胰岛素抵抗综合征三例临床分析并文献复习.中华内科杂志,2016,55 (1):11-15.
(本文编辑 律 舟 凡 心)
A case of systemic lupus eythematosus and type B insulin resistence
XUYixin,DUHong
DepartmentofEndocrinology,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
A 29 year old male was diagnosed diabetes six months ago. He has history of systemic lupus eythematosus and lupus nephritis, and had been treated by stem cell transplantation. Both the oral hypoglycemic drug and insulin treatment failed to control the blood glucose level. After the diagnosis of type B insulin resistance in our hospital, he was given immunosuppressive therapy. The insulin resistance improved after then, and insulin and hypoglycemic drugs gradually withdraw, the glucose level returned to normal finally.
trpe B insulin resistence special type diabetes lupus nephritis
10.3969/cndt.j.issn.1006-298X.2016.03.019
南京军区南京总医院内分泌科(南京 210016)
2016-04-06

