甲状腺功能紊乱与慢性肾脏病
周 岩 综述 程 震 审校
·肾脏病临床·
甲状腺功能紊乱与慢性肾脏病
周 岩 综述 程 震 审校
甲状腺激素可影响肾脏生长发育及改变肾功能。甲状腺功能紊乱可导致肾脏血流动力学的改变。甲状腺功能减低可降低肾小球滤过率(GFR)导致血清肌酐升高,而甲状腺功能亢进则可增加GFR。慢性肾脏病(CKD)患者常合并原发和亚临床甲状腺功能减低及低T3综合症。甲状腺激素降低能预测终末期肾病患者心血管和全因死亡率。本文重点就甲状腺病理生理学变化、对CKD患者肾功能的影响及CKD患者甲状腺功能紊乱作一综述。
甲状腺疾病 慢性肾脏病 甲状腺
甲状腺是人体内调节机体生理功能的最重要的腺体之一。甲状腺激素(TH)由甲状腺分泌,受垂体前叶的促甲状腺激素(TSH)的调节,TSH又受下丘脑促甲状腺激素释放激素(TRH)的调控[1]。甲状腺分泌三碘甲状腺原氨酸(T3)、甲状腺素(T4),影响机体的代谢、发育、蛋白质合成及其他重要激素的调节,T4转化为生物活性形式的T3。甲状腺功能异常可影响T3、T4的产生,与机体许多病理状态有关,可引起甲状腺功能亢进(甲亢)、甲状腺功能减低(甲减)及一些亚临床状态包括亚临床甲减。慢性肾脏疾病(CKD)患者同时存在TH水平异常[2]。目前关于CKD患者TH水平及如何影响CKD进展的研究较少。本文就甲状腺功能与CKD的关系进行综述,以利临床医师更好地处理甲状腺疾病与CKD的关系。
甲状腺功能紊乱与CKD的流行病学
美国的甲状腺疾病发病率高(约7.35%);基于最大的健康与营养调查Ⅲ(NHANES Ⅲ)人群调查,4.6%的美国人患有甲减,1.3%患甲亢[3]。2010年中华医学会内分泌分会在全国10大城市的流行病学调查显示中国甲亢发病率3.7%,甲减6.5%。CKD是全球范围内继心脑血管疾病、肿瘤、糖尿病后严重危害人类健康的一大公共健康问题。据统计中国CKD的患病率为10.8%,2020年我国透析人数预计达207人/百万人口[4]。CKD是持续进展的、不可逆的疾病,CKD相关风险因素包括糖尿病、高血压、高脂血症和甲状腺功能紊乱等。
甲状腺激素对肾脏的生长发育影响
TH通过影响全身或局部血流动力学直接影响肾功能,导致肾小管功能、肾小球滤过率(GFR)异常和引起蛋白尿[5]。先天性甲减的患儿肾功能不全的发生率增加[6],表明TH在胚胎发育过程中对肾脏的演变起着重要作用。动物研究亦是如此。新生甲亢大鼠增加蛋白质更新导致肾内肾素-血管紧张素系统(RAS)激活继而引起肾脏肥大,而甲减则相反[7]。TH参与肾小管许多共同转运系统的发展,包括Na+共运输磷酸盐,皮质的Na+/H+交换(NHE)和Na+-K+腺苷三磷酸酶。围产期大鼠的TH可调节近曲小管的多种酶能量代谢,如3-酮酸-辅酶A转移酶、柠檬酸合成酶。新生大鼠TH的减少可延缓肾脏α、β-肾上腺素能受体的发育。
甲状腺激素对GFR的影响
各种甲状腺疾病由于TH对GFR的影响而导致血清肌酐(SCr)、血胱抑素C(Cys C)水平的变化(表1)。甲减GFR下降而引起SCr升高的原因。甲减导致GFR降低的原因包括:(1)甲减可引起血流动力学和血管的变化,从而降低肾血流量(RBF)[8];(2)引起心输出量(CO)和循环量降低;(3)RAS活性降低、心钠素水平下降,导致肾灌注减少[5]。甲减大鼠由于生长迟缓肾小球面积减少,及通过干扰氯通道ClC-2活性引起远端肾小管的氯负荷,激活管球反馈导致GFR下降[5]。甲减可导致多种肾小球血管扩张剂包括胰岛素样生长因子1及血管内皮生长因子的表达减少而降低GFR[9]。原发性和亚临床甲减可导致成人和儿童的SCr的增加和GFR降低[10]。TH水平的恢复可增加GFR,因此不明原因的SCr增加的患者需完善甲状腺检查排除甲减。相反,甲亢则增加RBF和GFR而降低SCr。同样,甲亢经过治疗后随着甲状腺功能恢复正常肾功能亦恢复正常[11],主要由于其正性变时和变力的心脏作用而增加CO;另外RAS的激活导致血容量增加从而增加RBF。过量的TH引起肾小球入球小动脉收缩,导致肾小球静水压和GFR增加。CIC活动增强可增加近端小管和髓袢氯的重吸收,导致氯负荷减少与随后的球管反馈激活而增加GFR。
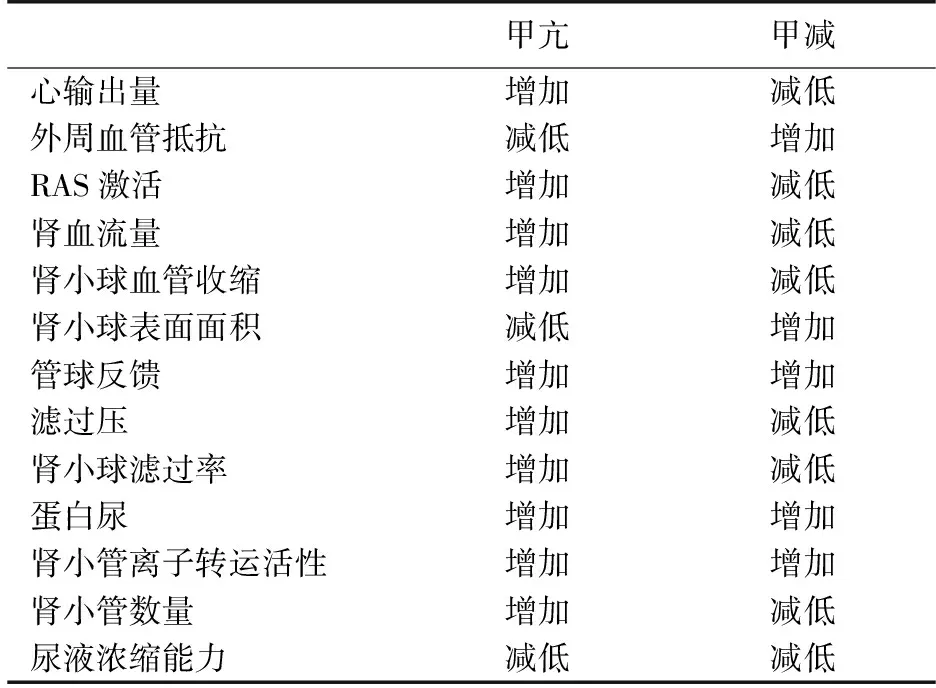
表1 甲状腺功能紊乱时血流动力学、肾小球、肾小管的改变
RAS:肾素-血管紧张素系统
甲状腺激素对肾小管功能影响
甲状腺疾病影响肾小管大部分的离子转运蛋白。甲减导致离子转运功能下降,甲亢则相反。研究发现甲减大鼠的肾脏与身体比例减少和蛋白质/DNA比值代偿性增加而肾细胞DNA成分未发生改变[5]。甲减对肾小管功能的影响大小取决于甲减持续的时间。动物研究显示短期甲减动物仅导致近曲小管、小管直部及皮质和髓质集合管Na+/K+-ATP酶活性降低。长期甲减动物的肾单位各段的Na+-K+-ATP酶活性均下降。由于抗利尿激素(ADH)释放增加和CO及GFR降低引起肾小管稀释功能降低导致低钠血症。甲减引起集合管的渗透驱动力降低,引起ADH减少和水处理受损,导致尿浓缩能力异常。甲亢的动物由于肾小管肥大和增生导致肾小管数量和肾脏重量增加,随着增生肥厚及活性的增加损伤肾小管上皮细胞。由于基因表达增加,多种载体蛋白包括Na+- K+- ATP酶和NHE合成及活性增加,有丝分裂指数增加,肾小管分泌和肾细胞重吸收能力增加。Vargas等[12]报道NHE活性增加和滤过钠负荷的降低增加肾小管重吸收钠,导致压力-利尿-排钠反应降低。甲亢患者的尿浓缩能力降低。
TH和RAS
甲状腺疾病可影响RAS,导致肾脏和心血管系统血流动力学、结构、功能的变化[10]。肾是肾素合成的主要场所,TH可以调节RAS。血浆TH水平与血浆血管紧张素原、血管活性的血管紧张素Ⅱ(ATⅡ)和醛固酮明显相关。TH通过增加心血管系统对神经系统的反应或/和直接激活RAS来调节血压。甲亢动物的肾皮质的β-肾上腺素能的密度和活性增加。血管紧张素转换酶抑制剂(ACEI)可使甲亢动物的高血压降至正常,同时增加心率和CO,表明甲亢患者高血压的主要因素是RAS活性增加并不是CO增加[13]。TH可增加大鼠肾球旁细胞肾素的合成和分泌。
TH可增强ACE的活性和表达,诱导内皮细胞合成ACE。新生和成年甲减的大鼠的ACE浓度降低,而甲亢患者和动物的血清ACE水平是升高的。血清ACE水平与TH水平呈正相关。TH缺乏或存在导致的肾素和血管紧张素水平的波动往往可影响ATⅡ水平。甲亢动物的血浆ATⅡ水平的增高与血浆PRA、血管紧张素原水平增高有关。相反,甲减大鼠的所有RAS系统的组份是降低的。
CKD与甲状腺功能紊乱
CKD患者的低T3综合征 CKD患者的甲减患病率高于普通人群,终末期肾病(ESRD)的临床和亚临床甲减及低T3综合征发病率增加,可能是由于′T4-5 -脱碘酶的活性降低[14]。亚临床原发性甲减的发生率随着eGFR逐渐降低而增加。Lo等[14]报道随着GFR的下降甲减的患病率从5%增加到25%。临床与亚临床甲减的不同是后者TSH减低但没有明显的临床症状。“低T3综合征”也称“甲状腺功能正常的病态综合征”,是CKD患者最常见的甲状腺功能紊乱,以T3降低为特征,而没有任何内在的甲状腺功能紊乱,由于GFR下降导致FT3水平升高。CKD患者也可导致T4水平降低。低T3综合征患病率随着CKD患者的eGFR的下降而增加。血液透析(HD)与腹膜透析(PD)患者存在类似情况[15-16]。HD通过影响TSH的细胞转运导致维持甲状腺瘤的状态。20%的HD患者TSH水平升高,PD可出现低T3综合征和亚临床甲减,主要由于营养不良和炎症所致[17]。PD患者的TH丢失的少且容易代偿,故而不需要补充TH。肾移植后前3个月低TH水平可恢复,低游离T3(FT3)水平与移植肾功能差有关。相比于其他甲状腺疾病,CKD患者的甲亢的发生率与一般人群类似。
CKD患者由于酶活性降低而减少外周T4向T3转化,组织和血浆T3水平均降低。其他干扰脱碘的因素包括营养不良和代谢性酸中毒。CKD患者的碘排泄减少导致血浆无机碘浓度升高,机体总的无机碘增加可阻断TH的产生,从而导致亚临床甲减发生率增加。尿毒症毒素致使TSH对TRH的反应异常导致甲状腺功能异常。慢性代谢性酸中毒、尿毒症毒素及HD时的肝素应用均可抑制T4蛋白结合。老年人、丙型肝炎病毒感染、慢性炎症和药物如胺碘酮、类固醇或β-受体阻滞剂也有影响[18]。原发性或亚临床甲减CKD患者的TH替代治疗可保护肾功能。T3水平正常化的替代治疗可改善RBF和GFR,这归因于改善心脏功能和调整血脂,逆转内皮功能障碍。
CKD与自身免疫性甲状腺炎 由于激素结合蛋白包括白蛋白、甲状腺素结合球蛋白(TBG)和运载蛋白从尿中丢失,肾病综合征(NS)患者的血清总T4、T3维持在较低的水平。TH的变化取决于蛋白尿和血清白蛋白水平[19]。然而,由于TH的合成与尿液丢失相抵消,FT3和游离T4水平保持在正常范围内[2]。NS患者在起病和治疗过程中由于TSH水平、程度、选择性均可导致非自身免疫性甲减[20]。NS的病程和肾小管重吸收TBG受抑制等参与甲减的发病。合并甲减的NS患者需要外源性补充TH维持甲状腺功能正常。多数情况下,NS缓解后甲减可以逆转。由于尿液的丢失TH和下丘脑-垂体-甲状腺轴的变化,原发性甲减与先天性NS相关。甲状腺疾病(包括甲亢、甲减)及最常见的自身免疫性甲状腺炎均与肾小球肾炎相关,包括膜性肾病(MN)、局灶节段性肾小球硬化、微小病变、膜增生性肾小球肾炎、IgA肾病和淀粉样变性。
肾小球肾炎和自身免疫甲状腺炎之间的确切机制尚不清楚。肾小球疾病常与自身免疫机制有关,如抗中性粒细胞胞质抗体相关血管炎或狼疮性肾炎可伴有自身免疫性甲状腺疾病。甲状腺疾病包括桥本氏甲状腺肿、无症状甲状腺炎、自发的黏液性水肿及Graves病存在循环免疫复合物。甲状腺疾病或CKD患者的免疫系统活化可诱导免疫复合物的形成。Akikusa等[21]报道1例桥本氏甲状腺炎合并MN的患者的甲状腺上皮基底蛋白和肾小球基膜有相同的抗原抗体复合物沉积。由此认为,同样的循环抗原抗体复合物参与疾病的发病机制。Shima等[22]报道1例合并Graves病的MN儿童不仅存在甲状腺球蛋白免疫复合物而且有可引起MN的甲状腺过氧化物酶免疫复合物沉积。
伴甲状腺功能异常的CKD患者心血管风险更高 CKD患者的动脉粥样硬化过程进展导致心血管疾病(CVD)的死亡率增加。甲状腺疾病可导致脂质代谢、血管内皮功能障碍、动脉硬化及炎症形成,均可加剧动脉粥样硬化和CVD。低水平的TH可预测透析患者发生CVD的风险和总体死亡率[15-16]。根据HEMO研究,超过80%的HD患者有心脏病,CVD是HD患者死亡的主要原因[23]。由于存在高血压、高血脂、血管内皮功能障碍、动脉硬化和加速动脉粥样硬化等多种心血管危险因素,CKD患者透析开始前合并CVD是非常普遍的。亚临床、原发性甲减和低T3综合征与普通人群和CKD患者的CVD发生率与死亡率密切相关。
TH可调节血压。甲减可增加外周血管阻力引起高血压[24]。高血压引起的左心室肥厚和(或)舒张功能障碍增加CVD的死亡率。Enia等[24]报道PD患者FT3水平与舒张压之间呈负相关性。甲减导致内皮功能障碍。Tatar等[25]报道HD和PD患者的FT3低与血管内皮功能障碍及炎症等CVD死亡率相关。
CKD患者常出现血脂异常,合并甲状腺功能紊乱时更加明显。血脂异常可加速CKD的进展和导致动脉粥样硬化。Liu等[26]报道HD患者的FT3水平和高密度脂蛋白胆固醇水平呈正相关,与低密度脂蛋白胆固醇和三酰甘油呈负相关。甲减患者由于脂蛋白脂酶活性降低导致高三酰甘油血症。动脉粥样硬化、高血压、容量超负荷、动脉钙化、氧化应激和脂质过氧化的增加的累积效应导致CKD患者的血管硬化。动脉硬化导致CKD患者的心血管事件恶化并可预测CVD死亡风险增加。研究显示普通人群的临床和亚临床甲减与动脉硬化等呈强相关性[27-28]。
左旋甲状腺素可降低收缩压、逆转动脉僵硬度[28]。低T3水平与HD患者的动脉硬化度和动脉粥样硬化呈负相关[25]。Carrero等[18]报道低T3水平、炎症标志物如C反应蛋白、白细胞介素6、白蛋白和CKD患者发生CVD呈一定相关性。总T3水平而不是FT3水平的降低与CKD患者的全因死亡率增加相关。Zoccali等[29]研究表明低T3水平通过炎症反应影响ESRD患者引起左心功能不全及左心室肥厚。亚临床甲减的PD患者左室收缩功能降低,Meuwese等[16]证实TH水平低的HD患者死亡风险增加主要由于CVD。Rhee等[30]报道甲减与HD患者的高死亡率相关,补充TH可改善。Fernandez-Reyes等[31]报道低FT3水平可预测HD患者的远期死亡率。甲减可引起HD患者对促红细胞生成素抵抗[32]。甲减是巨幼细胞性贫血的主要原因。CKD患者的贫血可增加CVD发生风险和死亡率。
CKD患者甲状腺功能异常的临床解释 CKD患者处于高代谢状态,而甲减可降低GFR及延缓CKD的进展[32]。通过手术切除甲状腺诱导肾功能不全动物的蛋白尿减少和肾功能恶化速度减慢。甲亢导致肾小球高滤过和蛋白尿,并增加氧化应激和RAS活性来加速CKD进展[5]。因此,低T3是一种延缓CKD进展的自身适应保护性机制,以减少慢性疾病的能量需求。CKD和CVD患者的低T3水平是炎症的结果。CKD患者TH水平减低反映健康状况不佳或营养不良[18,24]。
CKD患者是否应给予TH替代治疗及时机如何把握?如果低TH水平反映机体对能量需求的自适应性机制,TH替代疗法可能会带来相反的效果,如T3治疗可能会增加肌肉分解导致负氮平衡。另外TH替代治疗是否可导致甲亢?临床上TSH升高但小于20 IU/ml伴或不伴TH水平降低通常不需TH替代治疗。对CVD患者TH替代治疗是有益的。目前尚无TH替代治疗健康和(或)CKD患者生存率影响的资料研究结果。临床医师应权衡评估临床或亚临床型甲减的临床表现以及过度治疗的风险,决定是否对CKD患者TH替代治疗。
小结:CKD患者的甲状腺功能紊乱非常普遍。甲状腺疾病和CKD的因果关系是双向的。CKD患者的低TH是预测CVD和全因死亡率高风险因素。血脂异常、高血压、血管内皮功能障碍、加速的动脉粥样硬化、增加炎症负担可能增加CKD患者的CVD和甲状腺功能障碍的全因死亡风险。甲减和低T3综合征代表了一种自身适应机制。应充分评估甲减的临床表现及导致医源性甲亢的潜在风险后再决定是否进行TH替代治疗。
1 Visser TJ.Pathways of thyroid hormone metabolism.Acta Med Austriaca,1996,23(1-2):10-16.
2 Iglesias P,Díez JJ.Thyroid dysfunction and kidney disease.Eur J Endocrinol,2009,160(4):503-515.
3 Hollowell JG,Staehling NW,Flanders WD,et al.Serum TSH,T4,and thyroid antibodies in the United States population (1988 to 1994):National Health and Nutrition Examination Survey (NHANES III).J Clin Endocrinol Metab,2002,87(2):489-499.
4 Hallan SI,Coresh J,Astor BC, et al.International comparison of the relationship of chronic kidney disease prevalence and ESRD risk.J Am Soc Nephrol,2006,17(8):2275-2284.
5 van Hoek I,Daminet S.Interactions between thyroid and kidney function in pathological conditions of these organ systems:a review.Gen Comp Endocrinol,2009,160(3):205-215.
6 Kumar J,Gordillo R,Kaskel FJ,et al.Increased prevalence of renal and urinary tract anomalies in children with congenital hypothyroidism.J Pediatr,2009,154(2):263-266.
7 Kobori H,Ichihara A,Miyashita Y,et al.Mechanism of hyperthyroidism-induced renal hypertrophy in rats.J Endocrinol,1998,159(1):9-14.
8 Basu G,Mohapatra A.Interactions between thyroid disorders and kidney disease.Indian J Endocrinol Metab,2012,16(2):204-213.
9 Schmid C,Brändle M,Zwimpfer C,et al.Effect of thyroxine replacement on creatinine,insulin-like growth factor 1,acid-labile subunit,and vascular endothelial growth factor.Clin Chem,2004,50(1):228-231.
10 van Welsem ME,Lobatto S.Treatment of severe hypothyroidism in a patient with progressive renal failure leads to significant improvement of renal function.Clin Nephrol,2007,67(6):391-393.
11 den Hollander JG,Wulkan RW,Mantel MJ,et al.Correlation between severity of thyroid dysfunction and renal function.Clin Endocrinol (Oxf),2005,62(4):423-427.
12 Vargas F,Atucha NM,Sabio JM,et al.Pressure-diuresis-natriuresis response in hyperthyroid and hypothyroid rats.Clin Sci (Lond),1994,87(3):323-328.
13 García del Rio C,Moreno MR,Osuna A, et al.Role of the renin-angiotensin sys- tem in the development of thyroxine-induced hypertension.Eur J Endocrinol,1997,136(6):656-660.
14 Lo JC,Chertow GM,Go AS,et al.Increased prevalence of subclinical and clinical hypothyroidism in persons with chronic kidney disease.Kidney Int,2005,67(3):1047-1052.
15 Lin YC,Lin YC,Chen TW,et al.Abnormal thyroid function predicts mortality in patients receiving longtermperitoneal dialysis:a case-controlled longitudinal study.J Chin Med Assoc,2012,75(2):54-59.
16 Meuwese CL,Dekker FW,Lindholm B,et al.Baseline levels and trimestral variation of triiodothyronine and thyroxine and their association with mortality in maintenance hemodialysis patients.Clin J Am Soc Nephrol,2012,7(1):131-138.
17 Enia G,Panuccio V,Cutrupi S,et al.Subclinical hypothyroidism is linked to micro-inflammation and predicts death in continuous ambulatory peritoneal dialysis.Nephrol Dial Transplant,2007,22(2)538-544.
18 Carrero JJ,Qureshi AR,Axelsson J,et al.Clinical and biochemical implications of low thyroid hormone levels (total and free forms) in euthyroid patients with chronic kidney disease.J Intern Med,2007,262(6):690-701.
19 Feinstein EI,Kaptein EM,Nicoloff JT,et al.Thyroid function in patients with nephrotic syndrome and normal renal function.Am J Nephrol,1982,2(2):70-76.
20 Dagan A,Cleper R,Krause I,et al.Hypothyroidism in children with steroid-resistant nephritic syndrome.Nephrol Dial Transplant,2012,27(6):2171-2175.
21 Akikusa B,Kondo Y,Iemoto Y,et al.Hashimoto’s thyroiditis and membranous nephropathy developed in progressive systemic sclerosis (PSS).Am J Clin Pathol,1984,81(2):260-263.
22 Shima Y,Nakanishi K,Togawa H,et al.Membranous nephropathy associated with thyroid-peroxidase antigen.Pediatr Nephrol,2009,24(3):605-608.
23 Cheung AK,Sarnak MJ,Yan G,et al.Cardiac diseases in maintenance hemodialysis patients:results of the HEMO Study.Kidney Int,2004,65(6):2380-2389.
24 Enia G,Panuccio V,Cutrupi S,et al.Subclinical hypothyroidism is linked to micro-inflammation and predicts death in continuous ambulatory peritoneal dialysis.Nephrol Dial Transplant,2007,22(2):538-544.
25 Tatar E,Kircelli F,Asci G,et al.Associations of triiodothyronine levels with carotid atherosclerosis and arterial stiffness in hemodialysis patients.Clin J Am Soc Nephrol,2011,6(9):2240-2246.
26 Liu ML,Xu G,Huang ZY,et al.Euthyroid sick syndrome and nutritional status are correlated with hyposelenemia in hemodialysis patients.Int J Artif Organs,2011,34(7):577-583.
27 Dagre AG,Lekakis JP,Papaioannou TG,et al.Arterial stiffness is increased in subjects with hypothyroidism.Int J Cardiol,2005,103(1):1-6.
28 Peleg RK,Efrati S,Benbassat C,et al.The effect of levothyroxine on arterial stiffness and lipid profile in patients with subclinical hypothyroidism.Thyroid,2008,18(8):825-830.
29 Zoccali C,Benedetto F,Mallamaci F,et al.Low triiodothyronine and cardiomyopathy in patients with end-stage renal disease.J Hypertens,2006,24(10):2039-2046.
30 Rhee CM,Alexander EK,Bhan I,et al.Hypothyroidism and mortality among dialysis patients.Clin J Am Soc Nephrol,2013,8(4):593-601.
31 Fernández-Reyes MJ,Diez JJ,Collado A,et al.Are low concentrations of serum triiodothyronine a good marker for long-term mortality in hemodialysis patients? Clin Nephrol,2010,73(3):238-240.
32 Touam M,Guéry B,Goupy C,et al.Hypothyroidism and resistance to human recombinant erythropoietin.Nephrol Dial Transplant,2004,19(4):1020-1021.
(本文编辑 律 舟)
Update of relationship between thyroid disorders and chronic kidney disease
ZHOUYan,CHENGZhen
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Thyroid hormones may directly affect the kidney and alter kidney function. The renal manifestations of thyroid disorders are based on hemodynamic alterations or/and to direct effects of thyroid hormones. Hypothyroidism may be accompanied by an increase of serum creatinine and reduction of glomerular filtration rate (GFR), whereas hyperthyroidism may increase GFR. Treatment of thyroid disorders may lead to normalization of GFR. Primary and subclinical hypothyroidism and low triiodothyronine (T3) syndrome are common features in patients with chronic kidney disease (CKD). In addition low levels of thyroid hormones may predict a higher risk of cardiovascular and overall mortality in patients with end-stage renal disease. The causal nature of this correlation remains uncertain. In this review, special emphasis is given to the thyroid pathophysiology, its impact on kidney function and CKD and the interpretation of laboratorial findings of thyroid dysfunction in CKD.
thyroid disorders chronic kidney disease thyroid
10.3969/cndt.j.issn.1006-298X.2016.02.016
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2015-07-06

