生物钟基因Per1对人口腔鳞癌细胞生物学行为的影响和调控机制
李晗雪,杨 凯,付小娟,赵 钦
重庆医科大学 附属第一医院口腔颌面外科,重庆 400016
LI Han-xue,YANG Kai,FU Xiao-juan,ZHAO Qin
·论著·
生物钟基因Per1对人口腔鳞癌细胞生物学行为的影响和调控机制
李晗雪,杨凯,付小娟,赵钦
重庆医科大学附属第一医院口腔颌面外科,重庆 400016
摘要:目的探讨生物钟基因Per1对人口腔鳞癌细胞SCC15增殖、凋亡、迁移和侵袭的影响及调控机制。方法采用RNA干扰技术沉默SCC15细胞内Per1基因,应用流式细胞仪检测沉默后细胞的增殖和凋亡水平,Transwell小室检测细胞迁移和侵袭能力的改变,实时荧光定量PCR检测Ki- 67、鼠双微基因2(MDM2)、c-Myc、p53、Bax、Bcl- 2、金属蛋白酶(MMP)2、MMP9和血管内皮生长因子(VEGF)mRNA的表达情况。结果沉默SCC15癌细胞内Per1基因后促进了细胞的增殖,抑制了细胞凋亡,增强了细胞的迁移和侵袭能力 (P均<0.05)。Per1基因的低表达显著提高了Ki- 67、MDM2、Bcl- 2、MMP2 和MMP9 mRNA的表达(P均<0.05),降低了c-Myc、p53和Bax mRNA的表达(P均<0.05),而VEGF mRNA的表达差异无统计学意义(P>0.05)。结论生物钟基因Perl能调控下游重要的肿瘤相关基因Ki- 67、MDM2、c-Myc、p53、Bax、Bcl- 2、MMP2和MMP9,其表达变化影响癌细胞的增殖、凋亡、迁移和侵袭,对Per1深入研究有可能进一步明确癌症的发生发展机制,为癌症的治疗提供新的有效分子靶点。
关键词:生物钟基因;Per1;口腔;癌;鳞状细胞
ActaAcadMedSin,2016,38(2):155-163
研究表明哺乳动物体内的许多生命活动,如激素分泌、细胞代谢活动等,均表现出近似24 h的周期波动,称为昼夜节律[1- 3]。昼夜节律的产生是由细胞内生物钟基因呈昼夜节律性表达所导致[1- 4]。生物钟基因存在于体内几乎所有的细胞内[4- 6]。光线是影响昼夜节律的因素之一,但在无光线的黑暗环境下,机体的生命活动仍表现为近似24 h的周期波动,因此,昼夜节律是生命活动固有的内在基本特征[2,5,7]。目前人们已发现14个生物钟基因:周期蛋白(period,Per)1、Per2、Per3、隐花色素(cryptochrome,Cry)l、Cry2、昼夜节律运动输出周期故障、脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1、永恒蛋白、酪氨酸激酶ε、神经元PAS域蛋白2、核受体、软骨细胞差异表达基因(differentiated embryo-chondrocyte expressed gene,Dec)1、Dec2、视黄酸受体相关的孤儿受体[2- 3,7- 9]。生物钟基因具有3个重要功能:第一,生物钟基因通过周期性表达产生的昼夜节律使复杂的生命活动相互协调有序;第二,当外界环境发生变化,生物钟基因可通过重置作用适应环境的变化[2,4- 5];第三,哺乳类动物基因组中有2%~10%的基因受到生物钟基因的调控,这些基因被称为钟控基因[10- 12],生物钟基因可通过对下游钟控基因的调控影响细胞的生命活动。Per1是重要的生物钟基因,它具有维持昼夜节律稳定和控制节律周期的作用[4,13]。近年研究表明,Per1的异常表达不仅与哺乳动物的昼夜节律改变有关,而且与癌症的发生发展密切相关[6- 8,13- 16],昼夜节律与细胞周期具有密切联系,Per1异常表达导致下游钟控细胞周期相关基因,如细胞周期蛋白(cyclin) B1、Cyclin D、CyclinE、Wee- 1、细胞周期蛋白依赖性激酶1 (cyclin-dependent kinase 1,CDK1)和p53的异常表达,Per1是通过调控细胞周期和促进细胞周期检查点对DNA损伤的修复能力从而促进细胞恶性转化[6,17- 18]。但癌症的发生是个十分复杂的过程,包括细胞增殖、凋亡、侵润、转移和肿瘤新生血管形成等众多因素[7- 8,16,19- 20]。为进一步探讨Per1基因与癌症发生的关系,本研究通过RNA干扰技术对人口腔鳞状细胞癌细胞内的Per1基因沉默,检测Per1沉默后对人口腔鳞癌细胞的增殖、凋亡、迁移、侵袭和肿瘤新生血管形成的影响,并对调控这些细胞生物学行为的相关重要基因Ki- 67、鼠双微基因2(murine double minute 2,MDM2)、c-Myc、P53、Bax、Bcl- 2、金属蛋白酶(metalloproteinase,MMP)2、MMP9和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达改变情况进行检测,以进一步阐明生物钟基因Per1与癌症发生的机制。
材料和方法
材料总RNA提取试剂、逆转录试剂盒和实时荧光定量PCR试剂盒 (TaKaRa,日本),QIAGEN质粒抽提试剂盒(Qiagen,德国),慢病毒干扰表达质粒PLKO.1、scramble质粒和慢病毒包装质粒混合套装(Sigma,美国),Lipofectamine 2000(Invitrogen,美国)。
短发夹RNA慢病毒质粒的构建和鉴定根据人周期蛋白1的mRNA序列 (GenBank Accession:NM_002616.2),按照Reynolds A的RNA干扰序列设计原则[21],针对Per1基因3个不同靶点的序列(Per1-Ⅰ:CAGCACCACTAAGCGTAAATG;Per1-Ⅱ:CCAGCACC-ACTAAGCGTAAAT;Per1-Ⅲ:CCATGGACATGTCCACCTATA)分别设计合成3条Per1干扰序列,即Per1-短发夹RNA(short hairpin RNA,shRNA)-Ⅰ,Per1-shRNA-Ⅱ和Per1-shRNA-Ⅲ(表1)。然后用T4 DNA连接酶分别与Age I/EcoR Ⅰ双酶切的载体PLKO.1连接,构建Per1-shRNA-Ⅰ~Ⅲ慢病毒质粒,同时以不含Per1片段的scramble质粒为对照(序列为5’-CCTAAGGTTAAGTCGCCCTCGCTCGAGCGAGGGCGACTT AACCTTAGG- 3’)。将以上慢病毒质粒分别转入感受态大肠杆菌Dpα,然后涂布于含氨基核苷类抗生素的LB固体培养基上抗性培养,将形成的单克隆菌落接种于LB培养液中恒温摇菌(37℃,300 r/min)14 h。然后按照Qiagen质粒抽提说明书提取质粒后进行DNA测序,序列测定结果用软件Chromas V2.1进行分析鉴定。
Per1-shRNA慢病毒质粒的包装分别将Per1-shRNA-Ⅰ~Ⅲ和scramble质粒8 μg与20 μl Lipofectamine 2000混匀,室温下温育20 min后转移至293T细胞培养液中(细胞密度70%~80%)培养48 h(37℃、5%CO2),用孔径为0.45 μm的滤过器过滤293T细胞上清液获得4组病毒质粒液,分装保存于病毒管中(-80℃)。
Per1-shRNA质粒病毒感染SCC15癌细胞对数生长期的人口腔鳞状细胞癌SCC15细胞接种于5 ml的培养瓶内,加入含10%胎牛血清的DMEM/F12培养液4 ml,然后各加入1 ml质粒病毒液和5 μl聚凝胺,培养24 h后(37℃、5%CO2)更换含2 μg/ml 嘌呤霉素的培养液,每日1次,7 d后获得Per1稳定干扰的SCC15细胞株。实验分为5组。Per1-shRNA-I、Per1-shRNA-Ⅱ和Per1-shRNA-Ⅲ组:即分别转染Per1-shRNA-Ⅰ、Per1-shRNA-Ⅱ和Per1-shRNA-Ⅲ质粒病毒的SCC15细胞;对照组:即转染scramble质粒病毒的SCC15细胞;SCC15细胞组:即未做任何处理的SCC15细胞作为空白对照。
实时荧光定量PCR检测各基因mRNA的表达实验步骤按试剂盒说明进行,简述如下:(1)细胞总RNA的提取:用试剂盒提取细胞中的总RNA,用核酸蛋白分析仪测定在波长260 nm及280 nm处的光密度(optical density,OA) 值,计算RNA浓度和纯度。(2)cDNA的合成:用逆转录试剂盒合成cDNA,首先将等量的RNA反转录为cDNA,反应体系为10 μl,反应条件如下:37℃,15 min,85℃ 5 s。(3)实时荧光定量PCR:用Oligo7.0软件设计、合成目的基因Per1、Ki- 67、MDM2、c-Myc、p53、Bax、Bcl- 2、MMP2、MMP9、VEGF和内参基因β-actin的引物(表2)。反应体系为2×SYBR Premix Ex TaqTMⅡ 12.5 μl,浓度均为0.4 μmol/L的上游引物和下游引物各1 μl,DNA 模板2 μl(相当于100 ng),灭菌灭酶蒸馏水8.5 μl。反应液总体积为25 μl。反应条件均为:95℃预变性1.5 min,95℃变性10 s,60℃退火延伸30 s,扩增40个循环。60℃延伸时采集荧光信号,采用2-△△Ct法计算各基因mRNA的表达,实验重复3次。

表 1 Per1-shRNA 3组干扰序列
Per1:周期蛋白1;shRNA:短发夹RNA
Per1:period 1;shRNA:short hairpin RNA

表 2 各基因实时荧光定量PCR引物序列
MDM2:鼠双微基因2;MMP:金属蛋白酶;VEGF:血管内皮生长因子
MDM2:murine double minute 2;MMP:metalloproteinase;VEGF:vascular endothelial growth factor
Western blot检测PER1蛋白的表达用预冷的刮刀将各组感染细胞刮下,放入RIPA 裂解液后于冰上裂解细胞30 min,转子半径8.65 cm的离心机上离心(4℃ 12 000 r/min)15 min,取上清液,用BCA试剂盒测定蛋白质浓度。取50 μg蛋白样品上样,进行 6%SDS-PAGE电泳,湿转硝酸纤维素膜,5%脱脂奶粉室温封闭1 h后,加入一抗为兔抗人Per1多克隆抗体(1∶1 000)和鼠抗人GAPDH单克隆抗体(1∶3 000),4℃摇床过夜,用PBS清洗3次,加入二抗为辣根酶标记山羊抗兔IgG抗体(1∶5 000),室温孵育1 h。洗膜3遍后,ECL发光液均匀滴加在硝酸纤维素膜上,于化学发光仪曝光,凝胶成像系统拍照并测量条带灰度值,计算PER1和内参GAPDH条带灰度值比值。以上实验重复3次。
流式细胞仪检测细胞增殖与凋亡指数对数生长期Per1-shRNA-I、对照-shRNA和SCC15 3组细胞分别用0.25%胰酶消化后吹打制成单细胞悬液,转子半径14 cm的离心机上离心(1 000 r/min,4℃) 5 min后去上清液,用PBS液洗涤2次,用PBS液调整细胞浓度为1×106个/ml备用。细胞增殖检测:分别取1 ml各组细胞悬液,然后加入-20℃、浓度为70%的乙醇0.5 ml固定,4℃冰箱过夜后在转子半径14 cm的离心机上离心(1 000 r/min,4℃) 5 min,用PBS缓冲液洗涤细胞2遍,加入碘化丙啶染液1 ml,4℃避光30 min,用流式细胞仪检测细胞增殖指数,细胞增殖指数=(S+G2/M)/(G0/G1+S+G2/M)×100%。分别取1 ml各组细胞悬液加入200 μl AnnexinV-FITC染色液于室温下避光放置15 min,再加碘化丙啶染料1 ml混匀5 min后用流式细胞仪检测细胞凋亡指数,细胞凋亡指数=(凋亡细胞数/所测细胞总数)×100%。实验重复3次。
Transwell小室实验检测细胞的迁移能力取对数生长期Per1-shRNA-I、对照-shRNA和SCC15 3组细胞,用0.25%胰酶消化,转子半径14 cm的离心机上离心(1 000 r/min)5 min后用无血清细胞培养基重悬计数。Transwell小室被孔径为8 μm的聚碳酸多孔滤膜分为上、下两室,在Transwell小室的上室中加入100 μl的细胞悬液,每孔含1×104个细胞,下室加入含10%胎牛血清的培养基800 μl,培养(37℃、5%CO2)24 h后取出小室,室温下用甲醇固定细胞20 min,0.1%结晶紫染色15 min,用棉签擦去聚碳酸多孔滤膜上室面上未迁移的细胞,然后用200 倍光镜观察聚碳酸多孔滤膜的下室面,随机选择10个视野计算细胞数,即为穿过微孔膜的迁移细胞数。实验重复3次。
Transwell小室实验检测细胞的侵袭能力与前面细胞迁移实验基本相同,其差异在于Transwell小室的上室和下室间的聚碳酸多孔滤膜表面铺以基质胶液60 μl,其余步骤和方法相同。
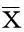
结果
Per1-shRNA慢病毒质粒的构建结果Per1-sh-RNA-Ⅰ~Ⅲ慢病毒质粒DNA测序结果分别与Per1-shRNA-Ⅰ~Ⅲ正义单链序列完全一致(图1),证实3条针对Per1基因的慢病毒质粒构建成功。
SCC15细胞感染shRNA质粒病毒后Per1 mRNA和蛋白的表达SCC15细胞转染重组质粒病毒前后细胞形态有所改变(图2),转染质粒病毒后SCC15细胞形态均变得不规则,并出现大核、多核细胞。Per1-shRNA-Ⅰ组细胞中Per1 mRNA和蛋白的表达均显著低于SCC15和对照-shRNA组(P均<0.01)(图3)。证明Per1-shRNA-Ⅰ组的Per1沉默效果最好,用于后面实验。
SCC15细胞增殖和凋亡流式细胞仪分析显示:Per1-shRNA-I组细胞的增殖指数为(48.58±0.59)%,显著高于对照-shRNA组(43.50±1.32)%和SCC15 组(41.78±0.85)% (P均<0.05)。Per1-shRNA-I组细胞的凋亡指数为(16.91±1.78)%,显著低于对照-shRNA组(20.14±2.00)%和SCC15组(22.13±3.17)% (P均<0.05)。而SCC15与对照-shRNA组细胞的增殖指数和凋亡指数差异均无统计学意义(P>0.05)(图4)。
SCC15细胞的迁移和侵袭能力Transwell小室实验结果显示,Per1-shRNA-I、对照-shRNA和SCC15组细胞穿过微孔膜的迁移细胞数分别为(113±12)、(31±9)和(32±8)个,穿过基质胶膜的侵袭细胞数分别为(52±6)、(23±6)和(21±6)个(图5)。Per1-shRNA-I组细胞穿过微孔膜和基质胶膜的细胞数显著高于对照-shRNA和SCC15组 (P均<0.05),而对照-shRNA和SCC15组差异无统计学意义(P>0.05)。

A.Per1-shRNA-Ⅰ组;B.Per1-shRNA-Ⅱ组;C.Per1-shRNA-Ⅲ组
A.Per1-shRNA-Ⅰ group;B.Per1-shRNA-Ⅱ group;C.Per1-shRNA-Ⅲ group
图 1Per1-shRNA慢病毒质粒DNA测序结果
Fig 1DNA sequencing results of lentivirus Per1-shRNA plasmids
A.SCC15细胞;B.对照组中SCC15细胞;C.转染Per1-shRNA-Ⅰ质粒病毒的SCC15细胞;D.转染Per1-shRNA-Ⅱ质粒病毒的SCC15细胞;E.转染Per1-shRNA-Ⅲ质粒病毒的SCC15细胞
A.SCC15 cells;B.SCC15 cells in control-shRNA group;C.SCC15 cells transfected with lentivirus Per1-shRNA-Ⅰ plasmid;D.SCC15 cells transfected with lentivirus Per1-shRNA-Ⅱ plasmid;E.SCC15 cells transfected with lentivirus Per1-shRNA-Ⅲ plasmid
图 2SCC15细胞转染Per1-shRNA慢病毒质粒前后的光学显微镜下图片(×200)
Fig 2SCC15 cells transfected and untransfected with lentivirus Per1-shRNA plasmids under microscope (×200)

Mr:相对分子质量;与SCC15组和对照-shRNA组比较,aP<0.05,bP<0.01
Mr:relative molecular mass;aP<0.05,bP<0.01 compared with SCC15 and control-shRNA groups
A.实时荧光定量PCR在mRNA水平上检测Per1基因的沉默效果;B. Western blot检测Per1基因沉默后PER1蛋白表达的凝胶成像图;C. Western blot在蛋白水平上检测Per1基因的沉默效果
A. effect of Per1 knockdown at mRNA level was detected by real-time polymerase chain reaction;B. gel images of PER1 protein level analyzed by Western blot after Per1 knockdown;C. effect of Per1 knockdown at protein level was detected by Western blot
图 3SCC15细胞转染Per1-shRNA质粒病毒后Per1 mRNA和蛋白的表达
Fig 3Expressions of Per1 at mRNA and protein levels in SCC15 cells transfected with lentivirus Per1-shRNA plasmids

PI:碘化丙啶
PI:propidium iodide
A.流式细胞检测Per1基因沉默对细胞增殖的影响;B.流式细胞检测Per1基因沉默对细胞凋亡的影响
A.effect of Per1 knockdown on cell proliferation;B. effect of Per1 knockdown on cell apoptosis
图 43组细胞的增殖和凋亡流式细胞仪分析图
Fig 4Flow cytometry profiles of proliferation and apoptosis in three groups
沉默Per1后SCC15细胞内肿瘤相关基因的表达Per1-shRNA-I组细胞中Ki-67、MDM2、Bcl-2、MMP2和MMP9 mRNA的表达水平显著高于对照-shRNA和SCC15组(P均<0.05),而c-Myc、p53和Bax mRNA的表达水平显著低于对照-shRNA和SCC15组(P均<0.05);对照-shRNA和SCC15组细胞中各基因mRNA的表达水平差异无统计学意义(P均>0.05);VEGF mRNA的表达水平在3组中差异均无统计学意义(P均>0.05)(表3)。
讨论
生物钟基因Per1的异常表达与肿瘤的发生发展密切相关[6,8,14- 15,18]。目前研究表明,下调Per1表达能促进乳腺癌细胞的生长[6],过表达Per1能抑制结肠癌、前列腺癌和人肺癌细胞的生长、促进细胞凋亡[7,15,17]。另有研究表明,Per1在口腔鳞癌中低表达,而且与口腔鳞癌患者的临床分期和颈淋巴结转移状态密切相关[8,16],提示Per1可能是重要的抑癌基因。
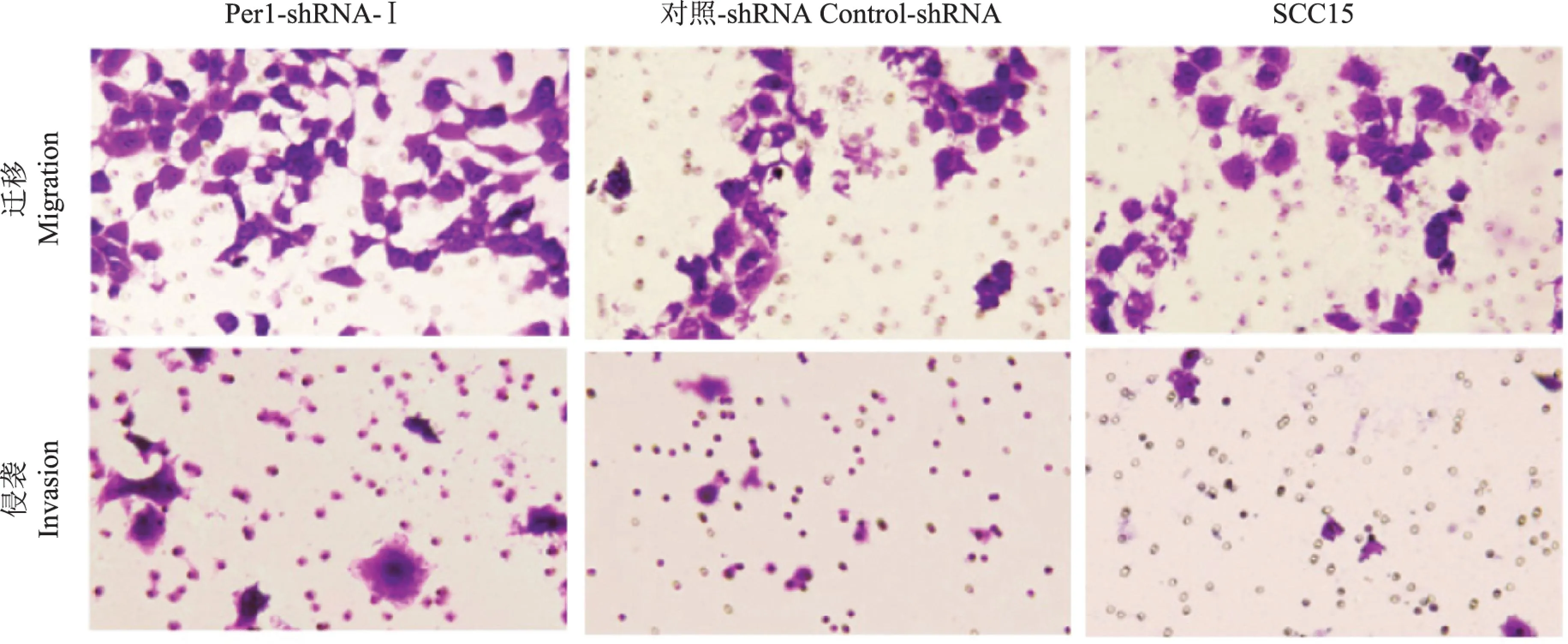
图 5光学显微镜下3组细胞的迁移和侵袭图 (结晶紫染色,×200)
Fig 5Representative migration and invasion images in three groups under a microscope (crystal violet staining,×200)

表 3 肿瘤相关基因在Per1-shRNA-I、对照-shRNA和SCC15组中mRNA的表达水平(x-±s)
P代表单因素方差分析结果;P1、P2和P3分别代表Per1-shRNA-I组与对照-shRNA组、对照-shRNA组与SCC15组、Per1-shRNA-I组与SCC15组组内应用LSD法两两比较结果
Pvalue represents the results of differences of each gene expression in three groups analyzed by one-way ANOVA;P1,P2,andP3represent the results of the inter group differences between Per1-shRNA-I and control-shRNA groups,control-shRNA and SCC15 groups,Per1-shRNA-I and SCC15 groups respectively,using LSD test after one-way ANOVA
本研究下调Per1后不仅能增强口腔鳞癌细胞的增殖并降低凋亡,同时还增强癌细胞的迁移和侵袭能力,表明Per1为重要的抑癌基因。
生物钟基因是通过维持机体正常昼夜节律和调控下游钟控基因两方面影响细胞的生命活动[2,5,10- 13,17- 18]。目前对生物钟基因Per1是如何维持和控制昼夜节律产生的机制方面研究较多,对昼夜节律产生的机制已初步清楚,即Per1和其他生物钟基因相互作用所形成的两个正负转录-翻译反馈调节环路而导致昼夜节律的产生[2,7,14]。但Per1表达改变导致癌症发生发展的机制研究较少。由于昼夜节律和细胞周期是人体内重要的两大周期活动,因而目前人们的研究主要集中在探讨昼夜节律与细胞周期两大周期活动之间的相互作用以及与癌变发生关系。目前研究表明昼夜节律和细胞周期具有密切联系,Per1基因表达改变会导致下游细胞周期基因Cyclin B1、Cyclin D、CyclinE、Wee- 1、CDK1、c-Myc和p53表达改变,Per1表达改变导致细胞恶性转变的机制是通过改变细胞周期进程和促进DNA损伤修复能力[6,17,19]。但癌症的发生是个复杂的过程,除了细胞周期异常改变外,还需要肿瘤新生血管形成供给肿瘤生长必需的营养,并需要具有迁移和侵袭的能力等[16,19- 20]。目前研究显示,除细胞周期基因外,许多与肿瘤增殖、侵润、转移和肿瘤新生血管生成的重要基因的表达也具有以24 h周期波动的昼夜节律特征,这些基因有细胞增殖基因Ki- 67[9,22]、原癌基因MDM2[23]、抗凋亡基因Bcl- 2[19]、促凋亡基因Bax[19]、肿瘤侵袭和转移基因MMP9[3]以及肿瘤新生血管生成基因VEGF[9,20]等,表明这些基因也是被生物钟基因调控的钟控基因,但目前不知道这些基因是否被Per1所调控。本研究显示在口腔鳞癌细胞中,沉默Per1基因后导致下游Ki- 67、MDM2、Bcl- 2、MMP2和MMP9的表达升高,Bax表达降低,从而增强了癌细胞的增殖、侵袭和转移能力,同时降低癌细胞凋亡水平。本研究结果也表明,沉默Per1基因后,细胞周期基因c-Myc和p53的表达降低,这与Gery等[17]的研究结果一致。本研究发现沉默Per1后VEGF mRNA的表达水平无改变。其原因可能是本研究细胞的培养条件未能达到VEGF高表达所需的缺氧状态[20,24],也可能是VEGF不受Per1基因的调控,而是被其他生物钟基因所调控。
Per1作为重要的生物钟基因,其表达变化可导致昼夜节律和细胞周期的改变,从而导致肿瘤的发生[6,20,23]。本研究进一步发现了Per1基因同时还调控下游许多重要的肿瘤相关基因Ki- 67、MDM2、Bax、Bcl- 2、MMP2和MMP9。因此,对Per1深入研究有可能进一步明确癌症的发生发展机制,为癌症的治疗提供新的有效分子靶点。
参考文献
[1]谭雪梅,叶华,杨凯,等. 鼠口腔黏膜癌变过程中生物钟基因Per1与细胞周期基因昼夜节律的表达[J]. 中华口腔医学杂志,2015,50(7):392- 398.
[2]Greene MW.Circadian rhythms and tumor growth [J]. Cancer Lett,2014,342(1):9- 18.
[3]Zieker D,Jenne I,Koenigstrainer I,et al. Circadian expression of clock-and tumor suppressor genes in human oral mucosa [J]. Cell Physiol Biochem,2010,26(2):155- 166.
[4]Zheng B,Albrecht U,Kaasik K,et al. Nonredundant roles of the mPer1 and mPer2 genes in the mammalian circadian clock [J]. Cell,2001,105(5):683- 694.
[5]Rohling JH,vanderLeest HT,Michel S,et al. Phase resetting of the mammalian circadian clock relies on a rapid shift of a small population of pacemaker neurons [J]. PLoS One,2011,6(9):e25437.
[6]Yang X,Wood PA,Ansell CM,et al.The circadian clock gene Perl suppresses cancer cell proliferation and tumor growth at specific times of day [J].Chronobiol Int,2009,26(7):1323- 1339.
[7]Cao Q,Gery S,Dashti A,et al. A role for the clock gene Per1 in prostate cancer [J].Cancer Res,2009,69(19):7619- 7625.
[8]Zhao N,Yang K,Yang G,et al. Aberrant expression of clock gene period1 and its correlations with the growth,proliferation and metastasis of buccal squamous cell carcinoma [J]. PLoS One,2013,8(2):e55894.
[9]Ye H,Yang K,Tan XM,et al. Daily rhythm variations of the clock gene PER1 and cancer-related genes during various stages of carcinogenesis in a golden hamster model of buccal mucosa carcinoma [J]. Onco Targets Ther,2015,8:1419- 1426.
[10]Panda S,Antoch MP,Miller BH,et al. Coordinated transcription of key pathways in the mouse by the circadian clock [J]. Cell,2002,109(3):307- 320.
[11]Storch KF,Lipan O,Leykin I,et al. Extensive and divergent circadian gene expression in liver and heart [J]. Nature,2002,417(6884):78- 83.
[12]Grundschober C,Delaunay F,Pühlhofer A,et al.Circadian regulation of diverse gene products revealed by mRNA expression profiling of synchronized fibroblasts [J]. J Biol Chem,2001,276(50):46751- 46758.
[13]Bae K,Jin X,Maywood ES,et al. Differential functions of mPer1,mPer2,and mPer3 in the SCN circadian clock [J]. Neuron,2001,30(2):525- 536.
[14]Hsu CM,Lin SF,Lu CT,et al. Altered expression of circadian clock genes in head and neck squamous cell carcinoma [J]. Tumour Biol,2012,33(1):149- 155.
[15]Gery S,Komatsu N,Kawamata N,et al. Epigenetic silencing of the candidate tumor suppressor gene Per1 in non-small cell lung cancer [J]. Clin Cancer Res,2007,13(5):1399- 1404.
[16]Chen R,Yang K,Zhao NB,et al.Abnormal expression of PER1 circadian-clock gene in oral squamous cell carcinoma [J]. Onco Targets Ther,2012,5:403- 407.
[17]Gery S,Komatsu N,Baldjyan L,et al. The circadian gene per1 plays an important role in cell growth and DNA damage control in human cancer cells [J]. Mol Cell,2006,22(3):375- 382.
[18]Sato F,Nagata C,Liu Y,et al. PERIOD1 is an anti-apoptotic factor in human pancreatic and hepatic cancer cells [J]. Biochem,2009,146 (6):833- 838.
[19]Granda TG,Liu XH,Smaaland R,et al. Circadian regulation of cell cycle and apoptosis proteins in mouse bone marrow and tumor [J]. FASEB J,2005,19(2):304- 306.
[20]Koyanagi S,Kuramoto Y,Nakagawa H,et al. A molecular mechanism regulating circadian expression of vascular endothelial growth factor in tumor cells [J]. Cancer Res,2003,63(21):7277- 7283.
[21]Reynolds A,Leake D,Boese Q,et al. Rational siRNA design for RNA interference [J]. Nat Biotechnol,2004,22(3):326- 330.
[22]Bjarnason GA,Jordan RC,Sothern RB. Circadian variation in the expression of cell-cycle proteins in human oral epithelium [J]. Am J Pathol,1999,154(2):613- 622.
[23]Fu L,Pelicano H,Liu J,et al.The circadian gene period2 plays an important role in tumor suppression and DNA damage responseinvivo[J]. Cell,2002,111(1):41- 50.
[24]Sato F,Bhawal UK,Kawanoto T,et al. Basic-helix-loop-helix(bHLH)transcription factor DEC2 negatively regulates vascular endothelial growth factor expression [J]. Genes Cells,2008,13(2):131- 144.
Effect and Regulatory Mechanism of Clock Gene Per1 on Biological Behaviors of Human Oral Squamous Carcinoma Cell
LI Han-xue,YANG Kai,FU Xiao-juan,ZHAO Qin
Department of Oral and Maxillofacial Surgery,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
ABSTRACT:ObjectiveTo investigate the effect and regulatory mechanism of clock gene Per1 on the proliferation,apoptosis,migration,and invasion of human oral squamous carcinoma SCC15 cells. MethodsRNA interference was used to knock down Per1 gene in human oral squamous cell carcinoma SCC15 cell line. Changes of cell proliferation and apoptosis were analyzed by flow cytometry. Transwell assay was carried out to assess cell migration and invasion. Real-time polymerase chain reaction was used to detect the mRNA expressions of Ki- 67,murine double minute 2(MDM2),c-Myc,p53,Bax,Bcl- 2,metalloproteinase (MMP)2,MMP9,and vascular endothelial growth factor (VEGF). ResultsshRNA-mediated knockdown of Per1 promoted the proliferation,migration and invasion capacity,and inhibited cell apoptosis capacity of SCC15 cells (all P<0.05). Additionally,Per1 knockdown also increased the mRNA expressions of Ki-67,MDM2,Bcl-2,MMP2,and MMP9 and decreased the mRNA expressions of c-Myc,p53,and Bax (all P<0.05);however,the VEGF mRNA expression did not differ significantly after Per1 knockdown (P>0.05). ConclusionsClock gene Perl can regulate important tumor-related genes downstream such as Ki- 67,MDM2,c-Myc,p53,Bax,Bcl- 2,MMP2,and MMP9,and the aberrant expression of Per1 can affect tumor cell proliferation,apoptosis,migration and invasion. An in-depth study of Per1 may further clarify the mechanism of tumorigenesis and tumor development and thus provides new effective molecular targets for cancer treatment.
Key words:clock gene;Per1;oral cavity;carcinoma;squamous cell
(收稿日期:2015- 11- 02)
Corresponding author:YANG KaiTel:023- 89012907,E-mail:cqfyyk@aliyun.com
DOI:10.3881/j.issn.1000- 503X.2016.02.006
中图分类号:R739.8;R852.6
文献标志码:A
文章编号:1000- 503X(2016)02- 0155- 09
通信作者:杨凯电话:023- 89012907,电子邮件:cqfyyk@aliyun.com

