紫苏籽油乳状液的制备及其稳定性评价
韩丽丽,侯占群,文剑,吴逸民,钱英燕,龚树立
(中国食品发酵工业研究院,北京,100015)
紫苏籽油乳状液的制备及其稳定性评价
韩丽丽,侯占群*,文剑,吴逸民,钱英燕,龚树立
(中国食品发酵工业研究院,北京,100015)
摘要将富含α-亚麻酸的紫苏籽油制备成水包油型(O/W)乳状液后,其稳定性、水溶性得到改善,并可作为ω-3多不饱和脂肪酸的传递系统,应用于功能食品的开发。分别采用阿拉伯胶、HI-CAP 100、纯胶2 000、可溶性大豆多糖、酪蛋白酸钠和大豆分离蛋白制备紫苏籽油乳状液,研究乳化剂对乳状液粒径、黏度及物理稳定性的影响。结果显示:4% 阿拉伯胶制备的乳状液粒径最小(0.678 μm),粒径主要分布在0.1~10 μm之间,随着乳化剂浓度的增大,乳状液的黏度不断升高,且不稳定性指数和Slope值逐渐降低,其中,除HI-CAP 100和酪蛋白酸钠外,乳化剂质量分数≥4%时,乳状液稳定性良好。
关键词乳状液;紫苏籽油;乳化剂;粒径;稳定性
现代社会的发展,生存环境的恶化以及社会压力的加大使现代人的健康受到严重威胁,营养型饮食逐步成为现代人的饮食观念。研究显示,ω-3多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)具有重要的营养及生理功效,如防治心血管疾病、癌症、炎性疾病及抑郁症等[1-2]。因此,发展(ω-3)PUFAs系列的保健食品,对改善亚健康人群的健康状态,提升我国国民的整体身体素质具有重要的理论和现实意义。紫苏籽油中α-亚麻酸含量高达60%[3],可作为(ω-3)PUFAs的重要来源应用于功能食品开发。然而,紫苏籽油较差的氧化稳定性、水溶性及分散性,严重限制了其应用范围。因此,最大限度保护其生物活性,提高其在功能食品中的稳定性,已成为我国紫苏籽油产业发展中亟待解决的难题。
O/W型乳状液是食品产业中的重要体系之一,如沙拉酱、人造黄油、冰激凌、牛乳饮料等均以乳状液的形式进行生产[4]。通过乳状液的制备,油脂的物化特性得到改善,并能促进人体对必需脂肪酸的吸收[4],克服了传统油脂的应用弊端,油脂乳状液的制备已成为食品领域中的研究热点之一。近年来,国内外科研工作者对富含(ω-3)PUFAs的功能性油脂,如鱼油、亚麻籽油乳状液进行了较多研究[5-9]。
本文选择阿拉伯胶(gum arabic,GA)、HI-CAP 100、纯胶(purity gum,PG)2000、可溶性大豆多糖(soluble soybean polysaccharid,SSPS)、酪蛋白酸钠(sodium caseinate,SC)、大豆分离蛋白(soybean protein isolate, SPI)6种乳化剂制备紫苏籽油乳状液,应用LUMiSizer稳定性分析仪评价乳状液的稳定性,以乳状液粒径、黏度及物理稳定性为评价指标,以确定制备紫苏籽油乳状液的最适乳化剂。
1材料与方法
1.1材料与试剂
紫苏籽油,河北欣奇典生物科技有限公司;可溶性大豆多糖-S-CA200,不二富吉(北京)科技有限公司;阿拉伯胶,天津滨海捷成专类化工有限公司;纯胶2000、HI-CAP 100,国民淀粉(上海)有限公司;大豆分离蛋白,杜邦郑州蛋白有限公司;酪蛋白酸钠,上海捷聪贸易有限公司。
1.2仪器与设备
PB602-N型电子精密天平,梅特勒-托利多仪器(上海)有限公司;SDF 0.4型多用分散机,江阴精细化工机械有限公司; T25基本型ULTRA-TURRAX分散机,德国IKA公司;Homelab型高压均质机,意大利FBF公司;RVA快速黏度分析仪,瑞典Perten公司;S3500激光粒度仪,美国麦奇克有限公司;LUMiSizer 611型稳定性分析仪,德国LUM仪器公司。
1.3实验方法
1.3.1紫苏籽油乳状液的制备
准确称取一定质量的乳化剂溶于50~60 ℃的蒸馏水中,高速搅拌使其充分溶解,高速剪切过程中缓慢加入紫苏籽油形成粗乳液,再经高压均质机(一级均质压力40 MPa,二级均质压力5 MPa)均质2次,制得含紫苏籽油8%的乳状液备用。
1.3.2紫苏籽油乳状液的黏度分析
采用快速黏度分析仪对乳状液黏度进行测定,仪器参数设置:温度35 ℃,转速160 r/min,时间10 min。
1.3.3紫苏籽油乳液的粒径分析
采用激光粒度分析仪测定乳状液的粒径及粒度分布,采用湿法分析模式。仪器基于动态光散射理论,通过建立粒子大小与散射强度的相关函数,确定粒子的粒径大小及粒度分布。粒径大小以体积平均粒径(D43)表示,按公式(1)计算:

(1)
其中:ni代表直径为di的颗粒个数。
1.3.4紫苏籽油乳液的物理稳定性分析
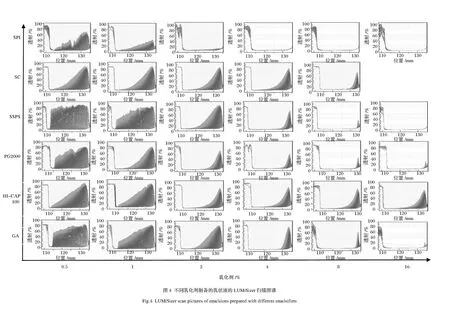
采用LUMiSizer快速稳定性分析仪对乳状液的稳定性进行评价。该仪器基于Stocks 理论及朗伯-比尔定律,通过加速分层和量化沉淀、悬浮的方法(STEP技术)测定乳状液的稳定性,其原理如图1所示。

图1 应用LUMiSizer评价乳状液稳定性的原理示意图Fig.1 Principle schematic diagram of LUMiSizer in evaluating the stability of emulsions
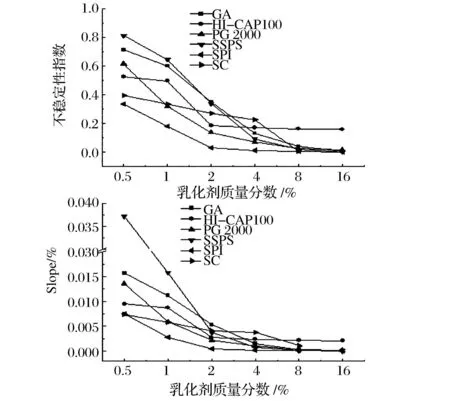
样品管离心过程中,平行的近红外光照射在样品管上,以时间和位置为参数,记录样品透光率的变化,以此确定乳状液中粒子的迁移过程。若样品管上部透光率变大表示粒子下沉,若底部透光率变大则表示粒子上浮。根据透光率变化谱图,可通过计算不稳定性指数(instability index)及Slope值,比较不同乳化剂制备的紫苏籽油乳状液的稳定性差异。其中,不稳定性指数反映了样品的整体分层情况,其值越接近于1,乳液分层越严重,越接近于0,表示乳液分层现象越不明显,稳定性越好;Slope值代表一段时间内乳液透光率的变化速度,整体透光对时间作图即可得到曲线斜率Slope值,其值越大,说明乳液的透光率变化越快,乳状液稳定性越差,反之Slope值越小,乳状液越稳定。
仪器参数设置:温度25 ℃,光波长865 nm,光散射系数1.0,离心速度4 000 r/min,透光率特征线每10 s记录1次,共计500次。
1.3.4数据处理
采用SPSS 19.0软件对试验数据进行单因素方差分析,显著性水平为P<0.05,并采用Origin 8.0软件进行作图。
2结果与讨论
2.1不同乳化剂对紫苏籽油乳状液粒径及分布的影响
2.1.1乳化剂种类对乳状液粒径及分布的影响
粒径大小及分布是衡量乳化剂乳化性能的关键指标之一,也是影响乳状液物理化学特性及感官特性的重要因素[10]。乳状液制备过程中,乳化剂中具有表面活性的分子结构吸附至油/水界面后,界面张力降低,有助于小液滴的形成,因此,乳化剂的结构、溶解度等特性都会对乳状液粒径产生影响。
由表1可知,相同质量分数的不同乳化剂制备的紫苏籽油乳状液的粒径各有差异。胶体浓度为0.5%~8%时,GA、PG2000、SC制备的乳状液粒径显著低于其他乳化剂制备的乳状液(P<0.05),其中,含4% GA的乳状液粒径最小(0.678 μm),说明GA具备良好的乳化活性,究其原因是其分子结构中存在约10%的阿拉伯半聚乳糖蛋白(arabinogalactan protein,APG),由于APG同时含有疏水性的多肽链和亲水性的碳水化合物成分,从而赋予了GA良好的界面特性[11]。胶体质量分数为16%时,除SPI外,各乳化剂制备的乳状液粒径无显著性差异(P>0.05)。乳状液的粒度分布图(图2)显示,除SPI外,各乳化剂制备的乳状液液滴大小主要分布在0.1~10 μm之间,而SPI制备的乳状液在10~100 μm之间也有较多分布。此外,GA、HI-CAP 100、SPSS、SC作为乳化剂时,乳状液的粒度分布主要为单峰,而SPI、PG 2000制备的乳状液粒度分布出现双峰现象,说明乳状液粒度分布不均匀,液滴均一性较差。

表1 不同乳化剂制备的紫苏籽油乳状液的粒径(平均值±标准差) 单位:μm
注:表中数据上标字母完全不同表示数据间存在显著性差异(P<0.05)。

A-GA; B-HI-CAP 100; C-PG 2000; D-SSPS; E-SPI; F-SC图2 不同乳化剂制备的乳状液的粒度分布Fig.2 Droplet size distributions of emulsions prepared with different emulsifiers
2.1.2乳化剂质量分数对乳状液粒径的影响
乳化剂质量分数对紫苏籽油乳状液粒径的影响较为显著(P<0.05)(见表1)。随着乳化剂质量分数的升高,GA、PG 2000、SC制备的乳状液粒径逐渐减小,乳化剂质量分数达4%时乳状液粒径降至最小,这是因为较低浓度的乳化剂不足以将全部的油水界面覆盖,均质过程中较大的机械应力会使液滴间相互聚结形成较大颗粒[12],导致乳液粒径较大。之后乳状液粒径有不同程度的增大,这是因为乳化剂浓度过大时,液滴表面吸附的乳化剂达到饱和,未吸附的乳化剂会使液滴间产生相互吸引力,且浓度越高,吸引力越强,最终导致乳状液发生耗尽絮凝(depletion flocculation)[13],乳状液粒径增大。此外,MCCLEMENTS[13]的研究表明,引起耗尽絮凝的临界浓度的大小与乳液粒径有关。其中,SPI在2%时乳液粒径达到最小(2.075 μm),之后粒径增加显著。其他乳化剂在4%时乳状液粒径降至最小,且均低于0.8 μm,大小顺序为:GA 2.2乳化剂种类及质量分数对紫苏籽油乳状液黏度的影响 从图3可以看出,乳化剂种类及浓度对紫苏籽油乳状液黏度的影响显著(P<0.05)。随着乳化剂浓度的增大,各乳化剂制备的乳状液的黏度具有不同程度的升高。粒子在乳液中会进行不规则的布朗运动,乳状液黏度增大时,粒子的运动速率变慢,有利于乳状液的稳定。其中,HI-CAP 100制备的乳状液黏度最低,且随着乳化剂浓度的升高,其黏度变化最小,仅由8×10-3Pa·s上升至15×10-3Pa·s,这是由于其淀粉结构中含有较多短链分子,故在高浓度时仍表现出较低黏度。其他乳化剂在0.5%~4%时,乳状液黏度上升幅度较小,但在乳化剂浓度超过4%后,乳状液黏度显著升高(P<0.05),特别是SSPS和SPI为乳化剂制备的紫苏籽油乳状液在其浓度为16%时,乳状液黏度分别达到(2533)×10-3Pa·s、(2202)×10-3Pa·s,显著高于其他乳化剂制备的乳状液黏度(P<0.05)。SSPS、GA虽均为多糖类乳化剂,但由于SSPS结构中多糖分子链的伸展性较好,故其制备的乳状液黏度较高[14]。此外,CHOI等[15]研究发现,相对分子质量是影响高分子量溶液黏度的一个重要因素,相对分子质量越大,分子链之间相互贯穿、勾挂缠结,使溶液黏度升高。因此,乳化剂的相对分子质量对乳状液的黏度具有一定影响。谢岩黎等[16]的研究表明,SPI的平均相对分子质量在103~104g/mol之间,虽明显小于GA、HI-CAP 100等多糖类物质的分子质量,但由于SPI分子结构中α-螺旋及β-折叠结构含量约占77%,分子排列有序,结构刚性,故乳状液黏度较高。 图3 不同乳化剂制备的紫苏籽油乳状液的黏度Fig.3 Viscosities of perilla seed oil emulsions prepared with different emulsifiers 2.3乳化剂种类及质量分数对紫苏籽油乳状液物理稳定性的影响 间的碰撞机率随之降低,有利于乳液的稳定。此外,乳状液的物理稳定性是评判乳化剂乳化稳定性的重要指标。 一般来讲,乳化剂通过在液滴之间形成相互排斥作用(如空间位阻、静电排斥)以及在液滴表面形成水化层,来防止液滴絮凝或聚结,从而维持乳状液的稳定[17]。由图4可知,随着乳化剂浓度的增大,样品管底部的透光率变化程度逐渐减小,说明乳状液的上浮现象减弱,稳定性逐步提高。此外,前述结果中GA、PG 2000、SPI、SC制备的乳状液粒径先减小后增大,这也说明乳化剂浓度高于4%时,乳状液的黏度对乳液稳定性的影响效果大于粒径。从图4还可以看出,乳化剂质量分数为2%时,SPI制备的乳状液透光率变化极小,说明尽管SPI的乳化活性较低,但其乳化稳定性极强,较适于用作稳定剂。乳化剂质量分数≥4%时,乳状液透光率变化程度为:SSPS、PG 2000、SPI、GA 3结论 本文对6种乳化剂(GA、PG 2000、HI-CAP 100、SSPS、SPI、SC)制备的紫苏籽油乳状液的粒径、黏度及物理稳定性进行了比较研究。结果显示,除SPI外,各乳化剂制备的紫苏籽油乳状液粒径主要分布在0.1~10 μm,且粒度分布多为单峰。4%GA制备的紫苏籽油乳状液粒径最小,为0.678 μm,且乳液不稳定性指数为0.131,Slope值为0.001 5 %/s,乳液稳定性良好,乳化剂质量分数高于4%时,乳状液的不稳定性指数和Slope值虽有一定降低,但综合考虑生产成本等因素,选择4%的GA对紫苏籽油乳状液进行后续的制备研究及氧化稳定性研究。 图5 不同乳化剂制备的乳状液的不稳定性指数及Slope值Fig.5 Instability index and the value of Slope of emulsions prepared with different emulsifiers [1]HARRIS W S, MILLER M, TIGHE A P, et al. Omega-3 fatty acids and coronary heart disease risk: Clinical and mechanistic perspectives[J]. Atherosclerosis, 2008,197(1):12-24. [2]MCMANUS A, MERGA M, NEWTON W. Omega-3 fatty acids. What consumers need to know[J]. Appetite, 2011,57(1):80-83. [3]牟朝丽, 陈锦屏. 紫苏油的脂肪酸组成、维生素E含量及理化性质研究[J]. 西北农林科技大学学报:自然科学版, 2006(12):195-198. [4]COUЁDELO L, BOUÉ-VAYSSE C, FONSECA L, et al. Lymphatic absorption of α-linolenic acid in rats fed flaxseed oil-based emulsion[J]. British Journal of Nutrition, 2011,105(7):1 026-1 035. [5]黄明丽. 酪蛋白酸钠与藻酸丙二醇酯相互作用及其对鱼 油乳状液稳定性的影响[D]. 青岛:中国海洋大学, 2014. [6]FARAJI H, MCCLEMENTS D J, DECKER E A. Role of continuous phase protein on the oxidative stability of fish oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2004,52(14):4 558-4 564. [7]LEE P, CHOO W. Characterization of flaxseed oil emulsions[J]. Journal of Food Science and Technology, 2015,52(7):4 378-4 386. [8]吴旭锦. 紫苏子油纳米乳的研究[D]. 杨凌:西北农林科技大学, 2008. [9]CHIVERO P, GOHTANI S, YOSHII H, et al. Effect of xanthan and guar gums on the formation and stability of soy soluble polysaccharide oil-in-water emulsions[J]. Food Research International, 2015,70:7-14. [10]GUZEY D, MCCLEMENTS D J. Formation, stability and properties of multilayer emulsions for application in the food industry[J]. Advances in Colloid and Interface Science, 2006,128-130:227-248. [11]XIANG S, YAO X, ZHANG W, et al. Gum Arabic-stabilized conjugated linoleic acid emulsions: Emulsion properties in relation to interfacial adsorption behaviors[J]. Food Hydrocolloids, 2015,48:110-116. [12]TCHOLAKOVA S, DENKOV N D, IVANOV I B, et al. Coalescence stability of emulsions containing globular milk proteins[J]. Advances in Colloid and Interface Science, 2006,123-126:259-293. [13]MCCLEMENTS D J. Comments on viscosity enhancement and depletion flocculation by polysaccharides[J]. Food Hydrocolloids, 2000,14(2):173-177. [14]石华乐, 秦玉昌, 姚怡莎, 等. 羧甲基化改性对不同分子量水溶性大豆多糖乳化性的影响[J]. 食品安全质量检测学报, 2015(5):1 790-1 798. [15]CHOI H M, YOO B. Steady and dynamic shear rheology of sweet potato starch-xanthan gum mixtures[J]. Food Chemistry, 2009,116(3):638-643. [16]谢岩黎, 朱晓路, 王芬. 常用微胶囊壁材的分子结构及流变学特性研究[J]. 现代食品科技, 2015(5):59-64.[17]MCCLEMENTS D J. Protein-stabilized emulsions[J]. Current Opinion in Colloid & Interface Science, 2004,9(5):305-313. Preparation and stability evaluation of perilla seed oil emulsions HAN Li-li, HOU Zhan-qun*, WEN Jian, WU Yi-min, QIAN Ying-yan, GONG Shu-li (China National Research Institute of Food & Fermentation Industries, Beijing 100015, China) ABSTRACTThe stability and water solubility of perilla seed oil rich of α-linolenic acid can be improved by incorporating them into oil-in-water emulsions. And perilla seed oil emulsions can be used as ω-3 polyunsaturated fatty acids delivery system in the development of functional food. The purpose of this study was to investigate the effect of emulsifiers on the droplet sizes, viscosities and the physical stability of perilla seed oil emulsions. Gum arabic, HI-CAP 100, Purity gum 2000, Soybean soluble polysaccharides, Sodium caseinate and Soybean protein isolate were used to prepare perilla seed oil emulsions. Results indicated that the emulsions prepared with Gum arabic with a concentration of 4% presented the smallest droplet size (0.678 μm) and the droplet distributed in the range of 0.1~10 μm. With the increase of concentration, viscosity of emulsions increased constantly, and the Instability index and value of Slope reduced gradually. Emulsions prepared with other emulsifiers exhibited a good stability when the concentration of emulsifiers exceeded 4% except HI-CAP 100 and Sodium caseinate. Key wordsemulsion; perilla seed oil; emulsifier; droplet size; stability 收稿日期:2015-11-17,改回日期:2015-12-22 基金项目:国家自然科学基金(31501526);北京市科技计划项目(Z141100002614019) DOI:10.13995/j.cnki.11-1802/ts.201604026 第一作者:硕士研究生(侯占群高级工程师为通讯作者,E-mail:zqhou08@gmail.com)。