熊去氧胆酸降低肝移植术后胆道并发症发生风险的随机对照研究
林建伟 郭志勇 鞠卫强 王东平 马毅 巫林伟 邰强 韩明王小平 陈茂根 朱晓峰 何晓顺
·论著·
熊去氧胆酸降低肝移植术后胆道并发症发生风险的随机对照研究
林建伟1郭志勇2鞠卫强2王东平2马毅2巫林伟2邰强2韩明2王小平2陈茂根2朱晓峰2何晓顺2
目的 评估熊去氧胆酸(UDCA)降低肝移植受者术后胆道并发症(BC)的临床疗效。方法 选取2011年7月至2013年12月于中山大学附属第一医院行肝移植术的215例受者作为本次研究的评估对象。采用随机对照研究方法。入组病例按2 ∶1随机分为用药组和空白组,用药组受者于肝移植术后第1天起每天服用UDCA 250 mg,2次/d;空白组不服用UDCA或其他安慰剂,治疗时间为6个月,停药后继续随访6个月。研究观察终点为复合观察终点,包括非外科因素引起的缺血性胆道病变(ITBL)、术后1个月后由非外科及排斥反应引起的总胆红素(TBIL)>51.3 μmol/L、移植物失功、受者死亡。比较两组受者术前一般情况、手术相关情况、术后各项生化指标、术后转归情况、复合观察终点累积发生率、受者生存比例及移植物累积存活率。采用两独立样本t检验或基于秩次的两独立样本Wilcoxon检验比较年龄、Child-Pugh评分和冷缺血时间等定量资料。用卡方检验或Fisher确切概率法比较开腹手术史、激素诱导等定性资料。采用Kaplan-Meier法绘制生存曲线,利用log-rank检验比较两组复合观察终点累计发生率。P<0.05为差异有统计学意义。结果 60例受者纳入研究:空白组20例,用药组40例。两组受者术前基线情况可比。手术相关情况(冷缺血时间、手术时间、无肝期、热缺血时间、术中出血量、红细胞输注量、ICU住院时间及激素诱导情况)差异均无统计学意义(t=1.12,U=298,U=331,U=359,U=344,U=398,U=329,χ2=0.01,P均>0.05)。空白组受者肝移植术后第1、2、3周血清γ-谷氨酰转肽酶,第2、3、4周血清碱性磷酸酶及第2、3、6个月血清总胆汁酸水平均高于用药组,差异均有统计学意义(U=206、160、148、222、211、219、144、140和94,P均<0.05)。空白组受者术后第1、6、12个月复合观察终点累计发生率分别为15%、15%、28%,用药组分别为3%、18%、18%,两组差异均无统计学意义(χ2=0.66,P>0.05)。空白组受者术后第1、6、12个月生存比例分别为90%、90%、84%,用药组均为97.5%。两组差异均无统计学意义(χ2=3.28,P>0.05)。空白组受者术后第1、6、12个月移植物累积存活率分别为90.0%、84.4%、77.9%,用药组均为97.5%,两组差异均有统计学意义(χ2=5.13,P<0.05)。结论 UDCA对移植肝具有保护作用,可有效减轻由缺血再灌注及疏水性胆汁酸造成的移植肝损伤,促进移植肝酶学指标恢复正常。用药组移植物存活率优于空白组,但在复合观察终点比较中未能显示出降低胆道并发症的临床效果。
熊去氧胆酸; 肝移植; 胆道并发症; 随机对照
我国肝移植供肝来源主要是心脏死亡器官捐献(donation after cardiac death,DCD)[1],因此受者胆道并发症(biliary complication,BC)总体发生率远高于来源于血流动力学相对稳定的脑死亡器官捐献(donation after brain death,DBD)肝移植受者。 DeOliveira等[2]对DCD和DBD肝移植受者进行了配对研究,术后BC发生率分别为19%和13%,其中仅DCD组出现4例缺血性胆道狭窄。Foley等[3]通过对比美国威斯康辛大学1993年至2008年1 157例 DBD肝移植受者和87例DCD肝移植受者发现,DCD组BC总体发生率较DBD组明显升高,其中DCD组缺血性胆道狭窄发生率明显高于DBD组。熊去氧胆酸(ursodeoxycholic acid,UDCA)具有促进胆汁分泌、减轻肝脏缺血再灌注损伤等作用[4],目前已广泛应用于治疗慢性病毒性肝炎、病毒性肝硬化、原发性胆汁性肝硬化及原发性硬化性胆管炎等疾病,是唯一被美国食品和药品监督管理局批准用于治疗原发性胆汁性肝硬化的药物,并可降低肝移植术后原发性胆汁性肝硬化复发[5]。本研究分析了UDCA对肝移植受者术后BC的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2011年7月至2013年12月于中山大学附属第一医院行肝移植术的215例受者作为本次研究的评估对象。入选标准:(1)肝移植受者;(2)年龄18~65周岁,具有独立行为能力;(3)签署知情同意书。排除标准:(1)孕妇或哺乳期;(2)严重的心、肾功能不全;(3)严重的内分泌、血液、神经精神疾病;(4)急性胃或十二指肠溃疡;(5)供、受者ABO血型不合;(6)供肝冷缺血时间超过15 h或热缺血时间超过20 min;(7)肝细胞肝癌患者肿瘤有大血管(肺静脉、肝静脉或下腔静脉)主干侵犯;(8)不在本移植中心随访。剔除标准:(1)依从性差,违反或不遵循试验方案;(2)出现药物相关严重不良事件或实验室检查结果明显异常;(3)受试者撤销知情同意或不愿意继续按方案治疗。共62例受者纳入本研究,进行随机分组后2例要求退出试验。
1.2 研究方法
本研究采用开放性、前瞻性、随机、对照研究方法。试验治疗阶段为6个月,停药后继续随访6个月。用药组受者于肝移植术后第1天起每天服用UDCA 250 mg,2次/d;空白组受者在知情的情况下不服用UDCA及其他安慰剂。用药组和空白组除了是否服用UDCA外,其他治疗不存在任何差别。研究人员将需要随机分组的受者姓名、性别、诊断、身份证号码及所在中心名称5项信息通过手机短信发送至统计学专家,符合入选标准的受者按SAS 9.0统计软件产生的随机数列进行随机分组,按2 ∶1分为用药组和空白组,统计学专家负责派发随机号码及分组。最终纳入研究的受者:空白组20例,用药组40例。研究方案已通过中山大学附属第一医院医学伦理委员会审批,批复件为[2011]231号;已在中国临床试验注册中心申请并注册审核通过,注册研究课题代码为2011A030400005。
1.3 观察指标
对纳入研究的受者进行随访并记录两组受者术后第1、2、3、4周及第2、3、6个月血清相关生化指标。研究的观察终点为复合观察终点,达到以下任一条即视为达到观察终点:(1)由非外科因素引起的缺血性胆道病变(ischemic-type biliary lesion,ITBL);(2)术后1个月后由非外科及排斥反应引起的总胆红素(total bilirubin,TBIL)>51.3 μmol/L;(3)移植物失功;(4)受者死亡。
1.4 统计学方法
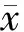
2 结 果
2.1 术前一般情况
空白组和用药组肝移植受者术前一般情况如表1所示,差异均无统计学意义(P均>0.05)。

表1 空白组和用药组肝移植受者术前一般情况
注: MELD. 终末期肝病模型;-. 无数据
2.2 手术相关情况
空白组及用药组供肝冷缺血时间、手术时间、无肝期、热缺血时间、术中出血量、红细胞输注量、术后ICU住院时间、激素诱导(甲泼尼龙500 mg)差异均无统计学意义(P均>0.05),见表2。除用药组中1例受者采用胆肠吻合方式,其余均采用胆管端端吻合方式。
2.3 肝移植术后生化指标及转归
对两组各随访时间点生化指标进行对比,其中空白组肝移植术后第1、2、3周血清γ-谷氨酰转肽酶(gamma glutamyltransferase,GGT)和第2、3、4周血清碱性磷酸酶(alkaline phosphatase,ALP)水平均高于用药组,第2、3、6个月血清总胆汁酸水平均低于用药组,差异均有统计学意义(P均<0.05)。见表3。
术后随访1年,两组肝移植受者术后转归情况见表4。空白组1例受者发生移植物失功。空白组和用药组分别有3例和1例受者死亡,其中空白组1例受者因肝动脉血栓(hepatic artery thrombosis,HAT)形成继发胆管炎、肝脓肿,于术后第8个月因肺部感染死亡;其余受者死亡原因均为移植物原发性无功能。两组受者共出现18例BC,外科因素和非外科因素所致的BC分别为12例和6例,空白组和用药组各出现9例BC。由于并发症统计中存在病例重复,因此综合起来,空白组和用药组分别有5例和6例受者达到观察终点。

表4 空白组和用药组肝移植受者术后1年转归情况(例)
注: ITBL. 缺血性胆道病变
空白组受者术后1、6、12个月复合观察终点累积发生率分别为15%、15%、28%,用药组分别为3%、18%、18%,两组差异无统计学意义(χ2=0.66,P>0.05)。
对BC发生情况进行分析,12例(空白组8例,用药组4例)发生在术后3个月内;3例(均为用药组)发生在术后3~6个月内;3例(空白组1例,用药组2例)发生在术后7~12个月内。BC明确诊断后,13例需行有创性治疗,其中空白组6例,用药组7例;7例(空白组4例,用药组3例)行经内镜下逆行胰胆管造影术治疗后痊愈;5例(空白组1例,用药组4例)行经皮经肝胆管引流术(percutaneous transhepaticcholangial drainage,PTCD)治疗,仅有空白组1例行PTCD后出现反复胆管炎、肝脓肿,最终于术后8个月继发肺部感染死亡;剩余空白组1例受者等待二次肝移植治疗。对发生BC的18例受者的供器官来源进行分析,其中DCD供肝12例(空白组8例,用药组4例);司法来源供肝6例(空白组1例,用药组5例)。
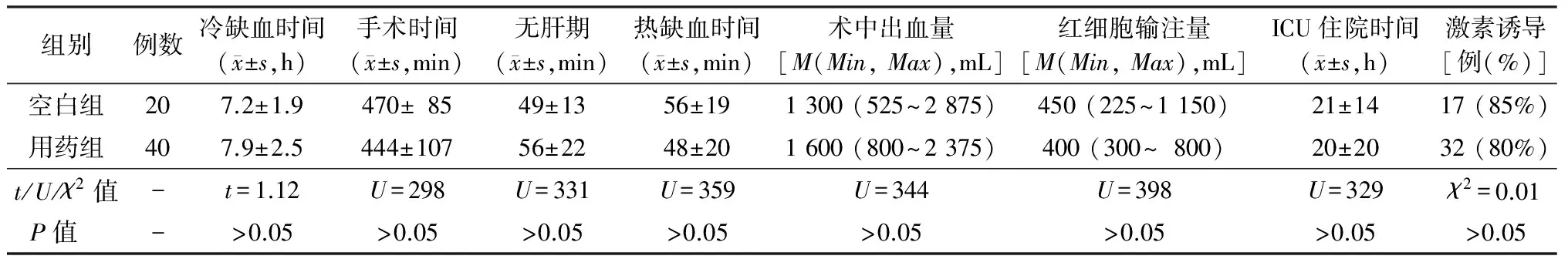
表2 空白组和用药组肝移植受者手术相关情况
注: -. 无数据
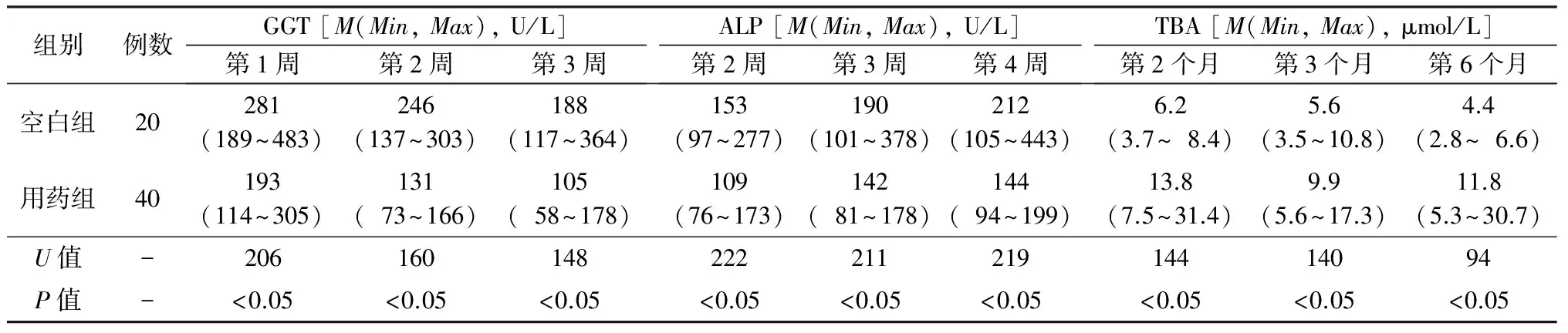
表3 空白组和用药组肝移植受者术后随访血清生化指标比较
注: GGT. γ-谷氨酰转肽酶;ALP. 碱性磷酸酶;TBA. 总胆汁酸;-. 无数据
空白组受者术后第1、6、12个月生存比例分别为90%、90%、84%,用药组均为97.5%,差异均无统计学意义[χ2=3.28,P>0.05;HR=6.10,95%CI(0.88,56.59)]。空白组术后1、6、12个月移植物累积存活率分别为90.0%、84.4%、77.9%,用药组均为97.5%,差异均有统计学意义[χ2=5.13,P<0.05;HR=8.16,95%CI(1.37 ,57.06)]。见图1。

图1 空白组和用药组肝移植受者术后移植物生存曲线
对不良事件进行临床分析,仅用药组发现1例全身荨麻疹事件与使用UDCA相关。该受者出现荨麻疹后,停用UDCA,12 h后荨麻疹消失,未再发皮疹。
3 讨 论
胆汁淤积性疾病相关研究证明,胆盐在细胞内蓄积会导致肝细胞损伤[6],同样的损伤也可发生在胆道上皮细胞。在发生缺血损伤时可导致胆管上皮细胞的顶端钠依赖性胆汁酸转运体和有机溶质转运蛋白α和β表达失平衡,导致毒性疏水性胆盐在胆管上皮细胞中淤积造成损伤。胆道上皮细胞通过分泌HCO3-在细胞表面形成碱性环境,使疏水性胆盐去质子化,阻挡疏水性胆盐对肝细胞和胆道上皮细胞膜的损伤。肝移植中的缺血损伤可导致胆道上皮细胞膜的Cl-/ HCO3-转运蛋白(阴离子交换蛋白2和囊性纤维化跨膜传导调节因子)表达下降,加上能量来源ATP减少,导致HCO3-分泌减少,使胆汁的碱性环境改变,最终导致疏水性胆盐对胆道上皮细胞膜的损伤加重。加用UDCA后,用药组血胆汁酸较空白组高,而GGT和ALP较空白组明显下降,提示UDCA可能通过替换疏水性胆汁酸减少毒性胆汁和膜稳定作用减轻细胞缺血再灌注损伤,从而减少GGT释放;同时通过胆汁酸肠肝循环不断生成HCO3-,刺激胆汁分泌,减轻胆汁淤积,促进GGT排泄,从而降低血清GGT水平。同样,当受者发生胆汁排泄受阻时,ALP可返流入血增多,导致血清中ALP水平增高。本研究中术后第2、3、4周空白组血清ALP均高于用药组。上述结果说明,UDCA对移植肝缺血再灌注损伤有保护作用,与降低GGT机制一致,可能通过减少ALP入血,促进ALP经胆汁排出从而降低血清ALP水平。
肝移植先驱Roy Calne将BC称为肝移植的“阿喀琉斯之踵”,严重制约肝移植的发展。国外报道BC发生率为7%~35%,其中ITBL发生率为1.4%~26%[7-9];BC至今仍占导致肝移植术后死亡原因的1%,占再次肝移植病因的10%[10]。目前BC发病机制仍未完全明确,主要考虑以下危险因素[2-3, 11-14]:(1)HAT形成;(2)手术导致肝外胆道周围动脉血管网破坏[15];(3)热缺血及冷缺血损伤;(4)缺血再灌注损伤;(5)外科吻合技术;(6)胆汁的毒性作用。此外,Halme等[16]提出CMV感染是BC的病因之一,发生BC的受者中75%存在CMV抗原血症。另外,硬化性胆管炎、自身免疫性肝炎、供肝脂肪样变、供者升压药使用、ABO血型不符等均被认为是肝移植受者术后发生BC的高危因素[7]。导致肝移植术后受者发生BC的原因中以外科因素为主,本研究中发生BC的18例受者中,与外科因素相关12例。已有大量文献证实缺血性胆道病变受各种供者因素影响[12, 17],其中包括供者年龄、体质量指数、器官获取前肝功能以及冷、热缺血时间等。针对UDCA的药物治疗作用,研究中选用外科因素所致的ITBL作为主要观察终点的重要组成部分,占入组病例的10%(6/60),空白组和用药组分别为1例和5例。目前认为ITBL是由于供器官在获取前及获取时供者胆道微循环动脉已经形成微血栓,再加上胆汁对胆道上皮的损伤,移植肝复流后胆管未能形成有效循环,造成胆管上皮细胞坏死脱落,形成胆管溃疡,诱发胆泥形成,并因溃疡基底肉芽组织增生形成纤维化愈合,导致胆道狭窄。
4 总 结
UDCA在肝移植受者中的使用是安全的,对移植肝具有保护作用,促进术后移植肝酶学指标(血清GGT和ALP)恢复正常及肝功能恢复。用药组移植物存活率优于空白组,提示UDCA对胆道上皮有保护作用,但在复合观察终点比较中未能显示出降低胆道并发症的临床效果。
因病例纳入进度缓慢,本研究仅为单中心中期报告。目前研究病例仅纳入60例,数量偏少,尚不能全面反映UDCA的治疗效果,需要多中心、大样本的进一步研究。
1 中华医学会器官移植学分会. 中国心脏死亡器官捐献工作指南(第2版)[J/CD]. 中华移植杂志: 电子版, 2012,6(3):221-224.
2 DeOliveira ML, Jassem W, Valente R, et al. Biliary complications after liver transplantation using grafts from donors after cardiac death: results from a matched control study in a single large volume center[J]. Ann Surg, 2011,254(5):722-723.
3 Foley DP, Fernandez LA, Leverson G, et al. Biliary complications after liver transplantation from donation after cardiac death donors: an analysis of risk factors and long-term outcomes from a single center[J]. Ann Surg, 2011,253(4):817-825.
4 Soderdahl G, Nowak G, Duraj F, et al. Ursodeoxycholic acid increased bile flow and affects bile composition in the early postoperative phase following liver transplantation[J]. Transpl Int, 1998,11(Suppl 1):S231-S238.
5 Bosch A, Dumortier J, Maucort-Boulch D, et al. Preventive administration of UDCA after liver transplantation for primary biliary cirrhosis is associated with a lower risk of disease recurrence[J]. J Hepatol, 2015,63(6):1449-1458.
6 Palmeira CM, Rolo AP. Mitochondrially-mediated toxicity of bile acids[J]. Toxicology, 2004,203(1-3):1-15.
7 Buis CI, Hoekstra H, Verdonk RC, et al. Causes and consequences of ischemic-type biliary lesions after liver transplantation[J]. J Hepatobiliary Pancreat Surg, 2006,13(6):517-524.
8 Heidenhain C, Pratschke J, Puhl G, et al. Incidence of and risk factors for ischemic-type biliary lesions following orthotopic liver transplantation[J]. Transpl Int, 2010,23(1):14-22.
9 Nakamura N, Nishida S, Neff GR, et al. Intrahepatic biliary strictures without hepatic artery thrombosis after liver transplantation: an analysis of 1,113 liver transplantations at a single center[J]. Transplantation, 2005,79(4):427-432.
10 Adam R, Karam V, Delvart V, et al. Evolution of indications and results of liver transplantation in Europe. A report from the European Liver Transplant Registry (ELTR)[J]. J Hepatol, 2012,57(3):675-688.
11 Sanni A, Asher J, Wilson C, et al. Predisposing factors for biliary complications following liver transplantation[J]. Transplant Proc, 2006,38(8):2677-2678.
12 Maheshwari A, Maley W, Li Z, et al. Biliary complications and outcomes of liver transplantation from donors after cardiac death[J]. Liver Transpl, 2007,13(12):1645-1653.
13 Teoh NC, Farrell GC. Hepatic ischemia reperfusion injury: pathogenic mechanisms and basis for hepatoprotection[J]. J Gastroenterol Hepatol, 2003,18(8):891-902.
14 Buis CI, Geuken E, Visser DS, et al. Altered bile composition after liver transplantation is associated with the development of nonanastomotic biliary strictures[J]. J Hepatol, 2009,50(1):69-79.
15 霍胜军, 范松青, 谭善彰. 肝外胆管供血动脉在临床肝移植的应用解剖研究[J]. 中华器官移植杂志, 2005,26(2):103-104.
16 Halme L, Hockerstedt K, Lautenschlager I. Cytomegalovirus infection and development of biliary complications after liver transplantation[J]. Transplantation, 2003,75(11):1853-1858.
17 de Vera ME, Lopez-Solis R, Dvorchik I, et al. Liver transplantation using donation after cardiac death donors: long-term follow-up from a single center[J]. Am J Transplant, 2009,9(4):773-781.
(本文编辑:徐小明)
林建伟, 郭志勇, 鞠卫强, 等. 熊去氧胆酸降低肝移植术后胆道并发症发生风险的随机对照研究[J/CD]. 中华移植杂志: 电子版, 2016, 10(4):159-164.
Ursodeoxycholic acid decreases risk of biliary complications after liver transplantation: a randomized controlled trial
LinJianwei1,GuoZhiyong2,JuWeiqiang2,WangDongping2,MaYi2,WuLinwei2,TaiQiang2,HanMing2,WangXiaoping2,ChenMaogen2,ZhuXiaofeng2,HeXiaoshun2.1
DepartmentofGeneralSurgery,theThirdPeople′sHospitalofShenzhen,Shenzhen518112,China;2OrganTransplantationCenter,FirstAffiliatedHospitalofSunYat-SenUniversity,Guangzhou510080,ChinaCorrespondingauthor:HeXiaoshun,Email:gdtrc@163.com
Objective This study was designed to investigate the effects of ursodeoxycholic acid (UDCA) administration on the incidence of biliary complication (BC) and the possible side effects after liver transplantation. Methods Two hundred and fifteen recipients who got liver transplantation in First Affiliated Hospital of Sun Yat-Sen University between July 2011 and December 2013 were selected as evaluation objects. Randomized controlled study method was used. The recipients who met the inclusion criterias were randomly divided into two groups by the ratio of 2 to 1. Time of drug treatment was 6 months and all the recipients were still followed up for 6 months after drug treatment. General preoperative, operation related indexes, prognosis, composite observation endpoints incidence, survival rate, graft cumulative survival rate of recipients were compared. The composite observation endpoints included ischemia-type biliary lesions (ITBL) by non-surgical factor, TBIL> 51.3 μmol/L 1 month after surgery without surgical and rejection factors, graft loss and death. Quantitative data like age, Child-Pugh score, cold ischemia time between the two groups was compared by two independent samplet-test or Wilcoxon rank testing. Qualitative data like the history of open operation and hormone induction between the two groups was compared by Chi-squared test or Fisher′s exact test. Survivorship curve was diagramed by Kaplan-Meier. The cumulative incidence of composite observation endpoints between the two groups was compared by log rank test. Results 60 cases were enrolled eventually, including 20 cases of the control group, 40 cases of UDCA treatment group. There was no statistical difference on general preoperative and operation related indexes (cold ischemia time, operation time, anhepatic phase, warm ischemic time, blood loss during operation, blood red cell transfusion, ICU stay time and hormone induction) between two groups (t=1.12,U=298,U=331,U=359,U=344,U=398,U=329,χ2=0.01,Pall>0.05). For UDCA treatment group, serum GGT levels at post-transplant week 1, 2, 3, ALP levels on post-transplant week 2, 3, 4 and TBA levels on post-transplant month 2, 3, 6 were all significantly lower than those of control group (U=206、160、148、222、211、219、144、140 and 94,Pall<0.05). There was no statistical difference on composite endpoint cumulative incidence and survival rate of recipients during 1th, 6th, 12th month between the two groups (χ2=0.66 and 3.28,Pall>0.05). Statistical significance was found when compared the graft cumulative survival rate of the two groups on post-transplant month 1, 6, 12 (χ2=5.13,P<0.05). Conclusions This study demonstrated that it was safe for UDCA using in liver transplant recipients. UDCA improves serum liver tests in the early postoperative period, which was consistent with the hypothesis that UDCA may protect the hepatobiliary system against hydrophobic bile acids and ischemical reperfusion injury early after liver transplantation. The graft survival rate of UDCA treatment group was better than the control group, but the clinical effect of reducing bile duct complications could not be shown in the comparison of the composite observation endpoints.
Ursodeoxycholic acid; Liver transplantation; Biliary complication; Randomized control
10.3877/cma.j.issn.1674-3903.2016.04.003
广东省器官捐献与移植免疫重点实验室建设项目(2013A061401007);公益性行业科研专项基金(201302009)
518112 深圳市第三人民医院普外科1; 510080 广州,中山大学附属第一医院器官移植中心2
何晓顺, Email: gdtrc@163.com
2016-05-06)

