西罗莫司联合常规免疫抑制方案治疗慢性移植物肾病的近期疗效
赵德威 周伊娜 高小民 林斌伟 夏鹏
·论著·
西罗莫司联合常规免疫抑制方案治疗慢性移植物肾病的近期疗效
赵德威 周伊娜 高小民 林斌伟 夏鹏
目的 探讨西罗莫司联合常规免疫抑制方案治疗慢性移植物肾病(CAN)的安全性和有效性。方法 回顾性分析1999年9月至2014年9月在温州医科大学附属第一医院肾移植术后发生CAN并采用西罗莫司联合常规免疫抑制方案治疗的56例患者资料。观察西罗莫司联合治疗前及治疗后1、3、6、12个月血清肌酐、肾小球滤过率、肝功能、血脂、血常规和尿常规等结果,观察联合治疗1年内急性排斥反应、感染和移植肾失功等发生情况。采用重复测量资料方差分析比较西罗莫司联合治疗前、后各时间点血清肌酐和肾小球滤过率。P<0.05为差异有统计学意义。结果 截至2015年12月,56例CAN患者接受西罗莫司联合治疗方案后平均随访时间(24±11)个月。西罗莫司联合治疗前患者平均血清肌酐和肾小球滤过率分别为(134±57)μmol/L和(61±21)mL/min,联合治疗后血清肌酐下降,肾小球滤过率上升。联合治疗后3、6、12个月与联合治疗前相比,差异均有统计学意义(P均<0.05);56例患者联合治疗后12个月均未发生急性排斥反应、感染、死亡及移植肾失功。6例患者联合治疗前已出现新发恶性肿瘤,联合治疗后肿瘤未见明显转移或病情进展;其余患者未见新发恶性肿瘤。新发高脂血症35例,经对症治疗后缓解。无新发肝功能异常和新发血糖异常患者。结论 西罗莫司联合常规免疫抑制方案治疗CAN患者是安全、有效的,可以改善移植肾功能,但需要注意患者血脂变化。
肾移植; 西罗莫司; 钙调磷酸酶抑制剂; 慢性移植物肾病; 联合治疗
肾移植是目前治疗终末期肾功能衰竭的有效方式,术后免疫抑制剂的合理应用对肾移植效果起着至关重要的作用。CNI主要包括他克莫司、环孢素等,基于CNI的免疫抑制方案对预防排斥反应、维持移植物功能有确定疗效[1]。然而,CNI肾毒性是导致慢性移植物肾病(chronic allograft nephropathy,CAN)发生的重要因素之一[2-3]。CAN定义为肾移植术后3个月开始出现肾功能缓慢下降,常伴有或不伴蛋白尿及高血压的恶化,是晚期移植肾丢失的主要原因之一。
西罗莫司是一种新型免疫抑制剂,其主要作用机制是通过结合哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),阻断T细胞及其他细胞由G1至S期的进程,阻止T细胞增殖,维持肾移植受者的免疫抑制状态[4]。西罗莫司对肾移植受者并发症的防治和提高移植物长期存活率的效果受到医学界广泛关注[5]。本研究旨在探讨西罗莫司联合常规免疫抑制方案治疗CAN患者的安全性及有效性。
1 资料与方法
1.1 一般资料
回顾性分析1999年9月至2014年9月在温州医科大学附属第一医院器官移植科行同种异体肾移植术的CAN患者资料。纳入标准:(1)首次接受肾移植;(2)肾移植术后出现爬行肌酐,6个月内升高超过25%或经移植肾穿刺病理活检,证实CAN;(3)确诊CAN后接受西罗莫司联合治疗的免疫抑制方案;(4)随访时间>12个月。排除标准:(1)有全身或局部活动性感染的征象;(2)移植肾存在活动性排斥反应;(3)辅助检查证实存在移植肾泌尿系统梗阻,并影响移植肾功能。最终56例CAN患者纳入研究,男性41例,女性15例,中位年龄46岁(20~69岁)。研究方案经医院伦理委员会批准,西罗莫司联合免疫抑制方案取得患者或家属知情同意。
1.2 治疗方案
肾移植术后常规免疫抑制方案:36例CAN患者肾移植术后采用他克莫司+吗替麦考酚酯(mycophenolate mofetil,MMF)+甲泼尼龙三联免疫抑制方案,20例采用环孢素+MMF+甲泼尼龙三联免疫抑制方案。他克莫司初始剂量为0.05~0.15 mg·kg-1·d-1,环孢素初始剂量为6~8 mg·kg-1·d-1,根据血药浓度谷值、血清肌酐及本中心既往用药经验调整剂量,他克莫司血药浓度控制在4~10 ng/mL,环孢素血药浓度控制在60~100 mg/mL。MMF起始剂量为1.5~2.0 g/d,维持剂量0.5~1.0 g/d;甲泼尼龙初始剂量64 mg,随后每日递减8 mg,维持剂量为4~6 mg/d。56例CAN患者被确诊后,在原免疫抑制方案基础上联合应用西罗莫司治疗,西罗莫司初始剂量为1 mg/d,服药1周后监测血药浓度,维持在3~6 ng/mL。
1.3 主要观察指标
西罗莫司联合治疗前及治疗后1、3、6、12个月检测血常规、血生化和尿常规等,观察血清肌酐、肾小球滤过率(采用Cockcroft-Gault公式计算)、肝功能、血糖、低密度脂蛋白、三酰甘油、总胆固醇、24 h尿蛋白(定性)及血小板变化。观察急性排斥反应、感染和移植肾失功发生情况。
1.4 统计学方法
2 结 果
截至2015年12月,56例CAN患者在接受西罗莫司联合治疗方案后平均随访时间(24±11)个月,无失访病例。37例患者因6个月内肌酐爬行性增高超过25%确诊CAN;19例经移植肾病理检查确诊CAN,其中16例为慢性间质性肾炎(包括5例合并急性间质性肾炎,2例合并IgA肾病),3例为慢性肾小球肾炎。此外,1例患者在肾移植术前曾行心脏死亡器官捐献供肝移植。
56例CAN患者西罗莫司联合治疗后12个月均未发生急性排斥反应、感染、移植肾失功及死亡。西罗莫司联合治疗前,6例患者出现新发恶性肿瘤(肺部2例、牙龈1例、膀胱1例、甲状腺1例、输尿管1例),联合治疗后肿瘤未见明显转移或病情进展;其余患者定期复查B超及肿瘤指标未见新发恶性肿瘤证据。
2.1 西罗莫司联合治疗效果
56例CAN患者在西罗莫司联合治疗前和治疗后1、3、6、12个月血清肌酐及肾小球滤过率见表1。西罗莫司联合治疗后,患者血清肌酐下降,肾小球滤过率上升。联合治疗前患者平均血清肌酐和肾小球滤过率分别为(134±57)μmol/L和(61±21)mL/min,联合治疗后1个月与治疗前相比差异无统计学意义(P>0.05),联合治疗后3、6、12个月与治疗前相比,差异均有统计学意义(P均<0.05)。17例患者联合治疗前24 h尿蛋白阳性,9例经联合治疗后好转,7例转为阴性;1例联合治疗后出现24 h 尿蛋白阳性。
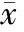
表1 56例慢性移植物肾病患者西罗莫司联合常规免疫抑制方案治疗前、后各时间点肾功能(±s)
注:a. 与治疗前相比,P<0.05
2.2 药物不良反应
西罗莫司联合治疗后,56例CAN患者中新发高脂血症35例。28例(50.0%)为总胆固醇升高,均伴有低密度脂蛋白升高,其中11例(19.6%)合并三酰甘油升高;5例(8.9%)仅三酰甘油升高;2例(3.6%)仅低密度脂蛋白升高,经饮食调整和口服他汀类药物后降至正常。
5例患者联合治疗前发现药物性肝损害,经护肝治疗后肝功能恢复正常,联合治疗后未再发生肝功能异常;其余患者联合治疗前、后均未发生肝功能异常。7例患者联合治疗前出现血糖升高,经调整降糖药或胰岛素用量后4例血糖恢复正常,联合治疗后未发生血糖异常;3例联合治疗后血糖维持在联合治疗前水平(<11 mmol/L);其余患者联合治疗前、后均未发生血糖异常。
1例患者联合治疗后发生血小板减少,经输注重组人促红素治疗后血小板计数恢复正常水平。随访过程中无患者发生白细胞减少。
3 讨 论
提高肾移植术后受者长期生存率,维持移植物功能,避免免疫抑制剂不良反应是肾移植术后免疫抑制治疗的目标。自CNI问世以来,其抗排斥反应疗效得到了广泛认可,但其长期应用所带来的肝肾毒性及其导致的CAN是困扰医学界的一个问题。Mattos等[6]研究发现,肾移植受者应用CNI类药物期间可以明确观察到肾毒性,如何有效地减少或预防CNI类药物肝肾毒性对CAN的防治有着重要意义。此外,肾移植受者长期应用免疫抑制剂,机体免疫监视功能下降,导致新发肿瘤发生率升高,也是影响肾移植受者术后长期生存率的因素之一。研究显示,肾移植术后恶性肿瘤发生率是透析患者的3倍以上,我国肾移植术后新发恶性肿瘤的发生率为3.6%,北方以泌尿系统肿瘤为主,南方则多见肝癌、皮肤癌、淋巴癌和Kaposi肉瘤[7-9]。
西罗莫司作为一种新型抗淋巴细胞药物mTOR抑制剂,其突出的特点是肾毒性较低,且具有抗增殖和抗肿瘤作用[10-13]。西罗莫司在肾移植术后的应用成为近年来临床研究的热点。王沫等[14]研究显示,低剂量CNI联合西罗莫司的四联免疫抑制方案可以改善CAN患者的移植肾功能。Knight等[15]对免疫应答低下的胰肾联合移植受者进行研究,一组采用西罗莫司+环孢素+泼尼松免疫抑制方案;一组联用小剂量环孢素+西罗莫司,早期撤除泼尼松,后期将环孢素转换为MMF;术后2年两组移植物功能无明显差异。此外,Campistol等[16]研究表明,应用西罗莫司可以降低器官移植受者术后恶性肿瘤的罹患率。
本研究56例CAN患者在西罗莫司联合治疗后,血清肌酐下降,肾小球滤过率升高,从联合治疗1个月后即开始显效,3个月后趋于稳定;提示西罗莫司可以在一定程度上缓解CAN,减轻以CNI为基础的免疫抑制方案的肾毒性。同时,56例CAN患者联合治疗后12个月内均未发生急性排斥反应和感染,提示西罗莫司联合常规免疫抑制方案治疗CAN的短期安全性较好。本研究中6例CAN患者在联合治疗前发现新发肿瘤,联合治疗后未见肿瘤转移或明显进展;其余50例患者在随访期间未见新发恶性肿瘤,提示西罗莫司联合治疗短期内未增加肿瘤发生和恶化的风险。
西罗莫司不良反应主要包括高脂血症、肝功能异常、感染和骨髓抑制[17-18]。丰贵文等[19]研究显示,西罗莫司转换治疗1年后高脂血症发生率为46.2%,他汀类药物对控制西罗莫司所致的高脂血症有显著效果。王长希等[20]研究也表明,高浓度西罗莫司的应用会增加高脂血症的发生率。本研究接受西罗莫司联合治疗的56例CAN患者中,35例出现血脂升高,经饮食调整和口服他汀类药物后均降至正常范围。尽管有研究表明西罗莫司也会导致肝功能异常[21],但本研究中未见新发肝功能异常病例。西罗莫司具有一定的骨髓抑制作用,应在治疗时定期复查血常规,必要时行骨髓穿刺,及时诊治。此外,与CNI可能增加移植后糖尿病发生率[22]相比,本研究结果显示西罗莫司联合治疗对血糖无明显影响。
霍文等[23]研究显示,西罗莫司不良反应与剂量和浓度相关,调整用量、降低血药浓度可减少不良反应。Cravedi等[24]研究表明,增加西罗莫司的剂量和浓度会增加移植肾功能延迟恢复和蛋白尿的发生风险。本研究中西罗莫司联合治疗期间未发生感染和白细胞减少,一方面考虑联合治疗方案中西罗莫司剂量低,且患者定期随访依从性较高,故相关不良反应较少;另一方面考虑本研究纳入病例较少,随访时间较短,可能导致相关不良反应未充分暴露而产生偏差。
本研究将西罗莫司作为辅助用药,减少剂量,降低血药浓度,与单独的西罗莫司转换方案相比,可以减少不良反应的发生;同时,西罗莫司治疗费用较高,相比于转换方案可以减轻患者的经济负担。本中心经验提示:经临床及病理结果确诊CAN后,常规免疫抑制方案联合应用西罗莫司2~4周,规律随访并调整剂量,如发生不良反应酌情减量或停药;对于既往有脑卒中、冠状动脉粥样硬化等疾病的患者,尤其需要关注其血脂变化,及时调整用药;同时,提高患者依从性,定期随访,对减少药物不良反应的发生非常重要。
综上所述,西罗莫司联合常规免疫抑制方案治疗CAN患者是安全、有效的,但其远期疗效和西罗莫司与其他免疫抑制剂的相互作用,还有待更多病例、更长随访时间的进一步研究。
1 Halloran PF. Immunosuppressive drugs for kidney transplantation[J]. N Engl J Med, 2004,351(26):2715-2729.
2 Nankivell BJ, Borrows RJ, Fung CL, et al. The natural history of chronic allograft nephropathy[J]. N Engl J Med, 2003,349(24):2326-2333.
3 Nankivell BJ, Borrows RJ, Fung CL, et al. Calcineurin inhibitor nephrotoxicity: longitudinal assessmment by protocol histology[J]. Transplantation, 2004,78(4):557-565.
4 Soliman GA. The mammalian target of rapamycin signaling network and gene regulation[J]. Curr Opin Lipidol, 2005,16(3):317-323.
5 Yu JH, Kim KW, Kim BM, et al. Safety and immunologic benefits of conversion to sirolimus in kidney transplant recipients with long-term exposure to calcineurin inhibitors[J]. Korean J Intern Med, 2016,31(3):552-559.
6 de Mattos AM, Olyaei AJ, Bennett WM. Nephrotoxicity of immunosuppressive drugs: long-term consequences and challenges for the future[J]. Am J Kidney Dis, 2000,35(2): 333-346.
7 Berardinelli L, Messa PG, Pozzoli E, et al. Malignancies in 2 753 kidney recipients transplanted during a 39-year experience[J]. Transplantat Proc, 2009,41(4):1231-1232.
8 刘广华, 李汉忠, 王惠君, 等. 肾移植术后恶性肿瘤的发病类型和治疗[J]. 中国医学科学院学报, 2009,31(3):288-291.
9 彭明强, 杨志豪, 方自林. 国内公开报道的肾移植后并发恶性肿瘤病例的总结分析[J]. 中华器官移植杂志, 2005,26(5):269-271.
10 林俊, 唐雅望, 孙雯, 等. 肾移植术后西罗莫司联合减量或停用环孢素A的应用体会[J]. 中华外科杂志, 2009,47(17):1319-1321.
11 Ventura-Aguiar P, Campistol JM, Diekmann F. Safety of mTOR inhibitors in adult solid organ transplantation[J]. Expert Opin Drug Saf, 2016,15(3):303-319.
12 Yu K, Toral-Barza L. Biochemical and pharmacological inhibition of mTOR by rapamycin and an ATP-competitive mTOR inhibitor[J]. Methods Mol Biol, 2012,821:15-28.
13 Law BK. Rapamycin: an anti-cancer immunosuppressant?[J]. Crit Rev Oncol Hematol, 2005,56(1):47-60.
14 王沫, 何辉, 胡建敏, 等. 低剂量钙调磷酸酶抑制剂联合西罗莫司的四联免疫抑制方案在治疗慢性移植肾肾病中的应用[J]. 广东医学, 2014, 35(6):925-927.
15 Knight RJ, Podder H, Kerman RH, et al. Comparing an early corticosteroid/late calcineurin-free immunosuppression protocol to a sirolimus-, cyclosporine A-, and prednisone-based regimen for pancreas-kidney transplantation[J]. Transplantation, 2010,89(6):727-732.
16 Campistol JM. Minimizing the risk of cancer in transplant patients[J]. G Ital Nefrol, 2010,27(Suppl 50):S81-S85.
17 胡平亚, 方国英, 史东明. 西罗莫司的抗肿瘤应用及不良反应概述[J]. 中国药师, 2014,17(1):156-158.
18 Augustine JJ, Bodziak KA, Hricik DE. Use of sirolimus in solid organ transplantation[J]. Drugs, 2007,67(3):369-391.
19 丰贵文, 王志刚, 李金锋, 等. 西罗莫司转换治疗对肾移植受者血脂的影响及辛伐他汀的降脂效果[J]. 郑州大学学报(医学版), 2014,49(1):69-72.
20 王长希, 尚文俊, 陈立中, 等. 雷帕霉素对肾移植受者血脂的影响[J]. 肾脏病与透析肾移植杂志, 2004,13(3):222-225.
21 Toscano E, Cotta J, Robles M, et al. Hepatotoxicity induced by new immunosuppressants[J]. Gastroenterol Hepatol, 2010,33(1):54-65.
22 Rodriguez-Rodriguez AE, Trianes J, Velazquez-Garcia S, et al. The higher diabetogenic risk of tacrolimus depends on pre-existing insulin resistance. A study in obese and lean Zucker rats[J]. Am J Transplant, 2013,13(7):1665-1675.
23 霍文. 肾移植后西罗莫司致不良反应的文献分析[J]. 中国组织工程研究与临床康复, 2010,14(31):5825-5828.
24 Cravedi P, Ruggenenti P, Remuzzi G. Sirolimus for calcineurin inhibitors in organ transplantation: contra[J]. Kidney Int, 2010,78(11):1068-1074.
(本文编辑:鲍夏茜)
赵德威, 周伊娜, 高小民, 等. 西罗莫司联合常规免疫抑制方案治疗慢性移植物肾病的近期疗效[J/CD]. 中华移植杂志:电子版, 2016,10(4):178-181.
Effect of combination therapy of sirolimus and conventional immunosuppressive therapeutic schedule on chronic allograft nephropathy
ZhaoDewei,ZhouYina,GaoXiaomin,LinBinwei,Xiapeng.
DepartmentofKidneyTransplantation,FirstAffiliatedHospitalofWenzhoumedicalUniversity,Wenzhou325000,China.Correspondingauthor:XiaPeng,Email:pengxia602@163.com
Objective To investigate the safety and validity of combination therapy of sirolimus and conventional immunosuppressive therapeutic schedule on chronic allograft nephropathy (CAN). Methods Clinical data of 56 recipients who developed CAN after getting renal transplantation during September 1999 to September 2014 in the First Affiliated Hospital of Wenzhou Medical University were retrospectively analyzed. The indexes of serum creatinine, glomerular filtration rate,liver function,blood lipid,blood routine examination and urinalysis were observed before and 1,3,6,12 months after combination therapy. The occurrence of acute rejection, infection and graft dysfunction were also observed one year during combination therapy. Results The mean follow-up time after getting combination therapy was (24±11) months. The mean serum creatinine and glomerular filtration rate of the 56 CAN recipients was (134±57) μmol/L and (61±21) mL/min before getting combination therapy, after combination therapy, the serum creatinine of them decreased and glomerular filtration rate increased, and the difference between before and 3,6,12 months after combination therapy showed statistically significant (Pall <0.05). No acute rejection, infection, death and graft dysfunction were occured in the above recipients one year after combination therapy. Six cases had new-onset malignant tumor before combination therapy, no tumor metastasis and progression were observed after combination therapy. The rest of the recipients did not develop new malignant tumor. Thirty-five recipients had new-onset hyperlipidemia, which relieved after symptomatic treatment. No new case of abnormal liver function and pathoglycemia was observed. Conclusions The combination therapy of sirolimus and conventional immunosuppressive therapeutic schedule for CAN was safe and effective, and could improve the function of transplant kidney. However, the change of blood lipid should be noted.
Renal transplantion; Sirolimus; Calcineurin inhibitor; Chronic allograft nephropathy; Combination therapy
10.3877/cma.j.issn.1674-3903.2016.04.007
325000 温州医科大学附属第一医院移植科
夏鹏,Email: pengxia602@163.com
2016-05-31)

