有机溶剂处理提高固定化脂肪酶活性及稳定性
祖 昕, 杜 凯, 曹 方, 孙玉梅(大连工业大学生物工程学院,辽宁大连116034)
有机溶剂处理提高固定化脂肪酶活性及稳定性
祖昕,杜凯,曹方,孙玉梅*
(大连工业大学生物工程学院,辽宁大连116034)
摘要:为提高固定化脂肪酶催化转酯化反应的活性和稳定性,采用活性炭、硅胶G和DM-130树脂吸附固定脂肪酶LVK-F100,并用甲醇、丙酮、丙醇、异丙醇、乙酸乙酯、正己烷以及环己烷处理湿的固定化脂肪酶。结果表明,甲醇、正己烷和环己烷处理对固定化脂肪酶有钝化作用,而丙酮、丙醇、异丙醇和乙酸乙酯处理能显著提高固定化脂肪酶的活性。用乙酸乙酯和异丙醇处理吸附固定的脂肪酶1 h,可使固定化脂肪酶活力分别提高1.70~2.25倍、半衰期延长3.2~8.4 h、催化大豆油转酯化反应延长使用周期2~5批。异丙醇和乙酸乙酯处理还可提高固定化脂肪酶的热稳定性。
关键词:脂肪酶;固定化;有机溶剂;活性;稳定性
脂肪酶在工业上通常被用于催化有机媒介中的酯化或转酯化反应。其在有机溶剂或无溶剂系统催化植物油酯化是制备生物柴油的环境友好工艺[1]。
酶的固定化技术解决了脂肪酶在酯化或转酯化反应过程中易结块、不易回收和重复利用等问题,提高了脂肪酶的活性和稳定性[2]。吸附法固定化酶具有操作简单、成本低、空间位阻小、在有机介质中催化反应时脱附量较小、保留活性高、可再生等优点[3]。固定化脂肪酶在有机介质中的催化活性明显低于在水相介质中的催化活性,提高固定化酶在有机介质中的催化活性和稳定性具有很大的研究价值。
将游离脂肪酶溶解于某些纯的极性有机溶剂或含有少量极性有机溶剂的水溶液中可以明显提高脂肪酶的催化活性和稳定性[4-6]。采用异丙醇干燥固定化酶可明显提高固定化酶的活性和对映体选择性[7]。一般认为极性有机溶剂改变了脂肪酶分子的构象,促进了酶与底物的结合,从而提高酶的催化性能。但以极性有机溶剂处理固定化Candida Antarctica脂肪酶,未表现出酶活性和稳定性的提高[8]。
采用不同载体在水相环境中吸附固定化脂肪酶(国产),用纯有机溶剂处理湿的固定化脂肪酶,并采用处理的脂肪酶催化大豆油转酯化反应,考察有机溶剂处理对固定化脂肪酶的催化活性和稳定性的影响。
1 材料与方法
1.1材料
脂肪酶LVK-F100:10000 U/g,深圳市绿维康生物工程有限公司产品;牛血清蛋白(BSA):美国Xiasi生物公司产品;硅胶G:青岛裕民源硅胶试剂厂产品;吸水硅胶:深圳市红叶杰科技有限公司产品;80-100、300-400目层析硅胶,青岛裕民源硅胶试剂厂产品;DM-130大孔树脂:山东鲁抗医药股份有限公司树脂分厂产品;大豆油,大连日清制油有限公司产品;气相色谱分析用脂肪酸甲酯标准品:美国SUPELCO公司产品。
1.2方法
1.2.1脂肪酶的固定化将15 g酶粉溶于300 mL磷酸缓冲液(50 mmol/L KH2PO4-K2HPO4,pH 7.0),于室温、200 r/min搅拌2 h后,于2 680 g离心10 min,得上清液。再用磷酸缓冲液稀释上清液,制得浓度为0.05 mg/mL的脂肪酶液。分别将1 g经预处理的活性炭、硅胶G以及DM-130树脂加入30 mL上述酶液中,于30℃、150 r/min振荡吸附2 h后,过滤出湿固定化酶,于4℃放置24 h。
1.2.2有机溶剂处理固定化脂肪酶取上述湿固定化酶1 g置于100 mL具塞三角瓶中,加入20 mL有机溶剂,于30℃、150 r/min振荡处理1h,抽滤得处理过的固定化酶,于4℃放置24 h,测定脂肪酶活力。
选取作用效果较好的有机溶剂,按上述条件分别振荡处理0.5~8 h,抽滤得处理过的固定化酶,于4℃放置24 h,测定脂肪酶活力。
1.2.3蛋白质测定采用Bradford法[9],使用牛血清蛋白为标准蛋白。
1.2.4固定化脂肪酶活力测定采用改进的橄榄油乳化法[10]。向150 mL 40 g/L的聚乙二醇溶液中加入50 mL橄榄油,混合均匀制成底物乳化液。在100 mL三角瓶中加入5 mL底物乳化液和4 mL的磷酸缓冲液(50 mmol/L KH2PO4-K2HPO4,pH 7.0),于38℃预热5 min,加入待测定的固定化脂肪酶,于38℃搅拌10 min,用10 mL体积分数95%的乙醇终止反应。以酚酞为指示剂,用0.025 mol/L的NaOH滴定水解产生的脂肪酸。
酶活力定义:在38℃、pH 7.0的条件下,每分钟水解橄榄油产生1 μmol脂肪酸所需的酶量为一个酶活单位(U)。
1.2.5固定化脂肪酶催化大豆油转酯化将22.5 g大豆油、11 mL正己烷及1 g固定化脂肪酶置于250 mL具塞三角瓶中,经30℃预热15 min,按醇油摩尔比3∶1,从反应开始每8 h等摩尔加入无水甲醇3次,于150 r/min振荡反应24 h。将转酯化反应液在0.1 MPa减压蒸馏,收集140℃~200℃脂肪酸甲酯组份,进行气相色谱定量分析。
1.2.6大豆油的完全甲酯化取1 g大豆油置于50 mL具塞三角瓶中,加入5 %的KOH-甲醇溶液2 mL,于75℃水浴中皂化15 min,再加入14 %的三氟化硼乙醚溶液2 mL,振荡反应2 min,待冷却至室温后,加入1 mL正己烷,充分振荡后静置,取上清液进行气相色谱定量分析。
1.2.7脂肪酸甲酯测定采用山东经纬GC8900型气相色谱仪,PEG-20M(30 m×0.32 mm×0.35 μm)毛细管柱;柱箱温度180℃,汽化室温度250℃,FID检测器温度250℃;载气为氮气,柱前压0.1 MPa;氢气流量30 mL/min,空气流量50 mL/min;进样量0.4 μL,无分流。
1.2.8大豆油的脂肪酸甲酯转化率X计算计算公式如下:

1.2.9固定化酶半衰期测定转酯化反应结束后,用15 mL丙酮分3次洗涤固定化脂肪酶,过滤分离固定化脂肪酶,于4℃干燥24 h,测定其脂肪酶活力,根据Inverted linear decay model计算固定化酶半衰期t1/2[11-12]。
1.2.10固定化酶热稳定性测定将1 g固定化酶置于100 mL三角瓶,加入20 mL磷酸缓冲液(50 mmol/L KH2PO4-K2HPO4,pH 7.0),分别置于30℃~70℃水浴摇床中振荡1 h,反应结束后,过滤分离固定化脂肪酶,于4℃放置24 h,测定其脂肪酶活力。
2 结果与讨论
2.1不同有机溶剂处理对固定化脂肪酶活力的影响
以40目活性炭、硅胶G以及DM-130树脂吸附固定脂肪酶,再用不同有机溶剂处理固定化脂肪酶,处理前后的固定化脂肪酶相对酶活见表1。
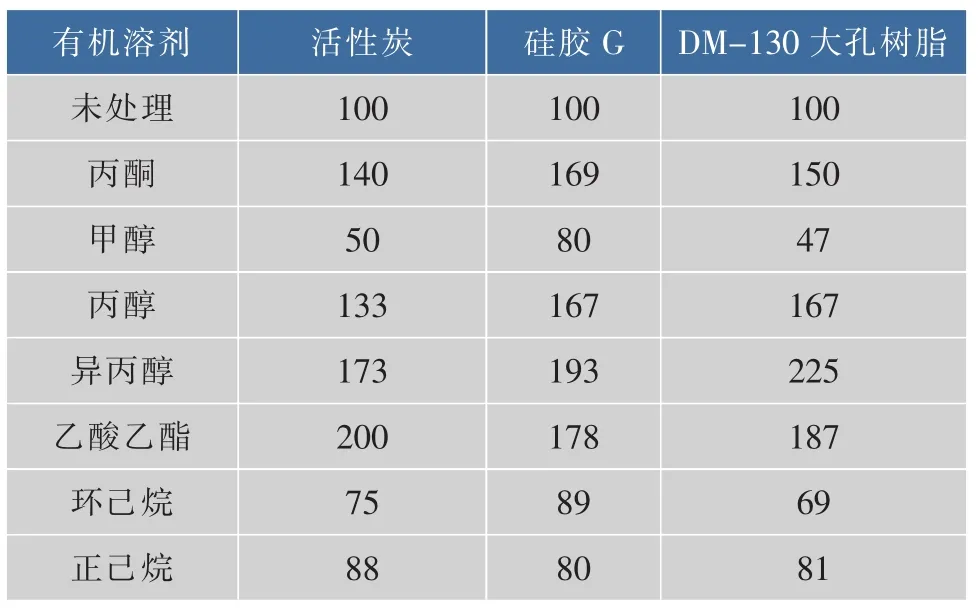
表1 不同有机溶剂处理的固定化脂肪酶相对酶活Table 1 Relative activities of immobilized lipases treated by various organic solvents
由表1可知,甲醇、正己烷和环己烷对固定化脂肪酶有钝化作用,而丙酮、丙醇、异丙醇、乙酸乙酯明显提高了固定化脂肪酶的活性,对硅胶G和DM-130树脂吸附固定脂肪酶的处理效果较好。
水因直接或间接参与所有的非共价相互作用而维持脂肪酶催化部位的构象[13-14]。丙酮、丙醇、异丙醇、乙酸乙酯的极性较大,与水的亲和作用较大,能吸收湿固定化脂肪酶结构中的多余水分,激活脂肪酶分子上某些处于关闭状态的活性部位,改变脂肪酶的分子构象,促进酶与底物的结合[15],而且有利于固定化酶的干燥。用具有较大极性的甲醇处理后的脂肪酶活力降低很多。而正己烷和环己烷的极性较小,与固定化脂肪酶结构中的水亲和作用较小,使固定化脂肪酶结构中的水较多残留,从而降低脂肪酶催化活性[16-17]。因此,有机溶剂对固定化脂肪酶的作用与溶剂极性强弱及其相关基团有关。
有机溶剂对固定化脂肪酶的作用还与溶剂分子的结构以及酶在载体上的吸附状态有关。Wu等[15]采用极性相同的辛烷和异辛烷处理表面包被的脂肪酶,发现辛烷和异辛烷对固定化脂肪酶均有钝化作用,且辛烷的钝化作用明显高于异辛烷。Park等[1]证明了固定化脂肪酶的多层包被或皱褶结构会形成空间位阻,阻碍底物与脂肪酶的接触以及反应产物的扩散,也会阻碍有机溶剂与脂肪酶分子的接触,降低极性溶剂的激活作用。
2.2有机溶剂处理时间对固定脂肪酶活力的影响
用乙酸乙酯处理活性炭吸附固定的脂肪酶,用异丙醇处理硅胶G、DM-130树脂吸附固定的脂肪酶,经处理不同时间的固定化脂肪酶相对酶活力如图1所示。
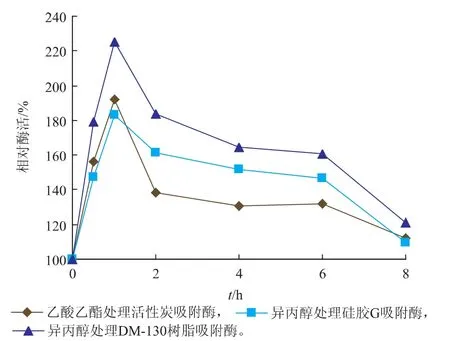
图1 不同有机溶剂处理时间的固定化脂肪酶相对酶活力Fig. 1 Relative activities of immobilized lipases treated by organic solvents for various time
由图1可知,乙酸乙酯处理活性炭吸附固定脂肪酶以及异丙醇处理硅胶G、DM-130树脂吸附固定脂肪酶的适宜时间均为1 h,随着处理时间的延长,酶活力不断下降。乙酸乙酯和异丙醇与固定化脂肪酶结构中的水亲和作用较大,虽然适当浸泡能吸收湿固定化脂肪酶结构中多余的水分,有利于稳定固定化脂肪酶分子构象和减少固定化脂肪酶结构中的非必需水,但较长时间浸泡会延长溶剂与其中水的亲和作用时间,剥夺固定化脂肪酶的必需水,破坏了脂肪酶的分子构象,导致部分脂肪酶变性失活。已有研究表明适量的极性有机溶剂处理对载体吸附酶量没有影响[18]。
2.3有机溶剂处理对固定化脂肪酶热稳定性的影响
用乙酸乙酯处理活性炭吸附固定的脂肪酶1 h,用异丙醇处理硅胶G、DM-130树脂吸附固定的脂肪酶1 h,经有机溶剂处理与未经处理的固定化脂肪酶在不同温度下的相对酶活力如图2所示。
与未经有机溶剂处理的固定化脂肪酶相比,经乙酸乙酯处理的活性炭吸附固定脂肪酶和经异丙醇处理的硅胶G吸附固定脂肪酶在各温度下的酶活力均较高,说明极性有机溶剂处理能提高固定化脂肪酶的热稳定性。但经异丙醇处理的硅胶G吸附固定的脂肪酶比经乙酸乙酯处理的活性炭吸附固定的脂肪酶具有更好的高温稳定性,这与活性炭孔隙较大,被吸附固定的酶呈片层堆积有关[19]。
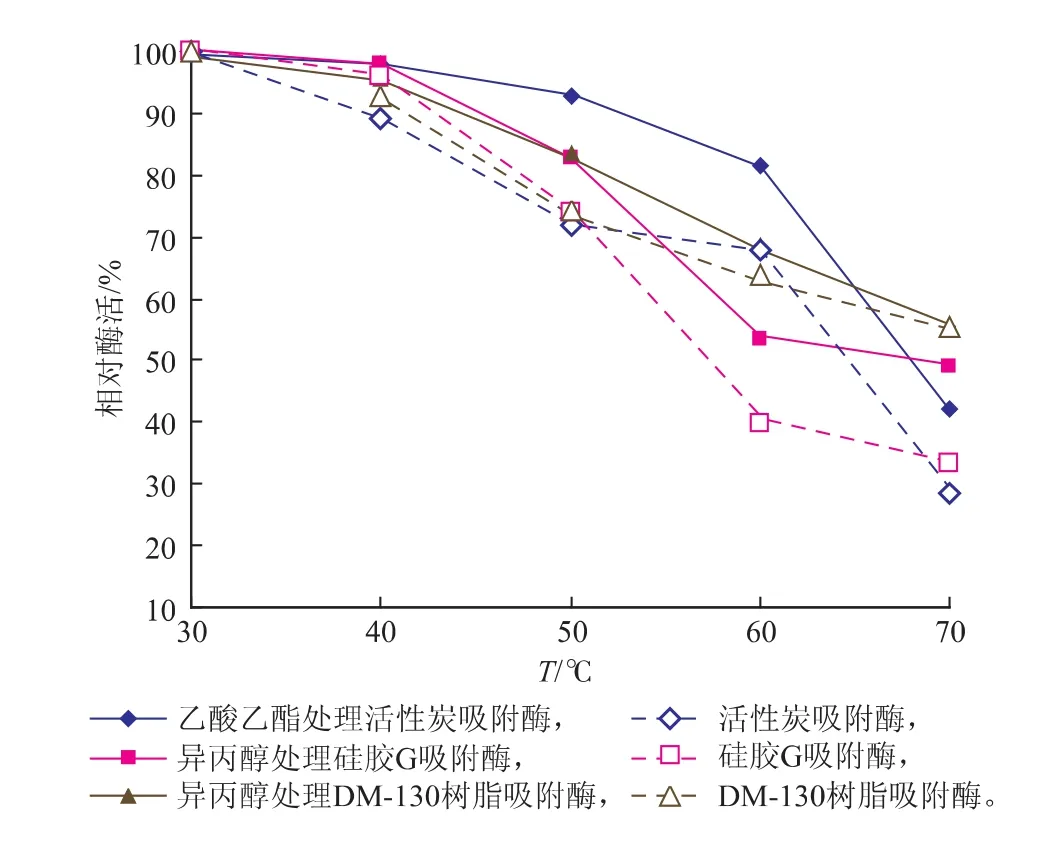
图2 经有机溶剂处理的固定化脂肪酶热稳定性Fig. 2 Thermal stability of immobilized lipases treated by organic solvents
2.4有机溶剂处理对固定化脂肪酶半衰期的影响
用乙酸乙酯处理活性炭吸附固定的脂肪酶1 h,用异丙醇处理硅胶G、DM-130树脂吸附固定的脂肪酶1h,经有机溶剂处理与未经处理的固定化脂肪酶半衰期如图3所示。
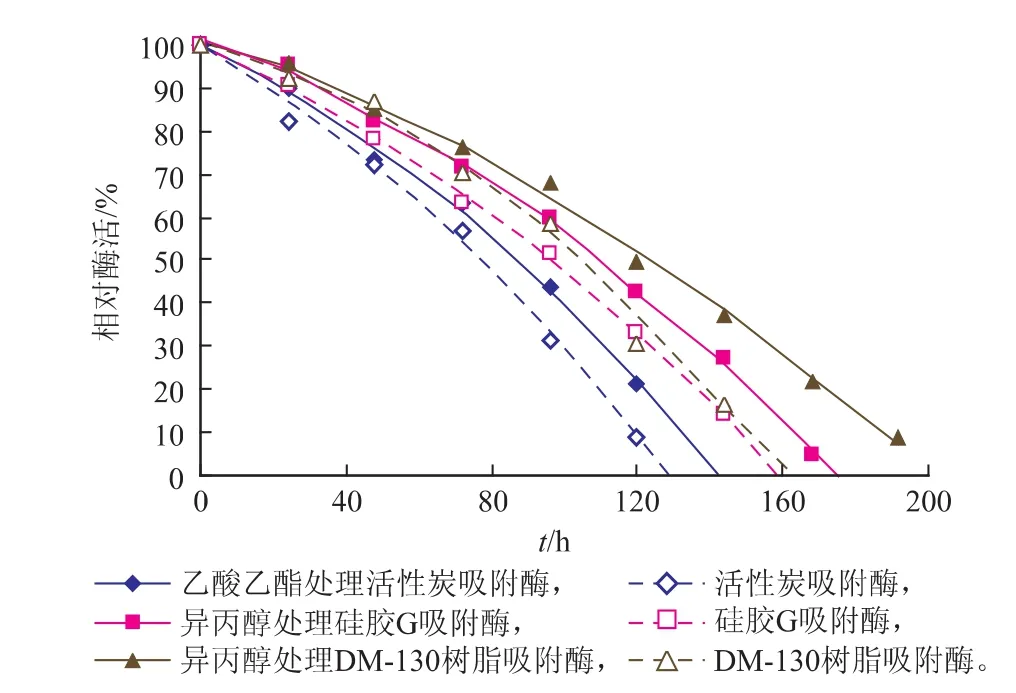
图3 经有机溶剂处理的固定化脂肪酶半衰期Fig. 3 Half -lives of immobilized lipases treated by organic solvents
由图3可知,与未经有机溶剂处理的相应固定化脂肪酶相比,经乙酸乙酯处理的活性炭吸附固定脂肪酶半衰期延长6.6 h,是未处理对照的1.1倍,经异丙醇处理的硅胶G吸附固定脂肪酶的半衰期延长8.4 h,是未处理对照的1.1倍,经异丙醇处理的MD-130树脂吸附固定脂肪酶半衰期延长3.2 h,是未处理对照的1.04倍。可见,极性有机溶剂处理能有效延长固定化酶的半衰期。一般认为,酶活力下降的主要原因是反应过程中酶分子活性部位的钝化和酶蛋白结构的变性失活,但酶蛋白结构改变并不一定导致酶活力下降[20]。适量的极性有机溶剂处理虽然改变了酶分子的部分结构,但却增强了脂肪酶的催化活性,并且稳定了酶分子的构象,延长了半衰期。硅胶G具有极性,对极性有机溶剂也有较强吸附作用,能促使极性有机溶剂进入到包被或载体结构的内部[19],对脂肪酶的激活或稳定作用效果更明显。
2.5有机溶剂处理对固定化脂肪酶操作稳定性的影响
用乙酸乙酯处理活性炭吸附固定的脂肪酶1 h,用异丙醇处理硅胶G、DM-130树脂吸附固定的脂肪酶1 h,经有机溶剂处理与未经处理的固定化脂肪酶重复应用于催化大豆油转酯化反应的酯转化率如图4所示。
由图4可见,在酯转化率不低于50%的情况下,与未经有机溶剂处理的相应固定化脂肪酶相比,经乙酸乙酯处理的活性炭吸附固定脂肪酶多用5批次,是未处理对照的1.6倍,经异丙醇处理的硅胶G吸附固定脂肪酶多用3批次,是未处理对照的1.3倍,经异丙醇处理的MD-130树脂吸附固定脂肪酶多用2批次,是未处理对照的1.2倍。可见,极性有机溶剂处理能有效延长固定化脂肪酶催化大豆油转酯化反应的使用寿命。经极性有机溶剂处理,增强了固定化脂肪酶对正己烷和甲醇的耐受性,从而增强其在大豆油、正己烷和甲醇反应环境中催化转酯化反应的稳定性。经乙酸乙酯处理的活性炭吸附固定脂肪酶的使用寿命明显高,是活性炭结构、吸附固定脂肪酶的方式和状态以及乙酸乙酯的处理效果使然。
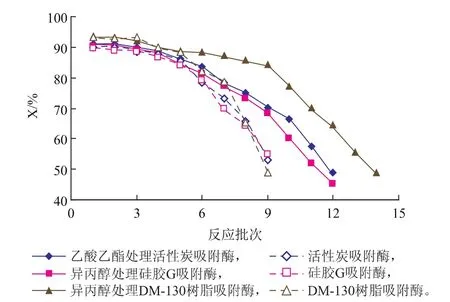
图4 经有机溶剂处理的固定化脂肪酶的循环利用效果Fig. 4 Recycling use of immobilized lipases with treatment in polar organic solvents
3 结语
有机溶剂对固定化脂肪酶LVK-F100的作用与溶剂极性强弱及其相关基团以及酶在载体上的吸附状态有关,较强极性的丙酮、丙醇、异丙醇、乙酸乙酯明显提高了固定化脂肪酶的活性,对硅胶G 和DM-130树脂吸附固定脂肪酶的处理效果普遍较好。而甲醇、正己烷和环己烷对固定化脂肪酶有钝化作用。
综合评价,用乙酸乙酯处理活性炭吸附固定的脂肪酶以及用异丙醇处理硅胶G吸附固定的脂肪酶,在酶活性、热稳定性、半衰期以及催化大豆油转酯化使用寿命方面均有较明显的改善作用。而硅胶G吸附固定的脂肪酶比活性炭吸附固定的脂肪酶具有更好的高温稳定性。经乙酸乙酯处理的活性炭吸附固定脂肪酶的使用寿命明显高。从而增加了固定化脂肪酶应用的可能性并降低其催化反应的成本。
参考文献:
[1]Park E Y,Sato M,Kojima S. Fatty acid methyl ester production using lipase-immobilizing silica particles with different particle sizes and different specific surface areas[J]. Enzyme and Microbial Technology,2006,39:889-896.
[2]蔡志强,杨广花,赵希岳,等.固定化酶催化高酸废油脂合成生物柴油的研究[J].中国粮油学报,2008,23(4):160-162. CAI Zhiqiang,YANG Guanghua,ZHAO Xiyue,et al. Synthesis of biodiesel fuel from waste oil with high acid value catalyzed by imobilized lipase[J]. Journal of the Chinese Cereals and Oils Association,2008,23(4):160-162.(in Chinese)
[3]何延青,刘俊良,杨平,等.微生物固定化技术与载体结构的研究[J].环境科学,2004,25(S1):101-104. HE Yanqing,LIU Junliang,YANG Ping,et al. Immobilization technology and construction of carrier[J]. Environmental Science,2004,25(S1):101-104.(in Chinese)
[4]Kim M G,Lee E G,Chung B H. Improved enantioselectivity of Candida rugosa lipase towards ketoprofen ethyl ester by a simple two-step treatment[J]. Process Biochemistry,2000,35:977-982.
[5]Matsumoto M,Kida K,Kondo K. Enhanced activities of lipase pretreated with organic solvents[J]. Journal of Chemical Technology and Biotechnology,2001,76(10):1070-1073.
[6]Chamorro S,Alcantara A R,Casa R M,et al. Small water amounts increase the catalytic behaviour of polar organic solvents pre-treated Candida rugosa lipase[J]. Journal of Molecular Catalysis B:Enzymatic,2001,11:939-947.
[7]Chang C S,Hsu C S. Enhancement of enantioselectivity on reaction rate of the synthesis of(S)-ketoprofen hydroxyalkyl ester in organic solvents via isopropanol-dried immobilized lipase[J]. Journal of Chemical Technology and Biotechnology,2005,80 (5):537-544.
[8]Wu J C,Lee S S,Mahmood M M B,et al. Enhanced activity and stability of immobilized lipases by treatment with polar solvents prior to lyophilization[J]. Journal of Molecular Catalysis B:Enzymatic,2007,45:108-112.
[9]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[10]江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75. JIANG Huifang,WANG Yaqin,LIU Chunguo. Comparison and improvement of three determination methods for lipase activity[J]. Chemistry & Bioengineering,2007,24(8):72-75.(in Chinese)
[11]Cardoso J P,Emery A N. A new model to describe enzyme inactivation[J]. Biotechnology and Bioengineering,1978,20(9):1471-1477.
[12]Bruno L M,Lima-Filho J L,Castro H F. Comparative performance of microbial lipases immobilized on magnetic polysiloxane polyvinyl alcohol particles[J]. Brazilian Archives of Biology and Technology,2008,51(5):889-896.
[13]Goldberg M,Thomas D,Legoy M D. The control of lipase catalysed transesterification and esterification reaction rates. Effects of substrate polarity,water activity and water molecules on enzyme activity[J]. Eur J Biochem,1990,190:603-609.
[14]Yahya A R M,Anderson W A,Moo-Young M. Ester synthesis in lipase catalyzed reactions[J]. Enzyme Microb Technol,1998,23:438-450.
[15]Wu J C,Song B D,Xing A H,et al. Esterification reactions catalyzed by surfactant-coated Candida rugosa lipase in organic solvents[J]. Process Biochemistry,2002,37:1229-1233.
[16]Jacques S L. Lipase-catalyzed esterification of terpene alcohols in a solventfree medium[D]. Waterloo:University of Waterloo,1993.
[17]Basheer S,Mogi K,Nakajima M. Surfactant-modified lipase for the catalysis of the interesterification of triglycerides and fatty acids[J]. Biotechnol Bioeng,1995,45(3):187-195.
[18]Goto M,Ogawa H,Isobe T,et al. 2-Propanol treatment of Candida rugosa lipase and its hydrolytic activity[J]. Journal of Molecular Catalysis B:Enzymatic,2003,24-25:67-73.
[19]杜凯.固定化催化剂催化植物油转酯化[D].大连:大连工业大学,2010.
[20]Invernizzi G,Casiraghi L,Grandori R,et al. Deactivation and unfolding are uncoupled in a bacterial lipase exposed to heat,low pH and organic solvents[J]. Journal of Biotechnology,2009,141(1-2):42-46.
Treatment of Organic Solvents to Improve Activity and Stability of Immobilized Lipases
ZU Xin,DU Kai,CAO Fang,SUN Yumei*
(School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China)
Abstract:The lipases immobilized on active carbon,silica gel G or DM-130 macro porous resin by adsorption were steeped in various organic solvents to improve the activity and stability for catalyzing transesterification. It was found that the activities of immobilized lipases could be increased with acetone,1-propanol,2-propanol and ethyl acetate,but could be deactivated with methanol,n-hexane and cyclohexane. Compared with the immobilized lipases dried directly after adsorption,the immobilized lipases treated in 2-propanol or ethyl acetate for 1 h displayed 1.70 to 2.25 times enzyme activities,their half-lives were prolonged 3.2 to 8.4 h and the operation lives were increased 2 to 5 batches for soybean oil transesterification. The thermal stability of the immobilized lipases could also be enhanced by the treatment with 2-propanol or ethyl acetate.
Keywords:lipase,immobilization,organic solvent,activity,stability
*通信作者:孙玉梅(1962—),女,吉林吉林人,教授,主要从事微生物代谢控制发酵研究。E-mail:sunyumei62@163.com
基金项目:辽宁省教育厅创新团队项目(LT2011008);辽宁省科技厅辽宁省发酵工业产品工程技术研究中心项目(辽科发200923)。
收稿日期:2014-11-24
中图分类号:Q 814
文献标志码:A
文章编号:1673—1689(2016)01—0089—06

