高山被孢霉发酵生产花生四烯酸的优化
曹刚刚, 管政兵, 廖祥儒, 蔡宇杰*(.江南大学工业生物技术教育部重点实验室,江苏无锡4;.江南大学生物工程学院,江苏无锡4)
高山被孢霉发酵生产花生四烯酸的优化
曹刚刚1,管政兵2,廖祥儒1,蔡宇杰*1
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
摘要:研究了高山被孢霉液态发酵产花生四烯酸过程中主要底物和培养条件对花生四烯酸产量的影响。采用单因素和正交试验设计优化了碳源、氮源、无机盐的种类及浓度,找出了最佳的培养温度和变温策略。试验结果显示最佳碳源和氮源及浓度是:玉米粉66 g/L,豆粕粉54 g/L;最佳无机盐配方是:KH2PO43 g/L,MgSO41 g/L,Na2SO42 g/L。采取逐级变温培养:30℃(3 d),25℃(4 d),20℃(4 d)。优化后生物量和花生四烯酸产量分别达到52.3和13.6 g/L。
关键词:谷物粗粉;碳氮比;变温策略;无机盐;花生四烯酸;高山被孢霉
花生四烯酸即全顺式Δ-5,8,11,14-二十碳四烯酸,缩写为ARA。ARA是重要的人体生长发育必需的三大脂肪酸之一,在维持人体的健康和正常的生长发育中扮演重要的角色。作为多不饱和脂肪酸家族的重要一员,ARA是ω-6系列脂肪酸的代谢枢纽。ARA主要在以下两个方面发挥它的生理功能:(1)结构组分。ARA是膜磷脂的组分之一,对于细胞的生长和分裂不可或缺。另外,其在人脑和视网膜等特殊结构中含量很高,对于智力和视力发育至关重要[1];(2)调节功能。ARA能被人体吸收并转化为多种二十碳衍生物,其中包括多种代谢调节物质,比如前列腺素、白细胞三烯和凝血噁烷等[2],对于维持人体的内稳态具有重要作用[3]。另外,近年来的研究发现,ARA与信号传导和癌症的发生也有较为密切的关系[4-5]。目前,ARA在食品、水产养殖、医药和化妆品等领域都得到了广泛的应用[6-8]。
ARA的传统来源主要是植物草籽、动物肝脏和猪肾上腺等。但是这些来源一方面ARA含量很低,资源少,提取成本高昂,而且产量远远达不到市场需求。近年来实现的微生物发酵生产,相对而言优势明显:ARA含量高,大大降低了提取成本;发酵周期短,产量高;生产可操作性强,不受季节、气候影响等[1,9]。
目前利用高山被孢霉已经实现了ARA的商业化生产,主要底物是葡萄糖、酵母粉等[10-11],生产成本仍然较高,作者探索玉米和豆粕等生物质原料经生物转化发酵生产ARA,并在此基础上优化培养条件以期进一步提高转化率和产量。
1 材料与方法
1.1菌种
高山被孢霉Mortierellaalpina,作者所在实验室保藏。
1.2培养基
斜面培养基(g/L):去皮马铃薯200,葡萄糖20,琼脂20;种子培养基:玉米粉40 g/L,pH自然;发酵初始培养基(g/L):葡萄糖20,酵母粉5,KH2PO43,MgSO40.5,Na2SO41,CaCl20.5,pH自然。以上培养基均经过115℃灭菌20 min。
1.3方法
1.3.1菌丝和孢子悬液的制备斜面种子在25℃培养7 d至白色菌丝铺满斜面。加入5 mL无菌水用接种环刮下斜面表面菌丝和孢子,取出后置于三角瓶中用玻璃珠打碎,使得菌丝分散均匀。然后接入种子培养基。
1.3.2种子培养菌丝和孢子悬液按照体积分数10%的接种量接入种子培养基,30℃、200 r/min条件下培养36 h。
1.3.3摇瓶培养种子液以体积分数10%的接种量接入发酵生产培养基,200 r/min培养7 d。
1.3.4碳源和氮源优化分别以葡萄糖和酵母粉为碳源和氮源,研究不同氮源和碳源对菌丝生长和ARA产量的影响。
1.3.5 4种无机盐质量浓度的优化玉米粉和豆粕粉作为碳源和氮源,按表1设计4因素三水平正交试验。
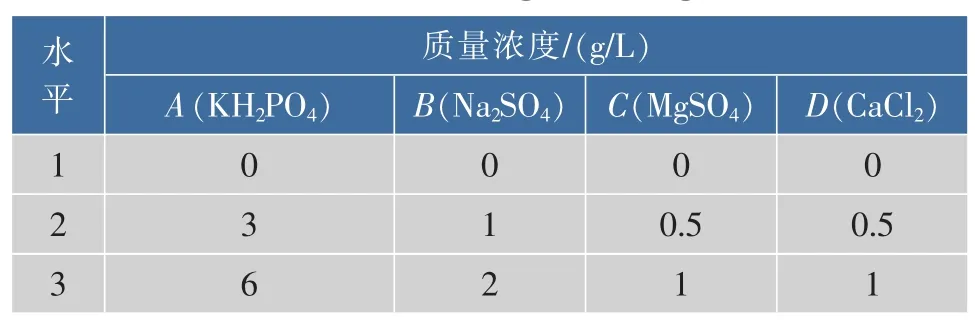
表1 L9(34)正交优化设计因素水平表Table 1 Orthogonal design
1.3.6最佳培养温度的确定发酵培养基接种后分别在20、25、30℃和分步降温条件下培养13 d,并且每隔2 d测定生物量、总油脂和油脂组成。
1.3.7生物量的测定发酵结束后,用双层纱布过滤发酵液,用去离子水洗涤菌体至滤液澄清。菌体70℃烘干至恒重。
1.3.8胞内油脂提取烘干后的菌体用研钵研磨成粉末,取0.5 g置于50 mL离心管中,加入2 mL去离子水和1.5 mL浓盐酸,密封后80℃水浴消化1 h。细胞经消化裂解后用6 mL v(氯仿)∶v(甲醇)= 2∶1,分3次提取油脂。合并每次的氯仿抽提液,烘干挥发除去溶剂,称重得油脂质量。
1.3.9脂肪酸组成分析取50 μL粗油脂加入50 mL离心管中,以2 mg十九烷酸作为内标,混合后加入2 mL 0.5 mol/L氢氧化钾甲醇溶液,70℃水浴保温0.5 h;冷却后再加入2 mL体积分数14%三氟化硼甲醇溶液,70℃水浴保温0.5 h。脂肪酸甲酯化后加入6 mL正己烷和3 mL饱和氯化钠溶液,震荡后离心分层。上层正己烷用于气相色谱检测。
脂肪酸甲酯采用配备FID检测器和EC-Wax (30 m×0.32 mm×0.25 μm)色谱柱的气相色谱仪GC-9160进行分析。条件如下:载气为氮气,进样量1 μL;进样口和检测器温度分别设定为250和280℃;程序升温:柱炉初始温度120℃,保持3 min,然后以2℃/min升温至160℃,再以4℃/min升温至190℃。
2 结果与分析
2.1不同碳源的比较
碳源是影响微生物生长和产物形成最重要的因素之一。用于构成细胞和代谢产物的碳链支架。高山被孢霉胞内油脂的主要存在形式是甘油三酯[12-13],主要元素即为碳。因此,要获得生物量和油脂的高产就必须找到对生长和油脂积累最佳的碳源种类,并且供应量必须充足。
图1显示了使用不同碳源时的生物量、总油脂和ARA的产量。由图可见,淀粉作为碳源时最有利于菌体的生长,以可溶性淀粉和玉米粉作为碳源时的生物量远高于其它碳源。由于油脂是胞内产物,使用这两种碳源也就得到了相对较高的总油脂和ARA产量。之前,国内外的相关研究普遍指出葡萄糖是高山被孢霉生长和产油的最佳碳源[11,14],区别可能源于使用的菌株不同。另外,玉米磨粉直接用于高山被孢霉液态发酵生产ARA还没有专门报道。由作者的研究结果可见,使用玉米粉作为碳源不仅可以大幅度降低原料成本,同时还可以获得更高的产量。最高的生物量和ARA产量分别达到10.34、1.86 g/L,接近葡萄糖做碳源时的3倍。
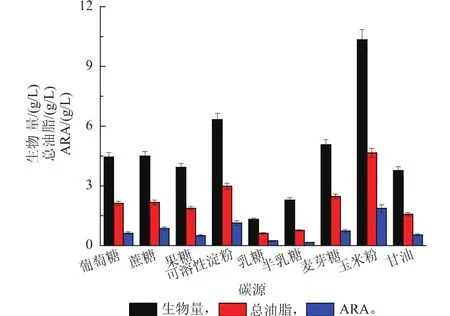
图1 不同碳源对于生长、总油脂和ARA产量的影响Fig. 1 Effect of different carbon sources on biomass,total lipids and ARA yield
2.2不同氮源的比较
氮源是又一决定产量的因素。作为氮源的营养物质主要为发酵体系提供氮元素。虽然氮并不直接参与ARA的元素组成,但是对于形成细胞成分的蛋白质及催化合成代谢产物的酶必不可少,因此间接影响了ARA产量。因为高生物量是高产的关键,因此,与碳源的优化相似,优良的氮源必须易于被菌体吸收同化并促进生长。
图2显示了不同氮源对于高山被孢霉生物量、总油脂和ARA产量的影响。总体上,高山被孢霉难于利用无机氮源而易于利用有机氮源。无机态氮作为唯一氮源时的生物量普遍极低,而有机氮源相反,尤其是豆粕粉,生物量达到14.45 g/L,相应的ARA产量达到了3.18 g/L。之前的研究者普遍报道酵母粉是ARA生产的最佳氮源[10,15]。作者的研究结果显示高山被孢霉对于豆粕粉具有优良的利用能力。另外,豆粕本身油脂含量较高,能被细胞作为碳源利用,也可以作为多不饱和脂肪酸合成的前体[16]。因此,豆粕作为氮源时菌体的总油脂含量较其他有机氮源为高。
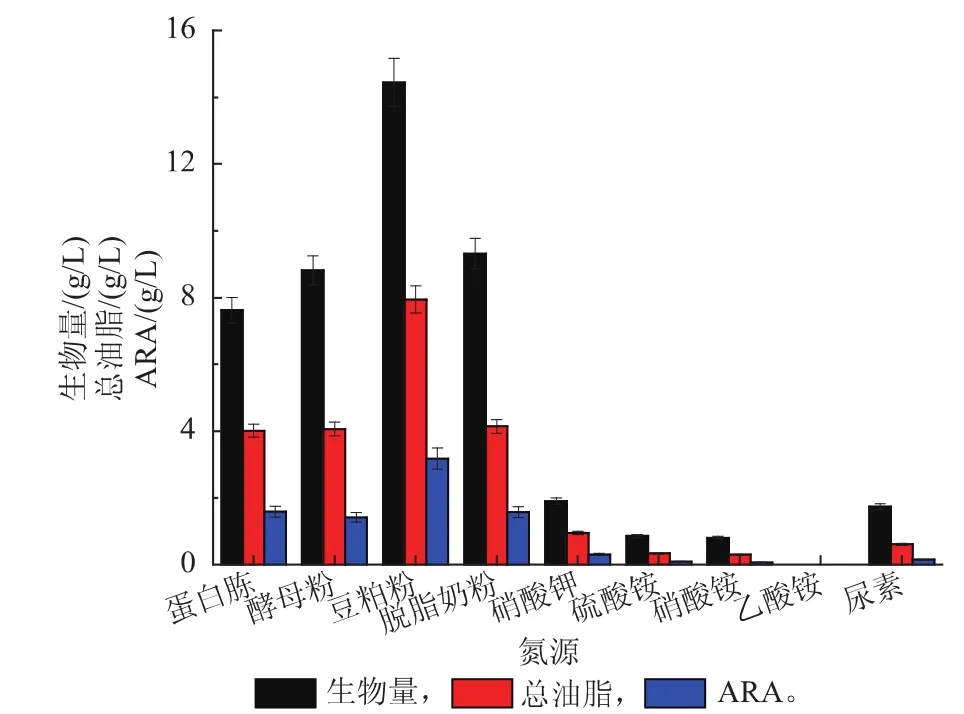
图2 不同氮源对于生长、总油脂和ARA产量的影响Fig. 2 Effect of different nitrogen sources on biomass,total lipids and ARA yield
2.3无机盐的正交优化
KH2PO4,MgSO4,Na2SO4,CaCl2是已报道的对高山被孢霉发酵产ARA产量影响较大的4种无机盐[17]。由于采用玉米粉和豆粕粉作为碳源和氮源,本身已经含有丰富的微量元素和生长因子,因此只选择以上几种优化浓度以提供充足的K、Na、Mg、Ca、P、S等元素。正交试验设计及结果见表2。
由表所示极差计算结果可知各因素对于ARA的产量影响大小依次为CaCl2>KH2PO4>Na2SO4>MgSO4。最佳组合为A2B3C3D1,最佳的无机盐添加配方为(g/L):KH2PO43,Na2SO42,MgSO41。其中MgSO4和Na2SO4质量浓度均是初始培养基的两倍。在最佳添加量时ARA的产量比优化前有了较大幅度的提高。
2.4碳氮质量比的优化
Koike等[18]研究表明,碳氮质量比对于菌体的油脂含量影响明显。低碳氮质量比时,氮源相对丰富,更有利于菌体的生长,此时菌体的总油脂质量浓度则相对偏低;反之,氮源相对匮乏,更有利于菌体的油脂积累,此时的生物量则相对偏低。为了获得较高的ARA产量,需要找到最佳的碳氮质量比,使得生物量和油脂质量浓度得以平衡,从而获得较高的总油脂产量。
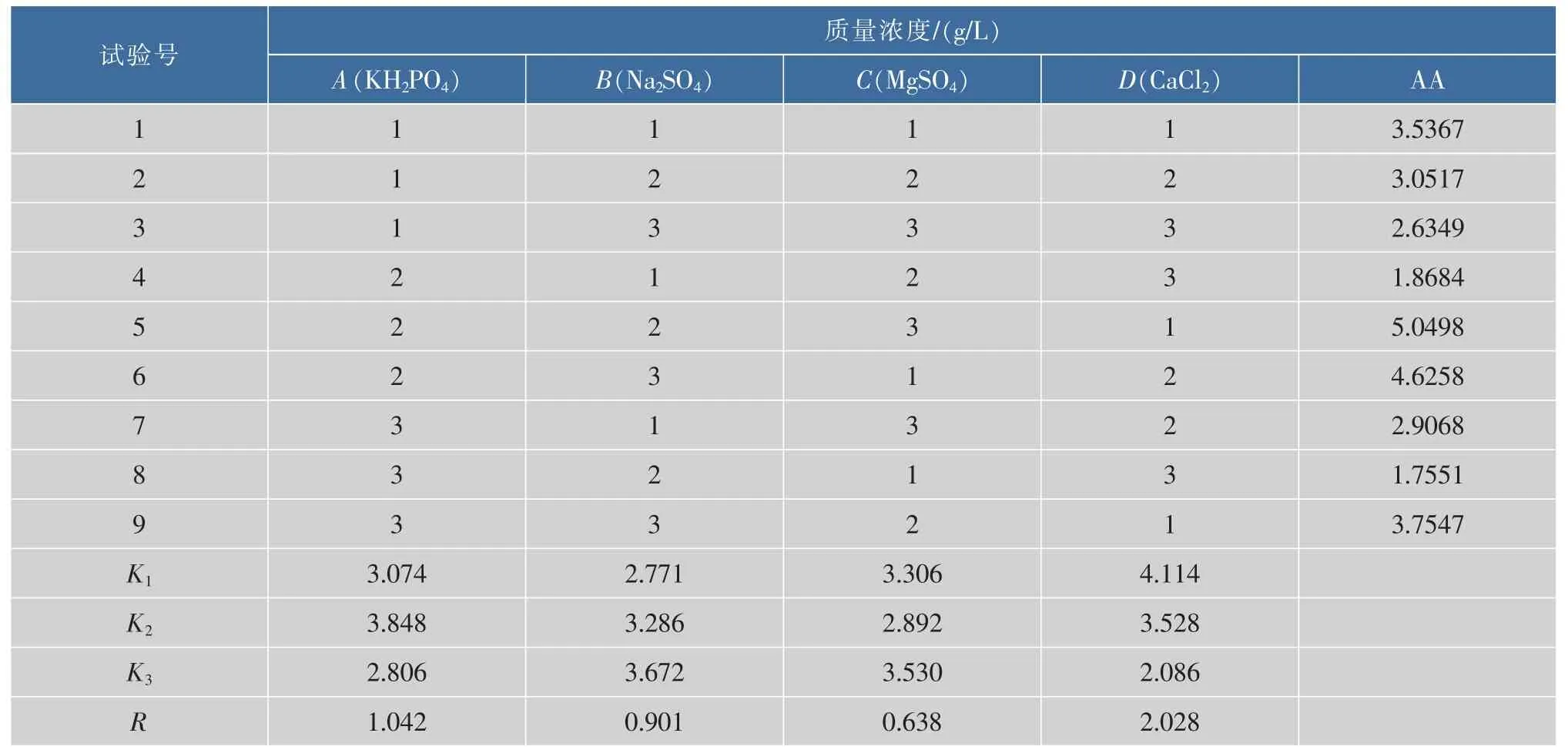
表2 无机盐优化L9(34)正交实验数据和结果Table 2 Data and results of orthogonal design for optimization of mineral addition
图3显示了碳氮质量比在13~28范围时生物量、菌体的油脂质量浓度和油脂中ARA质量浓度随碳氮质量比改变的变化趋势。随碳氮质量比的升高,生物量逐渐减少;菌体的油脂质量浓度逐渐增大;而油脂中的ARA质量浓度则先升高后降低,在19时达到最大,达到34 g/dL。可见作者的研究结果与先前的报道相符。最佳碳氮质量比下ARA产量比初始碳氮质量比13时提高了17%。
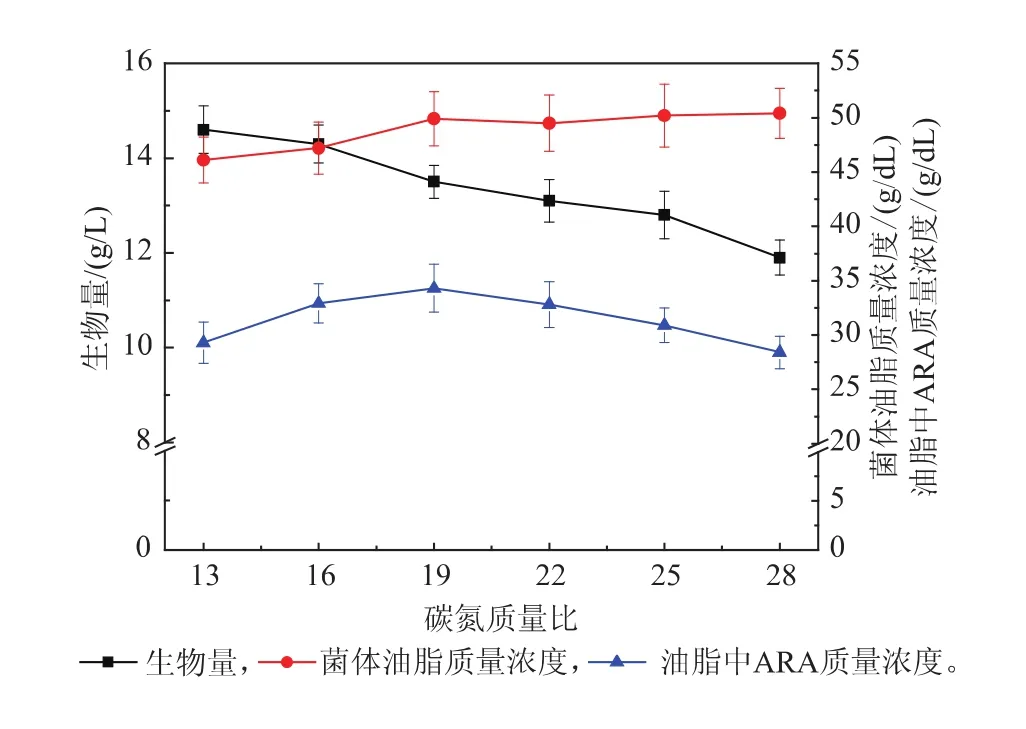
图3 碳氮质量比对生物量、菌体的油脂质量浓度以及油脂中ARA质量浓度的影响Fig. 3 Effect of C/N ratio on biomass yield,lipids and ARA content
在以上优化的基础上,把碳源和氮源质量浓度均提高3倍,在同样的发酵时间和发酵条件下,生物量、总油脂和ARA产量分别达到45.1、21.8、8.7 g/L。
2.5温度对生长及ARA产量的影响
温度从多个方面影响ARA的生产效率。温度偏低,菌体生长和分裂缓慢,造成迟滞期和对数期延长,延长了发酵周期,但是ARA含量高;温度偏高,虽然可以快速进入稳定期,但是ARA含量减少。因为在低温条件下菌体需要合成更多的多不饱和脂肪酸以维持细胞膜的流动性[19]。
不同温度下生物量、总油脂和ARA产量列于表3中。随着温度的升高,达到稳定期所需的时间缩短。20℃时,第7天生物量才达到最大值;而在30℃时只需要3天生物量即达到最大值。但是,较低的温度能得到更高的生物量(图4)。不同温度下菌体的油脂含量差别相对较小。油脂中ARA质量浓度也取决于温度,20℃、13 d时,ARA达到了总油脂的57%,比30℃时高了17%。总体上,20℃时ARA产量最高,发酵13 d达到13.4 g/L。但是过长的发酵时间降低了生产效率。为了缩短发酵周期,采取逐级降温的策略。如图4所示,即30℃培养3 d,降温到25℃培养4 d,最后降温到20℃再培养4 d。此时的生物量和ARA的产量达到了20℃的水平,发酵时间缩短了2 d,提高了经济效益。变温培养时的生物量、总油脂和ARA产量随时间的变化列于表3中。
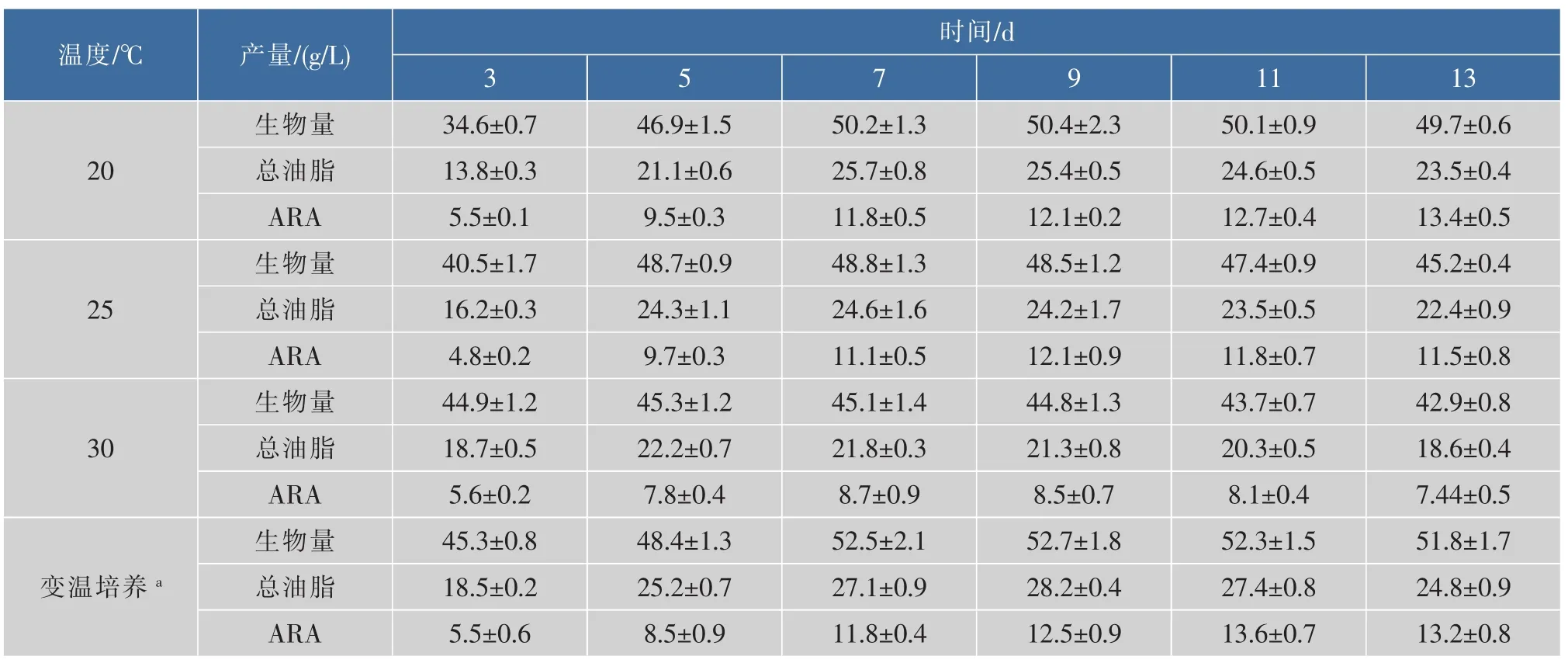
表3 延长发酵时间时不同温度及变温条件下的生物量、总油脂和ARA产量比较Table 3 Culture profiles of M. alpina grown at constant and stepwise temperature decreasing strategy associated with prolonged incubation time
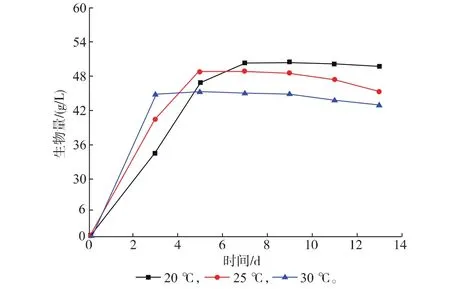
图4 不同温度下生物量随时间的变化Fig. 4 Time courses of M. alpina under different temperatures
3 结语
作者通过优化高山被孢霉发酵产花生四烯酸的培养基组分和培养条件,发现碳源、氮源、无机盐和温度都对产量有重要影响。前两者主要影响生物量,温度则影响生物量和总油脂中的ARA产量。研究得出培养基最佳组成为:玉米粉66 g/L,豆粕粉54 g/L,KH2PO43 g/L,MgSO41 g/L,Na2SO42 g/L。采用玉米粉和豆粕粉等作为原料,可降低生产成本,变温培养可以在不减少产量的同时缩短发酵时间。
参考文献:
[1]Ratledge C. Single cell oils—have they a biotechnological future?[J]. Trends in Biotechnology,1993,11:278-284.
[2]Marx J L. The leukotrienes in allergy and inflammation[J]. Science,1982,215:1380-1383.
[3]Carlson S E,Koletzko B,Gibson R A. PUFA in infant nutrition:consensus and controversies[J]. Lipids,1999,34:129-130.
[4]Rodríguez-Blanco G,Burgers P C,Dekker L J,et al. Serum levels of arachidonic acid metabolites change during prostate cancer progression[J]. The Prostate,2014,
[5]Wen Z,Su Y,Lai P,et al. Critical role of arachidonic acid-activated mTOR signaling in breast carcinogenesis and angiogenesis[J]. Oncogene,2013,32:160-170.
[6]Ward O P,Singh A. Omega-3/6 fatty acids:alternative sources of production[J]. Process Biochemistry,2005,40:3627-3652.
[7]Dyal S D,Narine S S. Implications for the use of fungi in the industrial production of essential fatty acids[J]. Food Research International,2005,38:445-467.
[8]Dedyukhina E,Chistyakova T,Vainshtein M. Biosynthesis of arachidonic acid by micromycetes(review)[J]. AppliedBiochemistry and Microbiology,2011,47:109-117.
[9]Radwan S S. Sources of C20-polyunsaturated fatty acids for biotechnological use[J]. Applied Microbiology and Biotechnology,1991,35:421-430.
[10]Bajpai P K,Bajpai P,Ward O P. Arachidonic acid production by fungi[J]. Applied and Environmental Microbiology,1991,57:1255-1258.
[11]Higashiyama K,Fujikawa S,Park E,et al. Production of arachidonic acid byMortierella fungi[J]. Biotechnology and Bioprocess Engineering,2002,7:252-262.
[12]Higashiyama K,Yaguchi T,Akimoto K,et al. Enhancement of arachidonic acid production by Mortierella alpina 1S-4[J]. Journal of the American Oil Chemists' Society,1998,75:1501-1505.
[13]Shimizu A. Production of functional lipids by microorganisms[J]. Bioscience & Industry,2004,62:11-16.
[14]Shinmen Y,Shimizu S,Akimoto K,et al. Production of arachidonic acid by Mortierella fungi[J]. Applied Microbiology and Biotechnology,1989,31:11-16.
[15]Chen H,Chang C,Chen C. Optimization of arachidonic acid production by Mortierella alpina Wuji-H4 isolate[J]. Journal of the American Oil Chemists' Society,1997,74:569-578.
[16]Aki T,Nagahata Y,Ishihara K,et al. Production of arachidonic acid by filamentous fungus,Mortierella alliacea strain YN-15[J]. Journal of the American Oil Chemists' Society,2001,78:599-604.
[17]Higashiyama K,Yaguchi T,Akimoto K,et al. Effects of mineral addition on the growth morphology of and arachidonic acid production by Mortierella alpina 1S-4[J]. Journal of the American Oil Chemists' Society,1998,75:1815-1819.
[18]Koike Y,Jie Cai H,Higashiyama K,et al. Effect of consumed carbon to nitrogen ratio of mycelial morphology and arachidonic acid production in cultures of[J]. Journal of Bioscience and Bioengineering,2001,91:382-389.
[19]Liang Y,Zhao X,Strait M,et al. Use of dry-milling derived thin stillage for producing eicosapentaenoic acid(EPA)by the fungus[J]. Bioresource Technology,2012,111:404-409.
Optimization for the Production of Arachidonic Acid from Mortierellaalpina
CAO Ganggang1,GUAN Zhengbing2,LIAO Xiangru1,CAI Yujie*1
(1. Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2. School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Abstract:Single factor and orthogonal experiments were applied to investigate effects of different nutrients and conditions on the fermentation of arachidonic acid by M. alpina. Results indicated that corn and soybean meal were preferred for fungal growth and lipid accumulation. With a temperature-shift strategy the fermentation time was shortened two days. Arachidonic acid reached the maximum yield(13.6 g/L)when the medium was comprised of 66 g/L corn meal,54 g/L soybean meal,3 g/L KH2PO4,1 g/L MgSO4and 2 g/L Na2SO4.
Keywords:raw crop materials,C/N ratio,temperature-shift strategy,arachidonic acid,Mortierella alpina
*通信作者:蔡宇杰(1973—),男,江苏无锡人,工学博士,教授,博士研究生导师,主要从事生物工程研究。E-mail:yjcai@jiangnan.edu.cn
收稿日期:2014-08-21
中图分类号:Q 815
文献标志码:A
文章编号:1673—1689(2016)01—0101—06
——化工原料、农副产品

