脱脂米糠碱溶醇溶物抗氧化活性研究
崔红军, 徐宝才,, 王 莉, 韩衍青, 罗小虎, 陈正行*(.江南大学食品学院/粮食发酵工艺与技术国家工程实验室,江苏无锡4;.肉品加工与质量控制国家重点实验室/江苏雨润肉类产业集团有限公司,江苏南京806)
脱脂米糠碱溶醇溶物抗氧化活性研究
崔红军1,徐宝才1,2,王莉1,韩衍青2,罗小虎1,陈正行*1
(1.江南大学食品学院/粮食发酵工艺与技术国家工程实验室,江苏无锡214122;2.肉品加工与质量控制国家重点实验室/江苏雨润肉类产业集团有限公司,江苏南京211806)
摘要:脱脂米糠的碱溶醇溶物具有良好的体外抗氧化活性。从脱脂米糠中提取抗氧化物,采用羟基自由基体系、DPPH自由基体系、超氧阴离子自由基体系、亚油酸体系、纯猪油体系、ORAC体系、PC12细胞氧化损伤体系,研究脱脂米糠的碱溶醇溶物清除自由基和脂质过氧化物的效果。结果表明:当样品质量浓度为0.2 g/mL时,其对·OH的清除率超过50%;样品质量浓度为0.6 mg/mL时,酶解产物的DPPH清除率可达90%;样品质量浓度45.0 mg/mL时,O2-清除率约为50%;样品浓度高于60 μg/mL时,样品的ORAC值与异VC钠相当;在亚油酸体系中,500 μg/mL的样品有明显的抗氧化效果,500 μg/mL和1 mg/mL的样品显著好于相同浓度的异VC钠;在猪油抗氧化体系中,质量分数5%样品添加组的猪油达到相同的pov所需的天数延长;随着样品质量浓度的增加,PC12细胞存活率呈现依次升高的趋势,5 mg/mL的样品的PC12细胞存活率达到82.2%,抗氧化效果好于200 μmol/L的Trolox。
关键词:脱脂米糠;抗氧化;DPPH;O2-;亚油酸;猪油;ORAC;PC12
目前用于食品抗氧化的物质大多为一些人工合成化合物,如BHA(叔丁基羟基茴香醚),BHT (2,6-二叔丁基对甲酚)等,但随着深入研究,发现其具有毒性、致癌性等副作用[1],近年来,消费者食品安全意识的日益提高给食品生产者带来新的压力与挑战,开发安全天然的抗氧化剂成为亟需解决的问题。
脱脂米糠是米糠制油后的剩余物,含有大量的优质蛋白质[2],碳水化合物,维生素矿物质,色素,植酸,γ-谷维素[3]等微量生理活性物质。据报道[4],米糠具有许多生理作用,能够降低血脂,降低血液总胆固醇和低密度脂蛋白胆固醇含量,增加高密度脂蛋白胆固醇含量,还能调节血糖,具有抗癌活性等。米糠的许多生理作用跟所含抗氧化组分有关。研究发现米糠中的γ-谷维醇[5],多糖[6],抗氧化肽[7]等都有很好的抗氧化能力。资料显示,米糠的深度开发利用,尤其是米糠中的提取物制成的功能性食品可使米糠附加值提高60倍,使其产值多倍增长[8]。联合国工业发展组织把米糠称为一种未充分利用的原料。就我国米糠的利用而言,少量米糠用作生生产米糠油和菲丁的原料,而大部分米糠主要当作饲料使用,这造成了资源的严重的浪费。国内外学者对米糠的抗氧化的研究主要集中在对全脂米糠,而对脱脂米糠碱醇提物的研究还较少。
因此,作者从脱脂米糠中提取抗氧化功能因子脱脂米糠碱溶醇溶物,在综合利用米糠的同时,优化提取工艺,并利用几种体外模型探讨其体外抗氧化活性,丰富了米糠抗氧化活性因子方面的内容,以期为工业化生产提供理论依据,促进在食品工业中的大规模商业化应用。
1 材料与方法
1.1材料与仪器
脱脂米糠:益海嘉里黑龙江分公司提供,-4℃保存,耐高温;1,1-二苯基苦基苯肼(DPPH)、菲啰嗪(Ferrozine):Sigma公司产品;其余试剂为分析纯。
UV-2000型紫外可见分光光度仪:日本日立公司产品;ALPHA 1-2LD PLUS型冻干机:德国Marin christ公司产品;IKA RV 10数显型旋转蒸发仪:德国IKA公司产品;飞鸽牌离心沉淀机:上海安亭科学仪器厂产品;FE20K型pH计:梅特勒-托利多仪器有限公司产品;MB23型水分分析仪:上海奥豪斯实验仪器有限公司产品;101-1型电热恒温鼓风干燥箱:上海锦昱科学仪器有限公司产品;MP-501A超级恒温水浴:上海一恒科学仪器有限公司产品;AB204-N型分析天平:梅特勒-托利多(上海)公司产品;实验用标准筛:新乡市康达新机械有限公司产品;IK-82电热真空干燥箱:上海实验仪器有限公司产品;Q-250A3多功能粉碎机:上海冰都电器有限公司产品。
1.2方法
1.2.1脱脂米糠碱溶醇溶物的提取工艺取1 kg脱脂米糠(80目,干重),加10 L水,调pH到11,45℃反应3 h,离心(4 200 r/min,15 min)取上清,上清液调pH到4.5,酸沉0.5 h,离心(8 500 r/min,15 min),沉淀冷冻干燥即是米糠粗蛋白,上清液浓缩,浓缩液加乙醇至体积分数80%,过夜醇沉,离心(8 500 r/min,15 min),沉淀冷冻干燥即是米糠粗多糖,上清液浓缩至干冷冻干燥即是米糠碱溶醇溶物。
1.2.2羟基自由基清除能力测定邻二氮菲法[9]:各取l mL 0.75 mmol/L邻二氮菲无水乙醇溶液于22个试管中,依次加入2 mL 0.2 mol/L pH 7.40磷酸盐缓冲溶液和l mL蒸馏水,充分混匀后,加入l mL 0.75 mmol/L硫酸亚铁溶液(FeSO4·7H2O)混匀,再加入l mL体积分数0.01%双氧水(H2O2),于37℃水浴60 min,以蒸馏水作参比,在510 nm处测其吸光值,所测得的数据为损伤管的吸光值A(损);以l mL样品液代替l mL蒸馏水则测得样品的吸光值A(样);用l mL蒸馏水代替l mL双氧水测得的吸光值为A(未损伤)。重复3次。清除率按下式计算:
1.2.3 DPPH自由基清除能力测定[10-11]吸取样品液各100 μL,加入100 μL DPPH溶液,混匀。室温避光反应30 min后于517 nm处测定其吸光度;同法吸取100 μL水,加入100 μL DPPH溶液,反应作为对照管。并以VC作阳性对照。每份样品平行测定3次,根据下述公式计算清除率。结果通过SPSS统计软件分析标准差(SD)及Duncan’s新复极差检验。DPPH清除率(%)=(1-(A样+DPPH-A样)/A对照)×100,式中,A样+DPPH为样品与DPPH反应后吸光度(即100 μL样品+100 μL的DPPH的吸光度),A对照为DPPH不加样品时的吸光度(即100 μL水+100 μL的DPPH的吸光度),A样为样品不加DPPH时的吸光度(即100 μL样品+100 μL无水乙醇的吸光度)。
1.2.4超氧阴离子自由基清除能力测定采用邻苯三酚自氧化法测定样品对超氧自由基的清除作用。在11个试管中各取9 mL 0.01mol/L磷酸盐缓冲液(pH 8.2)与l mL样品液混合,25℃恒温水浴15 min。取3 mL混合液于5 mL试管中,加入0.l mL 的45 mmol/L邻苯三酚,摇匀,在第四分钟加入浓盐酸1滴终止反应,于325 nm处测定样品吸光值(A1),同时分别测定不加邻苯三酚的样品液和磷酸盐混合液的吸光值(A2)和以l mL溶剂代替样品液的磷酸盐和邻苯三酚混合液的吸光值(A3),重复3次。结果计算:式中,A1为样品与邻苯三酚反应后吸光度,A2为不加邻苯三酚的样品液和磷酸盐混合液的吸光值,A3以l mL溶剂代替样品液的磷酸盐和邻苯三酚混合液的吸光值。
1.2.5 ORAC清除能力测定在96孔板各微孔中分别加入待测样品20 μL后添加缓冲溶液20 μL 及FL 20 μL,震荡,在37℃下预置5 min后,用多道移液器迅速在各孔中加入AAPH 140 μL启动反应,并将微孔板置于荧光分析仪中在37℃下以激发波长485 nm,发射波长538 nm进行连续测定,每2 min测定一次各孔荧光强度,测定时间一般设定在荧光衰减呈基线后为止。ORAC实验需要设定两种对照,即没有添加自由基的FL荧光自然衰减对照(-AAPH)和没有抗氧化剂存在时的自由基作用对照(+AAPH)。样品的抗氧化能力与自由基作用下荧光衰退曲线的延缓部分面积(NetAUC)直接相关。
1.2.6亚油酸体系清除能力测定采用硫氰酸铁盐(FTC)比色法,分别于8个试管中各加入1.0 mL的样品溶液,2.0 mL 0.05 mol/L pH7.0的磷酸盐缓冲液,1.0 mL含体积分数2.5%亚油酸的无水乙醇溶液,1.0 mL蒸馏水,混匀后,将试管密封,并避光,置于40℃恒温箱中反应,同时以乙醇做空白。在4.85 mL体积分数75%的乙醇中加入50 μL亚油酸乳化液,混匀后加入50 μL质量分数30%的硫氰酸氨,再加入50 μL 0.02 mol/L的氯化亚铁溶液(含质量分数3.5%盐酸),3 min后于500 nm下测定反应液的吸光度,亚油酸氧化程度以A500 nm表示。t时刻的过氧化值以t-t0表示,其中t0为0时刻的过氧化值,每24 h测定一次。以反应240 h时的氧化程度计算各样品的抗氧化能力,抑制率(%)如下式。
1.2.7纯猪油清除能力测定根据国标GB/ T5009.37-2003,采用烘箱强化氧化法测定油脂的过氧化值(POV)。(1)油脂自氧化:称取刚炼制冷却后的新鲜猪油9份(40 g/份)至锥形瓶中,分别按油质量的1%、2%、3%、4%、5%添加样品,混合均匀,置于60℃恒温烘箱中,每隔24 h搅拌一次,并交换其在烘箱中的位置,48 h取样一次,连续取样2周。(2)测定过氧化值(POV):称取2.00~3.00 g混匀的试样,置于250 mL碘量瓶,加30 mL CHCl3一冰乙酸混合液(2/3,V/V),使试样完全溶解。加入1.00 mL饱和KI溶液,塞上瓶盖,并轻轻振摇0.5 min,于暗处放置3 min,取出加100 mL水,摇匀,立即用硫代硫酸钠标准滴定液(0.002 mol/L)滴定,至淡黄色时,加1 mL淀粉指示液(10 g/L),继续滴定至蓝色消失为终点。取相同量CHC13-冰乙酸溶液、KI、水,按相同方法作试剂空白试验。X1(过氧化值g/hg)=(C×V× 0.126 9)/m×100,X2=X1×78.8,C—硫代硫酸钠溶液浓度(mol/L),V—滴定时消耗的硫代硫酸钠溶液体积减去空白消耗硫代硫酸钠溶液体积(mL),m,试样的质量g,0.126 9,与1 mL硫代硫酸钠标准滴定溶液(浓度:1 mol/l)相当碘的质量,单位为克(g),78.8,换算因子,计算结果保留2位有效数字[12]。
1.2.8 PC12细胞氧化损伤体系清除能力测定PC12细胞培养采用高糖DMEM培养基(体积分数10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素)培养,饱和湿度培养箱中37℃、体积分数5% CO2。单层培养,使用质量分数0.25%胰蛋白酶液消化,进行传代培养;噻唑蓝(MTT)法测定细胞存活率:参考郭旭的方法,将处于对数生长期的PC12细胞制备成一定密度的细胞悬液,每孔100 μL,接种于96孔板中,置于饱和湿度培养箱中37℃、5% CO2培养24 h,倒置显微镜观察细胞形态和数目,拍照(x200),终止培养前移去培养液,再加入H2O2溶液,100 μL/孔,继续培养2 h,倒置显微镜观察细胞形态和数目,拍照(x200),弃培养液,再向每孔中加入5 mg/mL MTT溶液20 μL,置于饱和湿度培养箱中37℃、5% CO2继续培养4 h,移去培养液,向每孔中加入150 μL DMSO溶液,振荡10 min,用酶标仪测定96孔板各孔A570 nm下的吸光值,细胞存活率,式中:A为实验组的A570 nm;A0为对照组的A570 nm。
1.2.9数据统计分析结果均用x±sd表示,运用SPSS 20.0软件对数据进行单因素方差分析(ANOVA),并用Tukey检验进行组件比较,显著水品为P<0.05,极显著水平位P<0.01。
2 结果与讨论
2.1米糠碱溶醇溶物清除羟基自由基活性
邻二氮菲-Fe2+氧化法主要用于检测体外羟自由基的氧化作用,利用H2O2和Fe2+混合发生Fenton反应,生成具有很高反应活性的·OH,Fe2+是催化剂,邻二氮菲-Fe2+水溶液被羟基自由基氧化为邻二氮菲-Fe3+后,使其在510 nm最大吸收峰消失,从而根据该波长下吸光度变化来判断提取物清除羟基的能力。以VC作对比,研究不同质量浓度(0.1~1 g/ mL)米糠碱溶醇溶物对·OH的清除能力,结果见图1。由图1可知,随样品质量浓度的增加,米糠碱溶醇溶物对·OH的清除率呈现上升趋势,并且具有明显的量效关系。当质量浓度为0.2 g/mL时,其对· OH的清除率超过50%。VC在低质量浓度(0.1~ 0.6)g/mL范围内,对·OH的清除率随浓度增加上升很快,而浓度在(0.6~1.0)g/mL时,清除率变化不大。经分析可知:VC的IC50约为0.25 mg/mL,酶解物的IC50约为0.2 g/mL。

图1 米糠碱溶醇溶物清除羟基自由基活性测定Fig. 1 Hydroxyl radical scavenging activity assay for the alkali and alcohol soluble extracts from the defatted rice bran
2.2米糠碱溶醇溶物清除DPPH自由基活性
二苯代苦味酰基自由基(DPPH·)在结构上具有苯环的共扼和位阻及硝基的吸电子作用,是一种稳定的自由基,广泛应用于测定纯抗氧化剂或植物提取物的体外抗氧化活性。其乙醇溶液呈紫红色,在517 nm处有一强吸收。当有抗氧化剂存在时,由于与其单电子配对而使其吸收逐渐消失,紫红色变淡,相应在517 nm处的最大吸收峰会减弱,因而可用光化学方法进行测定。结果如图2,由图2可知:在0~1 mg/mL质量浓度范围内,米糠碱溶醇溶物随浓度升高,清除率先增大后降低,其IC50为0.1 mg/ mL。当质量浓度为0.6 mg/mL时,酶解产物的DPPH清除率可达90%。VC在0~10 μg/mL随质量浓度成线性变化,在9.0 μg/mL时即达80%。
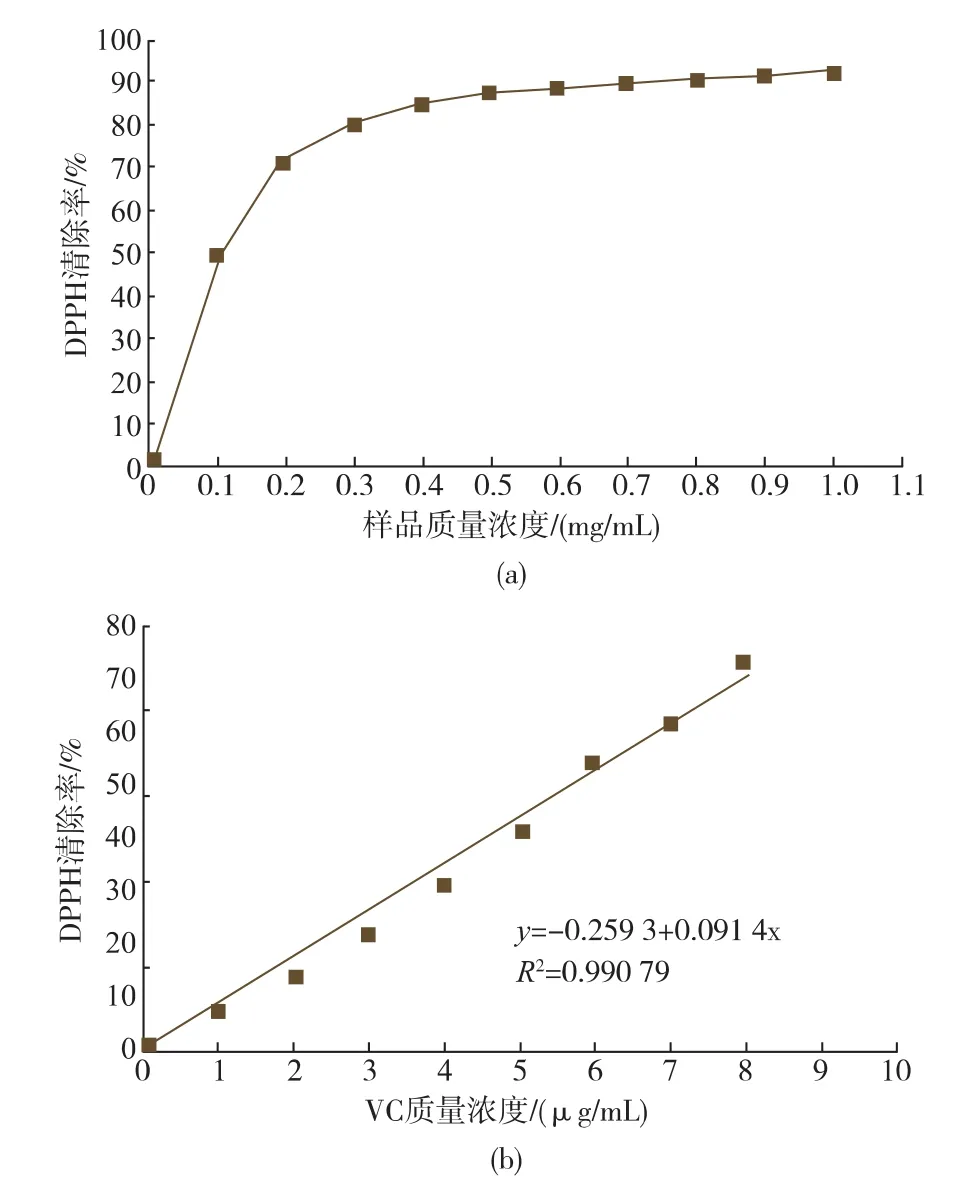
图2 米糠碱溶醇溶物清除DPPH活性测定Fig. 2 DPPH scavenging activity assay for the alkali and alcohol soluble extracts from the defatted rice bran
2.3米糠碱溶醇溶物清除超氧阴离子自由基活性
采用邻苯三酚自氧化法测定样品对超氧自由基的清除作用,超氧阴离子自由基O2-·能促进脂肪氧化,促进生物体衰老,诱发炎症和肿瘤。邻苯三酚自氧化法是测定清除O2-·活性的常用方法。在弱碱性介质中(pH=8.2)邻苯三酚会自身氧化分解产生O2-和有色中间产物,该有色中间产物在325 nm处有一特征吸收峰。利用O2-清除剂能使邻苯三酚自氧化产物在325 nm处的吸收峰受到抑制这一特点,通过测定吸光度可以推断清除剂对O2-的清除作用。实验与VC作对比,研究不同质量浓度(10~100)mg/mL碱溶醇溶物对O2-·的清除能力,结果如图3。由图3可知,米糠碱溶醇溶物对O2-·清除能力随着质量浓度的增加而增大,呈现量效关系。在45.00 mg/mL时,O2-清除率约为50%。VC的IC50约为0.35 mg/mL,酶解物的IC50约为45.00 mg/mL。
2.4米糠碱溶醇溶物清除ORAC清除能力测定
Oxygen radical absorbancecapacity(ORAC)方法,是目前抗氧化研究领域中为人们所关注的一个评价方法。该方法以偶氮类化合物AAPH作为过氧自由基来源。SodiumFluorescein为荧光指示剂,维生素E水溶性类似物Trolox为定量标准,使用荧光酶标仪进行分析。结果见图4,由图4可知,当样品质量浓度低于60 μg/mL时,样品的ORAC值低于异VC钠;当样品质量浓度高于60 μg/mL时,样品的ORAC值与异VC钠相当。
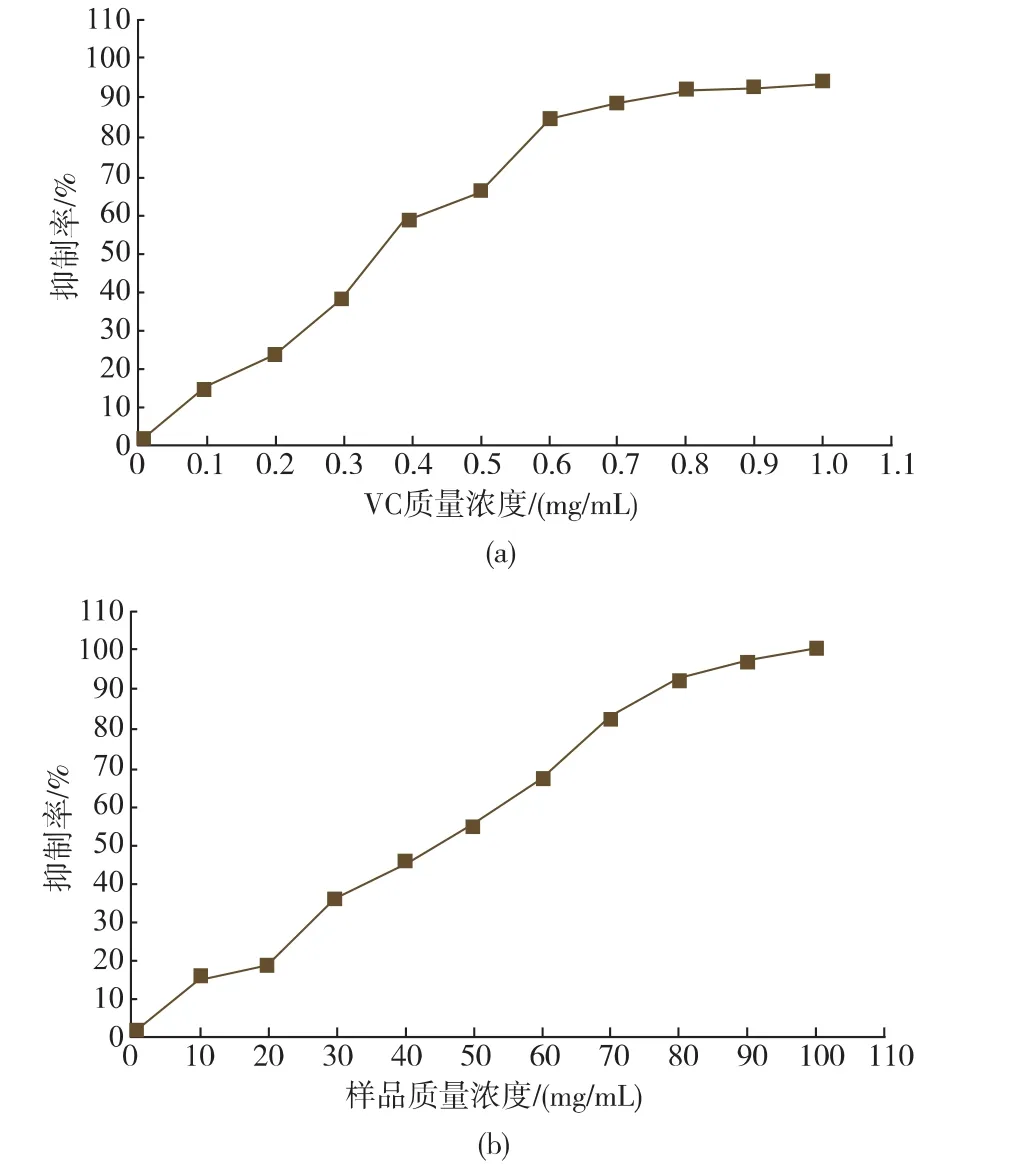
图3 米糠碱溶醇溶物清除超氧阴离子活性测定Fig. 3 Superoxide anion scavenging activity assay for the alkali and alcohol soluble extracts from the defatted rice bran

图4 米糠碱溶醇溶物ORAC测定Fig. 4 ORAC determination for the alkali and alcohol soluble extracts from the defatted rice bran
2.5米糠碱溶醇溶物亚油酸体系清除能力测定
硫氰酸铁盐(FTC)比色法是基于在酸性条件下,脂质氧化形成的过氧化物可将Fe2+氧化成Fe3+,然后Fe3+与硫氰酸根离子可形成在480~515 nm内有最大吸收的红色络合物。通常用500 nm处吸光值的高低表示物质抗脂质过氧化的能力,吸光值越小,表明物质的抗脂质过氧化能力越强。结果见图5,由图5可知500 μg/mL的样品有明显的抗氧化效果,500 μg/mL和1 mg/mL的样品显著好于相同浓度的异VC钠。

图5 米糠碱溶醇溶物在亚油酸体系中的抗氧化测定Fig. 5 Antioxidant activity of the alkali and alcohol soluble extracts from the defatted rice bran in linoleic System
2.6米糠碱溶醇溶物纯猪油清除能力测定
测定在纯猪油体系中的抗氧化效果,结果如图6所示,由图6可知,添加样品的猪油的pov小于未添加样品的猪油的pov,质量分数5%样品添加组的猪油的pov值明显小于质量分数1%样品添加组,猪油达到相同的pov所需的天数随着样品浓度的增加而延长,碱溶醇溶物的抗氧化效果弱于BHA和异VC钠。
2.7米糠碱溶醇溶物对PC12细胞氧化损伤体系清除能力测定
在倒置显微镜下观察,生长状态良好的正常细胞透明度大,呈现特有的细胞状态,细胞内颗粒少,质膜清晰,细胞功能不良或受损时,胞质清晰;细胞功能不良或受损时,胞质中常出现空泡和其他颗粒状物,细胞之间空隙加大,细胞表面的特化机构消失,细胞形态可变得不规则,甚至失去原有特点。
正常培养的PC12细胞为贴壁细胞,呈梭状,折光度强,成簇生长,细胞间有拉丝,见图7(a);H2O2损伤2 h后,PC12细胞数量明显减少,梭状特征逐渐消失,细胞间隙增大,贴壁能力降低,细胞变圆成簇,折光度减弱,见图7(b);与模型组相比,200 μmol/L的Trolox保护组的细胞原有形状有所恢复,细胞数目增多,见图7(c);1 mg/mL样品保护组的细胞原有形状恢复更好,细胞数目增加更多,少量细胞皱缩变圆,受损程度明显减轻,见图7(d)。

图6 米糠碱溶醇溶物清除猪油过氧化值测定Fig. 6 Determination of peroxide value of lard for the alkali and alcohol soluble extracts from the defatted rice bran
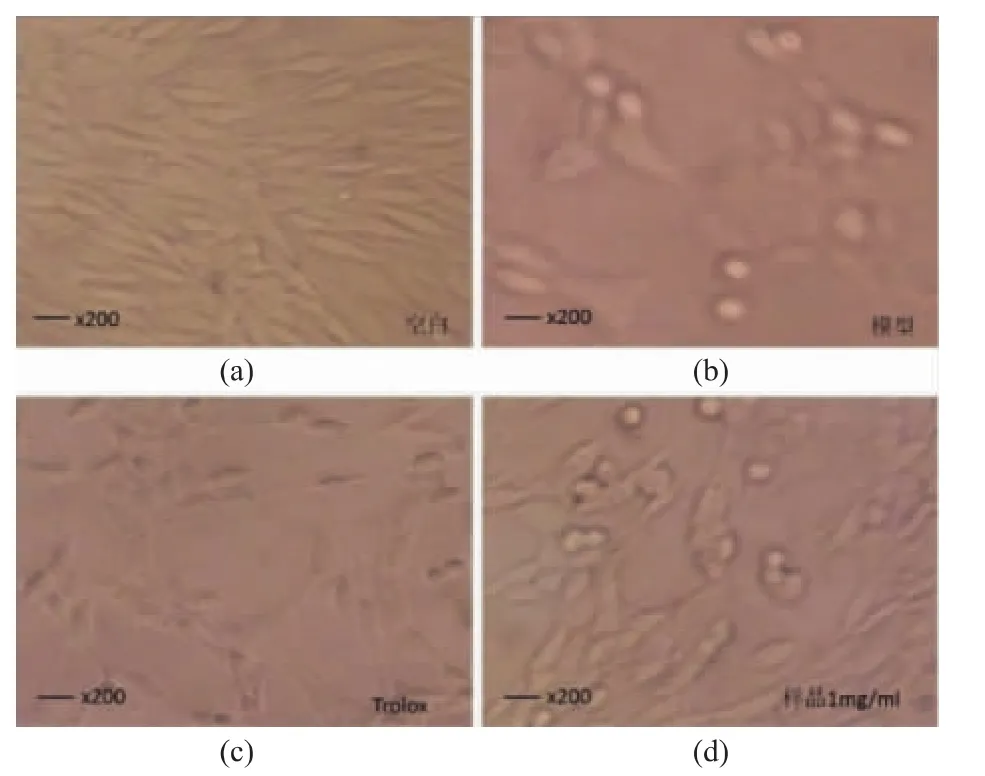
图7 倒置显微镜观察样品对PC12细胞氧化损伤后细胞形态的影响Fig. 7 Inverted microscope observation of PC12 cells morphology from oxidative damage cell
由图8(a)可知,样品对正常的PC12细胞有明显的毒害作用;由图8(b)可知,PC12细胞经样品保护下受到H2O2氧化损伤2h,细胞存活率有一定程度的改善,随着样品浓度的增加,PC12细胞存活率呈现依次升高的趋势,5 mg/mL的样品的PC12细胞存活率达到82.2%,5 mg/mL的样品抗氧化效果好于200 μmol/l的Trolox,这与倒置显微镜的观察一致。

图8 提取物对H2O2损伤PC12细胞的存活率Fig. 8 PC12 cell viability treated with the extractsl
参考文献:
[1]ITO N,HIROSE M,FUKUSHIMA S,et al. Studies on antioxidants:their carcinogenic and modifying effects on chemical carcinogenesis[J]. Food and Chemical Toxicology,1986,24(10):1071-1082.
[2]陈正行,姚惠源.米蛋白和米糠蛋白开发利用[J].粮食与油脂,2002(4):6-9. CHEN Zhengxing,YAO Huiyuan. Rice protein and the development and utilization of rice bran protein[J]. Cereals and Oils,2002(4):6-9.(in Chinese)
[3]田媛媛,林亲录,罗非君.米糠γ-谷维素生理功能研究新进展[J].粮食与油脂,2013,26(6):43-46. TIAN Yuanyuan,LIN Qinlu,LUO Feijun. New progress on physiological functions of γ-oryzanol from rice bran[J]. Cereals and Oils,2013,26(6):43-46.(in Chinese)
[4]QURESHI A A,SAMI S A,KHAN F A. Effects of stabilized rice bran,its soluble and fiber fractions on blood glucose levels and serum lipid parameters in humans with diabetes mellitus Types I and II[J]. The Journal of Nutritional Biochemistry,2002,13 (3):175-187.(in Chinese)
[5]龚院生,姚惠源.米糠中γ-谷维醇抗氧化功能与分子结构的关系[J].无锡轻工大学学报,2002,21(5):440-442. GONG Yuansheng,YAO Huiyuan. The relationship between the antioxidative function of γ-oryzanol and its molecular structure[J]. Journal of Wuxi University of Light Industry,2002,21(5):440-442.(in Chinese)
[6]ZHA X Q,WANG J H,YANG X F,et al. Antioxidant properties of polysaccharide fractions with different molecular mass extracted with hot-water from rice bran[J]. Carbohydrate Polymers,2009,78(3):570-575.
[7]张强,周正义,马玉涵,等.米糠肽抗氧化活性的研究[J].中国粮油学报,2008,23(5):9-12. ZHANG Qiang,ZHOU Zhengyi,MA Yuhan,et al. Antioxidation activity of rice barn peptide[J]. Journal of the Chinese Cereals and Oils Association,2008,23(5):9-12.(in Chinese)
[8]陈正行,王韧,王莉,等.稻米及其副产品深加工技术研究进展[J].食品与生物技术学报,2012,31(4):355-364. CHEN Zhengxing,WANG Ren,WANG Li,et al. Development in deep processing technology of rice and by-products[J]. Journal of Food Science and Biotechnolagy,2012,31(4):355-364.(in Chinese)
[9]殷微微,任学坤,赵永焕.麦胚蛋白酶解物清除自由基及抗氧化作用的研究[J].食品工业,2010(3):4-6. YIN Weiwei,REN Xuekun,ZHAO Yonghuan. Elimination effect on the free radical and antioxidation effectof wheat germ protein hydrolysates[J]. Food Industry,2010(3):4-6.(in Chinese)
[10]Thaipong K,Boonprakob U,Crosby K,et al. Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis,2006,19(6):669-675.
[11]Dudonne S,Vitrac X,Coutiere P,et al. Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J]. Journal of Agricultural and Food Chemistry,2009,57(5):1768-1774.
Antioxidant Activity of the Alkali and Alcohol Soluble Extracts from the Defatted Rice Bran
CUI Hongjun1,XU Baocai1,2,WANG Li1,HAN Yanqing2,LUO Xiaohu1,CHEN Zhengxing*1
(1. School of Food Science and Technology / National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China;2. State Key Laboratory of Meat Processing and Quality Control / Jiangsu Yurun Meat Group Co,LTD. Nanjing 211806,China)
Abstract:The alkali and alcohol soluble extracts from the defatted rice bran exhibit a good antioxidant activity in vitro. The antioxidant effects of the extracted antioxidants from the defatted rice bran on scavenging free radicals and lipid peroxides aganist oxidative damage system were studied by hydroxyl radical system,DPPH radical system,superoxide anion radical system,linoleic acid system,pure lard system,ORAC system,and PC12 cells,respectively. The scavenging rate of ·OH was over 50% for the extracts of 0.2 g/mL,while the clearance rate of DPPH was as high as 90% for 0.6 mg/mL extracts. The O2-clearance rate is about 50% for the extracts of 45.0 mg/mL andbook=36,ebook=41the ORAC value reached a comparable value with sodium D-isoascorbate when the extracts concentration was larger than 60 μg/mL,In linoleic acid system,a significant antioxidant activity was observed for the extracts of 500 μg/mL. At the meanwhile,the effect was better than sodium D-isoascorbate with same concentration for the extracts of 500 μg/mL and 1 mg/mL. In lard antioxidant studies,a longer duration was required for pov growing to the same level if the lard samples added with 5% extracts. The PC12 cell viability presented a successively increasing trend when the sample concentration increased,for example,the PC12 cell viability reached to 82.2% with 5 mg/mL sample added and the antioxidant effect was better than Trolox of 200 μmol/L.
Keywords:defatted rice bran,antioxidant,DPPH,O2-,linoleic acid,lard,ORAC,PC12
*通信作者:陈正行(1960—),男,江苏无锡人,工学博士,教授,博士研究生导师,主要从事粮食精深加工研究。E-mail:zxchen2007@126.com
基金项目:国家863计划项目(2013AA102200);国家自然科学基金项目(31101383);江苏省科技支撑计划项目(BE2012404)。
收稿日期:2014-11-24
中图分类号:TS 201.2
文献标志码:A
文章编号:1673—1689(2016)01—0035—07

