细菌诱导光滑鳖甲幼虫抑制差减cDNA文库的构建与分析∗
刘忠渊,王鹏,毛新芳
(新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆乌鲁木齐830046)
昆虫是地球上种类最多的生物类群,在长期的进化过程中它们形成了一套独特的天然免疫系统抵御外来微生物的感染[1].研究证明,昆虫能够对很多种病原物进行识别并产生免疫反应,包括细菌、真菌、原虫和寄生虫等[2,3].不同于哺乳动物,昆虫的免疫系统无T细胞和B细胞,昆虫只有天然免疫的保护[4].昆虫天然免疫由细胞免疫和体液免疫组成,细胞免疫主要依赖血细胞对外来抗原或异物的吞噬、集结和包囊[5].体液免疫包括能诱导抗菌肽产生的Toll和Imd信号通路,以及由酚氧化酶原(prophenoloxidase,PPO)等一系列酶参与的凝结和黑化反应[6].近10年来,关于昆虫免疫诱导表达的信号传递模式,主要是基于对果蝇抗菌肽的研究结果.目前在黑腹果蝇体内已发现8种抗菌肽,不同种类的抗菌肽的分子结构不同,抗菌谱和抗菌机制也不同[7].
新疆准噶尔盆地荒漠自然环境条件极端恶劣,在严酷的环境中生存着许多荒漠昆虫,它们适应极端环境的策略多种多样,不但耐受着荒漠极端环境的变化,而且也防御着生境中微生物的感染[8].拟步甲科的光滑鳖甲(Anatolica politaborealis),主要分布在准噶尔盆地、塔里木盆地和东疆诸盆地[9].前期研究发现,光滑鳖甲幼虫受到微生物的感染时,其血淋巴中会迅速产生有明显杀菌活性的抗菌物质.从Tricine-SDS-PAGE电泳检测发现细菌诱导后的泳道有明显增多的蛋白条带,暗示:增多的蛋白条带与光滑鳖甲的免疫抗菌调控相关.这些现象提示:光滑鳖甲可能存在着类似果蝇的免疫防御机制,产生了不同的抗菌肽,从而有效地防御外来微生物的感染.基于此,很有必要系统研究光滑鳖甲的免疫防御机制.
有关荒漠拟步甲科昆虫免疫防御机制尚未见报道.光滑鳖甲如何防御外来微生物的感染、体内免疫防御相关因子有怎样的变化规律、如何应答激活相关信号通路而产生抗菌肽等问题都有待于研究.为此,本研究构建了细菌诱导光滑鳖甲幼虫抑制差减cDNA文库,为进一步筛选和鉴定光滑鳖甲免疫抗菌相关基因,深入探讨光滑鳖甲的免疫防御机制奠定基础.
1 材料与方法
1.1 实验材料
光滑鳖甲成虫采自新疆阜康市222团.室内饲养成虫,进行产卵、孵化、幼虫生长,幼虫饲养条件为:喂食麦麸,恒温培养箱培育,30±2◦C,16 h光照/8 h黑暗,湿度50%.选取五龄幼虫进行细菌诱导实验,将大肠杆菌DH5α及金黄色葡萄球菌分别培养至OD600=0.5∼0.6,两种菌液按1:1的比例混合,用微量注射器取10µL混合菌液,注射至幼虫第三节侧腹部.培养16 h,将存活幼虫以75%酒精清洗干净,用于RNA的提取.
1.2 方法
根据抑制差减杂交原理,应用PCR-select cDNA Subtraction试剂盒(Clontech),以大肠杆菌DH5α与金黄色葡萄球菌混合菌液处理的、未处理的幼虫为Tester和Driver组进行差减杂交,对差减后产物进行两轮抑制PCR反应,PCR产物亚克隆至pGM-T载体中,构建抑制差减cDNA文库.
1.2.1 总RNA的提取
用TRIzol Reagent(Invitrogen)提取细菌处理和未处理的光滑鳖甲五龄幼虫的总RNA,琼脂糖凝胶电泳检测提取质量.进一步使用Oligotex mRNA试剂盒(TianGen)从总RNA中分离纯化mRNA.
1.2.2 双链cDNA的合成
分别取纯化的Tester和Driver mRNA各2.0µg,与1µL cDNA合成引物混合,补水至终体积为5µL,70◦C保温2 min后,冰浴2 min;然后在终体积为10µL的反应体系中,加入第一链反应缓冲液2µL、dNTP Mix(10µmol/L)1µL、MLV反转录酶1µL,42◦C保温1 h合成第一链cDNA.向第一链合成产物中加入:第二链反应缓冲液16.0µL、dNTP Mix(10µmol/L)1.6µL、第二链Cocktail酶4.0µL、无菌水48.4µL,16◦C孵育2 h;再加2µL(6U)T4 DNA聚合酶,16◦C孵育30 min,合成cDNA第二链.
1.2.3 抑制差减杂交
用RsaI酶切Tester和Driver的双链cDNA.Tester的双链cDNA酶切后分成两份,分别与adaptor 1和adaptor 2R连接后制成Tester1-cDNA和Tester 2-cDNA.Tester1-cDNA和Tester 2-cDNA分别与Driver cDNA进行第一次杂交,混合两种杂交产物,再与新变性的Driver cDNA进行第二次杂交.杂交产物用引物primer1进行第一次PCR扩增,第一次PCR扩增产物再用引物Nested primer1和2R进行第二次PCR扩增,反应结束后,根据PCR产物的电泳结果进行差减效率的检测.
1.2.4 抑制差减cDNA文库的构建
将获得的抑制差减杂交产物亚克隆至pGM-T载体上,转化E.coliDH5α感受态细胞,用氨苄青霉素和蓝白斑筛选阳性克隆.
1.2.5 差减文库的反向Northern Blot筛选
将阳性克隆中的菌落PCR产物,点到尼龙膜上,紫外线交联仪内固定核酸.依照Roche公司的DIG High Prime DNA Labeling and Detection Starter Kit使用说明进行操作,对2次PCR扩增产物进行探针标记,并进行杂交和免疫检测,筛选出信号差异的阳性克隆.
1.2.6 差异基因的测序及分析
根据2轮筛选得到的阳性克隆菌落PCR的结果,选取单一且插入片段大于200 bp的阳性克隆,送上海生物工程有限公司进行测序,将所得序列在GenBank数据库中进行BlastX比对分析,根据序列比对结果,对所获得的ESTs进行GO(Gene Ontology)功能及参与的生物途径归类.
2 结果
2.1 光滑鳖甲总RNA的提取及双链cDNA的合成
采用Trizol法提取的光滑鳖甲幼虫对照组(Driver)和实验组(Tester)的总RNA条带清晰且无拖尾现象,有完整的28S,18S和5.8S(图1A),经紫外分光光度检测实验组和对照组的OD260/280分别为1.98和1.97,表明RNA的纯度较高,完整性好,符合建库要求.使用Oligotex mRNA Kits从总RNA中分离纯化了mRNA,用M-MLV RTase cDNA Synthesis Kit合成了双链cDNA,Driver组主要分布在1 200~250 bp,Tester组主要分布在1 500~250 bp,条带呈弥散状均匀分布在相应区域内,区域内存在较明显的条带,Driver组主带大小约1 000 bp,Tester组主带大小约1 200 bp.
2.2 差减文库cDNA片段的PCR筛选
将差减cDNA片段连接入pGM-T载体,得到近2000个克隆的质粒文库,随机挑取300个克隆进行PCR筛选.发现其插入片段大小在200~750 bp之间,图2为随机挑取的17个克隆的PCR结果.
2.3 反向Northern杂交对差异片段的筛选
地高辛-dUTP进行随机引物DNA标记筛选结果见图3,其中A是正向差减探针杂交结果,B是反向差减探针杂交结果.杂交点的大小、深浅表示信号的强弱.若正向差减探针杂交有信号,反向无信号,表明是细菌诱导的差异表达基因,可进一步分析(如c1,c9,d10);若正向信号强度比反向强约3倍以上,也表明是差异表达基因,可以进行进一步分析(如a9);信号强度相似为非差异表达基因,不做进一步分析.根据判断从940个克隆中共筛选出70个可进一步分析的阳性克隆.
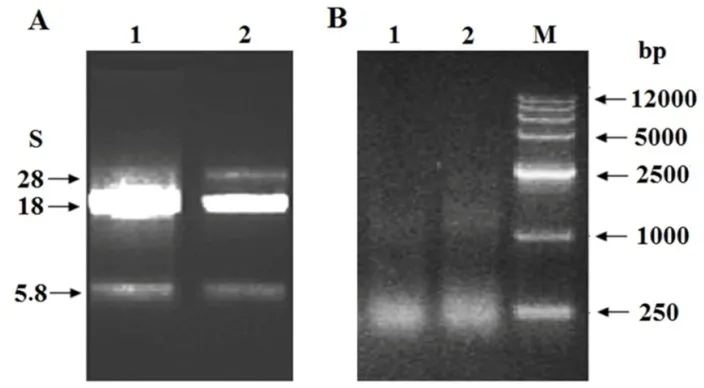
图1 光滑鳖甲总RNA(A)及双链cDNA(B)凝胶电泳图
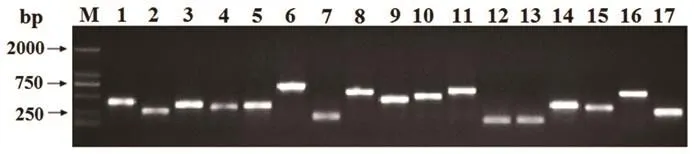
图2 差减cDNA文库中插入cDNA片段大小的鉴定
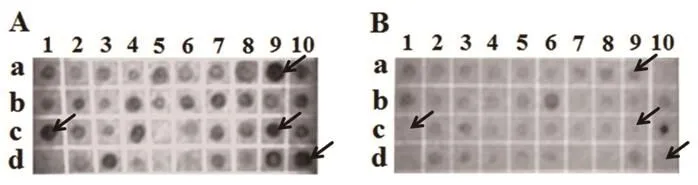
图3 反向Northern探针杂交结果
2.4 差减cDNA ESTs序列的统计与分析
将从940个克隆中筛选出的70个克隆送上海生工公司进行测序分析,测序结果在NCBI网站上进行Blast分析.结果显示,序列长度集中在250~350 bp,占所有序列的41%,其次150~250 bp及350~450 bp的序列分别占总序列的29%和23%,小于150 bp的序列占总序列的7%(图4 A).正向差减文库筛选出的序列主要为抗菌肽相关基因,涉及Attacin、coleoptericin、defensin等抗菌肽,占总数的40%;肽聚糖识别蛋白占5%;核糖体蛋白占4%;滞育蛋白占11%;其它包括化学感受蛋白、金属蛋白酶抑制样蛋白等占38%(图4B).此外,生物过程分析的结果显示,文库所涉及的生物过程包括生物调节,细胞杀伤,细胞分子与组织结构、细胞过程,免疫防御,代谢过程,多生物体过程,刺激应答几个过程,其中刺激应答和多生物体过程分别涉及20个和9个蛋白.
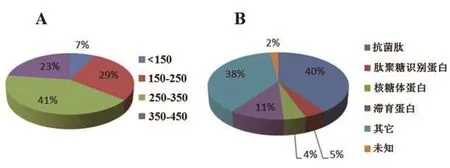
图4 文库测序片段的长度分析和功能分类
通过分析细菌诱导条件下的基因表达情况,初步建立了光滑鳖甲细菌诱导的基因表达谱.在正向抑制差减文库中,筛选到与同源序列的功能相似的ESTs的功能大致分为三类:一类是在先天免疫中发挥抗菌功能的功能蛋白和信号转导中起调控作用的蛋白,如抗菌肽类、肽聚糖识别蛋白(Peptidoglycan recognition protein,PGRP)、β-1,3-葡聚糖识别蛋白(β-1,3-glucan recognition protein,βGRP);一类是调节蛋白质合成类蛋白,如核糖体蛋白;一类是调控幼虫生长发育类蛋白,如滞育蛋白(表1).
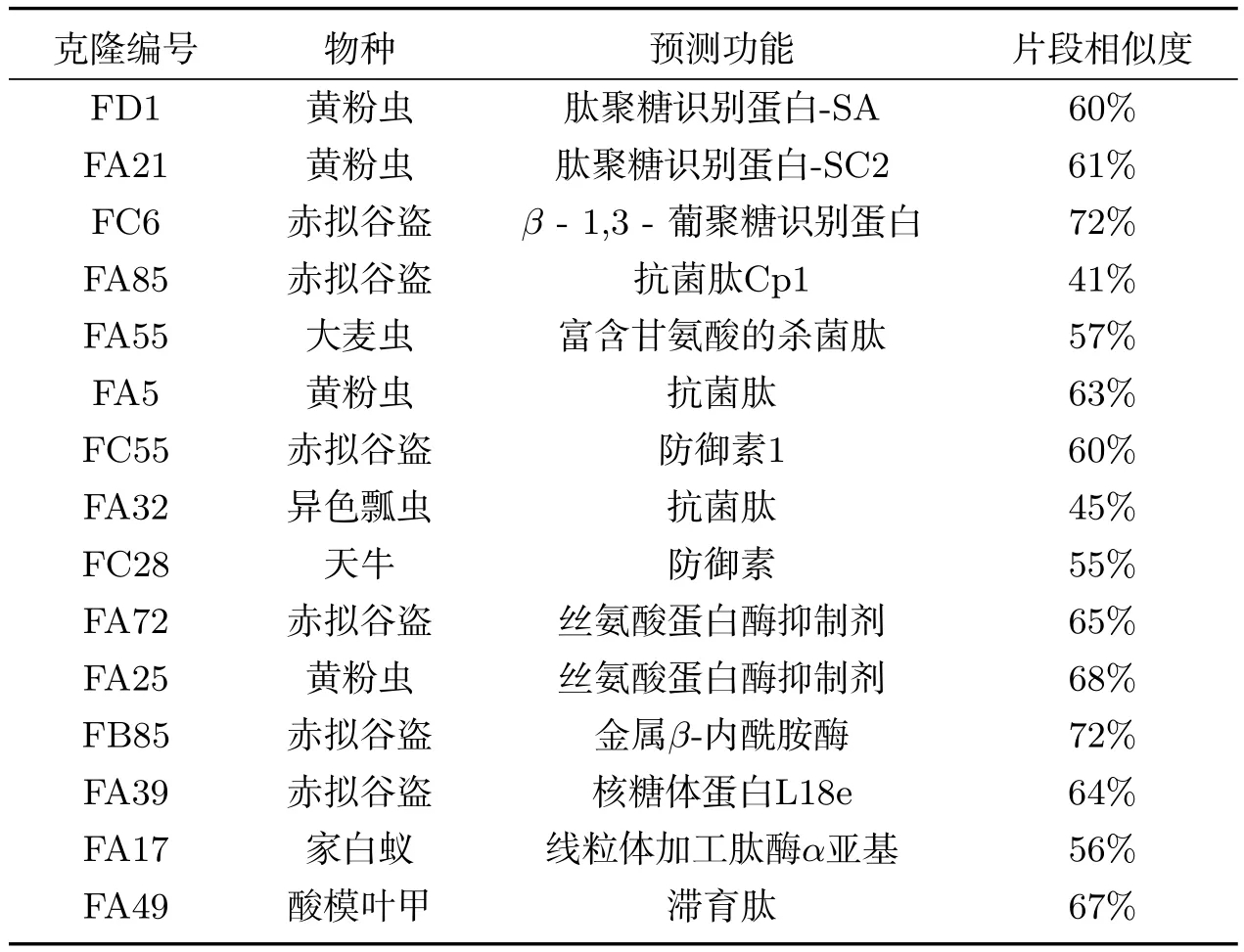
表1 部分阳性克隆cDNA片段的同源性分析
3 讨论
抑制差减杂交技术是一种利用抑制性PCR和差减杂交技术为基础的一种简单、快速地分离差异性表达基因的方法,该技术在研究基因克隆、基因表达及基因功能等方面有明显的优势[10,11].本研究选取光滑鳖甲5龄幼虫为实验材料,由于1∼4龄幼虫体型较小,诱导感染不便,且在光滑鳖甲整个生活周期中,5龄幼虫的诱导后免疫反应较强且生长周期相对适宜,构建相应的文库具有实际应用意义.在构建的光滑鳖甲抑制差减cDNA文库中,获得了6个编码抗菌肽基因的ESTs序列,2个编码肽聚糖识别蛋白基因的ESTs序列,1个编码β-1,3-葡聚糖识别蛋白基因的ESTs序列,2个编码丝氨酸蛋白酶抑制剂基因的ESTs序列及调节蛋白质合成类和调控幼虫生长发育类等相关基因.
根据本研究所得基因ESTs序列推测,在光滑鳖甲幼虫受到细菌感染时,机体可能产生一系列先天免疫应答反应,通过肽聚糖识别蛋白或β-1,3-葡聚糖识别蛋白识别细菌细胞壁及细胞膜表面受体,激活Toll和IMD两条信号途径[12],激活相关抗菌肽的表达,从而杀死外源微生物.昆虫实现有效防御的关键阶段是免疫的识别,只有对入侵病原微生物进行有效识别,才能激活和调动机体的各种免疫反应和抗菌效应.目前,在昆虫中发现的模式识别受体有肽聚糖识别蛋白、脂多糖结合蛋白(Lipopolysaccharide-binding protein,LPS-BP)、革兰氏阴性菌结合蛋白(Gram-negative bacteria-binding proteins,GNBP)、β-1,3-葡聚糖识别蛋白等,可识别外源微生物的肽聚糖、脂多糖、磷壁酸、β-1,3-葡聚糖等[13].当这些分子信号被昆虫的免疫受体捕获后,激发了包括体液免疫和细胞免疫在内的一系列免疫应答反应.其中,肽聚糖识别蛋白和β-1,3-葡聚糖识别蛋白主要激发体液免疫应答反应.
自家蚕的肽聚糖识别蛋白被鉴定以来,学者们从果蝇、大鼠、小鼠和人体内等成功克隆出约40多种PGRPs同源基因[14].Xiumei Wei等从大竹蛏体内克隆得到SgPGRP-S1和SgPGRP-S2基因[15],刘辉等通过构建金黄色葡萄球菌感染文昌鱼的差减文库,筛选到文昌鱼PGRPs[16].PGRPs基因从昆虫到哺乳动物具有高度的保守性,C-末端包含一个与细菌II型酰胺酶同源的PGRP结构域,表明PGRPs和原核肽聚糖II型裂解酶在进化上的同源性[17].第一个β-1,3-葡聚糖识别蛋白也是从家蚕中发现的,能识别革兰氏阴性细菌[18,19],还可以识别革兰氏阳性细菌和真菌[20−22].昆虫受到革兰氏阳性细菌和真菌攻击后,β-1,3-葡聚糖识别蛋白识别外源微生物,启动Toll信号通路进行免疫防御[23].研究表明,β-1,3-葡聚糖识别蛋白和肽聚糖识别蛋白能够形成模式识别复合物,共同识别细菌的入侵,引发下游的蛋白水解酶的级联反应,信号传递到细胞核内,诱导抗菌肽基因的分泌表达[24].
除Toll和Imd信号途径介导的抗菌肽合成以外,昆虫体液内的另一类重要的免疫应答是酚氧化酶级联引起的黑化反应,昆虫在病原菌入侵或身体受到损害后,上游初始信号也被丝氨酸蛋白酶(Serine proteinase,SP)级联放大后最终使酚氧化酶原裂解为酚氧化酶(Phenoloxidase,PO),对微生物进行清除、杀灭等[25].丝氨酸蛋白酶级联反应,可以将识别病原体产生的微弱信号爆炸式的传递和放大,快速的激活免疫应答.然而丝氨酸蛋白酶级联在激活过程中不是无限被放大的,需要被严格地调控,通常丝氨酸蛋白酶抑制剂(serine protease inhibitors,serpins)是潜在调控丝氨酸蛋白酶的抑制剂,丝氨酸蛋白酶抑制剂的靶标蛋白酶在其反应中心环中的裂解键切割并与之形成紧密的高分子复合物,从而被相应的丝氨酸蛋白酶抑制剂不可逆地抑制[26].目前从烟草天蛾中鉴定到7个丝氨酸蛋白酶抑制剂基因,分别是serpin1-7,其中serpin1含有12个可变剪切导致的亚型:serpin1A-1K和serpin-1Z[27].在酚氧化酶激活途径中,HP21被serpin-4调控,HP6被serpin-5调控,PAP3被serpin-6抑制,HP8被serpin-1J抑制[28−31].
既然从果蝇到人类有着类似的免疫诱导表达的信号传递模式,并且在信号通路上的很多因子具有结构和功能的同源性,但不清楚这些通路是否在所有的昆虫内严格保守;在文库中虽然筛选到了肽聚糖识别蛋白,β-1,3-葡聚糖识别蛋白、丝氨酸蛋白酶抑制剂、抗菌肽等基因的ESTs序列,但这些免疫相关基因以何种机制整合各种信号、如何应答激活相关信号通路而产生抗菌肽等问题都有待于研究.因而,本研究所构建的细菌免疫诱导的抑制差减cDNA文库,为进一步克隆免疫相关基因,探讨光滑鳖甲应对细菌感染的免疫相关基因的表达变化规律,揭示光滑鳖甲的免疫防御机制奠定了基础.
参考文献:
[1]Stanley D,Miller J,Tunaz H.Eicosanoid Actions in Insect Immunity[J].Journal of Innate Immunity,2009,1:282-290.
[2]Wang Q,Liu Y,He HJ,et al.Immune responses ofHelicoverpa armigerato different kinds of pathogens[J].BMC Immunology,2010,11:9.
[3]Short SM and Lazzaro BP.Female and male genetic contributions to post-mating immune defence in femaleDrosophila melanogaster[J].Proc R Soc B,2010,277,3649-3657.
[4]Kari B,Csord´as G,Honti V,et al.The raspberry gene is involved in the regulation of the cellular immune response inDrosophila melanogaster[J].PLoS One,2016,11(3):e0150910.doi:10.1371
[5]吴姗,凌尔军.昆虫细胞免疫反应中的吞噬、集结和包囊作用[J].昆虫学报,2009,52(7):791-798.
[6]Paddibhatla I,Lee MJ,Kalamarz ME,et al.Role for Sumoylation in Systemic Inf l ammation and Immune Homeostasis inDrosophilaLarvae[J].PLoS Pathogens,2010,6(12):1-14.
[7]邓小娟,杨婉莹,李怡峰,等.果蝇抗微生物肽基因的免疫诱导模式[J].昆虫学报,2007,50(4):405-415.
[8]李晨华,李彦,谢静霞,等.荒漠-绿洲土壤微生物群落组成与其活性对比[J].生态学报,2007,27(8):3391-3399.
[9]黄人鑫,吴卫,毛新芳,等.新疆荒漠昆虫区系及其形成与演变[M].乌鲁木齐:新疆科学技术出版社,2005.
[10]梅冰,陆翔,窦法楷,等.抑制性差减杂交技术(SSH)及其应用研究进展[J].山西农业科学,2016,44(2):271-273.
[11]武小霞,孙晶,苏安玉,等.大豆再生抑制消减杂交文库的构建[J].东北农业大学学报,2014,45(7):38-44.
[12]Ryu JH,Kim SH,Lee HY,et al.Innate immune homeostasis by the homeobox gene caudal and commensal-gut mutualism inDrosophila[J].Science,2008,319:777-782.
[13]Sharma P,Yamini S,Dube D,et al.Structural basis of the binding of fatty acids to peptidoglycan recognition protein,PGRP-S through second binding site[J].Archives of Biochemistry and Biophysics,2013,529:1-10.
[14]Koyama H,Kato D,Minakuchi C,et al.Peptidoglycan recognition protein genes and their roles in the innate immune pathways of the red f l our beetle,Tribolium castaneum[J].Journal of Invertebrate Pathology,2015,132:86-100.
[15]Wei Xi,Yang J,Yang D,et al.Molecular cloning and mRNA expression of two peptidoglycan recognition protein(PGRP)genes from molluskSolen grandis[J].Fish&Shellfish Immunology,2012,32:178-185
[16]刘辉,叶湘漓.文昌鱼抗金葡菌感染差减文库的构建及免疫相关基因分析[J].中国生物化学与分子生物学报,2009,25(8):727-733.
[17]Kang D,Liu G,Lundstr¨Om A,et al.A peptidoglycan recognition protein in innate immunity conserved from insects to humans[J].Proc Natl Acad Sci,1998,95:10078-10082.
[18]Anjugam M,Iswarya A,Vaseeharan B.Multifunctional role of b-1,3 glucan binding protein purified from the haemocytes of blue swimmer crabPortunus pelagicusandin vitroantibacterial activity of its reaction product[J].Fish&Shellfish Immunology,2016,48:96-205.
[19]Rao XJ,Zhong X,Lin XY,et al.Characterization of a novel Manduca sexta beta-1,3-glucan recognition protein(bGRP3)with multiple functions[J].Insect Biochemistry and Molecular Biology,2014,52:13-22.
[20]Chen YY,Chen JC,Kuo YH,et al.Lipopolysaccharide and b-1,3-glucan-binding protein(LGBP)bind to seaweed polysaccharides and activate the prophenoloxidase system in white shrimpLitopenaeus vannamei[J].Developmental and Comparative Immunology,2016,55:144-151.
[21]Wang L,Ligoxygakis P.Pathogen recognition and signalling in the Drosophila innate immune response[J].Immunobiology 2006,211:251-61.
[22]Matskevich AA,Quintin J,Ferrandon D.The Drosophila PRR GNBP3 assembles effector complexes involved in antifungal defenses independently of its Toll pathway activation function[J].Eur J Immunol 2010,40:1244-54.
[23]Huang WJ,Xu XX,Freed S,et al.Molecular cloning and characterization of aβ-1,3-glucan recognition protein from Plutella xylostella(L.)[J].New Biotechnology,2015,32(2):290-299.
[24]Gobert V,Gottar M,Matskevich AA,et al.Dual activation of the drosophila toll pathway by two pattern recognition receptors[J].Science 2003,302:2126-2130.
[25]Jiang HB,Vilcinskas A,Kanost M R.Immunity in lepidopteran insects[J].Advances in Experimental Medicine and Biology,2010,708:181-204.
[26]Gettins PGW.Serpin structure,mechanism,and function[J].Chemical Reviews,2002,102(12):4751-4804.
[27]Kanost MR.Serine proteinase inhibitors in arthropod immunity[J].Developmental and Comparative Immunology,1999,23:291-301.
[28]Wang Y,Jiang HB.Purification and characterization of Manduca sexta serpin-6:a serine proteinase inhibitor that selectively inhibits prophenoloxidase-activating proteinase-3[J].Insect Biochemistry and Molecular Biology,2004,34:387-395.
[29]Tong Y,Jiang HB,Kanost MR.Identification of plasma proteases inhibited by manduca sexta serpin-4 and serpin-5 and their association with components of the prophenol oxidase activation pathway[J].The Journal of Biological Chemistry,2005,280(15):14932-14942.
[30]An C,Kanost MR.Manduca sexta serpin-5 regulates prophenoloxidase activation and the Toll signaling pathway by inhibiting hemolymph proteinase[J].HP6 Insect Biochemistry and Molecular Biology,2010,40:683-689.
[31]An C Ragan EJ,Kanost MR.Serpin-1 splicing isoform J inhibits the proSp¨atzle-activating proteinase HP8 to regulate expression of antimicrobial hemolymph proteins in Manduca sexta[J].Developmental and Comparative Immunology,2011,35:135-141.
- 新疆大学学报(自然科学版)(中英文)的其它文章
- The Absolute Ruin Risk Model with Constant Interest Investment and Linear Threshold Dividend Strategy∗
- 煤基活性炭的氧化改性及其对Cd2+的吸附性能∗
- 资源型产业与制造业集聚特征与影响因素异同分析∗
- Distance Signless Laplacian Integral Complete R-partite Graphs∗
- Finite-time Stability of Continuous-time Systems with Time-varying Delays∗
- On the Dynamical Behavior of Pest and it’s Predator Model∗

