表阿霉素与替莫唑胺联合应用对C6脑胶质瘤细胞增殖及凋亡作用
轩亚茹,应 雪,张春春,王亚华,闫荷露,李 霞
832000新疆石河子市,石河子大学药学院特种植物药资源教育部重点实验室
·论著·
表阿霉素与替莫唑胺联合应用对C6脑胶质瘤细胞增殖及凋亡作用
轩亚茹,应 雪,张春春,王亚华,闫荷露,李 霞
832000新疆石河子市,石河子大学药学院特种植物药资源教育部重点实验室
【摘要】目的探讨表阿霉素(EPI)与替莫唑胺(TMZ)联合用药对C6脑胶质瘤细胞和细胞肿瘤球的增殖抑制及诱导凋亡作用。方法培养C6脑胶质瘤细胞,取对数生长期细胞活性>95%的细胞进行实验。取C6脑胶质瘤细胞接种于96孔细胞培养板中培养,24 h后加入各药液10 μl至细胞培养孔中,细胞培养孔中EPI浓度梯度为0.05、0.10、0.50、1.00、5.00、10.00 μmol/L,TMZ的浓度梯度为0.1、0.5、1.0、5.0、10.0、20.0 μmol/L,继续培养24 h和48 h。采用酶标仪在540 nm波长处测定每孔吸光度(OD)值,计算各孔C6脑胶质瘤细胞的抑制率。取C6脑胶质瘤细胞接种于6孔板中,加入EPI、TMZ、EPI+TMZ(EPI终浓度为0.50、1.00、5.00 μmol/L,TMZ终浓度为1.0、5.0、10.0 μmol/L),继续培养24 h和48 h,经流式细胞仪检测EPI和TMZ联合对C6脑胶质瘤细胞的凋亡作用。培养C6脑胶质瘤细胞肿瘤球,加入EPI、TMZ、EPI+TMZ,EPI终浓度为5.00 μmol/L,TMZ的终浓度为10.0 μmol/L,分别于给药后0、1、3、7 d于倒置显微镜下观察肿瘤球的形态、球体是否有裂解、球核是否有坏死等现象。结果不同浓度的各药物在24、48 h对C6脑胶质瘤细胞增殖的抑制率比较,差异有统计学意义(P<0.05);各浓度EPI+TMZ联合用药对C6脑胶质瘤细胞增殖的抑制率均高于相同EPI或TMZ浓度下单独用药,差异均有统计学意义(P<0.05)。培养至24 h时,1.00 μmol/L EPI与5.0 μmol/L TMZ联合用药对C6脑胶质瘤细胞的增殖抑制率呈协同作用;培养至48 h时,0.50 μmol/L EPI与1.0 μmol/L TMZ联合用药对C6脑胶质瘤细胞的增殖抑制率呈协同作用。培养至24、48 h时,阴性对照、各浓度的EPI、TMZ及EPI+TMZ对C6脑胶质瘤细胞凋亡率的比较,差异有统计学意义(P<0.05)。经EPI、TMZ及其联合用药后肿瘤球体积明显受到抑制,表现为体积缩小,表面细胞裂解;联合用药较单独用药后肿瘤球球体致密性减小,裂解程度增大。结论EPI和TMZ联合用药对C6胶质瘤细胞具有协同抑制细胞增殖及诱导凋亡的作用,可引起C6脑胶质瘤细胞肿瘤球的裂解死亡。
【关键词】神经胶质瘤;表柔比星;替莫唑胺;细胞增殖;细胞凋亡
轩亚茹,应雪,张春春,等.表阿霉素与替莫唑胺联合应用对C6脑胶质瘤细胞增殖及凋亡作用[J].中国全科医学,2016,19(8):925-930.[www.chinagp.net]
Xuan YR,Ying X,Zhang CC,et al.Effect of the combined use of epirubicin and temozolomide in the proliferation and apoptosis of C6 glioma cells[J].Chinese General Practice,2016,19(8):925-930.
脑胶质瘤是中枢神经系统最为常见的恶性肿瘤,预后较差,平均生存时间仅14.6个月,其中5年生存率不超过5%[1-2]。表阿霉素(EPI)是高效广谱蒽环类衍生物抗肿瘤药,主要作用机制是嵌入DNA链,形成抑制DNA和RNA合成的复合物,通过触发拓扑异构酶Ⅱ引起DNA裂解,导致细胞死亡[3-4]。EPI已在临床上用于治疗乳腺癌、非霍奇金淋巴瘤、卵巢癌、软组织肉瘤、胰腺癌、胃癌、小细胞肺癌和白血病[5-7],已有研究表明,其对脑胶质瘤细胞具有很好的抑制效果[8]。与阿霉素相比,EPI在可比剂量下表现出更小的血液和心肌毒性[9-10]。替莫唑胺(TMZ)是一类含有咪唑四嗪环的烷化剂抗肿瘤药物,通过鸟嘌呤的O-6或N-7位上发生的DNA烷基化作用,导致肿瘤细胞死亡[11]。临床治疗脑胶质瘤的效果显著[12-14]。目前,对EPI与TMZ联合应用治疗脑胶质瘤的研究报道较少。本研究旨在探讨体外EPI联合TMZ用药对脑胶质瘤细胞增殖、凋亡的影响,以及对脑胶质瘤细胞肿瘤球的抑制作用,为临床脑肿瘤的治疗提供实验依据。
1材料和方法
1.1仪器和试剂CO2恒温培养箱、超净工作台(美国Thermo科技有限公司),台式离心机(美国贝克曼公司),倒置显微镜(日本Olympus公司),流式细胞仪(FACSAria Ⅲ,美国BD公司),酶标免疫测定仪(上海基因科技有限公司),SartoriusBP211D电子天平(德国赛多利斯集团);DMEM高糖培养基(美国Gibco公司),胎牛血清(杭州四季青生物科技有限公司),0.25%胰酶(美国Gibco公司),双抗(北京索莱宝生物技术有限公司),PBS缓冲溶液(上海生工科技有限公司),磺酰罗丹明B蛋白(SRB,美国Sigma公司);Annexin Ⅴ-FITC细胞凋亡试剂盒(南京凯基生物科技发展有限公司)。
1.2细胞株及培养条件C6脑胶质瘤细胞株购自中国科学院上海细胞库。细胞培养条件为:DMEM高糖培养基(含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素),37 ℃、5% CO2饱和湿度培养箱。取对数生长期活性>95%的细胞进行实验。
1.3方法
1.3.1体外抗增殖作用取对数生长期C6脑胶质瘤细胞接种于96孔细胞培养板中,每孔3 000个(含190 μl培养液),置于37 ℃、5% CO2培养箱中培养。24 h后加入各药液10 μl至细胞培养孔中,每种药液浓度设4个复孔,另设溶剂对照4个复孔。各药液分别为用无血清培养液配制的系列浓度的EPI、TMZ、EPI+TMZ,细胞培养孔中EPI的浓度梯度为0.05、0.10、0.50、1.00、5.00、10.00 μmol/L,TMZ的浓度梯度为0.1、0.5、1.0、5.0、10.0、20.0 μmol/L。将加好各药液的细胞培养板置于培养箱中继续培养24 h和48 h。培养完毕后,吸弃培养液,每孔加入4 ℃预冷的10%(W/V)三氯乙酸100 μl,静置5 min后移入4 ℃冰箱中固定1 h,取出用去离子水冲洗5次,室温晾干。每孔加入0.4% SRB染液100 μl,室温下染色15 min,弃去各孔内染液,用1%(V/V)乙酸冲洗5次,室温晾干后,用非缓冲Tris-base碱液(10 mmol/L,pH=10.5)溶解,在平板振荡器上振荡20 min,采用酶标仪在540 nm波长处测定每孔吸光度(OD)值,计算各孔C6脑胶质瘤细胞的抑制率,抑制率(%)=〔1-(实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)〕×100%。
1.3.2药物联合作用评价[15]参照公式Q=Ee+t/(Ee+Et-Ee×Et)评价EPI和TMZ体外联合用药对C6脑胶质瘤细胞毒性是否具有协同作用,其中Ee+t为联合用药抑制率,Ee和Et分别为EPI和TMZ的抑制率,分子代表“实测合并效应”,分母是“期望合并效应”。Q值0.86~1.15为单纯相加作用(+),Q值1.16~2.00为协同作用(++),Q值0.55~0.85为拮抗作用(-),Q值<0.55为明显拮抗作用(--)。
1.3.3凋亡作用采用流式细胞仪检测EPI和TMZ联合对C6脑胶质瘤细胞的凋亡作用。取对数生长期C6脑胶质瘤细胞,接种于6孔板中,接种密度为2×105个/孔,于37 ℃、5% CO2条件下培养。24 h后,加入无血清培养液以及无血清培养液配置的EPI、TMZ、EPI+TMZ(EPI终浓度为0.50、1.00、5.00 μmol/L,TMZ终浓度为1.0、5.0、10.0 μmol/L),置培养箱中继续培养24 h和48 h。每组药物设3个复孔,以无血清培养液为阴性对照。培养完毕后,用冷PBS漂洗3次,不含EDTA的胰酶消化;1 000 r/min离心5 min后用PBS洗涤细胞2次;用300 μl的PBS将离心的下沉细胞吹匀,依次加入500 μl的Binding Buffer、5 μl Annexin V-APC、5 μl 7-AAD,混匀后于室温避光的条件下反应10 min,经流式细胞仪检测。
1.3.4C6脑胶质瘤细胞肿瘤球生长抑制实验
1.3.4.1C6脑胶质瘤细胞肿瘤球的培养[16]配制2%(W/V)的琼脂糖凝胶溶液,在80 ℃的水浴中加热30 min,过滤灭菌;将150 μl C6脑胶质瘤细胞以2 000个/孔接种到96孔培养板中(该培养板中的每孔均预先加入40 μl琼脂糖凝胶溶液包被),在操作台中轻轻晃动该培养板30 min,置37 ℃、5% CO2条件下培养24 h,即可长成肿瘤球。
1.3.4.2药物对C6脑胶质瘤细胞肿瘤球的抑制用无血清培养液配置EPI、TMZ、EPI+TMZ,每孔给药体积为20 μl,EPI终浓度为5.00 μmol/L,TMZ的终浓度为10.0 μmol/L,以无血清培养液为阴性对照。分别于给药后0、1、3、7 d于倒置显微镜下观察肿瘤球的形态、球体是否有裂解、球核是否有坏死等现象。

2结果
2.1体外抗增殖作用不同浓度的各药物在24、48h对C6脑胶质瘤细胞增殖的抑制率比较,差异有统计学意义(P<0.05);各浓度EPI+TMZ联合用药对C6脑胶质瘤细胞增殖的抑制率均高于相同EPI或TMZ浓度下单独用药,差异均有统计学意义(P<0.05,见表1)。
表1不同药物对C6脑胶质瘤细胞增殖抑制率的比较
Table1ComparisonofproliferationinhibitionrateofC6gliomacellsamongdifferentdrugs
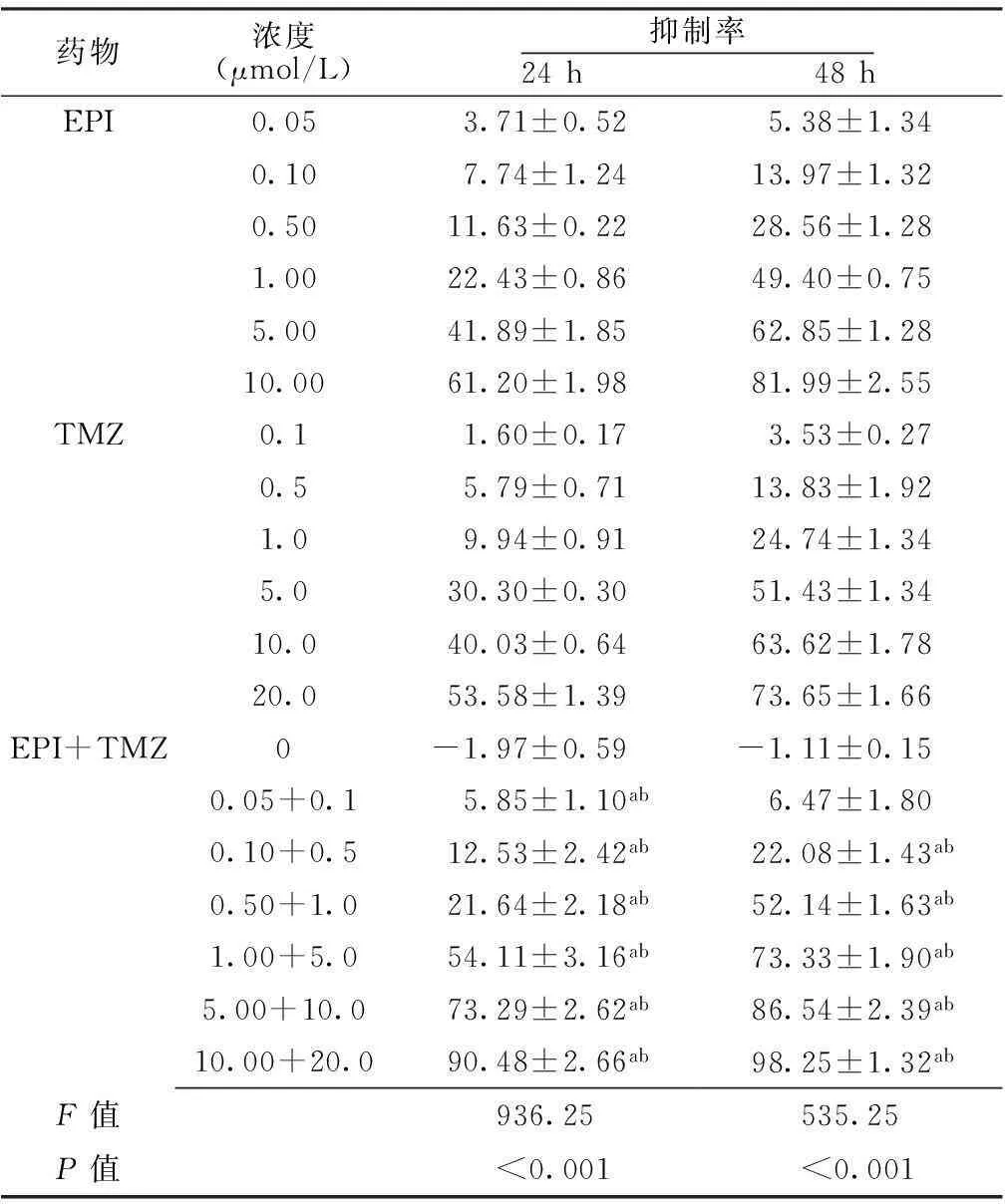
药物浓度(μmol/L)抑制率24h 48hEPI0.053.71±0.525.38±1.340.107.74±1.2413.97±1.320.5011.63±0.2228.56±1.281.0022.43±0.8649.40±0.755.0041.89±1.8562.85±1.2810.0061.20±1.9881.99±2.55TMZ0.11.60±0.173.53±0.270.55.79±0.7113.83±1.921.09.94±0.9124.74±1.345.030.30±0.3051.43±1.3410.040.03±0.6463.62±1.7820.053.58±1.3973.65±1.66EPI+TMZ0-1.97±0.59-1.11±0.150.05+0.15.85±1.10ab6.47±1.800.10+0.512.53±2.42ab22.08±1.43ab0.50+1.021.64±2.18ab52.14±1.63ab1.00+5.054.11±3.16ab73.33±1.90ab5.00+10.073.29±2.62ab86.54±2.39ab10.00+20.090.48±2.66ab98.25±1.32abF值936.25535.25P值<0.001<0.001
注:EPI=表阿霉素,TMZ=替莫唑胺;与同一浓度EPI比较,aP<0.05;与同一浓度TMZ比较,bP<0.05
2.2两药联合作用培养至24 h时,0.05 μmol/L EPI与0.1 μmol/L TMZ、0.10 μmol/L EPI与0.5 μmol/L TMZ、0.50 μmol/L EPI与1.0 μmol/L TMZ、5.00 μmol/L EPI与10.0 μmol/L TMZ、10.00 μmol/L EPI与20.0 μmol/L TMZ联合用药对C6脑胶质瘤细胞的增殖抑制率呈相加作用,1.00 μmol/L EPI与5.0 μmol/L TMZ联合用药对C6脑胶质瘤细胞的增殖抑制率呈协同作用;培养至48 h时,0.05 μmol/L EPI与0.1 μmol/L TMZ联合用药对C6脑胶质瘤细胞的增殖抑制率呈拮抗作用,0.10 μmol/L EPI与0.5 μmol/L TMZ、1.00 μmol/L EPI与5.0 μmol/L TMZ、5.00 μmol/L EPI与10.0 μmol/L TMZ、10.00 μmol/L EPI与20.0 μmol/L TMZ联合用药对C6脑胶质瘤细胞的增殖抑制率呈相加作用,0.50 μmol/L EPI与1.0 μmol/L TMZ联合用药对C6脑胶质瘤细胞的增殖抑制率呈协同作用(见表2)。

表2 EPI与TMZ对C6脑胶质瘤细胞的联合作用
注:++表示协同作用,+表示相加作用,-表示拮抗作用
2.3凋亡作用培养至24 h时,阴性对照、各浓度的EPI、TMZ及EPI+TMZ对C6脑胶质瘤细胞凋亡率的比较,差异有统计学意义(P<0.05);其中,1.00 μmol/L和5.00 μmol/L EPI、5.0 μmol/L和10.0 μmol/L TMZ及各浓度的EPI+TMZ对C6脑胶质瘤细胞凋亡率高于阴性对照,1.00 μmol/L EPI和5.0 μmol/L TMZ、5.00 μmol/L EPI和10.0 μmol/L TMZ联合用药对C6脑胶质瘤细胞凋亡率均高于同一浓度的EPI、TMZ单独用药,差异有统计学意义(P<0.05)。培养至48 h时,阴性对照、各浓度的EPI、TMZ及EPI+TMZ对C6脑胶质瘤细胞凋亡率的比较,差异有统计学意义(P<0.05);其中,1.00 μmol/L和5.00 μmol/L EPI、5.0 μmol/L和10.0 μmol/L TMZ及各浓度的EPI+TMZ对C6脑胶质瘤细胞凋亡率高于阴性对照,各浓度联合用药对C6脑胶质瘤细胞凋亡率均高于同一浓度的EPI、TMZ单独用药,差异有统计学意义(P<0.05,见表3)。
表3EPI、TMZ及其联合用药对C6脑胶质瘤细胞凋亡率的比较

Table3ComparisonofapoptosisrateofC6gliomacellsbetweenEPIorTMZaloneandEPI+TMZ

干预浓度(μmol/L)凋亡率24h 48h阴性对照-4.67±1.035.29±0.89EPI0.505.96±1.027.17±1.441.0011.73±0.87a16.10±1.32a5.0026.86±1.55a35.18±1.65aTMZ 1.0 5.09±1.575.84±1.30 5.0 9.22±1.09a14.04±1.41a10.023.43±3.01a30.67±2.22aEPI+TMZ0.50+1.07.78±1.39a11.27±1.68abc1.00+5.026.59±0.93abc31.96±1.74abc5.00+10.038.19±1.73abc56.50±2.49abcF值176.63290.90P值<0.001<0.001
注:与阴性对照比较,aP<0.01;与同一浓度EPI比较,bP<0.05;与同一浓度TMZ比较,cP<0.05
2.4C6脑胶质瘤细胞肿瘤球的生长抑制作用阴性对照C6脑胶质瘤肿瘤球细胞生长致密,增殖速度较快,肿瘤体积随培养时间明显增大。经EPI、TMZ及其联合用药后肿瘤球体积明显受到抑制,表现为体积缩小,表面细胞裂解;联合用药较单独用药后肿瘤球球体致密性减小,裂解程度增大(见图1,本文彩图请登录本刊官网www.chinagp.net查看)。
3讨论
脑胶质瘤为常见的颅内肿瘤,约占脑肿瘤患者的50%,由于其呈浸润性生长,无明显边界,手术不能完全根除,导致临床治愈率低,生存期短,病死率高,其中恶性脑胶质瘤患者5年生存率不足5%,病死率仅次于胰腺癌和肺癌,位居第3位[17-18]。化疗作为脑胶质瘤手术后的辅助治疗,为清除残余肿瘤细胞或抑制肿瘤复发提供可能。因此,开发对脑胶质瘤的治疗敏感有效、毒副作用小且经济适用的新的化疗方案成为当今研究热点。
TMZ是目前临床一线脑胶质瘤化疗药物,易于通过血-脑脊液屏障,能使脑胶质瘤细胞DNA烷基化,发挥其细胞毒作用[19]。EPI为一种作用于细胞周期的非特异性药物,是目前一线抗肿瘤药物,对多种实体瘤有效,其作用部位在细胞核,作用机制主要为进入细胞核与DNA结合,从而抑制核酸的合成和有丝分裂,引起细胞凋亡[20-21]。
本研究采用EPI联合TMZ作用于C6脑胶质瘤细胞,表现出较单独用药更强的抗增殖和促凋亡作用,且受时间和剂量的影响。培养24 h时,EPI(1.00 μmol/L)和TMZ(5.0 μmol/L)联合用药对C6脑胶质瘤细胞的增殖抑制表现为协同增强作用;培养48 h时,EPI(0.50 μmol/L)和TMZ(1.0 μmol/L)联合用药对C6脑胶质瘤细胞的增殖抑制表现为协同增强的作用,提示联合用药低剂量作用较长时间或高剂量作用较短时间均可增强对C6脑胶质瘤细胞的抗增殖作用。当联合用药剂量提高到EPI(5.00 μmol/L)和TMZ(10.0 μmol/L),在24、48 h时抑制率分别为73%和86%,凋亡率分别为38%和56%,可能因为给药浓度较高引起细胞死亡增加。联合用药后的抗增殖和促凋亡增强作用可能是因为EPI和TMZ能够分别迅速进入体外培养的细胞及细胞核内,与DNA结合[22]或使DNA烷基化[23-24],发挥细胞毒作用,引起细胞的凋亡甚至死亡。
然而,大多数脑肿瘤为实体瘤,肿瘤内的无血管区域能够阻止药物渗透到肿瘤的中心部位[25]。体外单层细胞的作用很强未必对体内实体瘤同样有效。与单层细胞的培养不同,神经胶质瘤体外三维球体模型(简称肿瘤球)可模拟实体瘤的无血管区域,更接近于体内肿瘤的细胞结构和环境[26]。通过评估药物体外对肿瘤球的抑制作用,从而预测其在体内对肿瘤的抑制效果[27]。本研究接种细胞后向同一方向晃动培养板,可将大部分细胞集中到培养板的中心位置,晃动时间过短,培养后形成多个分散的小聚集,无法对其定位拍照,预实验结果显示晃动25~30 min时,24 h后96孔板的大部分孔内只在中央位置形成一个大的细胞聚集,培养时间越长,聚集的细胞生长越紧密,形状更加接近球形;预先向96孔板内加入2%琼脂糖可为球体的形成提供骨架支撑,使细胞生长更为致密、行成的球体更加圆整。作用7 d后,阴性对照肿瘤球表面有轻微裂解,可能是由于培养时间长、球体过大,周围环境不足以提供细胞快速增殖需要的营养物质,而引起肿瘤球表面细胞死亡裂解[28-29]。与干预3 d后比较,EPI、TMZ单独用药7 d后肿瘤球变化不明显,分析原因可能为:(1)肿瘤球生长致密,药物无法渗透到球体内部;(2)单独给药作用较弱,只能引起肿瘤球表面细胞的死亡;(3)单次给药作用3~7 d,药物浓度下降,过低的浓度不足以使细胞凋亡。随时间延长,EPI+TMZ联合用药干预的肿瘤球裂解比较明显,但7 d时球体中间部分仍很致密,继续(多次)给药可能使肿瘤球进一步裂解,直至球体完全裂解。本研究的结果显示,与阴性对照、EPI及TMZ单独用药比较,EPI+TMZ联合用药更能有效地渗透至肿瘤球内部,进而抑制细胞增殖,减小肿瘤体积,预示临床上EPI联合TMZ用于治疗脑胶质瘤的可能性,提示一定浓度下多次给药,对实体肿瘤的治疗更为有效。
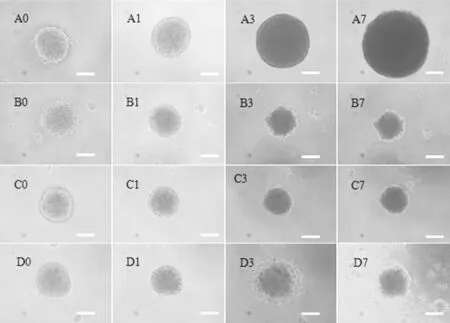
注:A0、A1、A3、A7分别为阴性对照干预后第0、1、3、7天,B0、B1、B3、B7分别为EPI干预后第0、1、3、7天,C0、C1、C3、C7分别为TMZ干预后第0、1、3、7天,D0、D1、D3、D7分别为EPI+TMZ干预后第0、1、3、7 d天;图中标尺为100 μm
图1EPI、TMZ及其联合用药对C6脑胶质瘤细胞肿瘤球的抑制作用(×100)
Figure 1Inhibiting effect of EPI,TMZ and EPI+TMZ on C6 glioma spheroids
本研究探讨了EPI及TMZ联合用药对C6脑胶质瘤细胞的增殖抑制及诱导凋亡的作用,为临床脑胶质瘤的治疗提供一定的实验和理论基础,但其复杂的联合作用机制,仍需进一步研究。
作者贡献:轩亚茹进行课题设计与实施、资料收集整理、撰写论文、成文并对文章负责;张春春、王亚华、闫荷露、李霞进行课题实施、评估、资料收集;应雪进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]Dolecek TA,Propp JM,Stroup NE,et al.CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J].Neuro Oncol,2012,14(Suppl 5):v1-49.
[3]Yuyama Y,Yagihashi A,Hirata K,et al.The effects of epirubicin hydrochloride(EPI) plus pretreatment of medroxyprogesterone acetate(MPA) on FM3A breast cancer cells transplanted in female C3H/He mice[J].In Vivo,2003,17(3):251-254.
[4]Altinoz MA,Bilir A,Gedikoglu G,et al.Medroxyprogesterone and tamoxifen augment anti-proliferative efficacy and reduce mitochondria-toxicity of epirubicin in FM3A tumor cells in vitro[J].Cell Biol Int,2007,31(5):473-481.
[5]Smith LA,Cornelius VR,Plummer CJ,et al.Cardiotoxicity of anthracycline agents for the treatment of cancer:systematic review and meta-analysis of randomised controlled trials[J].BMC Cancer,2010(10):337.
[6]van Dalen EC,Michiels EM,Caron HN,et al.Different anthracycline derivates for reducing cardiotoxicity in cancer patients[J].Cochrane Database Syst Rev,2010(5):CD005006.
[7]Kim SJ,Seo HY,Choi JG,et al.Phase Ⅱ study with a combination of epirubicin,cisplatin,UFT,and leucovorin in advanced hepatocellular carcinoma[J].Cancer Chemother Pharmacol,2006,57(4):436-442.
[8]Tian W,Ying X,Du J,et al.Enhanced efficacy of functionalized epirubicin liposomes in treating brain glioma-bearing rats[J].Eur J Pharm Sci,2010,41(2):232-243.
[9]Salvatorelli E,Guarnieri S,Menna P,et al.Defective one-or two-electron reduction of the anticancer anthracycline epirubicin in human heart[J].J Biol Chem,2006,281(16):10990-11001.
[10]Birtle AJ.Anthracyclines and cardiotoxicity[J].Clin Oncol(R Coll Radiol),2000,12(3):146-152.
[11]Di Martino A,Sedlarik V.Amphiphilic chitosan-grafted-functionalized polylactic acid based nanoparticles as a delivery system for doxorubicin and temozolomide co-therapy[J].Int J Pharma,2014,474(1/2):134-145.
[12]Zhang H,Gao S.Temozolomide/PLGA microparticles and antitumor activityagainst glioma C6 cancer cells in vitro[J].Int J Pharm,2007,329(1/2):122-128.
[13]Mathieu D,Fortin D.Chemotherapy and delivery in the treatment of primary brain tumors[J].Curr Clin Pharmacol,2007,2(3):197-211.
[14]Macdonald DR.Temozolomide for recurrent high-grade glioma[J].Semin Oncol,2001,28(13):3-12.
[15]Meng TT,Wei H,Guan DF,et al.Influence of curcumin on the proliferation and apoptosis of HL-60 cells and its mechanism[J].Chinese General Practice,2015,18(23):2800-2804.(in Chinese)
孟腾腾,魏虹,管东方,等.姜黄素对人早幼粒白血病细胞增殖和凋亡的影响及其机制研究[J].中国全科医学,2015,18(23):2800-2804.
[16]Ying X,Wen H,Lu WL,et al.Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals[J].J Control Release,2010,141(2):183-192.
[17]Zhang P,Hu L,Yin Q,et al.Transferrin-modified c[RGDfK]-paclitaxel loaded hybrid micelle for sequential blood-brain barrier penetration and glioma targeting therapy[J].Mol Pharm,2012,9(6):1590-1598.
[18]Mangiola A,Anile C,Pompucci A,et al.Glioblastoma therapy:going beyond hercules columns[J].Expert Rev Neurother,2010,10(4):507-514.
[19]Kong B,Sun Y,Li Y,et al.Preparation and the influencing factors of timozolomide liposomes[J].2009,37(6):279-282.
[20]Kebieche M,Lakroun Z,Lahouel M,et al.Evaluation of epirubicin-induced acute oxidative stress toxicity in rat liver cells and mitochondria,and the prevention of toxicity through quercetin administration[J].Exp Toxicol Pathol,2009,61(2):161-167.
[21]Mays AN,Osheroff N,Xiao Y,et al.Evidence for direct involvement of epirubicin in the formation of chromosomal translocations in therapy-related acute promyelocytic leukemia[J].Blood,2010,115(2):326-330.
[22]Zhu AX,Fuchs CS,Clark JW,et al.A phaseⅡ study of epirubicin and thalidomide in unresectable or metastatic hepatocellular carcinoma[J].Oncologist,2005,10(6):392-398.
[23]Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352(10):987-996.
[24]Wei X,Chen X,Ying M,et al.Brain tumor-targeted drug delivery strategies[J].Acta Pharma Sin B,2014,4(3):193-201.
[25]Al-Jamal WT,Al-Jamal KT,Bomans PH,et al.Functionalized quantum dot liposome hybrids as multimodal nanoparticles for cancer[J].Small,2008,4(9):1406-1415.
[26]Al-Abd AM,Lee SH,Kim SH,et al.Penetration and efficacy of VEGF siRNA using polyelectrolyte complex micelles in a human solid tumor model in-vitro[J].J Control Release,2009,137(2):130-135.
[27]Dhanikula RS,Argaw A,Bouchard JF,et al.Methotrexate loaded polyether-copolyester dendrimers for the treatment of gliomas:enhanced efficacy and intratumoral transport capability[J].Mol Pharm,2008,5(1):105-116.
[28]Goldbrunner RH,Bernstein JJ,Plate KH,et al.Vascularization of human glioma spheroids implanted into rat cortex is conferred by two distinct mechanisms[J].J Neurosci Res,1999,55(4):486-495.
[29]Kostarelos K,Emfietzoglou D,Papakostas A,et al.Binding and interstitial penetration of liposomes within avascular tumor spheroids[J].Int J Cancer,2004,112(4):713-721.
(本文编辑:吴立波)
Effect of the Combined Use of Epirubicin and Temozolomide in the Proliferation and Apoptosis of C6 Glioma Cells
XUANYa-ru,YINGXue,ZHANGChun-chun,etal.
KeyLaboratoryofXinjiangPhytomedicineResourcesandModernizationofTCM,ShiheziUniversity,Shihezi832000,China
【Abstract】ObjectiveTo investigate the effect of the combined used of epirubicin(EPI) and temozolomide(TMZ) on the proliferation and apoptosis of C6 glioma cells and C6 glioma spheroids.MethodsTo carry out the experiments,we used C6 glioma cells which were in the logarithmic phase and their cell activity was more than 95%.These C6 glioma cells were seeded into 96-well culture plates for 24 h.Then EPI and TMZ were severally added into 96-well culture plates with 10μl each and the concentration gradients were 0.05,0.10,0.50,1.00,5.00,10.00 μmol/L and 0.1,0.5,1.0,5.0,10.0,20.0 μmol/L,respectively.24 h and 48 h later,the absorbance was read on a microplate reader at 540 nm.The inhibition rate of C6 glioma cells in each hole was calculated after the above process.C6 glioma cells were seeded into 6-well culture plates and then EPI,TMZ and EPI+TMZ were added and the final concentrations of EPI were 0.50,1.00,5.00 μmol/L and those of TMZ were 1.0,5.0,10.0 μmol/L,respectively.After continuous culture for 24 h and 48 h,the apoptosis effect of EPI combined with TMZ was determined by flow cytometry.C6 glioma spheroids in vitro were developed and then EPI,TMZ,EPI+TMZ were added and the final concentrations of EPI and TMZ were 5.00 μmol/L and 10.0 μmol/L respectively.On the 0,1,3,7 d after adding the drugs,we used the inverted microscope to observe the morphologic changes of C6 glioma spheroids to see if the spheroids produced splitting decomposition and the spheroids nuclear had necrosis.ResultsThe inhibition rates of C6 glioma cells were significantly different among the drugs of different concentrations at 24 h and 48 h(P<0.05);the inhibition rates of EPI+TMZ were significantly higher than EPI or TMZ alone under the same concentration(P<0.05).The inhibition rates of C6 glioma cells showed synergy after adding 1.00 μmol/L EPI combined with 5.0 μmol/L TMZ at 24 h and 0.50 μmol/L EPI combined with 1.0 μmol/L TMZ at 48 h.At 24 h and 48 h,significant differences existed in the apoptosis rate of C6 glioma cells among negative control group and EPI,TMZ and EPI+TMZ groups of different concentrations(P<0.05).EPI,TMZ and EPI+TMZ evidently inhibited the volume of tumor spheres,with specific manifestations of shrinking volume and cell disruption on the surface;EPI+TMZ more obviously reduced the compactness of tumor spheres and caused greater splitting decomposition than EPI or TMZ alone.ConclusionThe combined application of EPI and TMZ could produce a significant synergic effect on inhibiting proliferation and inducing apoptosis of C6 glioma cells,and result in pyrolysis or death of C6 glioma spheroids.
【Key words】Glioma ;Epirubicin;Temozolomide;Cell proliferation;Apoptosis
(收稿日期:2015-10-20;修回日期:2016-01-22)
【中图分类号】R 730.264
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.08.013
通信作者:应雪,832000新疆石河子市,石河子大学药学院特种植物药资源教育部重点实验室;E-mail:yingxue2011@qq.com
基金项目:国家自然科学基金资助项目(81160396,81460540);石河子大学杰出青年科技人才培育计划项目(2012ZRKXJQ07);新疆生产建设兵团社会发展科技攻关与成果转化计划项目(2015AD007);石河子大学大学生创新创业训练计划项目(SRP2015256);国家级大学生创新创业训练计划项目(201510759066)

