基于新疆紫草转录组的对羟基苯甲酸香叶基转移酶(PGT)
刘谈 吕朝耕 王升 杨婉珍 郭兰萍


[摘要]对羟基苯甲酸香叶基转移酶(PGT)在紫草素类化合物的生物合成途径中起重要作用。该文主要通过生物信息学的方法从新疆紫草转录组中获得6个PGT基因,并预测其编码蛋白的理化性质,进行相关基因的表达分析。结构域预测结果显示,6个PGT蛋白序列均包含UbiA异戊烯基转移酶家族保守结构域及异戊烯焦磷酸结合位点NDxxDxxxD和可能的芳环的结合位点GX(K/Y)ST AL;系统进化树分析显示PGT与同源的对羟基苯甲酸多异戊烯转移酶(PPT)属于2个不同的进化枝;基因表达分析表明在紫草素类化合物产量较高的新疆紫草红色高产系悬浮细胞及植株的地下部分,其PGT基因的表达量明显高于白色低产系及植株的地上部分,说明新疆紫草PGT基因的表达量与紫草素类化合物的合成呈正相关。该研究为进一步了解对羟基苯甲酸香叶基转移酶(PGT)的功能及特性奠定了基础,并为紫草素类化合物生物合成及代谢调控提供依据。
[关键词]新疆紫草;对羟基苯甲酸香叶基转移酶;生物信息学分析;实时荧光定量
[Abstract]The phydroxybenzoate geranyltransferases(PGT) play an important role in the biosynthesis pathways of shikonin derivatives Six PGTs were obtained from transcriptome datebase of Arnebia euchroma by using bioinformatics methods and the proteins'physiochemical properties they encoded were predicted The result of protein domain prediction showed all of the six protein sequences contained the conserved domain of Ubia prenyltransferase family and possessed the motif NDxxDxxxD for prenyldiphosphate binding and a GX(K/Y)STAL sequence for putative aromatic ring binding The phylogenetic tree showed that PGT and phydroxybenzoate polyprenyltransferase(PPT) belonged to two different clades The results of gene expression analyses showed that the expression levels in the red shikoninproficient line and the overground part of A euchroma that could produce shikonin derivatives was much higher than the white shikonindeficient line and the underground part, which suggested a positive correlation between the expression levels of PGT genes and shikonin production This study aims to lay a foudation for further understanding of the function and enzymatic properties of PGT and provide a basis for the biosynthesis pathways and metabolic regulation of shikonin derivatives
[Key words]Arnebia euchroma; phydroxybenzoate geranyl transferase gene; bioinformatics analysis; Realtime PCR
doi:10.4268/cjcmm20160809
紫草素及其衍生物是紫草科植物的重要次生代谢产物,属于萘醌类化合物,同时也是传统中药紫草的有效成分。该类化合物主要来源于紫草科紫草属紫草Lithospermum erythrorhizon Siebet Zucc、滇紫草属滇紫草Onosma paniculatum Bur et Fr、假紫草属新疆紫草Arnebia euchroma (Royle) Johnst和内蒙古紫草A. guttata Bunge,具有抗炎[12]、抗氧化[3]、抗肿瘤[46]、保护肝脏[7]及抑制DNA拓扑异构酶[8]等生物学活性。以紫草素为主要成分的用于治疗烧、烫伤药紫草油剂及软膏剂已在我国、日本、欧洲用于临床,作为抗肿瘤药也已进入临床研究[9]。除具有重要的药用价值外,紫草素类化合物还是良好的天然色素,已广泛用于化妆品、食品和印染工业中。
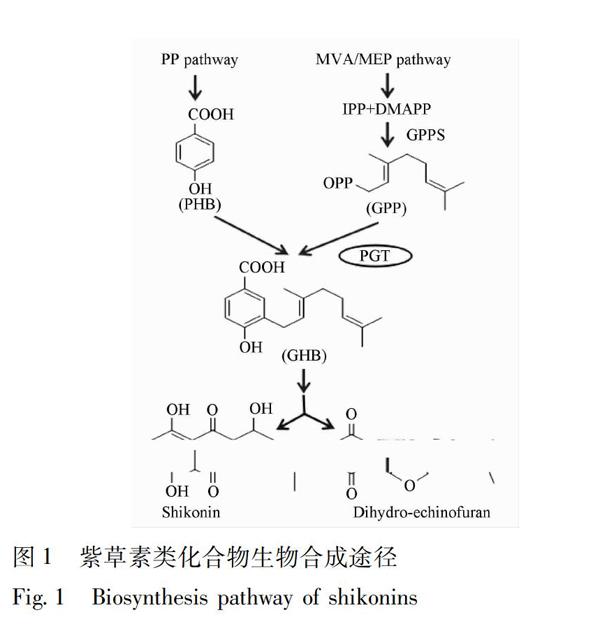
通常认为,紫草素类化合物是通过苯丙氨酸(phenylpropanoid,PP)途径甲羟戊酸(mevalonate,MVA)途径/去氧木酮糖还原(2CmethylDerythritol4phosphate,MEP)途径的复合途径而合成(图1)。在对羟基苯甲酸香叶基转移酶(phydroxybenzoate geranyltransferase,PGT)的作用下,MVA/MEP途径形成的焦磷酸香叶酯(geranyl pyrophosphate,GPP)的香叶烯基转移到来自PP途径代谢产物对羟基苯甲酸(phydroxybenzoate acid,PHB)上,形成香叶基对羟基苯甲酸(3geranyl4hydroxybenzoic acid,GHB),该化合物是生成紫草素及其衍生物的前几步反应中的重要前提[10]。然而,迄今为止,已报道的PGT基因仅有3个,即Yazaki[11]与Singh[12]等先后从硬紫草及新疆紫草中分离得到的LePGT1,LePGT2,AePGT。三者的异戊烯基供体底物均只有1种,即GPP,且都有2个明显的亲水环NDxxDxxxD和GX(K/Y) ST AL,前者为异戊烯焦磷酸结合位点,后者为可能的芳环结合位点[13]。此外,研究发现暗培养、寡糖和茉莉酸甲酯能同时增加培养基中紫草细胞PGT基因表达、PGT的酶活性以及紫草素类化合物的形成,而光照、铵离子和2,4D却起相反的作用,这充分证明了PGT基因的表达与紫草素类化合物的合成直接相关。为此,充分挖掘及克隆对羟基苯甲酸香叶基转移酶(PGT)基因,进行外源表达以及构建工程微生物,可为紫草素类化合物的合成提供全新的方法。本实验以新疆紫草转录组为材料所构建的本地数据库为基础,运用生物信息学方法筛选获得6个新疆紫草PGT基因,并分析了其核苷酸及编码蛋白的特性,比较了其在新疆紫草红色悬浮细胞系和白色悬浮细胞系、植物地上和地下部分的表达水平差异,为进一步解析新疆紫草中PGT功能及生物特性并进行外源表达奠定基础。
1材料
本研究所用的新疆紫草A euchroma PGT基因序列来源于实验室构建的转录组数据库。新疆紫草转录组测序样品取自细胞生长平顶期,采用Illumina HiSeq 2000测序,并使用SOAdenovo对转录组做从头组装。LePGT1,LePGT2,AePGT的信息来自NCBI数据库(http://wwwncbinlmnihgov/)。
新疆紫草愈伤细胞红色高产系和白色低产系是由新疆紫草胚轴诱导并人工筛选获得,取自中国科学院植物研究所叶和春研究员处,并由本实验室保存并继代为悬浮细胞。
2方法
21新疆紫草PGT基因的获得
从NCBI蛋白数据库中查询得到紫草对羟基苯甲酸香叶基转移酶(PGT)序列LePGT1,LePGT2及新疆紫草中已报道的PGT序列AePGT,并分别以它们为query sequence,通过Blast软件在新疆紫草转录组数据库中搜寻同源序列,识别标准为e≤1e-15,Score≥100,匹配数b=1;然后在NCBI数据库的ORF Finder(http://www ncbinlmnihgov/gorf/orfigcgi)中查找开放阅读框,推导编码氨基酸的基因序列。根据开放阅读框所编码的氨基酸序列,利用Bioedit软件进一步从中挑选出同时包含异戊烯焦磷酸结合位点NDxxDxxxD[14]和可能的芳环的结合位点GX(K/Y) ST AL[11]的转录本作为最终候选基因。
22生物信息学分析
借助ExPASy数据库的Protparam在线工具(Physicochemical parameters of protein sequence, http://wwwexpasyorg/tools/protparamhtml)对基因编码蛋白序列进行基本理化性质分析,包括氨基酸数目、理论等电点、分子式、脂溶指数、蛋白质疏水性、不稳定系数等;通过NCBI的CDD(Conserved Domain Datebase)数据库(http://wwwncbinlmnihgov/ Structure/cdd/ wrpsbcgi)及ExPASy的PROSITE(http://prosite expasy org/)对蛋白进行保守结构域分析;采用ExPaSy SOPMA(SelfOptimized Prediction Method with Aligment, https:// npsaprabi ibcpfr/cgibin/secpred_sopmapl)进行蛋白质二级结构分析。采用在线蛋白分析软件Psortb(http:// wwwpsortorg/psortb/)预测蛋白在细胞内的定位;利用TMHMM Server v 20(http://wwwcbsdtudk/services/TMHMM/)进行跨膜结构域分析;利用SignalP41 Serve(http://wwwcbsdtudk/ services/SignalP/)及TargetP 11 Server(http://wwwcbsdtudk/services/TargetP/)进行信号肽预测。
在NCBI数据库中通过Blastx检索与蛋白同源的其他植物序列,运用Bioedit软件进行相似性分析。采用MEGA 60软件,运用ClustalW进行多重序列比对,然后采用邻接法neighjoining method构建系统进化树,Bootstrap分析重复数设为1 000。
23荧光定量 PCR检测基因表达量
231RNA提取和cDNA合成用Trizol总RNA提取试剂(美国Invtrogen公司)提取新疆紫草红色高产系悬浮细胞、白色低产系悬浮细胞、植物地上部分样品及地下部分样品总RNA,1%琼脂糖凝胶电泳确定RNA完整性,紫外分光光度仪测定总RNA的A260和A280的值,选择A260/A280为18~20的总RNA进行反转录,反转录反应按照cDNA合成试剂盒(TaKaRa公司)说明书进行。
232Realtime PCR利用Primer Primer 50设计AePGT和新获得6个AePGTs基因实时荧光定量引物,扩增长度在100~150 bp,内参基因为18S RNA(引物序列见表1)。所用定量PCR仪为ABI公司7500型荧光定量PCR仪,PCR反应体系:5 μL power SYBR GreenPCR Master Mix(Applied Biosystems)、上下游引物(10 μmol·L1)各05,1 μL模板、3 μL ddH2O,合计10 μL。反应程序:95 ℃预变性10 min,95 ℃变性15 s,60 ℃复性1 min,40个循环。每个反应做3个平行试验,结束后进行熔解曲线分析。各基因表达量以内参基因18S RNA作为标准进行相对定量,相对定量方法采用2ΔΔCt法。
3结果与分析
31新疆紫草6个AePGTs基因的核苷酸特性分析
从NCBI蛋白数据库中查询得到LePGT1,LePGT2,AePGT序列(序列号分别为18389306,18389308,158957517),并分别以三者为探针,通过Blast软件在新疆紫草转录组数据库中搜寻同源序列,并结合Nr,Nt,Swissprot,COG,KEGG及GO的注释结果,共获得44条可能同源序列。而利用Biodit软件对候选基因进行进一步筛选时,发现其中只有6条PGT的蛋白序列同时含有NDxxDxxxD,GX(K/Y)STAL亲水环。将此6条序列分别命名为AePGT1,AePGT2,AePGT3,AePGT4,AePGT5,AePGT6。ORF Finder 预测表明AePGT1全长为1 170 bp;AePGT2全长为741 bp;AePGT3全长为771 bp;AePGT4全长为924 bp;AePGT5全长为735 bp;AePGT6全长为924 bp。将所获得的6个新疆紫草PGT基因提交GenBank核酸序列库,GenBank号依次为KT991519,KT991520,KT991521,KT991522,KT991523,KT991524。
32新疆紫草6个AePGTs基因编码蛋白特性分析
利用Protparam在线工具对本实验获得的6个AePGTs基因的编码蛋白序列进行基本理化性质预测(表2)。利用CDD数据库分析结构域,结果表明6个AePGTs均具有UbiA异戊烯基转移酶家族保守结构域,该家族蛋白主要功能是将异戊烯供体转移到芳香化合物受体被活化的C原子上,参与泛醌、甲萘醌、质体醌等化合物的生物合成。PROSITE分析结果进一步表明6个AePGTs中均具有UbiA异戊烯基转移酶家族标签(图2),此标签序列中包含膜结合型芳香族异戊烯基转移酶所具有的异戊烯焦磷酸结合区(N/D)DxxDxxxD。Psortb预测结果显示6个AePGTs均定位在细胞质膜上(cytoplasmic membrane),同时SignalP41 Server和TargetP 11 Server软件分析结果显示6个AePGTs均无线粒体信号肽,而这既是它们与已知的3个PGTs,LePGT1,LePGT2以及AePGT的共性,同时也是PGT有别于其他植物来源的的对羟基苯甲酸多异戊烯转移酶(phydroxybenzoate polyprenyltransferase,PPT)的地方[14],故推测PGTs与PPTs基因属于不同进化枝。利用TMHMM Server v 20进行跨膜结构域预测,结果表明AePGT3,AePGT5,AePGT6具有6个跨膜螺旋,AePGT1有7个跨膜螺旋,AePGT2有8个跨膜螺旋,AePGT4则有5个跨膜螺旋。
33新疆紫草6个AePGTs基因编码蛋白的二级结构分析
采用ExPaSy SOPMA在线软件对6个AePGTs蛋白进行二级结构预测(表3)。
34系统进化树分析
在NCBI数据库中分别查找得到与6个AePGTs同源的紫草、拟南芥、野生大豆、可可、玉米、毛霉菌、绿藻等物种序列,这些序列多为对羟基苯甲酸多异戊烯转移酶(phydroxybenzoate polyprenyltransferase,PPT)。PPT与PGT同为膜结合型芳香族异戊烯基转移酶,且都特异的以对羟基苯甲酸(PHB)作为异戊烯基的受体。不同的是,PPT的异戊烯基供体底物通常不止一种,而PGT则特异的以GPP作为异戊烯基的供体[13]。应用Bioedit对以上序列进行氨基酸序列比对分析,其中来源于紫草科已知的3个PGTs:LePGT1,LePGT2和 AePGT与本实验获得的6个AePGTs的同源性见表2。可见,AePGT1与三者的同源性较其余5个AePGTs明显偏低,而AePGT4,AePGT5与三者的同源性最高。LePGT1,LePGT2, AePGT与本实验获得的6个新疆紫草PGTs比对结果可见,6个AePGTs与LePGT1,LePGT2,AePGT序列在保守区域的同源性很高,但在序列的N端却存在较大差异。其中AePGT1较AePGT多出84 aa, AePGT2,AePGT3,AePGT5与AePGT相比则分别短缺61,51,63 aa,而AePGT4,AePGT6与AePGT在序列长度上几无差异。这一特点不仅有利于解释6个AePGTs功能上可能存在的差异,而且为PGTs的结构功能域确定提供了便利(图3)。
应用MEGA 60软件对16种植物对羟基苯甲酸异戊烯转移酶氨基酸序列进行系统发育分析(图4)。24条序列可分为4大类:8个双子叶植物,野生大豆、蒺藜苜蓿、川桑、可可树、木本棉、拟南芥、荠菜、琴叶拟南芥和3个单子叶植物,玉米、山羊草、图小麦聚为一类,都是高等植物中的种子植物;毛霉菌、胶球藻和绿藻聚为一类,都是低等植物;AePGT,AePGT2,AePGT3,AePGT4,AePGT5,AePGT6,LePGT1,LePGT2聚为一类;而AePGT1自成一类。尤为值得关注的是,来源于紫草科的9个PGTs与其他植物来源的PPTs的确分属于2个不同的进化枝,这为解释紫草科对羟基苯甲酸香叶基转移酶(PGT)功能的特殊性,即仅以GPP作为异戊烯基的供体提供了重要依据。
35基因表达分析
本实验室前期的研究结果发现红色高产系细胞紫草素类化合物含量可达到干重的695%,而白色低产系细胞不产生紫草素类化合物[15]。并且,在自然状态下,紫草素类化合物主要集中于植株的根部。因此,为了进一步了解新疆紫草中PGT基因的表达水平与紫草素类化合物生成的关系,本实验通过Realtime PCR分别分析比较了7个新疆紫草PGT基因 (包括AePGT)在不同细胞系(红色高产悬浮细胞系和白色低产悬浮细胞系)以及不同部位(植株地上部分与地下部分)的表达差异状况。7个新疆紫草PGT基因在新疆紫草红色高产细胞系和白色低产细胞系中的相对表达水平可知,在新疆紫草白色低产悬浮细胞系中7个PGT基因表达量由高到低依次为AePGT4>AePGT1>AePGT5>AePGT3>AePGT>AePGT6>AePGT2;而在红色高产悬浮细胞系中表达量由高到低则为AePGT5>AePGT4>AePGT>AePGT3>AePGT1>AePGT2>AePGT6。并且,7个PGT基因在白色低产细胞系中的表达水平均低于红色高产细胞系,尤以AePGT,AePGT2,AePGT3,AePGT4,AePGT5最为明显,暗示在不同细胞系中,紫草素类化合物的生成与相关PGT基因的表达呈正相关(图5)。
7个PGT基因在新疆紫草植株地上部分与地下部分的相对表达水平可知,在植株的地上部分7个PGT基因表达量由高到低依次为:AePGT3>AePGT4>AePGT2>AePGT5>AePGT>AePGT1>AePGT6;而地下部分表达量由高到低的次序为:AePGT4>AePGT5>AePGT3>AePGT>AePGT2>AePGT6>AePGT1(图6)。此外,通过对比可以看到,7个PGT基因在植株地下部分的表达水平均显著高于地上部分。这再一次证明,光照能够降低PGT基因的表达水平,减少紫草素类化合物的生成量,同时进一步说明了紫草素类化合物的生成与相关PGT基因表达水平的正相关性。
4讨论
长期以来,由于紫草素类化合物可观的药用及工业价值,作为其主要来源的紫草被过量采挖,野生资源破坏严重,加之环境的恶化及人工种植难度大,导致紫草资源日渐减少。为了满足紫草素的市场需求,人们试图通过其他方式来进行生产,如自20世纪80年代日本学者Terada等[16]首次完成对紫草素消旋体全合成以来,已有10多个研究组先后报道了紫草素的外消旋体、左旋或右旋异构体、以及紫草素的衍生物的合成方法[17]。但目前报道的合成方法大多合成路线长,收率较低或原料不易得、反应条件苛刻,不适于工业生产。除此之外,在过去的几十年间,日本与我国曾先后建立了紫草、新疆紫草和滇紫草的细胞培养体系,并对紫草素类化合物生物合成相关代谢酶和基因及其调控展开了全面研究[1820],以期通过筛选高产细胞系、改良培养基、调节外加物和外加条件及利用基因工程调控和生物反应器培养工艺等方式提高细胞培养体系中紫草素类化合物的产量[21]。目前,该方法已在日本实现了工业化生产,可惜生产成本仍然很高。然而,微生物工程的兴起使人们再次看到了从根本上解决市场需求与资源保护矛盾的希望,该技术主体是利用微生物,特别是用经过DNA重组技术改造过的微生物来生产商业产品[22]。为此,就紫草素类化合物而言,阐明其生物合成途径,找出其合成过程中的关键酶及基因,从而为DNA重组及发酵做好铺垫,是一项重要且有意义的研究。而测序技术及生物信息学(bioinformatics)的发展则为上述工作的顺利完成提供了强有力的保障。尤其是近年来,分子生物学的进步带动了生物信息学的发展,并将其应用到药用植物领域,为中药研究提供了新的研究手段。比如,可以将生物信息学与系统生物学相结合,运用基因组学、蛋白质组学、代谢组学研究手段,研究中药有效成分的产生机制,从而为中药开发利用提供理论依据。
本研究借助生物信息学技术,首先从新疆紫草转录组中检索目的基因,共获得了6个对羟基苯甲酸香叶基转移酶(PGT)基因。对其做进一步生物信息学研究发现,6个PGT基因编码的蛋白均具有UbiA异戊烯基转移酶家族标签、异戊烯焦磷酸结合位点NDxxDxxxD及芳环结合位点GX(K/Y)STAL,这说明新获得的6个AePGTs蛋白可能具有将异戊烯供体转移到芳香化合物受体被活化的C原子上的功能。细胞定位分析结果显示6个AePGTs均定位在细胞质膜上,同时信号肽分析结果显示6个AePGTs均无线粒体信号肽,故推测PGTs基因与其他植物来源的的对羟基苯甲酸多异戊烯转移酶(PPTs)不属于同一进化枝。而系统进化树分析则证明了该推论的正确性,这说明PGT基因所编码的蛋白在结构及功能上有其特殊性,如LePGT1和LePGT2具有严格的底物特异性,即仅以GDP作为异戊烯基的供体[11]。Singh等[12]研究结果表明暗培养、寡糖和茉莉酸甲酯能增加培养基中紫草细胞PGT基因表达和活性以及紫草素类化合物的形成;而光照、铵离子和2, 4D却起到相反的作用,证明PGT基因的表达与紫草素类化合物的合成直接相关。而本实验通过基因表达分析发现,7个AePGTs基因在新疆紫草红色高产细胞系、白色低产细胞系及植株的地上和地下部分的相对表达水平差异明显,且在紫草素类化合物产量较高的新疆紫草红色高产系细胞及植株的地下部分,其PGT基因的相对表达水平明显高于白色低产系及植株的地上部分。这进一步证明了PGT基因的表达与紫草素类化合物生物合成呈正相关。
尽管PGT在紫草素的生物合成过程中扮演重要的角色,但在不产生紫草素类化合物的新疆紫草白色低产细胞系及植株的地上部分仍然能检测到PGT的表达。并且,本实验室前期的研究成果显示[15,23],在紫草素的生物合成过程中,位于PGT上游的一些关键酶在白色低产细胞系中同样能够表达,并且用茉莉酸甲酯对白色低产悬浮细胞进行处理后检测到了紫草呋喃类化合物,该类化合物与紫草素类化合物的共同前体正是GBA的下游产物香叶基氢醌(geranylhydroquinone, GHQ)[10]。由此可见,白色低产系生成紫草素类化合物的障碍发生位置应当位于PGT酶促反应的下游,即GHQ及下游产物的催化反应。然而,至今为止,与之相关的基因和酶却鲜有报道,可见对新疆紫草白色低产系形成原因的探究及紫草素类化合物生物合成途径的探索仍然任重而道远。
本研究综合了目前应用广泛认可度较高的生物信息分析手段对新疆紫草做了较为完善的生物信息学研究,也为传统中药的生物信息学研究提供了文献支持和参考。研究结果为进一步了解新疆紫草中对羟基苯甲酸香叶基转移酶(PGT)的功能及特性奠定基础,并为紫草素类化合物生物合成及代谢调控提供依据。
[参考文献]
[1]Wang L, Li Z, Zhang X, et al. Protective effect of shikonin in experimental ischemic stroke:attenuated TLR4, pp38MAPK, NFκB, TNFα and MMP9 expression, upregulated claudin5 expression, ameliorated BBB permeability[J]. Neurochem Res, 2014, 39(1):97.
[2]Lu L, Qin A, Huang H, et al.Shikonin extracted from medicinal Chinese herbs exerts antiinflammatory effect via proteasome inhibition[J].Eur J Pharmacol, 2011, 658((2/3):242.
[3]Han J, Weng X C, Bi K S. Antioxidants from a Chinese medicinal herb Lithospermum erythrorhizon[J].Food Chem, 2008, 106:2.
[4]Cheng Y W, Chang C Y, Lin K L. Shikonin derivatives inhibited LPSinduced NOS in RAW264.7 cells via down regulation of MAPK/NFB signaling[J]. J Ethnopharmacol, 2008, 120(2):264.
[5]Wei P L, Tu C C, Chen C H, et al.Shikonin suppresses the migratory ability of hepatocellular carcinoma cells[J].J Agric Food Chem, 2013, 61(34):8191.
[6]Wang H, Wu C, Wan S, et al.Shikonin attenuates lung cancer cell adhesion to extracellular matrix and metastasis by inhibiting integrin 1 expression and the ERK1/2 signaling pathway[J].Toxicology, 2013, 308(7):104.
[7]刘燕, 买尔旦·马合木提, 尼加提·热合木. 新疆紫草提取物对小鼠免疫性肝损伤的保护作用[J]. 新疆医科大学学报, 2006, 29(6):471.
[8]Kashiwada Y, Bastow K F, Lee K. Novel lignan derivatives as selective inhibitors of DNA topoisomeraseⅡ[J]. Bioorg Med Chem Lett, 1995, 5(4):905.
[9]徐新刚. 新疆紫草的化学成分研究[D]. 北京:北京中医药大学, 2009.
[10]Wang S, Guo L P, Xie T, et al.Different secondary metabolic responses to MeJA treatment in shikoninproficient and shinokindeficient cell lines from Arnebia euchroma (Royle) Johnst[J]. Plant Cell Tiss Org, 2014, 119:587.
[11]Yazaki K, Kunihisa M, Fujisaki T, et al. Geranyl diphosphate:4hydroxybenzoate geranyltransferase from Lithospermum erythrorhizon. Cloning and characterization of a key enzyme in shikonin biosynthesis [J]. J Biol Chem, 2002, 277(8):6240.
[12]Singh R S, Gara R K, Bhardwaj P K, et al. Expression of 3hydroxy3methylglutarylCoA reductase, phydroxybenzoatemgeranyltransferase and genes of phenylpropanoid pathway exhibits positive correlation with shikonins content in arnebia [Arnebia euchroma(Royle) Johnston] [J]. BMC Mol Biol, 2010, 11:88.
[13]高娟, 曾英, 卢山. 芳香族异戊烯基转移酶的研究进展[J]. 植物学报, 2010, 45(6):751.
[14]Ohara K, Yamamoto K, Hamamoto M, et al. Functional characterization of OsPPT1, which encodes phydroxybenzoate polyprenyltransferase involved in ubiquinone biosynthesis in Oryza sativa[J]. Plant Cell Physiol, 2006, 47:581.
[15]王升,谢腾,叶和春,等. 新疆紫草2种悬浮细胞生长及紫草素类化合物积累的动力学研究[J]. 中国中药杂志,2013,38(8):1138.
[16]Terada A, Tanoue Y, Hatada A, et al.Synthesis of shikalkin(±shikonin) and related compounds[J]. Bull Chem Soc Jpn, 1987, 60:205.
[17]徐德峰,管鹏键,毛志强,等. 紫草素的全合成研究[J]. 有机化学,2005,25(7):771.
[18]Tabata M,Mizukami H,Hiraoka N. Pigment formation in callus cultures of Lithmpemtum erythrorhison[J]. Phytochemistry,1974,13:927.
[19]李国凤,伍正容,叶和春,等. 离体培养的新疆紫草萘醌色素的诱导形成[J]. 植物学通报,1988,5(2):84.
[20]周立刚,郑光植,王世林. 滇紫草愈伤组织培养与紫草素产生[J]. 云南植物研究,1991,13(3):315.
[21]黄文虎,葛锋,刘迪秋,等. 紫草素及其衍生物的调控策略[J]. 中国生物工程杂志,2010,30(11):100.
[22]史先振. 现代发酵技术在食品领域的应用研究进展[J]. 中国酿造,2005(12):1.
[23]王升,谢腾,周良云,等. 两种新疆紫草细胞系紫草素生物合成关键酶基因的表达差异分析[J]. 中华中医药杂志,2014,29(5):1356.
[责任编辑吕冬梅]

