磁性固相萃取-高效液相色谱-串联质谱法测定环境水样中的四环素类抗生素
国 明, 于 峰, 贾科玲, 李 姣, 孙 海
(浙江省化工研究院, 浙江 杭州 310023)
研究论文
磁性固相萃取-高效液相色谱-串联质谱法测定环境水样中的四环素类抗生素
国明,于峰*,贾科玲,李姣,孙海
(浙江省化工研究院, 浙江 杭州 310023)
摘要:建立了磁性固相萃取-高效液相色谱-串联质谱同时测定环境水样中四环素类抗生素的方法。以6种四环素类抗生素(差向四环素、土霉素、四环素、去甲金霉素、金霉素和脱水四环素)为目标化合物,考察并优化了吸附和解吸条件,确定了最佳萃取条件。萃取后的目标化合物经ZORBAX Eclipse Plus C(18)柱分离,用高效液相色谱-串联质谱在多反应监测(MRM)模式下进行检测。在优化的条件下,6种四环素在1~100 μg/L范围内线性关系良好,线性相关系数为0.996 7~0.999 3,检出限为2.44~25.21 ng/L,样品加标回收率为80.6%~90.0%,日内相对标准偏差(RSDs)为0.6%~2.5%,日间RSDs为1.1%~7.1%。该方法灵敏度高、背景干扰低,适用于环境水样中6种痕量四环素类抗生素的同时检测。
关键词:磁性固相萃取;高效液相色谱-串联质谱;四环素类抗生素;环境水样
抗生素作为一种能抑制和杀灭细菌的药物,已被广泛用于医疗卫生、畜禽养殖、农业生产等行业,为经济发展做出了很大的贡献。在畜禽养殖业,抗生素作为饲料添加剂用于预防和治疗动物疾病,促进动物生长。但过量使用抗生素对环境微生物种群造成恶劣影响,使耐药菌在环境中被诱发和散播,进而对水体系统产生不可逆转的破坏,对人类健康和生态环境也带来了潜在的风险。四环素类抗生素(TCs)是由链霉菌产生的一类广谱抗生素,主要包括四环素、土霉素、金霉素等。据相关文献[1-3]报道,四环素类抗生素已经进入环境水中,引起了人们的高度重视。

图 1 6种四环素类抗生素的化学结构式Fig. 1 Chemical structures of the six tetracycline antibiotics
四环素类抗生素的检测方法有荧光分析法[4]、毛细管电泳法[5]、免疫分析法[6]、薄层色谱法[7]、液相色谱法[8,9]、高效液相色谱-质谱联用法[10-18]等。其中,高效液相色谱-质谱联用法具有分离良好、检测灵敏等特点,越来越多地用于四环素类抗生素的检测中。目前,用于四环素类抗生素复杂基质样品的前处理方法主要有固相萃取、传统热水萃取法、QuEChERS等。水体中的抗生素浓度通常较低,仅为ng/L至μg/L数量级,因此研究开发快速、准确检测环境水中痕量四环素类抗生素的高灵敏度分析方法具有重要意义。考虑到环境水样的复杂性和四环素类抗生素在水体中浓度较低的特点,检测前必须进行浓缩、富集及净化等预处理。磁性固相萃取(MSPE)[19,20]是一种以磁性或可磁化的材料作吸附剂基质的一种固相萃取技术,它保留了传统固相萃取简单、高效和有机溶剂耗量少的优点。在磁性固相萃取过程中,磁性吸附剂不是填充到吸附柱中,而是直接被添加到样品的溶液或悬浮液中,将目标化合物吸附到分散的磁性吸附剂表面,在外部磁场作用下就可使目标化合物与样品基质分离。近年来,有研究者[21-25]用磁性固相萃取技术进行样品预处理并取得了很好的应用效果,避免了普通固相萃取技术中过柱操作繁琐、吸附柱容易堵塞、重复性差等问题,同时具备富集效率高、分离过程简便等优点,因而具有很好的应用前景。
本文采用磁性材料作为固相萃取剂进行样品前处理,建立了高效液相色谱-串联质谱法测定环境水样中四环素类抗生素的分析方法。相较于其他以有机试剂作为洗脱溶剂的前处理方法,本实验采用水作为洗脱剂,绿色环保,分离快速、简便,回收率高,灵敏度高,重复性好,可用于环境水样的检测。
1实验部分
1.1仪器与试剂
高效液相色谱-串联质谱(Agilent 1290 Infinity/6460 Triple Quad,美国Agilent公司); Milli-Q超纯水器(美国Millipore公司); KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司)。
甲醇、乙腈均为色谱纯(美国Sigma-Aldrich公司);二氯甲烷为分析纯(杭州双林化工试剂厂);乙酸为分析纯(上海凌峰化学试剂有限公司);质量分数为25%的氨水(杭州龙山精细化工有限公司);实验用水为超纯水;磁性材料由浙江大学环境与资源学院环境科学研究所文岳中课题组提供。
标准品:差向四环素(4-epitetracycline,ETC,纯度≥95%)、土霉素(oxytetracycline,OTC,纯度≥95%)、四环素(tetracycline,TC,纯度≥95%)、去甲金霉素(demclocycline,DMC,纯度≥95%)、金霉素(chlortetracycline,CTC,纯度≥95%)和脱水四环素(anhydrotetracycline,ATC,纯度≥95%)均购自百灵威公司。6种四环素类抗生素的化学结构式见图1。
分别准确称取一定量的6种四环素类抗生素标准品,用甲醇溶解并配制成1 000 mg/L的标准储备液,分别吸取一定量标准储备液配制成1 000 μg/L的混合标准工作溶液及不同浓度的单标准工作液,储存于-4 ℃冰箱中。
磁性萃取材料GO/nZVI由浙江大学提供,是纳米零价铁(nZVI)和氧化石墨烯(GO)的复合物,具有pH调控特性。
1.2样品前处理方法
水样采自杭州地区不同河段,所有水样均通过0.45 μm滤膜过滤除去悬浮物。量取100 mL水样于200 mL烧杯中,加入15 mg磁性材料,在40 ℃恒温水浴中加热搅拌15 min进行磁性固相萃取,使用磁铁收集萃取完全后的磁性材料,弃去萃取后的水样。然后用pH 11的氨水水溶液作洗脱剂,在室温下超声10 min进行洗脱,并在磁铁作用下收集洗脱溶液,用pH 11的氨水水溶液定容至10 mL,经0.45 μm滤膜过滤后,用HPLC-MS/MS进行定量分析。
1.3HPLC-MS/MS条件
1.3.1HPLC条件
色谱柱:ZORBAX Eclipse Plus C18(100 mm×3.0 mm, 1.8 μm);柱温:35 ℃;进样体积:10 μL;流速:0.3 mL/min;流动相为乙腈(A)和1%(体积分数)乙酸水溶液(B)。梯度洗脱程序:0~10 min, 10%A~30%A; 10~11 min, 30%A~100%A; 11~14 min, 100%A~10%A; 14~17 min, 10%A。
1.3.2MS/MS条件
采用电喷雾离子(ESI)源,正离子模式,使用多反应监测(MRM)模式进行检测。干燥气温度:300 ℃;干燥气流速:5 L/min;雾化气压力:0.31 MPa;鞘气温度:250 ℃;鞘气流速:10 L/min;毛细管电压:3 500 V;喷嘴电压:1 000 V;干燥气、雾化气和鞘气均为高纯氮气。
2结果与讨论
2.1色谱条件和质谱条件的优化
将6种四环素类抗生素的单标准工作液直接进样,先进行全扫描,准确找出准分子离子[M+H]+,然后对准分子离子进行轰击获得二次碎裂的子离子,将准分子离子和2个信号强度最高的子离子组成监测离子对,以MRM模式检测。在此基础上重点优化对灵敏度影响较大的毛细管电压和喷嘴电压,使选定的母离子和子离子组成的特征离子丰度达到最佳,选择其中丰度较大的子离子作为定量离子。6种四环素类抗生素的质谱参数见表1。

表 1 多反应监测模式下6种四环素类抗生素的质谱参数
*Quantitative ion pair.
在优化的梯度洗脱程序下,除差向四环素和土霉素无法很好分离外,其余4种四环素类抗生素均能实现基线分离。6种四环素类抗生素(50 μg/L)的MRM谱图见图2。

图 2 6种四环素类抗生素(50 μg/L)的MRM谱图Fig. 2 MRM chromatogram of the six tetracycline antibiotics (50 μg/L)
2.2磁性固相萃取条件的优化
在磁性固相萃取过程中,影响萃取效率的主要因素有萃取时间、萃取温度、磁性材料的用量、洗脱溶剂的种类及pH值、洗脱时间、离子强度等,分别对这些因素进行了优化。
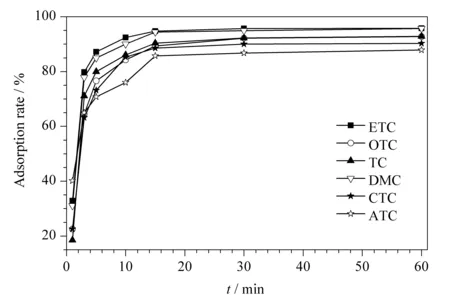
图 3 萃取时间对6种四环素类抗生素吸附率的影响Fig. 3 Effect of the extraction time on the adsorption rates of the six tetracycline antibiotics (TCs) Extraction conditions: GO/nZVI, 10 mg; sample volume, 100 mL; mass concentration of TCs, 10 μg/L; extraction temperature, 40 ℃.
2.2.1萃取时间
萃取时间是固相萃取技术的重要参数之一。当吸附剂与目标化合物之间未达到吸附平衡时,萃取效率会随着萃取时间的增加而增加。同时,在保证富集效果的前提下,应该尽量缩短萃取时间。试验考察了萃取时间分别为1、5、8、10、15、30和60 min时对萃取效果的影响。如图3所示,萃取时间为15 min时,6种四环素类抗生素的萃取效率基本不再升高,萃取效率趋于稳定。
2.2.2萃取温度
考察了萃取温度分别为10、20、30、40、50和60 ℃时的萃取效果(见图4)。结果表明,萃取温度在40 ℃以下时,磁性材料对6种四环素类抗生素的吸附率随萃取温度的升高而增大,这可能是由于温度升高使分子热运动加快,目标化合物和磁性固相材料分子表面的羧基和羟基的缔和机会增加,从而使萃取效率增加。在40 ℃时,6种四环素类抗生素的吸附率均已达到96%以上,温度继续升高吸附率变化不大,吸附萃取基本达到平衡,因此最终选择萃取温度为40 ℃。
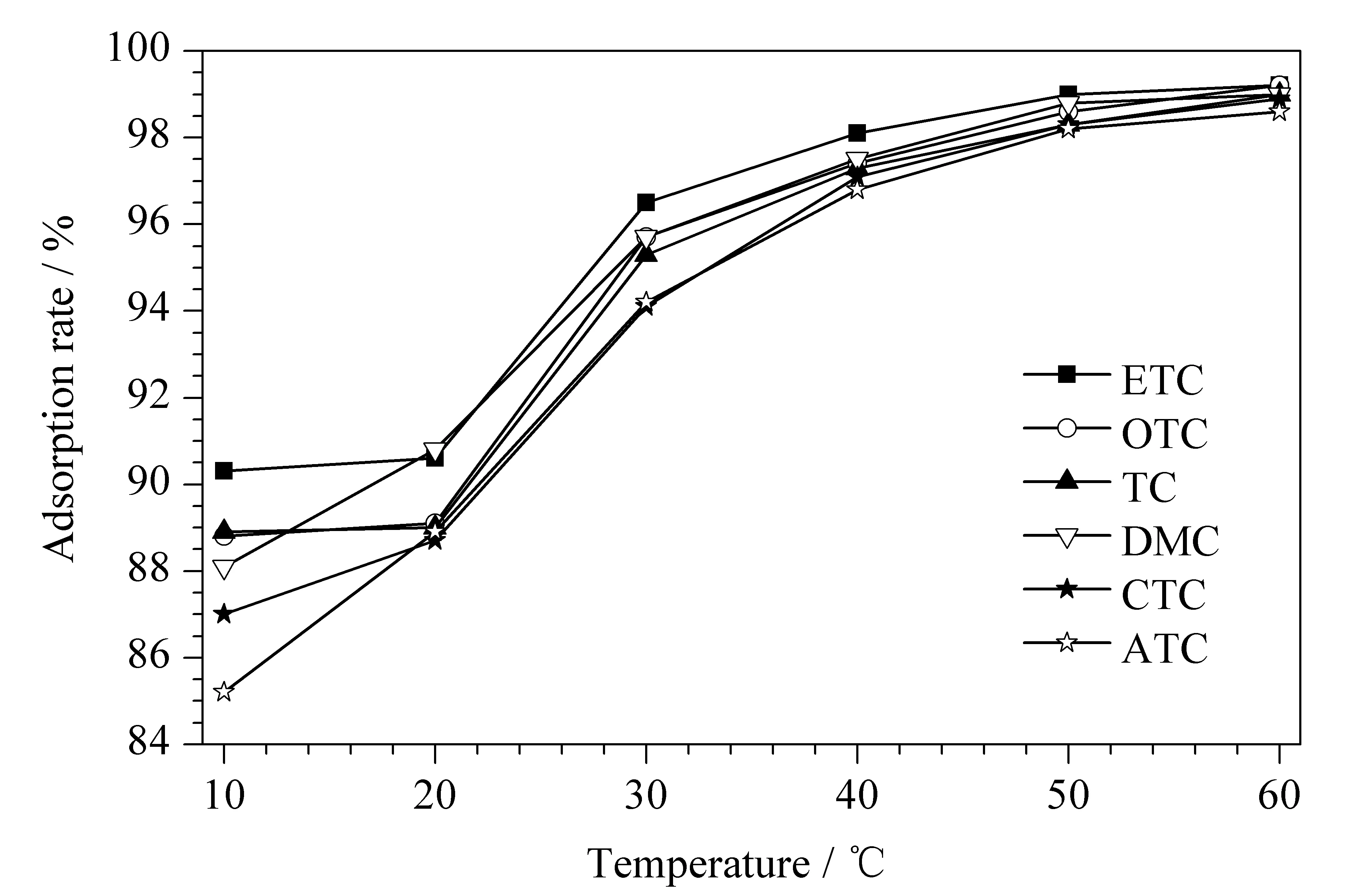
图 4 萃取温度对6种四环素类抗生素吸附率的影响Fig. 4 Effect of the extraction temperature on the adsorption rates of the six tetracycline antibiotics Extraction conditions: GO/nZVI, 10 mg; sample volume, 100 mL; mass concentration of TCs, 10 μg/L; extraction time, 15 min.
2.2.3磁性材料的用量
在100 mL水样中分别加入5、10、15、20和25 mg磁性材料,考察了磁性材料的用量对6种四环素类抗生素富集效果的影响(见图5)。结果表明,当磁性材料用量从5 mg增至15 mg时,6种四环素类抗生素的吸附率均明显增加,但继续增加磁性材料用量,吸附率无明显增加。故选择在100 mL水中加入15 mg磁性材料进行吸附萃取。

图 5 磁性材料用量对6种四环素类抗生素吸附率的影响Fig. 5 Effect of the magnetic material dosages on the adsorption rates of the six tetracycline antibiotics Extraction conditions: sample volume, 100 mL; mass concentration of TCs, 10 μg/L; extraction temperature, 40 ℃; extraction time, 15 min.
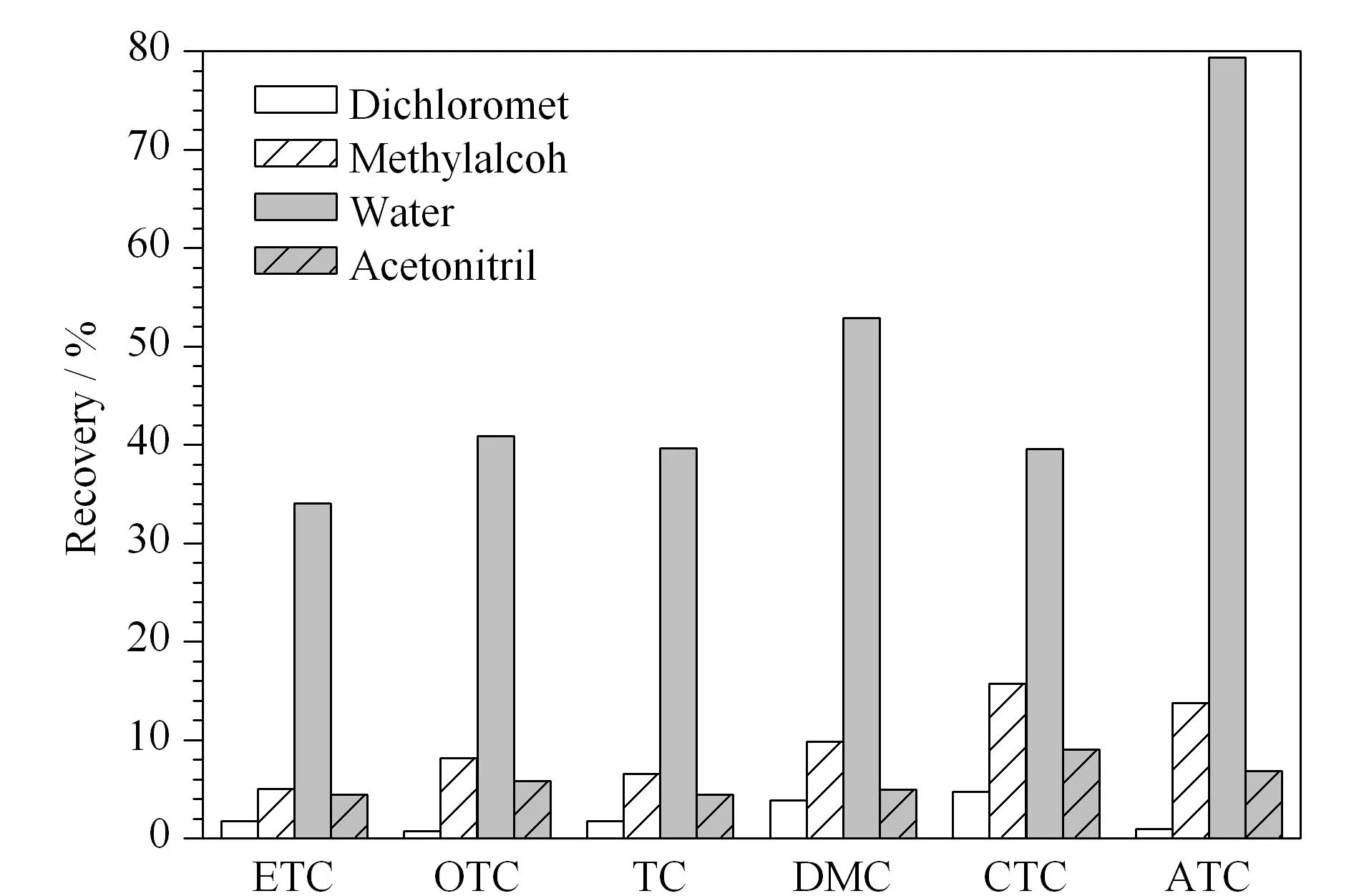
图 6 不同洗脱溶剂对6种四环素类抗生素回收率的影响Fig. 6 Effect of different desorption solvents on the recoveries of the six tetracycline antibiotics Extraction conditions: GO/nZVI, 15 mg; sample volume, 100 mL; mass concentration of TCs, 10 μg/L; extraction temperature, 40 ℃; extraction time, 15 min; desorption time, 5 min; pH value of the desorption solvent, 11.
2.2.4洗脱溶剂的种类
洗脱溶剂的种类是影响洗脱效率的重要因素,使用合适的洗脱溶剂能够使待测物更容易地被洗脱下来。试验选取二氯甲烷、甲醇、水和乙腈等常用的溶剂作为洗脱溶剂,考察了其对6种四环素类抗生素洗脱效率的影响(见图6)。结果表明,采用水作为洗脱溶剂对6种四环素类抗生素的洗脱效率最大,且基底杂质较少,因此选择水作为洗脱溶剂。
2.2.5洗脱溶剂的pH值
四环素类抗生素的质子化形式易于被磁性材料吸附,去质子化形式易于洗脱。当pH值为9~11时,四环素类抗生素以负离子形式存在,由于磁性材料与羟基结合获得负电荷,所以在静电斥力的作用下易于洗脱。当pH值达到11时,洗脱剂对四环素类抗生素的洗脱效果最优,6种四环素类抗生素的回收率均大于80%(见图7)。当pH值大于11时,四环素类抗生素在强碱性条件下不稳定,影响洗脱效率。所以选择pH 11的氨水溶液作为洗脱剂。

图 7 洗脱溶剂pH值对6种四环素类抗生素回收率的影响Fig. 7 Effect of different pH values of the desorption solvent on the recoveries of the six tetracycline antibiotics Extraction conditions: GO/nZVI, 15 mg; sample volume, 100 mL; mass concentration of TCs, 10 μg/L; extraction temperature, 40 ℃; extraction time, 15 min; desorption time: 5 min, desorption solvent: water.

CompoundLinearequationr2Linearrange/(μg/L)LOD/(ng/L)LOQ/(ng/L)ETCy=26781.9x+25238.90.99751-1009.2030.67OTCy=26322.5x+53807.50.99841-1003.4911.64TCy=31525.8x+12857.20.99931-1004.7815.92DMCy=11614.6x-372.30.99911-10025.2184.03CTCy=8760.0x+2799.70.99931-10020.9869.93ATCy=25278.8x+30483.60.99671-1002.448.14
y: peak area;x: mass concentration, μg/L.
2.2.6洗脱时间
为缩短样品前处理时间,对样品的洗脱时间进行了优化,在2、5、8、10、15和20 min时考察了6种四环素类抗生素的回收率。如图8所示,洗脱时间为10 min时,回收率基本达到最大值,超过10 min后回收率趋于平稳,因此选择洗脱时间为10 min。

图 8 洗脱时间对6种四环素类抗生素回收率的影响Fig. 8 Effect of the desorption time on the recoveries of the six tetracycline antibiotics Extraction conditions: GO/nZVI, 15 mg; sample volume, 100 mL; mass concentration of TCs, 10 μg/L; extraction temperature, 40 ℃; extraction time, 15 min; desorption solvent, water; pH value of the desorption solvent, 11.
此外,还考察了样品溶液的离子强度对磁性固相萃取效率的影响,通过加入不同质量浓度的NaCl来增加离子强度,结果表明NaCl浓度对萃取效率影响很小,并且NaCl会污染质谱离子源,因此实验中不加入NaCl。
2.3方法学评价
2.3.1线性范围、检出限与定量限
准确量取适量的6种四环素类抗生素混合标准工作溶液(1 000 μg/L),用甲醇稀释,获得质量浓度分别为1、5、10、20、50和100 μg/L的系列标准溶液,按1.2节方法处理后建立定量离子峰面积(y)与质量浓度(x, μg/L)的线性关系。结果表明,6种四环素类抗生素在1~100 μg/L的质量浓度范围内线性关系良好,相关系数r2≥0.996,检出限(LODs,S/N=3)和定量限(LOQs,S/N=10)范围分别是2.44~25.21 ng/L和8.14~84.03 ng/L(见表2)。
此外,表3列出了本方法与其他方法对目标化合物检出限的对比结果,与文献[5,18,22-26]相比,本方法对目标化合物的检出限更低。本方法简单快速,由于采用磁性固相萃取作为样品前处理手段,避免了过滤、离心等繁琐步骤,可进行批量操作。本方法的灵敏度可以满足对环境水中痕量四环素类抗生素的分析。
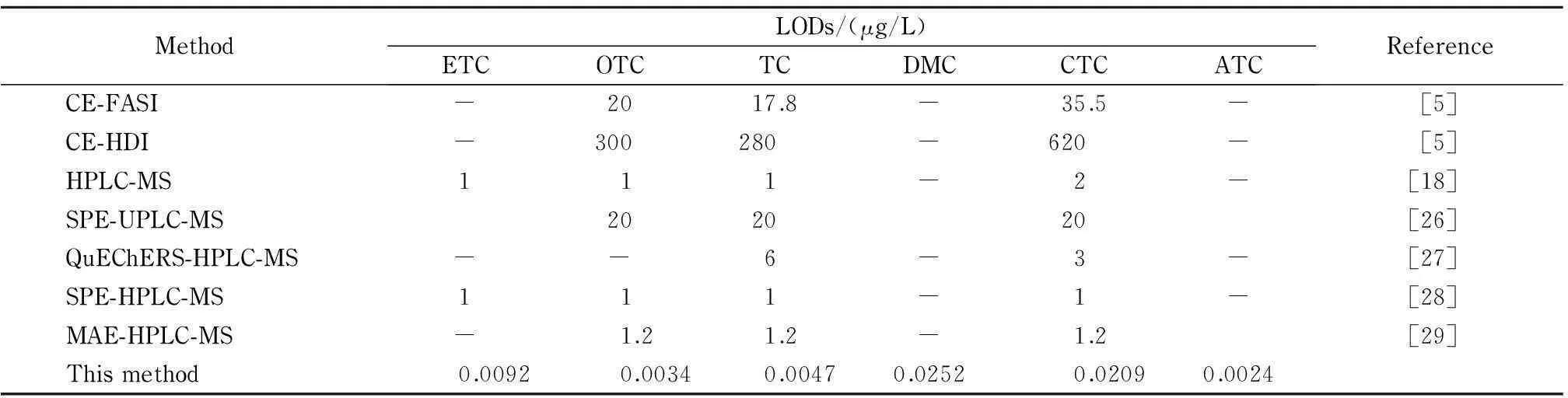
表 3 本方法与其他方法对6种四环素类抗生素检出限的比较
FASI: field-amplified sample injection; HDI: hydrodynamic injection; MAE: microwave-assisted extraction. -: not mentioned.
2.3.2回收率和精密度
在已知质量浓度为10 μg/L的水样中添加标准溶液,进行加标回收率的测定。加入不同体积的6种四环素类抗生素混合标准工作液(1 000 μg/L),配制成30、50和70 μg/L 3个质量浓度水平的水样进行实际样品加标试验,每个水平测定5次。按1.2节方法处理后进行HPLC-MS/MS测定,计算回收率。分别在样品处理当日不同时间点和处理后不同天数进样分析(n=5),计算日内和日间精密度。6种四环素类抗生素的加标回收率均大于80%,日内精密度和日间精密度分别不高于2.5%和7.1%。回收率和精密度结果见表4。

表 4 6种四环素类抗生素在环境水样中的回收率和精密度
2.4实际样品分析
利用本文建立的方法分析了杭州市郊区河段中四环素类抗生素的残留,5份水样分别取自该河段中不同排污口附近。结果表明,5份水样均有不同种类和含量的四环素类抗生素检出(见表5)。图9是实际水样经磁性固相萃取前后的MRM谱图。本方法具有良好的实用性,可应用于不同环境水样中四环素类抗生素的测定。

表 5 实际水样中6种四环素类抗生素的含量(n=3)
ND: not detected.
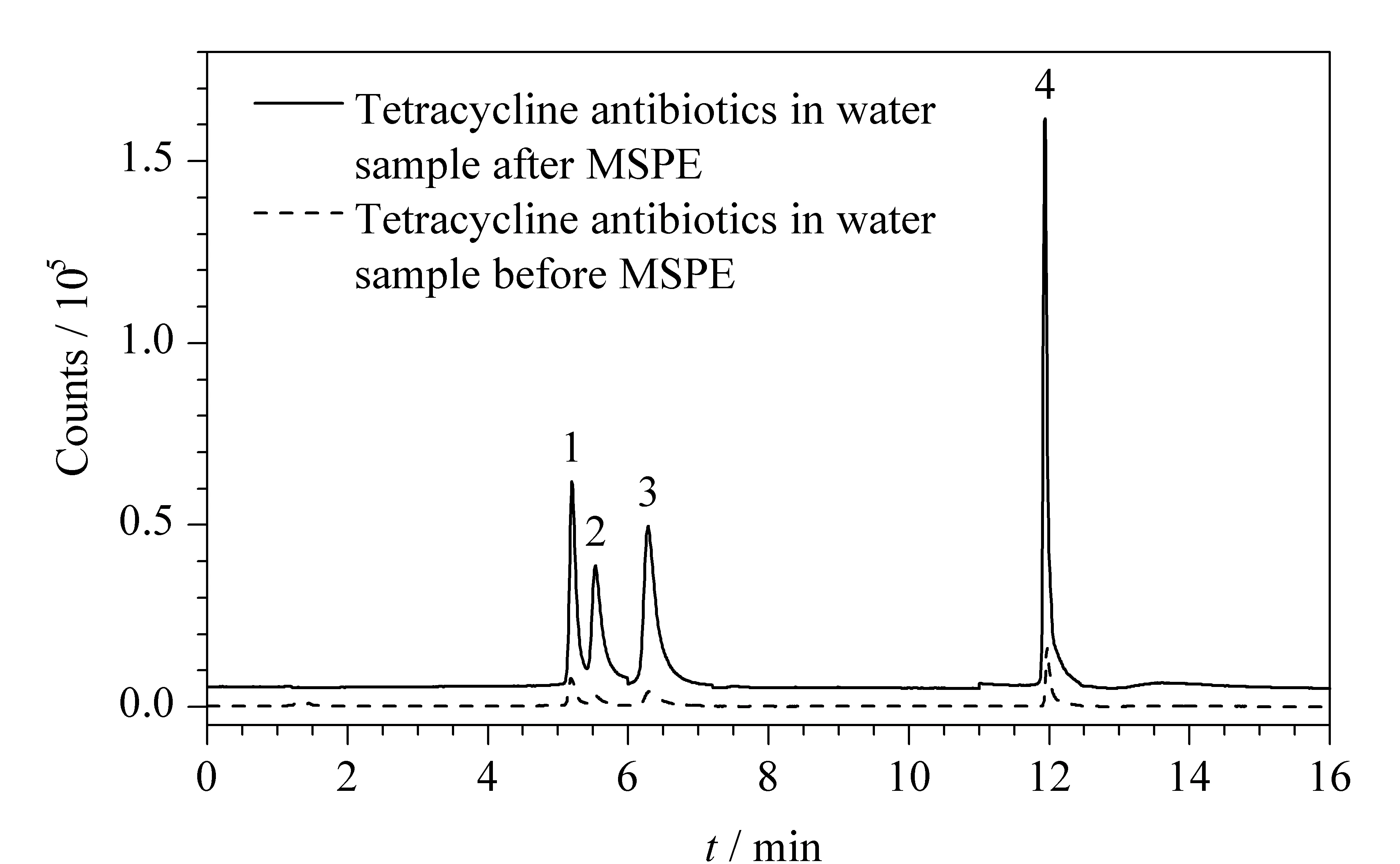
图 9 实际水样中6种四环素类抗生素的MRM谱图Fig. 9 MRM chromatograms of the six tetracycline antibiotics in water sample 1. ETC; 2. OTC; 3. TC; 4. ATC.
3结论
本文建立了基于GO/nZVI的磁性固相萃取-HPLC-MS/MS分析测定环境水样中的6种四环素类抗生素的方法,分别对色谱及质谱条件、萃取时间、萃取温度、磁性材料用量、洗脱剂种类和洗脱剂的pH值进行了优化。本方法操作简便、快速、绿色环保、结果可靠、检出限低、重现性好,可应用于不同环境水样中四环素类抗生素的测定。
参考文献:
[1]Yang C Q, Wang L X, Hou X H, et al. Chinese Journal of Chromatography, 2012, 30(8): 756
杨常青, 王龙星, 侯晓虹, 等. 色谱, 2012, 30(8): 756
[2]Yang S, Cha J, Carlson K. J Chromatogr A, 2005, 1097: 40
[3]Hou L W, Zhang H, Wang L G, et al. Chem Eng J, 2013, 229: 577
[4]Zhao Y B, Pan J, Guo X Q, et al. Chinese Journal of Analytical Chemistry, 1993, 21(12): 1439
赵一兵, 潘洁, 郭祥群, 等. 分析化学, 1993, 21(12): 1439
[5]Li A M, Huang Z, Lu W P, et al. Chinese Journal of Chromatography, 2014, 32(8): 897
李爱梅, 黄茁, 卢文平, 等. 色谱, 2014, 32(8): 897
[6]Liu Z H, Ye N, Guo W L, et al. Scientia Agricultura Sinica, 2009, 42(1): 318
刘智宏, 叶妮, 郭文林, 等. 中国农业科学, 2009, 42(1): 318
[7]Qian Y. Occupation and Health, 2000, 16(12): 37
钱英. 职业与健康, 2000, 16(12): 37
[8]Yang X Q, Yang C X, Yan X P. J Chromatogr A, 2013, 1304: 28
[9]Patyra E, Kowalczyk E, Kwiatek K. Anal Bioanal Chem, 2013, 405: 6799
[10]Wang L, Zhong D L, Chen G C, et al. Chinese Journal of Chromatography 2013, 31(10): 1010
王丽, 钟冬莲, 陈光才, 等. 色谱, 2013, 31(10): 1010
[11]Pamreddy A, Hidalgo M, Havel J, et al. J Chromatogr A, 2013, 1298: 68
[12]Tölgyesi A, Tölgyesi L, Békési K, et al. Meat Sci, 2014, 96: 1332
[13]Nebot C, Guarddon M, Seco F, et al. Food Control, 2014, 46: 495
[14]Zhou W J, Xie Z F, Shao L Z. Chinese Journal of Chromatography, 2012, 30(7): 684
周卫军, 谢正福, 邵琳智. 色谱, 2012, 30(7): 684
[15]Ben W W, Qiang Z M, Adams C, et al. J Chromatogr A, 2008, 1202: 173
[16]Jia A, Xiao Y, Hu J Y, et al. J Chromatogr A, 2009, 1216: 4655
[17]Dasenaki M E, Thomaidis N S. Anal Chim Acta, 2010, 672: 93
[18]Liu R R, Wu L M, Zhou J H, et al. Chinese Journal of Food Science, 2011, 32(10): 232
刘蓉蓉, 吴黎明, 周金慧, 等. 食品科学, 2011, 32(10): 232
[19]Wang Z, Wang C. Chinese Journal of Chromatography, 2012, 30(10): 977
王志, 王春. 色谱, 2012, 30(10): 977
[20]Yang J, Jiang H M, Lian H Z. Journal of Analytical Science, 2014, 30(5): 718
杨静, 蒋红梅, 练鸿振. 分析科学学报, 2014, 30(5): 718
[21]Hu W L, Li L, Pang M, et al. Chinese Journal of Analysis Laboratory, 2014, 33(5): 547
胡文凌, 李莉, 庞明, 等. 分析试验室, 2014, 33(5): 547
[22]Hu W L, Zhang J, Yu W J, et al. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2014, 51(2): 153
胡文凌, 张杰, 余卫娟, 等. 理化检验-化学分册, 2014, 51(2): 153
[23]Gao Q, Feng Y Q. Chinese Journal of Chromatography, 2014, 32(10): 1043
高强, 冯钰锜. 色谱, 2014, 32(10): 1043
[24]Huang Q, He M, Chen B B, et al. Chinese Journal of Chromatography, 2014, 32(10): 1132
黄倩, 何蔓, 陈贝贝, 等. 色谱, 2014, 32(10): 1132
[25]Li H F, Yang H Y, Zhang Y, et al. Chinese Journal of Chromatography, 2014, 32(4): 413
李海芳, 杨红云, 张英, 等. 色谱, 2014, 32(4): 413
[25]Sun G D, Su Z Y, Chen M, et al. Chinese Journal of Chromatography, 2009, 27(1): 54
孙广大, 苏仲毅, 陈猛, 等. 色谱, 2009, 27(1): 54
[26]Cao Y F, Kang J, Chang Q Y, et al. Chinese Journal of Chromatography, 2015, 33(2): 132
曹亚飞, 康健, 常巧英, 等. 色谱, 2015, 33(2): 132
[27]Fan Z Y, Liu Q S, Shi D D, et al. Feed Processing and Testing, 2013, 49(9): 74
范志影, 刘庆生, 石冬冬, 等. 饲料加工与检测, 2013, 49(9): 74
[28]Ni Y F, Zhu L P, Wang Y, et al. Journal of Instrumental Analysis, 2012, 31(Suppl): 101
倪永付, 朱莉萍, 王勇, 等. 分析测试学报, 2012, 31(增刊): 101
Determination of tetracycline antibiotics in environmental water using magnetic solid phase extraction combined with high performance liquid chromatography-tandem mass spectrometry
GUO Ming, YU Feng*, JIA Keling, LI Jiao, SUN Hai
(Zhejiang Research Institute of Chemical Industry, Hangzhou 310023, China)
Abstract:A method has been developed for the simultaneous determination of tetracycline antibiotics in environmental water by magnetic solid phase extraction and high performance liquid chromatography-tandem mass spectrometry. Several important parameters affecting the magnetic solid phase extraction procedure have been optimized for the best recovery. The eluate was analyzed by high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) under multiple reaction monitoring (MRM) mode with a ZORBAX Eclipse Plus C(18) column. Under the optimized conditions, the six tetracycline antibiotics (4-epitetracycline, oxytetracycline, tetracycline, demclocycline, chlortetracycline,anhydrotetracycline) showed good linearities in the range of 1-100 μg/L with the correlation coefficients of 0.996 7-0.999 3. The limits of detection (LODs) were in the range of 2.44 ng/L to 25.21 ng/L. The spiked recoveries were 80.6%-90.0%. The intra-day relative standard deviations (RSDs) were 0.6%-2.5%, while the inter-day RSDs were 1.1%-7.1%. The method has low background and high sensitivity. It was successfully applied to the simultaneous determination of the six trace tetracycline antibiotics in environmental water.
Key words:magnetic solid phase extraction; high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); tetracycline antibiotics; environmental water
中图分类号:O658
文献标识码:A
文章编号:1000-8713(2016)04-0407-07
基金项目:浙江省公益性技术应用研究(分析测试)项目(2014C37090).
*收稿日期:2015-11-23
DOI:10.3724/SP.J.1123.2015.11038
*通讯联系人. Tel:(0571)81182373,E-mail:y_u_f2006@163.com.
Foundation item: Zhejiang Provincial Public Service Technology Applied Research (Analysis Test) Project (No. 2014C37090).

