不同年龄马睾丸组织中miRNA-34家族含量的变化
何良军, 王时伟, 邓海峰, 董 红,4, 田 方, 陈静波
(1.石河子大学动物科学院,新疆石河子 832000; 2.塔里木大学动物科学学院,新疆阿拉尔 843300;3.新疆伊犁州昭苏马场,新疆昭苏 835602;4.新疆畜牧科学院,新疆乌鲁木齐 830000)
不同年龄马睾丸组织中miRNA-34家族含量的变化
何良军1, 王时伟2, 邓海峰3, 董红1,4, 田方1, 陈静波4*
(1.石河子大学动物科学院,新疆石河子 832000; 2.塔里木大学动物科学学院,新疆阿拉尔 843300;3.新疆伊犁州昭苏马场,新疆昭苏 835602;4.新疆畜牧科学院,新疆乌鲁木齐 830000)
摘要:为研究microRNA(miRNA)-34家族在马不同发育阶段睾丸组织内的表达规律,应用实时荧光定量PCR方法,以GAPDH 作为内参基因,分别对miRNA-34家族(miRNA-34a、miRNA-34b 和miRNA-34c) 在3个发育阶段哈萨克马睾丸组织表达情况进行检测。结果表明miRNA-34a 在马睾丸发育过程中表达量较为稳定,在不同发育阶段睾丸组织内无显著差异(P>0.05)。miRNA-34b和miRNA-34c在马驹和周岁马睾丸组织中的表达量较低,在这两个年龄段表达量无显著差异(P>0.05)。而在成年马阶段出现明显上升,成年马miRNA-34b和miRNA-34c表达量与马驹和周岁马表达量有极显著的差异(P<0.01)。位于同一基因簇上的miRNA-34b 和miRNA-34c具有极为类似的表达模式和结构,分析认为马的miRNA-34b和miRNA-34c 也具有冗余功能。
关键词:哈萨克马;miRNA-34家族;实时荧光定量PCR
MicroRNA(miRNA)是一种长度为19 nt~25 nt的RNA。它们通过与靶基因3′UTR碱基互补方式进行结合,能够抑制mRNA翻译或者降低mRNA的稳定性[1]。成熟miRNA是由长链的初级miRNA转录体和miRNA前体切割形成的。miRNA种子序列是成熟miRNA 5′端第2~8个碱基,这个片段与靶基因的3′-UTR区通过碱基配对的方式进行结合。根据成熟miRNA和pre-miRNA的结构和序列,miRNA可以被划分为不同的miRNA家族[2]。同一家族内的成员具有相同的种子序列,这意味着它们有冗余的功能。
已知很多miRNA有特异性表达模式,这种特异性表达模式表现在这些miRNA在特定组织内或特定发育阶段内表达。从斑马鱼到人的进化过程中,miRNA-122序列是保守的,并且在这2种物种中,miRNA-122均表现为肝脏特异性表达[3]。已证实miRNA-122是调控肝炎病毒C感染、类固醇代谢和肝癌发挥重要作用[4]。 再如,miRNA-1在心脏和肌肉组织中呈特异性表达的,敲除小鼠miRNA-1-2基因会导致50%的小鼠由于心脏缺陷在出生前后死亡,剩余的小鼠也表现出心脏缺陷[5]。上述研究表明,miRNA的分布可能决定了组织和细胞的功能特异性,在细胞生长和发育过程中发挥重要作用。
2001年10月26日,《Science》杂志发表了美国麻省理工学院Whitehead生物研究所Nelson等利用Northern 杂交技术在秀丽隐杆线虫(Caenorhabditis.elegans)中发现一组类似于lin-4和let-7(最先发现的2个miRNA)具有21 nt~24 nt的非编码RNA,这组RNA可能具有调控作用,其中包括miRNA-34[6]。
自发现miRNA-34后,对其研究也随即展开。目前已知在无脊椎动物中miRNA-34只有1个成员,而在哺乳动物miRNA-34有3个分别是miRNA-34a、miRNA-34b 和 miRNA-34c,因此,人们也称之为miRNA-34家族。p53是一个转录因子,当DNA损伤或细胞受胁迫时都可以激活p53[7]。为研究p53肿瘤抑制通路中miRNA的作用,通过放射处理小鼠野生型胚胎成纤维细胞与小鼠p53-/-胚胎成纤维细胞,结果只能增加野生型细胞中p53的表达,同时miRNA-34家族的3个成员的表达量与p53表达量呈正相关,并证实miRNA-34基因家族启动子有p53的结合位点。利用强力霉素(doxycycline)处理可重新激活内源性p53的表达,从而增加miRNA-34家族的表达。这些证据表明miRNA-34家族是p53通路下游的重要成员[8]。此后miRNA-34家族就成为人们研究的热点。
研究表明,miRNA-34家族参与多种生物功能,很多重要生物过程中发挥重要作用,例如细胞增生[9]、细胞凋亡[10]和细胞分化[11]。 因此,研究miRNA-34家族在不同组织中的表达量有重要意义。在人和小鼠的相关报道中,miRNA-34具有调节原始生殖发育和精子生成的作用[12]。在家畜中已研究了猪睾丸发育过程中miRNA-34家族成员的序列和功能及表达规律[13-14]。
截止2015年8月,在mirBase( http://www.mirbase.org ) 数据库中已收录马的690个成熟的miRNA,715个前体miRNA,已有miRNA-34a、miRNA-34b和miRNA-34c的序列描述,miRNA-34a位于第2号染色体上,属于起源于内含子的miRNA, miRNA-34b和 miRNA-34c 位于第7号染色体上,形成一个miRNA 基因簇,但还没有它们功能的报道。马作为经济价值极高的家畜,其繁殖能力是发展马产业的关键因素。本试验参照马的GAPDH为内参基因,为分析miRNA在不同发育阶段哈萨克马睾丸组织的表达规律和特异性,运用荧光定量PCR的方法对马睾丸组织中miRNA-34家族的表达量进行了检测和分析,研究这3个miRNA在马睾丸不同发育阶段的表达规律。
1材料与方法
1.1材料
1.1.1试验用动物及样品的采集试验用马匹均来自新疆伊犁地区的哈萨克马,分别采集马驹(5月龄)、周岁马(1.5岁)和成年公马(4岁~8岁)各3匹,每匹采集睾丸组织 ,共计9个组织样品。在采集组织前,先通过牙齿,判断马的年龄。马屠宰后,采集所有样品迅速在液氮中冷冻,然后在-80℃保存。
1.1.2主要试剂DEPC,Sigma公司产品;氯仿,国药分析纯;琼脂糖,Biowest公司产品;胰蛋白胨,Oxoid公司产品;琼脂粉,Chembase公司产品;酵母提取物,Oxoid公司产品;DNA Marker DL 2 000,TaKaRa公司产品。
1.1.3主要仪器 电泳仪(DYY-5型),北京市六一仪器厂;紫外分光光度计(UV2101 PC型)、凝胶成像系统,Bio-Rad公司产品;常规PCR仪,Thermo Forma公司产品;Mx3005P型实时荧光定量PCR仪,低温高速离心机等。
1.2方法
1.2.1总RNA的提取 利用Trizol 试剂(Invitrogen,USA)提取样品中的总RNA,用Agilent Technologies 2100 Bioanalyzer测定RNA的纯度。试验运用以往试验中介绍的方法[15],测定马睾丸组织中miRNA-34a ,miRNA-34b 和miRNA-34c 的表达量。参照Chen C F等[16]介绍的方法设计qRT-PCR的引物,由上海生工生物工程技术服务有限公司合成。试验应用M-MuLV反转录酶(RevertAidTM和特异性引物(表1),将1 μg RNA反转录为cDNA,反应条件是37℃15 min ,85℃ 5 min,然后是4℃ 5 min。
1.2.2实时荧光定量PCR分析为了进一步分析miRNA在不同发育阶段哈萨克马不同组织的表达规律,利用荧光定量PCR方法,以GAPDH作为内参,分别对miRNA-34a、miRNA-34b 和miRNA-34c 在哈萨克马3个不同发育阶段(马驹、周岁马、成年马)睾丸组织的表达情况进行检测,每个样品设3个重复。
运用Applied Biosystems 9700 Thermocycler 进行SYBR Green PCR。试验条件为20 μL的反应体积,包含1 μL cDNA (10倍稀释),95℃预变性3 min;95℃ 15 s,60℃ 40 s,40个循环。本研究以马GAPDH作为内参基因[17-18],采用2-△△Ct法进行相对定量比较。用SPSS12.0进行显著性检验。

表1 实时荧光定量PCR引物序列
2结果
2.1miRNA-34家族在不同发育阶段睾丸组织中的变化趋势结果见图1。
如图1所示, miRNA-34a 在马睾丸内相对表达量较为稳定,在成年马阶段略微有些下降。总体上看,在不同发育阶段睾丸组织内无显著差异(P>0.05)。miRNA-34b和miRNA-34c在马驹和周岁马睾丸组织中的表达量较低,在这两个年龄段表达量相似,均无显著差异(P>0.05)。而在成年马阶段出现明显上升,成年马miRNA-34b和miRNA-34c表达量与马驹和周岁马表达量有极显著的差异(P<0.01)。
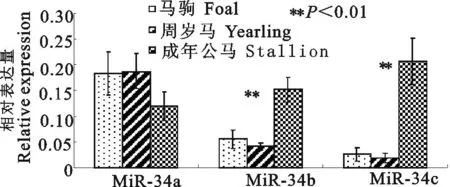
图1 miRNA-34家族在不同发育阶段马睾丸组织的
2.2miRNA-34家族的冗余功能
马的miRNA-34家族在5′端有相同的“种子序列”(GGCAGUG)。miRNA-34a有22个碱基,与miRNA-34b 和miRNA-34c有19个碱基相同,具有86%(19/22 nt)和82%(18/22 nt)的同源性。miRNA-34b 与miRNA-34c序列长度相同为23 nt,有21个碱基是相同,2个碱基是不同的,同源性是91%(21/23 nt)(图2)。 表明miRNA-34b和miRNA-34c含有的相同靶基因比miRNA-34a的要多。本试验数据显示miRNA-34b和miRNA-34c在不同发育阶段睾丸组织表达量的平行关系可能也是一种预防差错的机制。

miRNA-34a和miRNA-34b之间相同序列用斜体标识;miRNA-34b和miRNA-34c之间相同序列用下划线标识Sequences highlighted in italics indicate identical nucleotides shared miRNA-34b and miRNA-34c;Sequences highlighted by underlining indicate identical nucleotides shared miRNA-34b and miRNA-34c
图2马成熟miRNA-34a、miRNA-34b和 miRNA-34c
(http://www.mirbase.org)序列
Fig.2Mature sequences of miRNA-34a,miRNA-34b and miRNA-34c
3讨论
3.1miRNA-34家族在不同发育阶段睾丸组织的表达
miRNA-34家族参与哺乳动物精子发生的过程。有研究显示,miRNA-34a在小鼠不同组织内广泛表达[19-20],其中miRNA-34b和miRNA-34c主要在大脑、肺脏和睾丸内表达[20]。在小鼠睾丸发育的整个过程中,miRNA-34a表达量较为恒定,并且只在精原细胞内表达[21]。通过对小鼠的研究显示,miRNA-34b和miRNA-34c在成年鼠睾丸组织内表达高[22]。比较未成熟和成熟睾丸组织发现,在小鼠[22]、猪[13]和猕猴[23]的成熟睾丸内,miRNA-34b和miRNA-34c有很高程度的特异性表达。本研究显示哈萨克公马不同发育阶段睾丸内miRNA-34家族时空表达模式与小鼠、猪、猕猴的相类似。
miRNA-34作为一类保守的、非编码miRNA,通过p53通路调控细胞的增殖和凋亡,其在生殖领域中的作用引起广泛关注。Bouhallier F等[24]发现,miRNA-34c在小鼠出生后12 d睾丸中表达量很低,此后miRNA-34c表达量迅速升高到成年水平,并且发现miRNA-34c在小鼠粗线期精母细胞和圆形精子细胞内表达量很高,说明miRNA-34c的表达体现出减数分裂期特异性;miRNA-34b与miRNA-34c有相同的表达模式,但是miRNA-34b表达量要低于miRNA-34c,证明它们在小鼠睾丸内的功能主要与精子发生过程后期有关。本试验结果不仅证实了以上结论,而且更清楚地表达了马睾丸组织中miRNA-34家族表达量从马驹到成年阶段的表达规律。从本研究结果可以看出,伴随着马的生殖发育过程,马睾丸组织中miRNA-34b和miRNA-34c表达变化趋势是先增后减,待睾丸组织发育到成熟阶段相对表达量显著上升,并高于miRNA-34a,据此推断miRNA-34b和miRNA-34c可能与公马生殖细胞发育相关。
崔胜等利用原位杂交技术也得出类似结果,地高辛核酸标记探针检测,证实miRNA-34c可作用于环磷酸腺苷(转录激活因子Ⅰ,ATF1)来促进小鼠雄性生殖细胞的凋亡。研究数据显示,在胚胎期第13.5天至出生后12 d,小鼠睾丸内均未检测到miRNA-34c,而在出生后第14天的粗线期精母细胞内开始出现miRNA-34c,并于出生后第16天信号开始加强,直至成年后几乎每个曲精细管内都存在miRNA-34c的信号[25]。小鼠睾丸组织学观察显示,小鼠生后初期睾丸曲细精管中只有支持细胞和原始生精细胞; 至生后8 d出现精原细胞;15 d出现初级精母细胞;23 d时出现次级精母细胞及少量圆形精子细胞,此后圆形精子细胞逐渐增多;30 d时圆形精子细胞发生变态;36 d时大量精子开始稳定出现于曲细精管管腔中,并延续至此后各期[26]。说明小鼠睾丸中miRNA-34c的表达与精母细胞的出现是同步的。
新疆哈萨克公马睾丸组织的观察显示,雄性幼驹的曲精细管尚未发育完整,为睾丸索,睾丸索之间有大量间质细胞。睾丸索管腔内含有生殖母细胞(精原细胞)和支持细胞;周岁马的曲细精管已经形成,曲细精管密度明显增大,管腔直径变化大,曲细精管内细胞多由3层~4层组成,但是生殖细胞发育还不完全,细胞间出现空腔,与小鼠出生后11日龄睾丸组织学特征相似[26]。成年马睾丸曲细精管管腔中生殖细胞种类完整,可见精原细胞、精母细胞、圆形精子细胞和长形精子细胞的存在,后2种细胞位于管腔中央,精原细胞位于基底膜上,睾丸已发育成熟,此阶段miRNA-34c的含量是最高的。本研究证明了精母细胞的数量与miRNA-34c表达量呈正相关,与小鼠的研究结果相类似。
由于miRNAs 通过直接抑制靶mRNA的翻译发挥着重要的基因调控作用,接下来的工作是预测和筛选miRNA-34家族可能的靶基因,以进一步了解它们及其靶基因在公马生殖发育过程中的作用。
3.2miRNA-34家族的冗余功能
在生物体内,一个miRNA有几十到几百个靶基因,同时一个靶基因又受到多个miRNA的控制,这种现象造成了miRNA功能的冗余。miRNA-34b 和miRNA-34c作为miRNA-34基因家族中的成员,在结构上具有很高的同源性。miRNA-34b 和miRNA-34c 位于同一基因簇上,具有同源性,同时在整个RNA片段的非种子序列也具有同源性。这种具有高度同源和成簇排列的方式还出现在其他类型的基因中,例如rRNA基因簇。研究者发现rRNA基因成簇排列,这种排列方式可能有利于RNA基因高效、协调地转录和胚胎发育以及早期rRNA基因的大量扩增[27]。与单个基因以及基因家族不成簇的其他成员不同,成簇基因表达不仅保持高度的时空协调,在表达量上也表现出高度的协调性。同一簇内基因在各发育分化阶段保持合适的表达比例,确保功能上的平衡[27]。在本研究发现位于同一基因簇上的miRNA-34b 和miRNA-34c具有极为类似的表达模式和结构,这种现象可能是机体为了实现miRNA时空表达的高度精确控制。
马的miRNA-34家族在5′端有相同的“种子序列”(GGCAGUG)。对HeLa (LGC Promochem) 细胞用RNA进行转染,分析miRNA-34a和miRNA-34c的通路,证明它们的靶基因不完全相同,但是有部分是重叠的[28]。 哺乳动物miRNA通过5′端和它们靶基因的3′-UTR区通过碱基互补结合调控靶基因。但有时候,miRNA 3′端也会参与碱基配对,有时甚至补偿5′端的碱基错配[29]。马成熟miRNA-34b 和 miRNA-34c 有21个碱基是相同,2个碱基是不同的。miRNA-34a和miRNA-34b 有19个碱基相同(图2)。表明miRNA-34b和miRNA-34c含有的相同靶基因比它们与miRNA-34a的要多。已证明miRNA-449家族与miRNA-34家族含有相同的“种子序列”,这两个家族在小鼠睾丸内功能是冗余的[21]。在小鼠睾丸内敲除miRNA-449会上调miRNA-34b和miRNA-34c表达,同时并不影响精子发生。证明这种冗余现象是一种预防差错的机制。本试验数据显示miRNA-34b和miRNA-34c在不同发育阶段睾丸组织表达量的平行关系可能也是一种预防差错的机制。
参考文献:
[1]Kim V N.MicroRNA biogenesis:coordinated cropping and dicing[J].Nat Rev Mol Cell Biol,2005,6:376-385.
[2]Kozomara A,Griffiths-Jones S.MiRBase:integrating microRNA annotation and deep-sequencing data[J].Nucleic Acids Res,2011,39:D152-D157.
[3]Wienholds E,Kloosterman W P,Miska E,et al.MicroRNA expression in zebrafish embryonic development[J].Science,2005,309:310-311.
[4]Lewis A P,Jopling C L.Regulation and biological function of the liver-specific miR-122 [J].Biochem Soc Trans,2010,38:1553-1557.
[5]Zhao Y,Ransom J F,Li A K,et al.Dysregulation of cardiogenesis, cardiac conduction,and cell cycle in mice lacking miRNA-1-2[J].Cell,2007,129:303-317.
[6]Lau N C,Lim L P,Weistein E G,et al.An abundant class of tiny RNAs with probable regulatory roles inCaenorhabditiselegans[J].Science,2001,294(5543):858-862.
[7]Vogelstein B,Lane D,Levine A J.Surfing the p53 network[J].Nature,2000,408:307-310.
[8]He L,He X Y,Lim L P,et al.A miRNA component of the p53 tumour suppressor network[J].Nature,2007,447(7148):1130-1134.
[9]Comey D C,Flesken-Nikitin A,Godwin A K,et al.MicroRNA-34b and microRNA-34c are targets of p53 and cooperate in control of cell proliferation and adhesion-independent growth[J].Cancer Res,2007,67:8433-8438.
[10]Welch C,Chen Y,Stallings R L.MicroRNA-34a functions as a potential tumor suppressor by inducing apoptosis in neuroblastoma cells[J].Oncogene,2007,26:5017-5022.
[11]Aranha M M,Santos D M,Sola S,et al.MiR-34 regulates mouse neural stem cell differentiation[J].PLoS One,2011,6:e21396.
[12]Dominici M,Blanc K L,Mueller I,et al.Minimal criteria for defining multipotent mesenchymals stomal cells.International society cellular therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[13]Lian C J,Sun B X,Niu S L,et al.A comparative profile of the microRNA transcriptome in immature and mature porcine testes using solexa deep sequencing[J].FEBS J,2012,279(6):964-975.
[14]赵伟,李传民,高峰,等.荧光定量分析猪睾丸组织中miR-34b的表达规律[J].中国兽医学报,2013,33(5):785-787,794.
[15]Erika V G,Wu R M,Wood M,et al.Protocol: a highly sensitive RT-PCR method for detection and quantification of microRNAs[J].Plant Meth,2007,3(1):12.
[16]Chen C F,Ridzon D A,Broomer A J,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucleic Acids Res,2005,33(20):e179.
[17]Ing N H,Laughlin A M,Varner D D,et al.Gene expression in the spermatogenically inactive "Dark" and maturing "Light" testicular tissues of the prepubertal colt[J].J Androl,2004,24:535-544.
[18]Shields J E,Kochan K J,Jeong J,et al.Initial characterization of a gene abundantly expressed in stallion testis[J].J Equine Vet Sci,2009,29(5):324-325.
[19]Dutta K K,Zhong Y,Liu Y T,et al.Association of microRNA-34a overexpression with proliferation is cell type-dependent[J].Cancer Sci,2007,98:1845-1852.
[20]Bommer G T,Gerin I,Ying F,et al.P53-mediated activation of miRNA34 candidate tumor-suppressor genes[J].Cur Biol,2007,17:1298-1307.
[21]Bao J Q,Li D,Wang L,et al.MicroRNA-449 and microRNA-34b/c function redundantly in murine testes by targeting E2F transcription factor-retinoblastoma protein(E2F-pRb) pathway[J].J Biol Chem,2012,287(26):21686-21698.
[22]Yan N H,Lu Y L,Sun H Q,et al.A microarray for microRNA profiling in mouse testis tissues[J].Reproduction,2007,134:73-79.
[23]Yan N H,Lu Y L,Sun H Q,et al.Microarray profiling of microRNAs expressed in testis tissues of developing primates[J].J Assist Reprod Gene,2009,26(4): 179-186.
[24]Bouhallier F,Allioli N,Lavial F,et al.Role of miR-34c microRNA in the late steps of spermatogenesis[J].RNA,2010,16:720-731.
[25]Xuan L X,Zhou D D,Chao W,et al.MicroRNA-34c enhances murine male germ cell apoptosis through targeting ATF1[J].PLoS One,2012,7(3):e33861.
[26]罗兰,张彦,杨芳,等.小鼠睾丸发育全过程的组织学观察[J].实验动物科学,2010,27(3):10-13.
[27]徐海明,刘德培.成簇基因的时空表达调控[J].生命科学,1999,11(3):98-100.
[28]Ebner O A,Selbach M.Quantitative proteomic analysis of gene regulation by miR-34a and miR-34c[J].PLoS One,2014,9(3):e92166.
[29]Shin C,Nam J W,Farh K K H,et al.Expanding the microRNA targeting code: functional sites with centered pairing[J].Mole Cell,2010,38(6):789-802.
Content Changs of miRNA-34 Family in Testis Tissues of Different Age Horses
HE Liang-jun1, WANG Shi-wei2, DENG Hai-feng3, DONG Hong1,4,TIAN Fang1,CHEN Jing-bo4
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi,Xinjiang,832000,China;2.CollegeofAnimalScience,TarimUniversity,Alar,Xinjiang,843300,China;3.ZhaosuHorseFarm,YiliKazakAutonomousPrefecture,Zhaosu,Xinjiang,835602,China;4.XinjiangAcademyofAnimalHusbandry,Urumqi,Xinjiang,830000,China)
Abstract:In order to study miRNA-34 family expression patterns in horse testes,the present study employed real-time PCR and used GAPDH as a reference gene to determine miRNA-34a,miRNA-34b and miRNA-34c expression patterns in Kazakh horse testes of three development stages.The results showed that miRNA-34a has relative stable expression in horse testicular development and shows no significant difference in expression of three testicular developmental stages(P>0.05);miRNA-34b and miRNA-34c have low expressions in foal and yearling testes and show no significant differences in expression(P>0.05);miRNA-34b and miRNA-34c have significantly higher expression in stallions and significantly higher expressions than that in foals and yearlings(P<0.01).miRNA-34b and miRNA-34c,forming one miRNA gene cluster,have very similar temporal expression patterns and RNA structures,suggesting function redundancy of miRNA-34b and miRNA-34c.
Key words:Kazakh horse;miRNA-34 family;real-time PCR
文章编号:1007-5038(2016)04-0040-05
中图分类号:S852.165
文献标识码:A
作者简介:何良军(1974-),男,湖北钧县人,博士研究生,主要从事动物遗传育种与繁殖研究。*通讯作者
基金项目:新疆维吾尔族自治区重大专项( 201130101-2);国家科技支撑项目(2012BAD44B02)
收稿日期:2015-04-07

