大鼠成熟的肺表面活性蛋白B的原核表达及纯化
张潇骏,王万能, ,周继红,刘 钦,顾仕苓,周代君,邱 俊,代 维,袁丹凤,刘大维
(1.重庆理工大学药学与生物工程学院,重庆 400054;2. 第三军医大学大坪医院野战外科研究所第四研究室,重庆 400042)
大鼠成熟的肺表面活性蛋白B的原核表达及纯化
张潇骏1,王万能1,2*,周继红2*,刘钦1,顾仕苓1,周代君2,邱俊2,代维2,袁丹凤2,刘大维2
(1.重庆理工大学药学与生物工程学院,重庆 400054;2. 第三军医大学大坪医院野战外科研究所第四研究室,重庆 400042)
摘要:为表达和纯化SP-B蛋白,先对SP-B基因进行稀有密码子优化,PCR反应获得SP-B 片段,构建重组质粒pGEX4T-1/SP-B,转化到E.coli BL21(DE3)中诱导表达;用SDS-PAGE与Western blot进行检测;用GSTPrep FF 16/10对融合蛋白进行纯化。经双酶切鉴定证实质粒中插入基因长250 bp,测序结果与大鼠SP-B cDNA 序列相符;质粒转化后用IPTG进行诱导,在分子质量约34 ku处出现1个新条带,与pGEX4T-1/SP-B蛋白预期大小一致,且该融合蛋白能可溶性表达并被纯化。结果表明成功构建了pGEX4T-1/SP-B 重组质粒,表达、纯化得到GST/SP-B蛋白,为研究肺表面活性物质替代药物奠定了基础。
关键词:肺表面活性蛋白B;原核表达;免疫印迹;蛋白纯化;大鼠
肺表面活性物质通过肺表面活性蛋白起到降低肺泡表面张力,增加肺顺应性,维持大小肺泡容积相对稳定,防止肺不张和肺水肿的作用[1],目前已知有4种肺表面活性蛋白,分别是SP-A、B、C和D 4种亚型,其中成熟的SP-B来源于肺泡Ⅱ型上皮细胞,分子质量为8.7 ku,是构成肺表面活性物质的小分子疏水性蛋白之一,属于鞘脂激活蛋白样蛋白超家族[2],是一种多样的脂质相互作用蛋白[3],主要功能是促进磷脂分子扩散,使磷脂快速吸附于气液界面成为单分子层,增加单分子膜的稳定性,提高脂质复合物的表面活性[4-6],参与管状髓磷脂的形成[7],具有调节肺泡液-气界表面张力及参与肺器官局部防御体系等重要的生理功能[8-10]。SP-B合成减少、活性降低及组分的改变,会导致呼吸衰竭和肺不张,说明SP-B是维持呼吸的关键因素;SP-B基因突变会导致某些肺部疾病如特发性的肺纤维化的发生[11];Nogee等指出,SP-B基因的失活会影响SP-C基因的表达,导致SP-C蛋白表达水平降低,进而引起间质性肺病,同时会增加病原感染的可能性,这也说明SP-B在肺功能维持和修复中起着不可替代的作用。
SP-B在肺组织的含量极少,仅占肺表面活性蛋白总含量的1%~1.5%,从动物体内大量提取异源性SP-B并应用于临床药物存在许多困难,且容易产生免疫原反应[12]。Surfaxin(KL4-surfactant)是Discovery laboratories公司根据成熟SP-B设计的人工合成多肽[13],但是Palmblad M等[14]研究结果表明,KL4与SP-B的作用仍存在差异,其作用机制可能与SP- C相似,无法完全替代SP-B在肺表面活性物质的完整功能。迄今为止,尚未见到成功表达并纯化成熟SP-B的相关报道。
本试验旨在通过克隆SP-B基因,构建一个含有成熟SP-B蛋白基因片段的原核表达载体,利用大肠埃希菌原核表达系统表达成熟SP-B蛋白,并且初步摸索纯化条件,为大量表达、纯化成熟SP-B蛋白,开发肺表面活性物质替代药物奠定了基础。
1材料与方法
1.1材料
1.1.1菌株与载体pGEX4T-1、E.coliDpα、E.coliBL21(DE3),重庆理工大学药学与生物工程学院生物工程技术实验室保存。
1.1.2试剂2×Master MixTaq聚合酶、T4 DNA 连接酶,广州复能基因有限公司产品;限制性内切酶BamH I、XhoI,美国NEB公司产品;SDS-PAGE凝胶配制试剂盒、PVDF膜,中国Biosharp公司产品;兔抗鼠SP-B多克隆抗体,美国Merck Millipore公司产品;辣根酶标记山羊抗兔IgG(H+L),北京中杉金桥生物技术有限公司产品;GSTPrep FF 16/10预装柱,美国GE公司产品。
1.2方法
1.2.1SP-B基因合成与引物设计通过查询、获得大鼠SP-B cDNA序列(GenBank accession number:HQ267704),用Condon Adaptation Tool进行稀有密码子优化,合成模版SP-B并构建在pMD19-T质粒上。依据pGEX4T-1质粒图谱及pMD19-T/SP-B DNA序列分析,用Primer Premier 5.0软件设计引物:上游引物:5′- TTTGGATCCATGGAGGGTTAGGGAGACG-3′,下游引物:5′- AAACTCGAGAGTGGAACAGCGGAGGACCAG
GCC-3′;上、下游引物分别引入限制性酶切位点BamH I、XhoI,目的基因大小为258 bp。
1.2.2SP-B的PCR扩增条件94℃变性5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,共35个循环;最后72 ℃ 7 min。PCR产物纯化按DNA纯化回收试剂盒说明书进行。
1.2.3pGEX4T-1/SP-B原核表达载体的构建将pGEX4T-1和SP-B 片段进行BamH I、XhoI双酶切并切胶回收酶切产物,T4 DNA 连接酶4 ℃过夜连接。重组质粒转化E.coliDpα感受态细胞, LA 固体培养基(含50 μg/mL 氨苄青霉素的LB 培养基)涂布,37 ℃培养;隔天挑取单菌落做菌落PCR鉴定。对初步鉴定后的菌落进行扩大培养,提取质粒做双酶切鉴定,将鉴定为阳性的重组质粒命名为pGEX4T-1/SP-B,送公司测序。
1.2.4IPTG诱导SP-B表达将重组质粒pGEX4T-1/SP-B转化至E.coliBL21(DE3)中。分别挑取单菌落接种于LA液体培养基,37 ℃、250 r/min摇床过夜培养。次日以10 mL/L转接于新鲜LA液体培养基中,37 ℃、250 r/min摇床培养,至菌液OD 600 nm 值为0.8,12 000 r/min离心收集菌体作为诱导前对照;其余菌液中加入IPTG至终浓度为0.2 mmol/L[15],于37 ℃、16 ℃、250 r/min振荡培养,并于3、6、9、12 h时分别离心收集菌体,表达产物用SDS-PAGE分析。
1.2.5Western blot检测SP-B的表达表达产物经SDS-PAGE后,蛋白转印到PVDF膜上,根据Marker剪下GST/SP-B所在区域,用含5 g/100 mL 脱脂奶粉的 TBS-T(20 mmol/L Tris-HCl,500 mmol/L NaCl,1 mL/L Tween-20,pH 7.5)封闭1 h;加入兔抗鼠SP-B多克隆抗体(1∶5 000 稀释),4℃孵育过夜;隔天用TBS-T洗涤后加入辣根酶标记山羊抗兔IgG(H+L)(1∶5 000 稀释),室温孵育1 h,膜经TBS-T洗涤后滴加Chemiluminescent HRP Substrate发光液,用Tanon 6200 发光成像工作站成像。
1.2.6GST/SP-B蛋白的纯化按10 mL/L接种量将重组菌接种于LA 液体培养基中,诱导12 h后离心收集所有菌体。用20 mmol/L PBS(含0.1 mmol/L PMSF,pH7.4)重悬菌体沉淀,400 W×5 s×5 s超声破菌20 min,12 000 r/min离心收集上清, 上清用0.45 μm微孔滤膜过滤。表达蛋白用GSTPrep FF 16/10预装柱进行纯化,先后用洗脱缓冲液(50 mmol/L Tris-HCl, 10 mmol/L还原性谷胱甘肽,pH8.0)和结合缓冲液(10 mmol/L PBS,pH7.4)平衡层析柱。上清液上样GSTPrep FF 16/10,流速为5 mL/min,收集穿透液。用洗脱缓冲液洗脱目的蛋白,收集洗脱峰,洗脱体积约20 mL。用5 ku超滤管浓缩至5 mL,取浓缩后蛋白收集物10 μL进行SDS-PAGE分析,Western blot检测方法同1.2.6,并用BCA蛋白定量试剂盒测定蛋白浓度。
2结果
2.1稀有密码子的优化
用Condon Adaptation Tool针对大鼠SP-B序列进行稀有密码子优化后,得到如图1所示的SP-B cDNA基因序列。经过分析,密码子优化后的成熟SP-B氨基酸排列顺序与天然成熟SP-B的氨基酸排列没有发生改变。

图1 密码子优化后的SP-B cDNA 序列
2.2SP-B基因的原核表达载体构建
以pMD19-T/SP-B为模板,经PCR扩增、琼脂糖凝胶电泳,检测所得目的条带约在250 bp(图2 A),符合SP-B cDNA阅读框的大小。菌落PCR筛选出阳性菌落与PCR扩增产物大小一致(图2 B)。质粒用BamH I和XhoI进行双酶切,在约4 960 bp和约250 bp处得到两条条带(图2 C),目的条带单一、位置正确,与pGEX4T-1和SP-B大小符合,初步证明质粒构建成功。阳性克隆测序结果显示,pGEX4T-1质粒GST标签后多克隆位点BamH I、XhoI酶切位点中间插入长240 bp的基因片段,为一开放阅读框架,与GenBank中公布的大鼠SP-B cDNA基因序列、氨基酸序列皆完全一致。图3为载体构建的示意图。
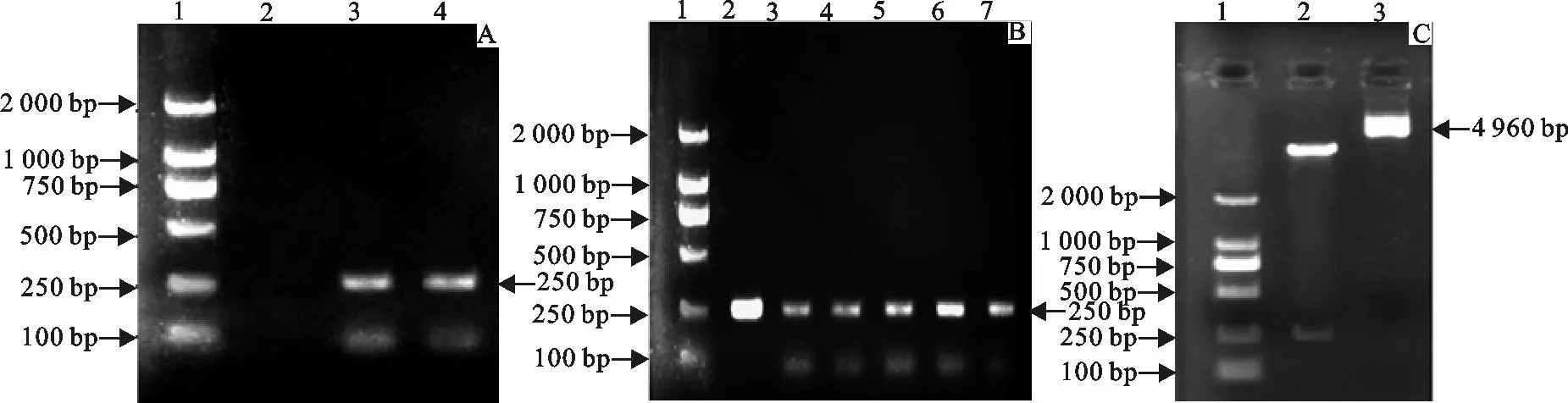
A.SP-B PCR扩增结果;1.DNA标准DL 2 000;2.不加模版空白对照组; 3、4.SP-B PCR扩增片段
B.菌落PCR筛选鉴定结果;1.DNA标准DL 2 000;2.SP-B PCR 扩增片段;3~7.菌落PCR筛选鉴定结果
C.阳性菌落双酶切鉴定结果;1.DNA标准DL 2 000;2.pGEX4T-1/SP-B经BamH I、XhoI双酶切产物;3.未酶切的pGEX4T-1/SP-B质粒
A.Results of SP-B PCR;1.DNA Marker DL 2 000;2.Blank control;3,4.SP-B PCR fragment
B.Results of colony PCR screening and identification;1.DNA Marker DL 2 000;2.SP-B PCR fragment;3-7.Colony PCR screening and identificationv
C.Identification results of positive colony by double enzyme digestion;1.DNA Marker DL 2 000;2.Products of pGEX4T-1/SP-B digested byXhoI andBamH I;3.pGEX4T-1/SP-B
图2SP-B PCR扩增与表达载体构建鉴定结果
Fig.2The results of SP-B PCR and vector construction identification
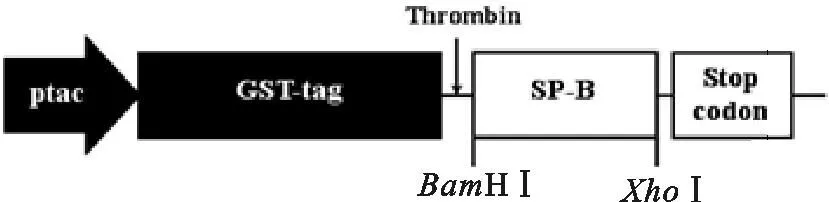
图3 载体构建示意图
2.3重组蛋白的表达与分析
分别于37 ℃、16 ℃条件下诱导蛋白表达6 h 时取样进行SDS-PAGE,结果如图4 A 所示,利用ITPG诱导,诱导温度为16 ℃时所获得的目的蛋白量较37 ℃条件下诱导表达量相对大些,将菌体超声破碎,离心后上清表达条带浓度与全菌体表达条带浓度较一致,证明在此温度下,重组蛋白大多形成可溶性上清,因此确定IPTG诱导最佳温度为16 ℃。
以确定诱导温度的重组大肠埃希菌于16 ℃下诱导表达,考察诱导持续的时间,分别于诱导后3 h~12 h 取样进行SDS-PAGE 分析,并同时与未诱导空白对照组在相同的IPTG 诱导条件下进行比较,进一步确定IPTG诱导的最佳时间,结果如图4 B 所示。同一温度和IPTG浓度下,在3 h~12 h 内,目的蛋白的表达量随时间延长逐渐最佳,至6 h 后增加量较少,即诱导表达12 h 可得到最大的诱导量,因此选定诱导时间为12 h。

A.不同温度下IPTG诱导表达的结果;1.未诱导的菌体表达产物;2.37℃条件下IPTG(终浓度0.2 mmol /L) 诱导产物;3.16 ℃条件下IPTG诱导产物;4.16 ℃条件下IPTG诱导表达菌体破碎后上清产物;5.蛋白分子质量标准
B.16 ℃不同诱导持续时间重组蛋白表达SDS-PAGE结果;1.蛋白分子质量标准;2.未诱导的菌体表达产物;3.IPTG诱导3 h表达产物;4.IPTG诱导6 h表达产物;5.IPTG诱导9 h表达产物;6.IPTG诱导12 h表达产物;7.IPTG诱导12 h菌体破碎上清产物
A.Results of expression after IPTG induction at different temperatures;1.Blank control;2.E.coliafter induction by IPTG (0.2 mmol /L) at 37℃;3.E.coliafter induction by IPTG (0.2 mmol /L) at 16℃;4.Expression of the supernatant ofE.coliafter induction by IPTG at 16 ℃;5.Protein molecular weight Marker
B.Results of SDS-PAGE of recombinant protein expressed at 16 ℃ in different inducing time;1.Protein molecular weight Marker;2.Blank control;3.Expression of SP-B induce by IPTG in 3 h;4.Expression of SP-B induced by IPTG in 6 h;5.Expression of SP-B induced by IPTG in 9 h;6.Expression of SP-B induced by IPTG in 12 h;7.Expression of the supernatant of theE.coliinduced by IPTG in 12 h
图4不同条件下IPTG诱导表达结果
Fig.4The results of expression after IPTG induction in different conditions
2.4Western blot结果分析
Western blot显示,不同诱导持续时间SP-B蛋白均为单一条带,无明显降解或非特异性条带出现,说明该GST/SP-B蛋白可与特异性抗体结合发生抗原抗体反应,同时证明了GST/SP-B在E.coliBL21(DE3)超声破碎后的上清液中得到可溶性表达,且目的蛋白在表达后超声处理的过程中无降解(图5)。
2.5重组蛋白的纯化结果
诱导表达成功后将含有重组质粒pGEX4T-1/SP-B的E.coliBL21(DE3)接种于200 mL LB液体培养基中大量表达,表达蛋白用GSTPrep FF 16/10进行纯化(图6)。取含有目的蛋白的细菌裂解上清液(纯化前)和收集的峰值洗脱液(纯化后) 用SDS-PAGE检测(图7A),可见蛋白经纯化后在电泳图上蛋白分子质量约34 ku处出现一条带,与预期的大小一致。对纯化后的蛋白进行Western blot(图7B),结果显示在分子质量约34 ku处SP-B有特异性抗体结合发生抗原抗体反应,证明纯化后的重组蛋白是GST标签与SP-B的融合蛋白。用BCA蛋白定量试剂盒测定的经纯化并浓缩后的重组蛋白浓度约为52 mg/L。

1.未诱导的菌体表达产物;2.IPTG诱导3 h表达产物;3.IPTG诱导6 h表达产物;4.IPTG诱导9 h表达产物;5.IPTG诱导12 h表达产物;6.IPTG诱导12 h菌体破碎上清产物
1.Blank control;2.Expression products induced by IPTG in 3 h;3.Expression products induced by IPTG in 6 h;4.Expression products induced by IPTG in 9 h;5.Expression products induced by IPTG in 12 h;6.Expression products induced of the supernatant by IPTG in 12 h
图5不同诱导时间重组蛋白Western blot检测
Fig.5The results of Western blot of recombinant proteins
in different induction time

A.洗脱液电导率变化曲线;B.洗脱液蛋白紫外吸收曲线
A.The change curve of the conductivity of the solution;B.Ultraviolet absorption curve of elution liquid protein
图6重组蛋白纯化监视图
Fig.6Monitor map of purified recombinant protein
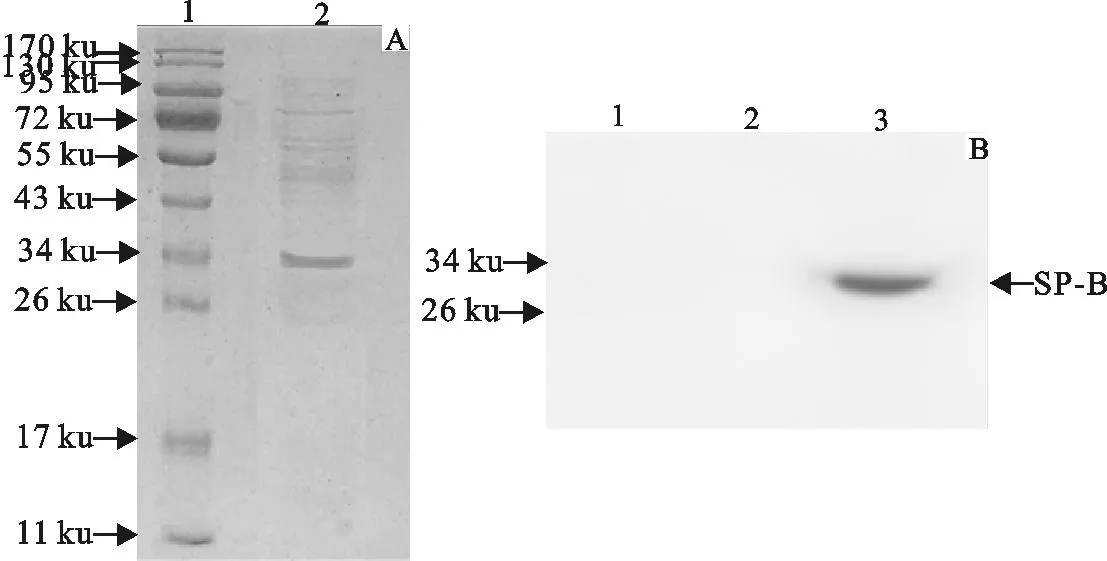
A.重组蛋白纯化后SDS-PAGE结果;1.蛋白分子质量标准;2.16 ℃ IPTG诱导12 h菌体破碎上清纯化产物
B.重组蛋白纯化后Western blot结果;1.蛋白分子质量标准;2.未诱导的菌体表达产物;3.16 ℃ IPTG诱导12 h菌体破碎上清纯化产物
A.SDS-PAGE results of purified recombinant proteins;1.Protein molecular weight Marker;2.Expression of the supernatant ofE.coliinduced by IPTG in 12 h at 16 ℃
B.Western blot results of purified recombinant proteins;1.Protein molecular weight Marker;2.Blank control;3.Expression of the supernatant ofE.coliinduced by IPTG in 12 h at 16 ℃
图7重组蛋白纯化后SDS-PAGE与Western blot检测
Fig.7Western blot and SDS-PAGE detection of purified recombinant protein
3讨论
本研究中大鼠SP-B的cDNA序列经过密码子优化后合成获得,有利于真核基因在原核系统中的表达。E.coliBL21(DE3)作为宿主菌,其遗传背景清楚、稳定,培养简便并且代谢易于控制,是目前使用广泛的蛋白表达系统[16],但是由于真核生物的基因片段含有在大肠埃希菌表达体系中难以被高效转录和翻译的稀有密码子,因此,本研究中大鼠SP-B的cDNA序列通过查询基因文库,密码子优化,合成基因,获得完整的连续编码序列,密码子优化有利于提高SP-B在大肠埃希菌原核表达体系中的转录、翻译效率。我们之前的研究通过提取大鼠肺组织,RT-PCR反应获得成熟SP-B的cDNA片段,虽然这种方法也可以获得完整的连续编码序列,但是因为基因中出现有多个稀有密码子,将其转化到大肠埃希菌Rosetta(DE3)原核表达体系中也难以达到高效表达。有文献报道[17],尝试采用真核表达载体转染细胞表达成熟SP-B,但由于SP-B的疏水性和膜结合性对细胞膜的稳定性产生不良影响,最终无法成功获得成熟的SP-B蛋白。
选用pGEX4T-1表达质粒,其N端多克隆位点及表达区域由Ptac启动子控制,Ptac是一种强效的杂合启动子,在IPTG存在的条件下,可在E.coliBL21(DE3)等宿主菌中高效表达GST标签融合蛋白。本试验中将GST-tag与疏水性较强的SP-B相融合,GST-tag在N端,SP-B在C端,在对菌体诱导时该标签能形成可溶性蛋白,这有利于促进SP-B形成可溶性蛋白而非包涵体,与GST介质发生螯合作用可对融合蛋白进行纯化,且可根据需要由特异性蛋白酶——凝血酶切除。GST-tag不仅简化了重组SP-B下游纯化的步骤,减少菌体杂蛋白的污染[18],而且可避免后期纯化步骤包涵体复性过程中强裂解液或复性液对蛋白结构和蛋白活性的影响,GST-Tag纯化的成熟SP-B蛋白可以直接免疫动物制备多克隆抗体。
对于蛋白的诱导方式,采用较低温度,时间较长的方法,有助于增加重组蛋白在上清液中的溶解。Andreas H等[19]曾用构建有SP-B基因的pET-21b质粒在37 ℃诱导温度表达蛋白,证实SP-B蛋白形成包涵体,经复性试验后表明蛋白因为结构改变而失去活性。用GST作为纯化标签特异性比较高,在纯化操作过程中,加大上样的流速,缩短作用时间,采用PBS作为裂解缓冲液(含PMSF),有助于防止蛋白降解,减少非特异吸附。用10 mmol/L还原型谷胱甘肽温和洗脱,也使目的蛋白的活性受到了很好的保护。
试验中成功构建SP-B的原核表达载体,并且通过蛋白纯化与Western blot的检测,证明在大肠埃希菌体内确实能表达SP-B蛋白,且能形成可溶性蛋白。但是试验后期在研究用凝血酶切除GST-tag,进一步纯化SP-B蛋白时,通过SDS-PAGE结合考马斯亮蓝R250检测,发现GST-tag无法被凝血酶切下,蛋白分子质量大小没有发生改变,无法形成两条分子质量不同的蛋白条带,这可能与使用大肠埃希菌原核表达系统不能对表达的蛋白质进行正确的翻译后修饰、折叠,菌体中表达的GST-tag/SP-B上的凝血酶酶切位点无法暴露在外面、被表达的蛋白所包埋有关系,这也成为下一步工作中的一个重点。
有学者[20-21]尝试构建SP-B与尿激酶融合蛋白,N端融合SP-B信号肽表达分泌蛋白的方法,结果显示,uPA的溶纤能力与对照组相比反而大大降低,SP-B也无法被成功纯化,最后证实只有在N端构建uPa及其信号肽,C端融合SP-B,才能实现了uPa/SP-B在CHO细胞中的分泌表达。此时可利用SP-B的疏水性和膜结合性将其作为一种靶向蛋白进行研究[22],这也能为测定分析SP-B与磷脂膜结构的相互作用以及运用SP-B靶向蛋白功能治疗肺部疾病提供方法。
总之,根据E.coli的密码子偏好性对成熟的SP-B基因进行了密码子优化,构建了pGEX4T-1/SP-B原核表达载体,pGEX4T-1携带有GST标签,可促进重组成熟 SP-B在E.coli中可溶表达。成熟的SP-B肽链疏水性很强,在原核系统中极易形成包涵体,影响蛋白质的正确折叠与活性,甚至不表达。通过亲水性标签可提高融合蛋白的水溶性,在疏水蛋白的折叠、组装过程中发挥着重要的作用。本文提供了一种在E.coli中高效表达SP-B的方法,实现了SP-B的原核载体表达,有助于进一步的蛋白结构及折叠机理研究,对其他重组肺表面活性蛋白质的表达、生产具有指导意义。
参考文献:
[1]Samuel H,Matthew D,Francis P.Structure and properties of surfactant protein B[J].Biochim Biophy Acta,1998,1408:150-160.
[2]Barbara O,Begona G,Jesus P.Structure-function correlations of pulmonary surfactant protein SP-B and the saposin-like family of proteins[J].Eur Biophys J,2013,42:209-222.
[3]Zaltash S,Palmblad M,Curstedt T,et al.Pulmonary surfactant protein B: A structural model and a functional analogue[J].Biochim Biophys Acta,2000,7:179-186.
[4]Elisa P,Lara H,Ivan L,et al,A combined action of pulmonary surfactant proteins SP-B and SP-C modulates permeability and dynamics of phospholipid membranes[J].Biochem J,2011,438:555-564.
[5]Nogee L M,De Mello D,Dehner L,et al.Pulmonary surfactant protein B deficiency in congenital pulmonary alveolar proteinosis[J].N Engl J Med,1993,328:406-410.
[6]Tore C,Jan J.Different effects of surfactant proteins B and C-implications for development of synthetic surfactant[J].Neonatology,2010,97:367-372.
[7]De Mello D,Nogee L M,Heymans,et al.Molecular and phenotypic variability in the congenital alveolar proteinosis syndrome associated with inherited surfactant protein B deficiency[J].J Pediatr,1994,125:43-50.
[8]Whitsett J,Weaver T.Hydrophobic surfactant proteins in lung function and disease[J].N Engl J Med,2002,26:2141-2148.
[9]Nogee L M.Genetics of pediatric interstitial lung disease[J].Curr Opin Pediatr,2006,18(3):287-292.
[10]Ariki S,Kojima T,Gasa S,et al.Pulmonary collections play distinct roles in host defense againstMycobacteriumavium[J].J Immunol,2011,187(5): 2586-2594.
[11]Moises S,Hung-mo L,Martha M,et al.Sufactant protein A and B genetic variations predispose to idiopathic pulmonary fibrosis[J].Hum Genet,2003,113(6):542-550.
[12]Atsuyasu S,Machiko I.SP-B and SP-C containing new synthetic surfactant for treatment of extremely immature lamb lung[J].PLoS One,2012(7):1-11.
[13]王鹏,王万能,吕婧,等.疏水性肺表面活性蛋白SPB-结构类似物的研究进展[J].华西药学杂志,2013,28(6):98-102.
[14]Palmblad M,Johansson J,Robertson B,et al.Biophysical activity of an artificial surfactant containing an analogue of surfactant protein (SP)-C and native SP-B[J].Biochem J,1999:339:381.
[15]Thouvenin G,Abou T R,Flamein F,et al.Characteristics of disorders associated with genetic mutations of surfactant protein C[J].Arch Dis Child,2010,95(6):449-454.
[16]Sorensen H P,Mortensen K K.Advanced genetic strategies for recombinant protein expression inEscherichiacoli[J].J Biotechnol,2005(115):113-128.
[17]Sui L,Phillips K S,Wilder M R,et al.Structural requirements for intracellular transport of pulmonary surfactant protein B (SP-B)[J].Biochim Biophys Acta,1996,1312:177-185.
[18]Seltsam A,Grueger D,Blasczyk R,et al.Easy identification of antibodies to high-prevalence Scianna antigens and detection of admixed alloantibodies using soluble recombinant Scianna protein[J].Transfusion,2009,49(10):2090-2096.
[19]Andreas H,Karen S P,Timothy E W.Single-step purification/solubilization of recombinant proteins:Application to surfactant protein B[J].Bio Tech,1996(20):804-808.
[20]Clemens R,Poornima M,Malgorzata W,et al.Recombinant production of a hybrid plasminogen activator composed of surfactant protein B and low-molecular-weight urokinase[J].J Thromb Haemost,2008,100(6):1185-1192.
[21]Ruppert C,Markart P,Schmidt R,et al.Chemical crosslinking of urokinase to pulmonary surfactant protein B for targeting alveolar fibrin[J].Thromb Haemost,2003(89): 53-64.
[22]Lin S,Akinbi H T,Breslin J,et al.Structural requirements for targeting of surfactant protein B (SP-B) to secretory granulesinvitroandinvivo[J].J Biol Chem,1996(271):19689-19695.
Prokaryotic Expression and Purification of Mature Pulmonary Surfactant Protein B of Rats
ZHANG Xiao-jun1,WANG Wan-neng1 ,2,ZHOU Ji-hong2,LIU Qin1,GU Shi-ling1,ZHOU Dai-jun2,QIU Jun2,DAI Wei2,YUAN Dan-feng2LIU Da-wei2
(1.SchoolofPharmacyandBioengineering,ChongqingUniversityofTechnology,Chongqing,400054,China;2.Department4,InstituteofSurgeryResearch,DapingHospital,ThirdMilitaryMedicalUniversity,Chongqing,400042,China)
Abstract:In order to express and purify surfactant protein B(SP-B),and the gene of SP-B from rat was cloned,constructed into the prokaryotic vector pGEX4T-1.Firstly,rare codons of SP-B gene were optimized,and cloned into linear pGEX4T-1 after PCR.Secondly,the recombinant plasmid was transformed into E.coli BL21(DE3),and the expression of SP-B was detected by SDS-PAGE and Western blot.Then,the recombinant protein was purified by GSTPrep FF 16/10. The results showed that the SP-B gene was 250 bp and the result of sequencing pGEX4T-1/SP-B was consistent with the SP-B cDNA sequence.At the same time, the E.coli BL21(DE3) was induced by IPTG,and one new band about 34 ku appeared.Those results indicated that the pGEX4T-1/SP-B recombinant plasmid was constructed successfully,and the expression and purification of SP-B could be the foundation of pulmonary surfactant alternative drugs.
Key words:surfactant protein B;prokaryotic expression;Western blot;protein purification;rat
文章编号:1007-5038(2016)04-0018-06
中图分类号:S852.21;Q789
文献标识码:A
作者简介:张潇骏(1990-),男,广东汕头人,硕士研究生,主要从事微生物与生化药学研究。*通讯作者
基金项目:国家自然科学基金项目 (81471865)
收稿日期:2015-09-17

