复智散通过细胞周期依赖性蛋白激酶5通路减轻皮层神经元Tau蛋白过度磷酸化
张兆旭,王德生
(1.山东省千佛山医院神经内科,山东济南 250000;2.哈尔滨医科大学附属第一医院神经内科,黑龙江哈尔滨 150001)
复智散通过细胞周期依赖性蛋白激酶5通路减轻皮层神经元Tau蛋白过度磷酸化
张兆旭1,王德生2
(1.山东省千佛山医院神经内科,山东济南 250000;2.哈尔滨医科大学附属第一医院神经内科,黑龙江哈尔滨 150001)
目的 探讨复方中药复智散(FZS)能否通过抑制细胞周期依赖性蛋白激酶5(CDK5)通路,减轻Aβ25-351诱导的新生鼠皮层神经元Tau蛋白过度磷酸化。方法 选用24 h内新生Wistar大鼠,分离纯化皮层神经元,进行体外培养。皮层神经元在体外培养7 d后,应用20 μmol·L-1Aβ25-351作用于皮层神经元24 h。药物治疗组则应用FZS(20 mg· L-1)、CDK5抑制剂Roscovitine(15 μmol·L-1)、钙蛋白酶(calpain)制剂Calpeptin(20 μmol·L-1)预处理24 h,然后用20 μmol·L-1Aβ25-351作用24 h。用Western blot检测Tau蛋白Ser396、Ser202和Thr231位点磷酸化水平和CDK5的激活蛋白p25/p35的蛋白水平;荧光酶标仪测定荧光强度来反映calpain活性;免疫沉淀法检测CDK5激酶活性。结果 20 μmol·L-1Aβ25-351作用于皮层神经元24 h后,Tau蛋白在Ser396、Ser202、Thr231位点磷酸化水平增加,CDK5激酶活性升高,CDK5激活蛋白p25水平升高,calpain活性升高。20 mg·L-1FZS治疗组则明显抑制了Aβ25-351导致的Tau蛋白在Ser396、Ser202、Thr231位点磷酸化水平增加,抑制了CDK5激酶活性、p25蛋白水平以及calpain活性升高。CDK5抑制剂roscovitine和calpain抑制剂calpeptin作为阳性对照药物也显示了抑制Tau蛋白过度磷酸化的作用。结论 复智散可能通过calpain-p25/CDK5通路抑制Aβ25-351导致的皮层神经元Tau蛋白过度磷酸化。
阿尔茨海默病;CDK5;Tau蛋白;复智散;钙蛋白酶;p25
阿尔茨海默病(Alzheimer’s disease,AD),是老年期痴呆最常见的类型,神经细胞外β-淀粉样蛋白(Aβ)异常沉积引发的老年斑(SPs)和神经细胞内Tau蛋白过度磷酸化形成的神经原纤维缠结(NFTs)是其特征性病理学变化[1]。尽管Aβ和Tau蛋白的关系尚未完全明确,但越来越多的证据表明,不论在体内还是在体外实验,Aβ均可引起的Tau蛋白过度磷酸化,引起神经元微管崩解、轴浆运输障碍,最终导致神经元凋亡,因此Aβ引起的Tau蛋白过度磷酸化被普遍认为是AD的重要的发病机制之一[2]。Aβ可以激活各种蛋白激酶引起Tau蛋白磷酸化,CDK5是最重要的Tau蛋白激酶之一。p35是CDK5神经专一性的激活亚基,在钙依赖性calpain剪切作用下,转变为p25,使CDK5过度激活,从而导致Tau蛋白过度磷酸化[3]。
复方中药复智散(FZS)是用于治疗老年性痴呆多年,临床及实验室研究证明,FZS治疗AD有效;FZS可改善老龄鼠的水迷宫试验,增加痴呆模型鼠脑内乙酰胆碱含量[4];FZS对抗Aβ毒性,提高体外神经细胞细胞存活率[5];FZS治疗AD患者可改善认知功能,提高生活能力,PET证实增加患者脑内糖代谢[6-7]。但FZS对Tau蛋白磷酸化的作用尚不清楚。本研究运用凝聚态Aβ25-35建立皮层神经元Tau蛋白过度磷酸化的细胞模型,探讨FZS能否通过calpain-CDK5通路抑制Tau蛋白过度磷酸化,为FZS治疗AD提供更新的理论依据。
1 材料与方法
1.1 实验动物 新生24 h内Wistar大鼠(清洁级),由山东大学动物中心提供。
1.2 试剂 FZS中药合剂由哈尔滨医科大学第一临床医学院神经科王德生教授组方,由人参、当归、黄芩、节菖蒲按比例(2∶1∶1∶1)组成,原料购自哈尔滨市药材公司,加工为粉剂后文火煎制30 min,3 000 r·min-1离心10 min,吸取上清,留取上清过滤配成浓度为0.5 g·mL-1的贮存液,0.15 kPa压力灭菌30 min,分装,4℃保存2周或-20℃冻存。实验中给药剂量以水提液中所含生药的量计算。胎牛血清购自杭州江滨生物技术有限公司。Neuro-basal培养基购Invitrogene公司。Aβ25-35淀粉样肽片段购Sigma公司,多克隆抗体Tau(Ser396)、Tau (Ser202)、Tau(Thr231)、p35/25(C-19)、CDK5(C-8)购置Santa Cruz公司。Western blot化学发光检测试剂盒购自KPL公司。
1.3 皮层神经元原代培养 在无菌条件下取出胎鼠,解剖分离大脑皮层,分散细胞,将神经细胞以5 ×104每孔的密度接种于涂有左旋多聚赖氨酸的96孔板中,以2×105每孔的密度种植于24孔板中(孔板中放置12 mm的载玻片),细胞接种后,将孔板置于5%的CO2、37℃、饱和湿度培养箱中过夜,24 h后更换培养基,将种植液(Neurobasal培养基约88.5%,胎牛血清10%,谷氨酰胺储备液1%,青链霉素储备液0.5%)更换为饲养液(Neurobasal培养基约95.5%,N-21%,B-27 2%,谷氨酰胺储备液1%,青链霉素储备液0.5%)。以后每48 h半量换液一次。皮层神经元在体外培养7 d后,应用FZS (20 mg·L-1)、Roscovitine(15 μmol·L-1)或Cal-peptin(20 μmol·L-1)预处理24 h,然后用20 μmol ·L-1Aβ作用24 h。
1.4 Western blot分析 将种植于24孔的神经元进行各种干预后,吸尽培养基,PBS冲洗,冷胰酶裂解20 min,用细胞刮刀将细胞刮下,离心(2 000 r· min-15 min),吸上清液至EP管中,Bradford法进行蛋白定量。以10%SDS聚丙烯酰胺凝胶电泳分离,用半干电转移法将蛋白转移到硝酸纤维素膜,室温下用封闭液封闭1 h后,将膜移入用封闭液稀释的一抗Tau[pSer396],Tau[pSer202],Tau[pThr231],p35多克隆抗体和Tau-5单克隆抗体(1∶10 000稀释),4℃孵育过夜,辣根过氧化物酶偶联的二抗(1 ∶1 000稀释)反应2 h,用化学发光法显色,X线底片曝光,β-actin作为内参照,凝胶图像分析仪(Al-pha Imager 2200,美国安莱公司)计算点密度。实验重复3次。
1.5 CDK5激酶活性测定 体外培养的皮层神经元经各种干预后,吸尽培养基,裂解蛋白,取蛋白200 μg,用CDK5抗体10 μg,加入细胞溶解缓冲液中(50 mmol·L-1Tris-HCl,pH 7.4,80 mmol·L-1b-glycerophosphate,20 mmol·L-1EGTA,15 mmol· L-1MgCl2,and 1 mmol·L-1dithiothreitol),在4℃环境下孵育1 h。所产生的免疫复合物用Asephar-sose沉降法收集,收集到的免疫复合物用清洗缓冲液清洗,然后,将该免疫复合物用CDK5激酶缓冲液包括50 μmol·L-1ATP,1.25 μCi-γ32 ATP,和500 μmol·L-1histone H1作为底物在室温下孵育20 min,最后用液体闪光计数器测定。
1.6 calpain活性测定 取蛋白20 μg放入96孔板中,每孔加入130 μmol·L-1calpain底物N-suc-ciny lleu-tyr-7-amido-4-methylcoumarin,在室温下孵育30 min。N-succinyl-leu-tyr-7-amido-4-methylcoum-arin(calpain底物)本身是非荧光性的,其被calpain (Calpain)裂解后能发出荧光。应用酶标仪(550 Bio-Rad)检测荧光,激发波长为360 nm,发射波长为480 nm,检测数值间接反映calpain的活性。
2 结果
2.1 FZS抑制Aβ25-35导致的皮层神经元Tau蛋白过度磷酸化 为探讨FZS对皮层神经元Tau蛋白磷酸化作用,应用能够分别识别Ser396、Ser202、Thr231这3个位点的磷酸化抗体,Western blot检测磷酸化Tau蛋白的表达情况。如Fig 1显示,20 μmol·L-1Aβ25-35作用于皮层神经元24 h,3个不同位点(Ser396、Ser202、Thr231)的Tau磷酸化均明显增加。然而,应用20 mg·L-1FZS预处理皮层神经元24 h明显缓解Aβ25-35导致的Tau磷酸化作用。CDK5抑制(roscovitine)和calpain抑制剂(calpetin)也有类似的作用,缓解了Aβ25-35导致的Tau磷酸化。
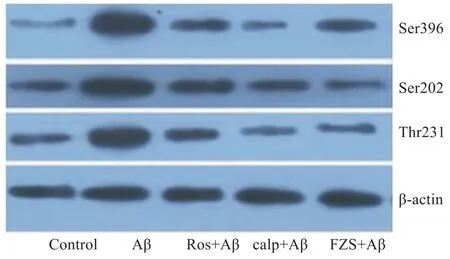
Fig 1 FZS prevents Aβ25-35-induced Tau phosphorylation
2.2 FZS抑制Aβ25-35导致的CDK5激酶过度激活为了探讨Aβ25-35和FZS对CDK5激酶活性的作用,治疗组皮层神经元应用20 mg·L-1FZS预处理24 h后,再应用20 μmol·L-1Aβ25-35作用24 h。CDK5激酶活性采用CDK5抗体、免疫沉淀法,应用液体闪烁计数仪检测。和未处理组皮层神经元比较,20 μmol·L-1Aβ25-35处理组神经元CDK5激酶活性升高了近3倍;20 mg·L-1FZS治疗则明显抑制了Aβ25-35导致的CDK5激酶活性升高(P<0.01),见Fig 2。由此可见,FZS抑制了Aβ25-35导致的CDK5激酶过度激活,但对CDK5激酶本身的生理活性没有影响。

Fig 2 FZS blocks Aβ25-35-induced CDK5 activation
2.3 FZS抑制Aβ25-35导致的p35向p25转变p35是CDK5生理性的激活亚基,在calpain作用下,p35降解、转变为p25能使CDK5过度激活,从而导致神经元变性、凋亡[3]。以往研究发现Aβ暴露能够使皮层神经元的p35转变为p25[8]。本研究为探讨FZS及Aβ25-35对皮层神经元p35或p25是否有影响,应用Western blot,p35/p25抗体检测p35、p25蛋白表达情况。20 μmol·L-1Aβ25-35处理皮层神经元24 h后,p35蛋白水平明显降低,而p25蛋白水平明显增高;20 mg·L-1FZS则抑制Aβ25-35导致的p35向p25转变,见Fig 3。结合上述结果,可以推断FZS对CDK5激酶活性的抑制可能是通过抑制Aβ25-35导致的p35向p25转变而实现的。

Fig 3 FZS prevents Aβ25-35-induced conversion of p35 to p25
2.4 FZS抑制Aβ25-35导致的calpain激活 p35降解、转变为p25是由calpain激活介导的。因此,我们进一步探讨了FZS和Aβ25-35对calpain活性的作用。经过7 d成熟期的神经元经药物干预后,裂解、提取细胞蛋白,calpain活性的活性应用酶标仪检测。皮层神经元经20 μmol·L-1Aβ25-35处理24 h后,calpain活性明显增高(P<0.01),20 mg·L-1FZS预处理皮层神经元24 h则明显抑制Aβ25-35导致的calpain激活,见Fig 4。
3 讨论
NFTs是AD的特征性病理改变之一,而NFTs的主要成分是过度磷酸化的微管相关tau蛋白。Tau蛋白磷酸化,可以引起微管崩解,轴浆运输障碍,最终导致神经元死亡[2]。在APP(淀粉样前体蛋白)转基因鼠的实验中发现[9],抑制内源性Tau蛋白可以缓解Aβ引起的认知功能损害,因此,有学者认为,Aβ的神经毒性是通过Tau蛋白磷酸化来实现的,Aβ引起的Tau蛋白磷酸化可能是AD的重要发病机制之一。

Fig 4 FZS prevents Aβ25-35-induced calpain activation
越来越大的研究证明,Aβ可以在多个AD发病相关的磷酸化位点导致Tau蛋白磷酸化。Tau蛋白的磷酸化位点很多,研究表明[10]Ser396、Ser202、Thr231这3个位点磷酸化可导致NFTs,中枢神经系统变性,被认为和AD的发病相关。和以往研究相似,20 μmol·L-1Aβ25-35作用于皮层神经元24 h,明显增加了这3个位点(Ser396、Ser202、Thr231)的Tau蛋白磷酸化。
CDK5是最重要的Tau蛋白激酶之一,其活性受神经专一性的激活亚基p35调节。生理状态下,CDK5在p35调节亚基的信号作用下锚定于膜上,在神经元发育、迁移、神经元存活中发挥重要作用[2,8]。Aβ暴露或各种应激损害,可导致神经元细胞内钙超载,从而激活calpain。calpain使p35裂解为p25片段,p25十分稳定,不容易降解,为CDK5更稳定的激活亚基,与CDK5结合导致CDK5持久过度激活[11]。过度激活的CDK5导致Tau蛋白过度磷酸化,从而引起微管崩解,损害轴浆运输,导致神经元凋亡。AD患者脑内p25表达水平明显增加,CDK5活性明显升高[12]。在体外培养的神经元中[13],抑制CDK5或calpain活性均明显缓解Aβ导致的Tau蛋白磷酸化及神经元的凋亡,这与本研究结果是一致的,CDK5抑制剂Roscovitine(15 μmol ·L-1)和calpain制剂Calpeptin(20 μmol·L-1)均明显抑制了Aβ25-35导致的Tau蛋白磷酸化。在动物试验中也发现CDK5抑制剂缓解了Aβ导致的Tau蛋白磷酸化,提高了AD模型鼠的认知功能。p25转基因鼠的大脑皮层中CDK5活性明显升高,并出现Tau蛋白过度磷酸化,神经原纤维缠结形成,神经元的变性与凋亡,且伴随明显认知功能障碍[14]。
研究认为[11],p25/CDK5导致了Tau蛋白过度磷酸化,因此抑制p35/CDK5向p25/CDK5转变对缓解Tau蛋白过度磷酸化及AD的治疗有重要意义。本研究显示,FZS能够有效抑制Aβ25-35导致的calpain激活,从而缓解了p35向p25转变,降低了CDK5激酶活性,从而减轻了Aβ25-35导致的皮层神经元Tau蛋白过度磷酸化。calpain是钙依赖性的蛋白激酶,细胞内钙超载是导致其活性过度增高的主要原因。在以往研究中[5],应用PC12细胞体外培养,发现FZS能够对抗Aβ1-42导致的细胞内钙超载,从而起到神经保护作用。由此可见,抑制细胞内钙超载、钙依赖性calpain过度激活,从而抑制p35 向p25转变,缓解CDK5过度激活引起的Tau蛋白磷酸化,可能为FZS治疗AD的有效机制之一。
FZS由人参、当归、黄芩等中药组成,其神经保护作用的有效成分尚不完全清楚。人参是我国传统药物,具有增强记忆、益智延年、强身健体之功效。人参的主要有效成份是人参皂苷,包括Rb1、Rg1、Rg2等。人参皂苷Rgl还可通过抗氧化应激、抗神经元凋亡、抑制兴奋性氨基酸毒性、减少钙内流等发挥其对神经元的保护作用[15]。近期,黄天文等[15]应用原代皮层神经元培养,发现人参皂苷Rbl能够抑制CDK5激酶活性,从而抑制Aβ白导致的Tau蛋白过度磷酸化,保护皮层神经元。由此可见,人参皂苷可能为FZS神经保护作用的有效成分之一。其它成分如当归、黄芩是否也具有相似的神经保护作用尚不清楚,在以后的研究中还需进一步探讨。
(致谢:本文实验是在山东省千佛山中心实验室完成,特别感谢曹莉莉主任给予的实验技术指导和帮助。)
[1] 纪超男,胡馨月,郭远新,等.米索前列醇对APP/PS1转基因小鼠的神经保护作用[J].中国药理学通报,2015,31(3):334-9.
[1] Ji C N,Hu X Y,Guo Y X,et al.Protective effect of misoprostol on neurodegeneration in APP/PS1 transgenic mice[J].Chin Phar-macol Bull,2015(3):334-9.
[2] Michaelis M L,Dobrowsky R T,Li G.Tau neurofibrillary pathol-ogy and microtubule stability[J].J Mol Neurosci,2002,19(3):289-93.
[3] Sundaram J R,Poore C P,Sulaimee N H,et al.Specific inhibition of p25/Cdk5 activity by the Cdk5 inhibitory peptide reduces neu-rodegeneration in vivo[J].J Neurosci,2013,33(1):334-43.
[4] 李绪领,王德生,孙曼霁,等.复智散(FZS)对Alzheimer`s dis-ease(AD)模型小鼠治疗作用的研究[J].中国药理学通报,2007,23(10):421-4.
[4] Li X L,Wang D S,Sun M Q,et al.Effect of Fuzhisan on Alzheim-ers disease model mice[J].Chin Pharmacol Bull,2007,23 (10):421-4.
[5] 温世荣,王德生,张景艳,等.复智散对SH_SY5Y细胞生存状态的影响[J].哈尔滨医科大学学报,2003,37(5):383-5.
[5] Wen S R,Wang D S,Zhang J Y,et al.Effect of Fuzhisan on the viability of SH-SY5Y cell[J].J Harbin Med Univ,2003,37(5):383-5.
[6] 刚宝芝,王德生,王春丽,等.复智散治疗老年性痴呆的临床疗效观察[J].中风与神经疾病杂志,2005,22(4):535-7.
[6] Gang B Z,Wang D S,Wang C L,et al.The efficacy of Fuzhisan in patients with Alzheimer’s disease[J].J Apoplexy Ner Dis,2005,22(4):535-7.
[7] Bi M,Tong S,Zhang Z.Changes in cerebral glucose metabolism in patients with mild-to-moderate Alzheimer’s disease:a pilot study with the Chinese herbal medicine fuzhisan[J].Neurosci Lett,2011,501(1):35-40.
[8] Shukla V,Skuntz S,Pant H C.Deregulated Cdk5 activity is in-volved in inducing Alzheimer's disease[J].Arch Med Res,2012,43(8):655-62
[9] Li SQ,Yu Y,Han J Z,et al.Deficiency of macrophage migration inhibitory factor attenuates tau hyperphosphorylation in mouse mod-els of Alzheimer's disease[J].J Neuroinflammation,201,12(1):177.
[10]Nikkel A L,Martino B,Markosyan S,et al.The novel calpain in-hibitor A-705253 prevents stress-induced tau hyperphosphoryla-tion in vitro and in vivo[J].Neuropharmacology,2012,63(4):606-12.
[11]Zhou J,Wang H,Feng Y,et al.Increased expression of cdk5/p25 in N2a cells leads to hyperphosphorylation and impaired axonal transport of neurofilament proteins[J].Life Sci,2010,86(13-14):532-7.
[12]Shi L L,Yang W N,Chen X L,et al.The protective effects of tan-shinone IIA on neurotoxicity induced by β-amyloid protein through calpain and the p35/Cdk5 pathway in primary cortical neurons [J].Neurochem Int,2012,61(2):227-35.
[13]Town T,Zolton J,Shaffner R,et al.p35/Cdk5 pathway mediates soluble amyloid-beta peptide-induced tau phosphorylation in vitro [J].J Neurosci Res,2002,69(3):362-72.
[14]Zhao H,Chang R,Che H,et al.Hyperphosphorylation of tau pro-tein by calpain regulation in retina of Alzheimer's disease transgen-ic mouse[J].Neurosci Lett,2013,551:12-6.
[15]黄天文,陈晓春,张 静,等.钙蛋白酶-细胞周期依赖性蛋白激酶5通路参与β淀粉样蛋白25-35诱导的tau蛋白过度磷酸化[J].中华神经科杂志,2006,39(7):477-80.
[15]Huang T W,Chen X C,Zhang J,et al.Calpain-CDK5 pathway is involved in β-amyloid peptide25-35-induced tau hyperphosphory-lation[J]〗.Chin J Neurol,2006,39(7):477-80.
Role of Fuzhisan in reducing Tau protein hyperphosphorylation in cortical neurons through a cyclin-dependent kinase 5 pathway
ZHANG Zhao-xu1,WANG De-sheng2
(1.Dept of Neurology,Qianfoshan Hospital of Shandong Province,Jinan 250000,China;2.Dept of Neurology,the First Affliated Hospital,Harbin Medical University,Harbin 150001,China)
Aim Fuzhisan(FZS),a Chinese herbal complex prescription that has been used for the treat-ment of AD for over 15 years,is known to enhance the cognitive ability in AD patients.In this study,to in-vestigate whether FZS reduces Aβ25-35-induced Tau protein hyperphosphorylation in neonatal rat cortical neurons by suppressing the cyclin-dependent kinase 5 (CDK5)pathway.Methods Neonatal Wistar rats born within 24 h were selected to separate and purify their cortical neurons for culture in vitro.After 7-day culture of cortical neurons in vitro,20 μmol·L-1Aβ25-35was used to act on them for 24 h.Medication groups were pretreated with FZS(20 mg·L-1),CDK5 inhibitor roscovitine(15 μmol·L-1)and cal-pain preparation calpeptin(20 μmol·L-1)for 24 h,followed by reaction with 20 μmol·L-1Aβ25-35for 24 h.Tau protein phosphorylation levels at Ser396,Ser202 and Thr231 and the protein level of CDK5 acti-vator proteins p25/p35 were assayed by Western blot.Fluorescence intensity was measured with a fluores- cence microplate reader to reflect calpain activity.CDK5 kinase activity was assayed by immunoprecipita-tion.Results After 20 μmol·L-1Aβ25-35acting on cortical neurons for 24h,there were increments in the following:Tau protein phosphorylation levels at Ser396,Ser202 and Thr231,CDK5 kinase activity,CDK5 activator protein p25 level,and calpain activity.In the 20 mg·L-1FZS treatment group,Aβ25-35was suppressed markedly,resulting in increments in Tau protein phosphorylation levels at Ser396,Ser202 and Thr231,suppression of CDK5 kinase activity and p25 protein level,and elevation in calpain activity.Both CDK5 inhibitor roscovitine and calpain preparation cal-peptin,as positive control drugs,also played a role in suppressing Tau protein hyperphosphorylation.Con-clusion FZS can suppress Aβ25-35-induced Tau pro-tein hyperphosphorylation in cortical neurons through the calpain/CDK5 pathway.
Alzheimer’s Disease;CDK5;Tau protein;Fuzhisan;calpain;p25
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.048.html
10.3969/j.issn.1001-1978.2016.03.024
A
1001-1978(2016)03-0422-05
R-332;R282.71;R322.81;R329.28;R745.7;R977.3;R977.6
2015-11-04,
2015-12-21
国家自然科学基金资助项目(No 81303013)
张兆旭(1981-),男,博士,主治医师,研究方向:老年性痴呆,E-mail:zhangzhaoxu33@163.com