马钱苷对糖基化终末产物诱导足细胞损伤的保护作用
吴云皓,陈玉萍,吕 兴,周芷若,沈红胜,戴国英,许惠琴
(1.南京中医药大学药学院,2.江苏省中药药效与安全性评价重点实验室,江苏南京 210023)
马钱苷对糖基化终末产物诱导足细胞损伤的保护作用
吴云皓1,2,陈玉萍1,2,吕 兴1,2,周芷若1,沈红胜1,2,戴国英1,2,许惠琴1,2
(1.南京中医药大学药学院,2.江苏省中药药效与安全性评价重点实验室,江苏南京 210023)
目的 探讨山茱萸环烯醚萜苷特征性成分马钱苷对糖基化终末产物(AGEs)诱导肾脏足细胞损伤的保护作用及其机制。方法 体外培养小鼠肾小球足细胞,分为空白对照组、模型组(AGEs组)、马钱苷组,并设氨基胍组作为阳性对照。MTT法检测马钱苷对足细胞存活率的影响;Hoechst 33342/PI双染观察足细胞凋亡情况,流式细胞仪检测细胞凋亡率;Western blot法检测足细胞AGEs受体(RAGE)、足细胞损伤标志蛋白desmin以及凋亡相关蛋白bax、bcl-2、cleaved caspase-3的表达。结果 马钱苷能够抑制AGEs导致的足细胞损伤,下调足细胞Desmin、RAGE蛋白的表达,明显降低AGEs诱导的足细胞凋亡率,降低足细胞Bax/Bcl-2的比值和促凋亡蛋白cleaved caspase-3的表达。结论 马钱苷能够改善AGEs诱导的肾小球足细胞损伤,其作用机制与降低RAGE蛋白表达,抑制凋亡通路有关。
山茱萸;马钱苷;糖基化终末产物;足细胞;糖尿病肾病;凋亡
糖尿病肾病(diabetic nephropathy,DN)是糖尿病严重的微血管并发症之一,也是引起终末期肾病的首要原因[1],其特征主要表现为炎症、系膜基质累积、肾小管间质纤维化以及血管透明变性[2]。大量研究表明,糖基化终末产物(advanced glycation end products,AGEs)在DN的发生发展中起到重要的作用[3-4]。肾脏中AGEs的累积能够通过不同的途径导致肾脏结构渐进性改变以及肾功能衰退[5]。足细胞是位于肾小球基底膜(GBM)外层的终末分化细胞,在维持肾小球滤过屏障的结构和功能上扮演着重要的角色。DN中足细胞受损并且数量减少,伴随着肾小球超滤、白蛋白排泄率增加以及GBM增厚,最终导致肾小球硬化[6]。
山茱萸环烯醚萜苷类成分具有抑制糖尿病大鼠肾皮质AGEs的形成,下调其受体mRNA的表达,降低DN小鼠尿微量白蛋白,减轻肾脏病理学改变的作用[7-8],并且能够对抗AGEs对肾小球系膜细胞的损伤作用[9]。马钱苷为山茱萸环烯醚萜苷类主要效应成分,能够降低糖尿病小鼠血糖、改善血脂以及抑制AGEs的生成并下调其受体的表达[10]。有研究表明AGEs作用于足细胞后能够对其造成不同形式的损伤,且其受体RAGE被激活后能够诱导足细胞凋亡[11-13]。因而本实验采用体外AGEs刺激足细胞的方法,研究马钱苷对AGEs诱导足细胞损伤的影响,并探讨其作用机制,为马钱苷的临床应用提供理论研究基础。
1 材料与方法
1.1 实验材料 小鼠肾小球足细胞,购自上海瑞鹿生物科技有限公司;马钱苷,上海源叶生物科技有限公司,质量分数为≥98%,批号:20100528。氨基胍,Sigma公司进口分装。小鼠重组γ干扰素(IFN-γ),美国Protech公司;DMEM培养基、0.25%胰蛋白酶,美国Gibco公司;胎牛血清(FBS),杭州四季青公司;二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT),美国Sigma公司;Hoechst 33342/PI双染试剂盒,南京凯基生物科技发展有限公司;RIPA裂解液,碧云天生物技术研究所;RAGE抗体、Desmin抗体,Ab-cam公司;Bax、Bcl-2、cleaved caspase-3抗体,Affinity公司。
1.2 实验仪器 Synergy HT酶标仪,美国Bio-Tek公司;二氧化碳细胞培养箱,日本SANYO公司;超净工作台,苏州净化设备有限公司;倒置荧光显微镜(Ti型),日本尼康公司;FACSCalibur流式细胞仪,美国BD公司。
1.3 方法
1.3.1 AGEs的制备 将50 g·L-1的牛血清白蛋白与0.5 mol·L-1葡萄糖溶于0.2 mol·L-1磷酸盐缓冲液(PBS,pH=7.4)中,37℃避光孵育3个月,使其形成AGEs-BSA。平行条件下配制不加入葡萄糖的上述BSA溶液,以制备无糖基化BSA(0-BSA)作为对照。待AGEs形成后,用孔径为分子质量1万的透析袋低温透析24 h,除去未反应的葡萄糖,然后用0.22 μm滤膜过滤除菌。
1.3.2 细胞培养 未分化的小鼠肾小球足细胞用含10%胎牛血清和10 000 U·L-1的IFN-γ的DMEM低糖培养基在33℃、5%CO2培养箱中使其传代增生,用不含IFN-γ的DMEM低糖培养基在37℃、5%CO2培养箱中培养7~14 d使其分化成熟,取对数生长期细胞用于实验。
1.3.3 MTT法检测细胞增殖 取对数生长期的分化成熟细胞,调整细胞密度至5×107·L-1接种于96孔板,每孔100 μL,于37℃、5%CO2培养箱中静置培养24 h。当细胞贴壁生长至80%~90%融合状态时,换无FBS的DMEM低糖培养液饥饿培养23 h,加入氨基胍、马钱苷(终浓度分别为10、1、0.1 μmol·L-1)预孵1 h后,加入终浓度为100 mg· L-1的AGEs刺激,同时设模型组和空白对照组。24 h后每孔加入5 g·L-1的MTT溶液20 μL,继续孵育4 h,吸弃孔中培养上清液,每孔加入150 μL的DMSO,震荡混匀10 min,酶标仪测定490 nm处各孔的吸光度(A)值,计算细胞存活率。
1.3.4 Hoechst 33342/PI双标法检测细胞凋亡分组与加药处理同“2.2”项,马钱苷终浓度分别为0.1、1、10 μmol·L-1。足细胞培养24 h后,离心搜集各组细胞,将105~106个细胞悬浮于1 mL培养基中,再加入10 μL Hoechst 33342染液,混匀,37℃孵育15 min,离心弃去上清,加入1 mL工作液悬浮细胞,加入5 μL PI染液,室温避光放置15 min后混匀,荧光显微镜下观察(×200)细胞凋亡情况,流式细胞仪检测细胞凋亡百分率。
1.3.5 Western blot检测相关蛋白表达 取对数生长期细胞,以2×108·L-1接种于6孔板,分组与加药处理同“2.2”项。处理24 h后离心收集细胞,用RIPA裂解液提取细胞总蛋白,并测定蛋白浓度。蛋白样品加入1/4体积的4×蛋白上样缓冲液,沸水煮沸5 min,进行SDS-PAGE凝胶电泳,然后转印至PVDF膜上,用含按约0.1 mL·cm-2量加入封闭液封闭1 h,一抗4℃过夜。次日PBST漂洗3次,加入辣根过氧化酶标记的二抗室温孵育2 h,ECL显色。利用Image J软件分析各组灰度值,以β-actin为内参计算各蛋白的变化。
1.3.6 统计学分析 实验结果使用SPSS16.0进行分析,数据以±s表示。组间比较方差齐性采用t检验。
2 结果
2.1 对AGEs损伤足细胞存活率的影响 给予AGEs刺激24 h后,与空白组比较,模型组细胞存活率明显降低(P<0.01);与模型组比较,氨基胍组在终浓度0.1、1、10 μmol·L-1时,马钱苷在终浓度1、10 μmol·L-1时,对AGEs损伤足细胞具有明显的保护作用(P<0.05、0.01),且呈浓度相关性。见Fig 1。
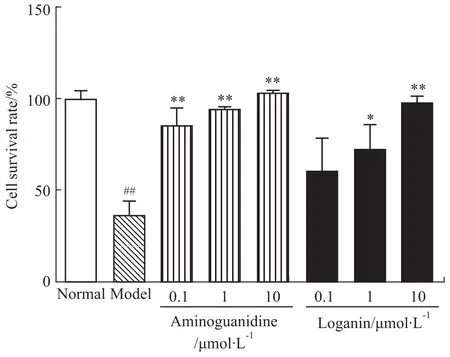
Fig 1 Effect of loganin on cell viability of podocytes induced by AGEs(±s,n=6)
2.2 对足细胞RAGE、Desmin蛋白表达的影响给予AGEs刺激24 h后,模型组RAGE、Desmin蛋白表达明显增加(P<0.01);与模型组比较,氨基胍、马钱苷各剂量组RAGE、Desmin蛋白表达明显下调(P<0.01)。见Fig 2和Fig 3。

Fig 2 Effect of loganin on expression of RAGE in podocytes(±s,n=3)
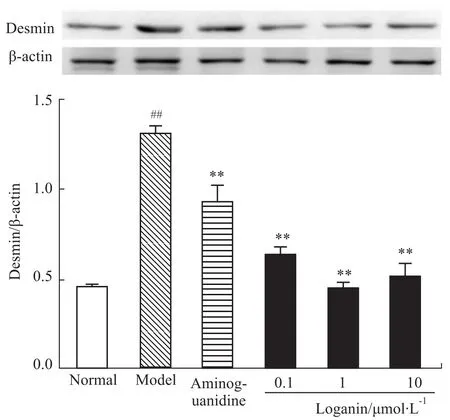
Fig 3 Effect of loganin on expression of desmin in podocytes(±s,n=3)
2.3 对AGEs诱导足细胞凋亡的影响 Hoechst 33342/PI荧光染色结果显示空白对照组足细胞发出低蓝/低红色荧光,细胞形态无明显改变;模型组足细胞大部分发出高蓝/低红色荧光,细胞膜通透性增强,呈细胞凋亡形态改变;氨基胍与马钱苷组均可不同程度改善细胞状态。见Fig 4。

Fig 4 Effect of loganin on apoptosis of podocytes induced by AGEs(Hoechst33342/PI staining)
流式细胞仪检测结果显示,AGEs能诱导细胞凋亡,与空白组比较差异具有显著性(P<0.01);与模型组比较,氨基胍组与马钱苷组能够明显降低细胞凋亡率(P<0.01),改善细胞凋亡。见Tab 1。
Tab 1 Effect of loganin on apoptosis of podocytes induced by AGEs(±s,n=3)

Tab 1 Effect of loganin on apoptosis of podocytes induced by AGEs(±s,n=3)
##P<0.01 vs normal group;**P<0.01 vs model group
Group Dose/μmol·L-1Apoptosis rate/% Normal - 4.43±0.34 Model - 17.36±0.77##Aminoguanidine 1 8.26±1.22**Loganin 0.1 13.62±0.58**1 6.42±0.75**10 10.71±0.57**
2.4 对足细胞凋亡相关蛋白Bax、Bcl-2、cleaved caspase-3表达的影响 与空白对照组相比,模型组Bax/Bcl-2比值增加(P<0.05);与模型组比较,马钱苷1、10 μmol·L-1组Bax蛋白表达下调明显(P <0.05、P<0.01),但氨基胍组与马钱苷0.1 μmol ·L-1组差异无显著性,结果见Fig 5。空白对照组足细胞中cleaved caspase-3几乎不表达,模型组cleaved caspase-3表达量明显增加(P<0.01);与模型组比较,氨基胍组与马钱苷各剂量组均能明显降低细胞中cleaved caspase-3的表达(P<0.01),见Fig 6。

Fig 5 Effect of loganin on expression of Bax/Bcl-2 in podocytes(±s,n=3)
3 讨论
足细胞又称为肾小球脏层上皮细胞,贴覆于GBM外侧。足细胞间由足突相互交联形成的裂孔隔膜(SD)相连,是蛋白质丢失的最后屏障,也是肾小球中最容易受到损伤的细胞成分。研究发现,足细胞损伤是导致DN和肾小球硬化的决定性因素[14]。AGEs是非酶糖基化反应的终末产物,糖尿病条件下AGEs形成速率加快,糖基终末化产物受体(RAGE)与AGEs结合后活性增强,致使足细胞产生大量衰退的变化。所有的这些变化都会破坏肾小球滤过屏障,导致白蛋白渗透增加,进而加速DN的发生发展。
AGEs对肾脏具有直接毒性作用或通过其受体产生毒性作用,而山茱萸具有补益肝肾、涩精固脱的功效,其环烯醚萜苷类成分对糖尿病肾病及血管并发症均有良好的保护作用[7]。马钱苷为山茱萸环烯醚萜苷类主要效应成分,能够改善DN小鼠三多一少症状,降低肾脏和血清AGEs水平,减少肾脏RAGE蛋白以及mRNA表达[15]。因此,本实验通过AGEs直接刺激肾小球足细胞,进一步研究马钱苷对AGEs损伤足细胞的保护作用,并探讨其作用机制。研究结果表明,马钱苷能够减轻AGEs诱导的足细胞损伤,且随着浓度的升高而增强。Desmin蛋白是一种骨架丝蛋白,可以作为反映足细胞损伤程度的标志性蛋白[16]。正常情况下足细胞无明显表达,当足细胞受到损伤时可大量表达。实验结果发现马钱苷能够不同程度降低足细胞Desmin表达,表明马钱苷对足细胞损伤具有一定的保护作用。同时,研究发现马钱苷能够下调足细胞RAGE的蛋白表达,提示马钱苷保护足细胞损伤可能与降低RAGE表达有关。
细胞凋亡是程序化、多基因调控的细胞死亡过程。Hoechst 33342/PI染色以及流式细胞检测结果显示AGEs能够有效诱导足细胞凋亡。Bcl-2家族蛋白是在细胞凋亡过程中起关键性作用的一类蛋白质,主要分为抗凋亡蛋白如Bcl-2、Bcl-xL等以及促凋亡蛋白如Bax、Bak等[17]。而Caspase家族作为凋亡机制中重要的效应成分,参与多种与凋亡有关的生理和病理过程。Caspase-3被称为“死亡蛋白酶”,是Caspase家族中的最重要的凋亡执行因子之一,它的活化是凋亡进入不可逆阶段的标志[18]。本实验结果表明,马钱苷能明显降低反映细胞凋亡程度的Bax/Bcl-2比值以及caspase-3活性形式cleaved caspase-3的表达,提示马钱苷能够通过抑制凋亡通路,减少足细胞凋亡,进一步对足细胞产生保护作用。
综上所述,马钱苷对AGEs诱导的足细胞损伤具有保护作用,其机制可能与下调RAGE蛋白表达,抑制凋亡通路的活性相关,但其它作用机制还有待进一步深入研究。
(致谢:本实验于江苏省中药药效与安全性评价重点实验室完成。感谢实验室老师与全体同学的大力帮助,在此致谢!)
[1] Xu X,Xiao L,Xiao P,et al.A glimpse of matrix metalloprotein-ases in diabetic nephropathy[J].Curr Med Chem,2014,21 (28):3244-60.
[2] Kumar S,Joachim H L,Anna V M,et al.Pirfenidone for diabetic nephropathy[J].J Am Soc Nephrol,2011,22(6):1144-51.
[3] Sun Y M,Su Y,Li J,et al.Recent advances in understanding the biochemical and molecular mechanism of diabetic nephropathy [J].Biochem Biophys Res Commun,2013,433(4):359-61.
[4] 吕 翠,刘洪娟,刘晓丽,等.晚期糖基化终末产物受体及其抑制剂的研究进展[J].中国药理学通报,2013,29(4):452-456.
[4] Lyu C,Liu H J,Liu X L,et al.The research progress on RAGE and RAGE inhibitor[J].Chin Pharmacol Bull,2013,29(4):452-6.
[5] Bouma B,Kroon-Batenburg L M,Wu Y P,et al.Glycation in-duces formation of amyloid cross-beta structure in albumin[J].J Biol Chem,2003,278(43):41810-9.
[6] Stieger N,Worthmann K,Schiffer M.The role of metabolic and haemodynamic factors in podocyte injury in diabetes[J].Diabetes Metab Res Rev,2011,27(3):207-15.
[7] 许惠琴,朱 荃.山茱萸环烯醚萜总苷对实验性糖尿病肾病变的保护作用[J].南京中医药大学学报,2003,19(6):342-4.
[7] Xu H Q,Zhu Q.Protecting effect of iridoid glycoside in fructus corni officinalis on experimental diabetic nephropathy[J].J Nan-jing TCM Univ,2003,19(6):342-4.
[8] 吕 兴,许惠琴,刘 斌,等.莫诺苷对晚期糖基化终末产物加重链脲佐菌素诱导糖尿病肾病保护作用及其机制[J].中草药,2014,45(21):3109-16.
[8] Lyu X,Xu H Q,Liu B,et al.Protection of morroniside on STZ-induded diabetic nephropathy aggravated by AGEs in mice and its mechanism[J].Chin Trad Herbal Drugs,2014,45(21):3109-16.
[9] 许惠琴,刘 洪,沈 健,等.山茱萸环烯醚萜总苷对AGEs培养肾小球系膜细胞的影响[J].中国药理学通报,2006,22 (4):432-6.
[9] Xu H Q,Liu H,Shen J,et al.Influence of iridosides of cornus officinalis on glomerular mesangial cells cultured with AGEs[J].Chin Pharmacol Bull,2006,22(4):432-6.
[10]Yamabe N,Noh J S,Park C H,et al.Evaluation of loganin,iri-doid glycoside from Corni Fructus,on hepatic and renal glucolipo-toxicity and inflammation in type 2 diabetic db/db mice[J].Eur J Pharmacol,2010,648(1-3):179-87.
[11]Cheng C L,Zheng Z D,Shi C G,et al.Advanced glycation end-products reduce podocyte adhesion by activating the renin-angio-tensin system and increasing integrin-linked kinase[J].Exp Ther-ap Med,2013,6(6):1494-8.
[12]Ha T S,Choi J Y,Park H Y,Lee J S.Ginseng total saponin im- proves podocyte hyperpermeability induced by high glucose and ad-vanced glycosylation endproducts[J].J Korean Med Sci,2011,26(10):1316-21.
[13]Chuang P Y,Yu Q,Fang W,et al.Advanced glycation endprod-ucts induce podocyte apoptosis by activation of the FOXO4 tran-scription factor[J].Kidney Int,2007,72(8):965-76.
[14]Estacio R O,Schrier R W.Diabetic nephropathy:pathogenesis,diagnosis,and prevention of progression[J].Adv Intern Med,2001,46:359-408.
[15]Liu K,Xu H Q,Lv G H,et al.Loganin attenuates diabetic ne-phropathy in C57BL/6J mice with diabetes induced by streptozoto-cin and fed with diets containing high level of advanced glycation end products[J].Life Sci,2015,123:78-85.
[16]Floege J,Alpers C E,Sage E H,et al.Markers of complement-dependent and complement-independent glomerular visceral epi-thelial cell injury in vivo.Expression of antiadhesive proteins and cytoskeletal changes[J].Lab Invest,1992,67(4):486-97.
[17]Hardwick J M,Soane L.Multiple functions of Bcl-2 family pro-teins[J].Cold Spring Harb Perspect Biol,2013,5(2):a008722.
[18]赵瑞杰,李引乾,王 会,等.Caspase家族与细胞凋亡的关系[J].中国畜牧杂志,2010,46(17):73-8.
[18]Zhao J R,Li Y Q,Wang H,et al.Relationship of Caspase family and apoptosis[J].Chin J Animal Sci,2010,46(17):73-8.
Protective effect of loganin on podocyte injury induced by advanced glycation end products
WU Yun-hao1,2,CHEN Yu-ping1,2,LYU Xing1,2,ZHOU Zhi-ruo1,2,SHEN Hong-sheng1,2,DAI Guo-ying1,2,XU Hui-qin1,2
(1.College of Pharmacy,Nanjing University of Chinese Medicine,Nanjing 210023,China;2.Jiangsu Key Laboratory for Pharmacology and Safety Evaluation of Chinese Materia Medica,Nanjing 210023,China)
Aim To explore the protective effect of lo-ganin(an active component in Cornus officinalis)on podocyte injury induced by advanced glycation end products(AGEs)and its possible mechanism.Meth-ods Mouse podocytes were cultured in vitro and di-vided into Normal group,model group(AGEs group),loganin group and aminoguanidine group(set as posi-tive control).After being incubated with loganin(final concentrations are 0.1,1,10 μmol·L-1)for 1 h,podocytes were stimulated by AGEs of 100 mg·L-1for 24 h.Then,the cell viability was measured by u-sing MTT method.Podocytes apoptosis was evaluated by Hoechst33342/PI staining and flow cytometry.Re-ceptors of advanced glycation end products(RAGE),desmin and apoptosis-related protein like Bax,Bcl-2,cleaved caspase-3 in podocytes were detected by West-ern blot.Results Loganin ameliorated podocyte inju-ry induced by AGEs,down-regulated the expression of desmin and RAGE.Loganin also reduced the apoptotic rate of podocytes and decreased the ratio of Bax/Bcl-2 and the expression of pro-apoptotic protein cleaved caspase-3 in podocytes.Conclusion Loganin could ameliorate podocyte injury,and its mechanism may be related to the decrease of the expression of RAGE and inhibition of the apoptotic pathway.
Cornus officinalis Sieb.et Zucc.;loga-nin;advanced glycation end products;podocyte;dia-betic nephropathy;apoptosis
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.016.html
10.3969/j.issn.1001-1978.2016.03.008
A
1001-1978(2016)03-0332-05
R-332;R284.1;R322.61;R329.25;R587.1;R977.6
2015-12-07,
2015-12-21
国家自然科学基金资助项目(No 81374029,81073111);江苏高校优势学科建设工程资助项目(No nzyzyxjp1006)
吴云皓(1991-),男,硕士,研究方向:内分泌药理学,E-mail:719807174@qq.com许惠琴(1961-),女,博士,教授,博士生导师,研究方向:内分泌药理学,通讯作者,E-mail:hqxu309@sina.com